一种定向分离免疫调节性肠道乳杆菌的方法与流程
本发明涉及一种定向分离免疫调节性肠道乳杆菌的方法,属于生物制剂技术领域。
背景技术:
乳杆菌是益生菌的重要成员,广泛存在于人体和动物胃肠道内。国内、外已有大量试验证实体内的多种乳杆菌可调节宿主对免疫系统功能,这是它们预防传染性疾病、改善食物过敏、抗癌、稳固肠黏膜屏障、改善免疫佐剂性能和缓解肠道炎症等作用的基础。其作用机制与其直接激活免疫细胞和分泌免疫调节物有关。
国内外已经开展了大量分离肠道免疫调节性乳杆菌的研究。分离筛选肠道免疫调节性乳杆菌已有前人采用常规传统的方法进行筛选,用MRS固体培养基进行平板涂布法得到大量菌株,然后进行革兰氏染色,镜检,弃掉革兰氏阴性菌株,之后通过过氧化氢酶实验和产气荚膜梭菌汹涌发酵实验,弃掉过氧化氢酶阳性和产气荚膜梭菌,最终将革兰氏阳性、过氧化氢酶阴性和无芽孢杆状暂定为乳杆菌,最后做乳杆菌特异性的PCR最终确定筛出的菌为乳杆菌。该方法具有一定的局限性,筛菌周期长且筛出的菌不一定为肠道免疫调节性乳杆菌,传统方法的不确定性导致筛选工作的不确定性。另外,这种培养法方法检出限是10cfu/g。
综上,肠道免疫调节性乳杆菌是采用经验指导性的传统分离方法进行筛选得到的。首先利用选择性培养基分离获得大量肠道乳杆菌菌株,然后分别考察其粘附肠道细菌能力、耐酸性和体外诱导细胞因子活性。这种分离方法工作量非常大,需要大量人力、物力,活性菌株筛选周期也很长。但许多体外生理表现相似的菌株的体内活性差别很大[Ibnouzekri et al.,2003],更加增加了筛选工作的复杂性。
技术实现要素:
为了解决上述问题,本发明建立了一种靶向分离高免疫调节活性乳杆菌菌株的方法。本发明的快速、定向的从人或动物肠道内容物或粪便分离高免疫调节性乳杆菌的方法,基于免疫磁珠技术的优点,利用生物素与链霉亲和素易于结合的特点,快速有效地从粪便中分离IgA包裹乳杆菌,然后再利用特异性培养基分离菌株,并用乳杆菌特异性PCR进行快速初步鉴定。
乳杆菌可通过M细胞进入小肠派伊尔结(PP)。PP是小肠最重要的抗原采集部位,内部存在大量巨噬细胞、树突细胞、T细胞和B细胞。树突细胞摄取乳杆菌,被刺激成熟,将诱导B细胞成为产IgA浆细胞。B细胞可以产生两种IgA,一种为以弱作用力结合大部分肠道细菌天然IgA,另外一种为以高亲和力结合免疫诱导菌的IgA。乳杆菌的免疫调节作用具有明显的菌株依赖性,高活性菌株可进入PP诱导高亲和性IgA产生,因此,免疫刺激活性较强的肠道乳杆菌其细胞表面都被高亲和性IgA所包裹。IgA包裹后也可促进乳杆菌进入PP持续诱导免疫反应,也可以增强其抗炎活性。
本发明的定向分离免疫调节性肠道乳杆菌的方法,先后包括:(1)制备菌体悬浮液;(2)在悬浮液中加入山羊血清或者牛血清白蛋白,冰浴一段时间;然后加入生物素标记的兔抗人IgA冰浴一段时间;再加入链霉亲和素磁珠,冰浴一段时间;最后磁性吸附结合有菌体的链霉亲和素磁珠,洗涤即得到菌体;(3)将上一步得到的菌体富集培养;(4)鉴定富集培养到的菌株,鉴定为乳杆菌的菌株即为高免疫调节活性的乳杆菌菌株。
在本发明的一种实施方式中,所述菌体悬浮液为唾液、肠道内容物或粪便制备的细菌悬浮液。
在本发明的一种实施方式中,所述菌体悬浮液,当样品为固态或半固态时,是将样品加入灭菌的缓冲液中,漩涡混匀,低速离心取上清液并经细胞过滤网处理,过滤得到的液体经多次高速离心、洗涤,然后重悬于缓冲液中,得到混合细菌的菌体悬浮液;当样品为液体时,直接将样品加入灭菌的缓冲液中,漩涡混匀,高速离心取沉淀,经多次洗涤、离心,然后重悬于缓冲液中得到菌体悬浮液。
在本发明的一种实施方式中,所述低速离心是在800~1200rpm;所述高速离心是在8000~12000rpm。
在本发明的一种实施方式中,所述缓冲液为蛋白胨缓冲液。
在本发明的一种实施方式中,所述山羊血清或牛血清白蛋白的作用是封闭非特异性结合。
在本发明的一种实施方式中,所述山羊血清或牛血清白蛋白的添加量为在菌悬液的终浓度分别为10%、0.05~0.5%。
在本发明的一种实施方式中,所述链霉亲和素磁珠的添加量为0.1-1.0mg/mL。
在本发明的一种实施方式中,所述链霉亲和素磁珠的制备是先制备氨基化纳米磁珠,然后与戊二醛连接,将连接上戊二醛的氨基化纳米磁珠与链霉亲和素在缓冲液中反应,反应结束后利用外加磁场吸附链霉亲和素化的纳米磁珠,清洗,即得到链霉亲和素磁珠。
在本发明的一种实施方式中,所述链霉亲和素磁珠的制备具体是:
①氨基化纳米磁珠:将所用实验器皿在王水中过夜浸泡,洗净烘干,向放有转子的圆底烧瓶中加入60mL乙二醇,13g己二胺,4g无水醋酸钠,2g FeCl3·6H2O,在50℃油浴至溶液均匀,将液体转移至带有四氟乙烯内衬的高压反应釜中,于198℃反应6h,冷却至室温后转移至烧杯中,使用无水乙醇和去离子水反复冲洗多次黑色固体后,将黑色固体在50℃条件下烘干10h,然后干燥的黑色固体使用玛瑙研钵研磨成粉末,即得到氨基化纳米磁珠。
②戊二醛连接:称取2mg氨基化磁珠于离心管中,加入戊二醛/PBS缓冲溶液(体积比为5%)2mL,37℃摇床中反应2h,利用吸铁石的磁力吸住磁珠,用PBS缓冲溶液反复清洗5次以上,除去未结合的戊二醛。
③链霉亲和素磁珠:在连接上戊二醛的氨基化磁珠中加2mL PBS缓冲溶液,然后再加入1mg/mL的链霉亲和素250uL,37℃摇床中反应12h,利用外加磁场用PBS缓冲液反复清洗5次以上,除去未结合的链霉亲和素,收集沉淀,即得到链霉亲和素化的纳米磁珠。磁珠清洗后放置在4℃环境中保存备用。
在本发明的一种实施方式中,所述冰浴的时间为10-30min。
在本发明的一种实施方式中,所述步骤(3)具体是:
①在混合细菌悬浮于蛋白胨缓冲液得到的菌体悬浮液中,加入5%的山羊血清,冰浴15min;加入生物素标记的兔抗人IgA,冰浴20min;然后加入链霉亲和素磁珠,冰浴20min。
②用吸铁石或磁珠分选器吸附磁珠结合细菌,倒掉上清液;之后用蛋白胨缓冲液清洗3次菌体。
③最后将链霉亲和素磁珠吸附的菌体重悬在蛋白胨缓冲液中。
在本发明的一种实施方式中,所述富集培养,是先在富集培养基上富集培养6-8h,然后多次在乳杆菌特异性分离培养基(LAMVAB)上划线、纯化,得到候选菌株。
在本发明的一种实施方式中,所述富集培养基的配方:阿拉伯糖20mM;核糖20mM;MgSO41mM;MnSO40.1mM;FeSO45uM。
在本发明的一种实施方式中,所述乳杆菌特异性分离培养基的配方:溶液A:MRS培养基250mL,盐酸半胱氨酸0.0125g,溴甲酚绿0.0012g,调pH至5.0±0.1;溶液B:10g琼脂溶于250mL去离子水中;溶液C:5mL盐酸万古霉素,2mg/mL,无菌水配制;等量A、B溶液121℃灭菌15min,B冷却至50℃,A冷去至室温加溶液C,混匀,再将A、B溶液混匀,倒平板。
在本发明的一种实施方式中,所述鉴定是使用乳杆菌属特异性引物进行PCR鉴定。
在本发明的一种实施方式中,所述鉴定具体是:提取候选菌株基因组DNA,利用乳杆菌属特异性引物进行PCR,所用引物为(序列分别如SEQ ID NO:1和SEQ ID NO:2所示):
LbLMA1-rev(5’-CTCAAAACTAAACAAAGTTTC-3’)和R16-1(5’-CTTGTACACACCGCCCGTCA-3’);得到的含有200~500bp特征性产物的菌株即为高免疫调节活性的乳杆菌菌株。
本发明的优点:
本发明方法,包括免疫磁珠的制备、肠道内容物或粪便细菌悬浮液制备、磁珠结合反应和磁珠分选、细菌富集和选择性培养、PCR法乳杆菌鉴定。本发明方法基于高活性菌株诱导分泌的IgA进入肠腔可特异性地结合该菌株,利用靶向结合IgA的亲和磁珠与粪便细菌悬液作用并清洗。在实验过程中,与细菌结合的天然IgA及与之结合的磁珠在清洗过程中就会被洗掉,仅保留与高亲和性IgA结合的磁珠,通过磁珠分选,并富集培养,从而快速分离活性菌株。同时,通过对分离方法中,山羊血清或牛血清白蛋白的添加量、链霉亲和素磁珠的添加量、冰浴时间等优化,进一步提高了筛选效率、缩短了筛选周期。
与常规的乳杆菌筛选相比,本发明通过细胞表面高亲和性IgA存在情况分离、筛选乳杆菌,大大提高免疫调节菌分离选择性,也明显缩短菌株筛选周期。
附图说明
图1为定向分离高亲和性IgA结合乳杆菌的流程图;
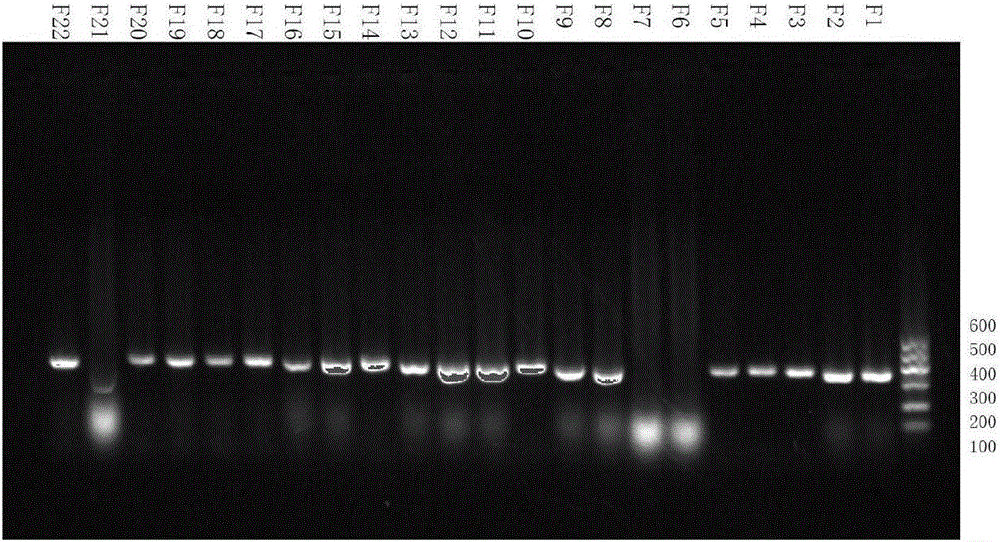
图2为从粪便中筛选的IgA包裹乳杆菌的乳杆菌特异性PCR电泳结果图;
图3为从唾液中筛选的IgA包裹乳杆菌的乳杆菌特异性PCR电泳结果图;
图4为不同来源的免疫调节性乳杆菌诱导小鼠腹腔巨噬细胞Raw264.7细胞因子TNF-α(a)、IL-6(b)、IL-12(c)和IL-10(d)的产生;其中,LPS代表脂多糖;F1代表粪便中磁珠吸附的乳杆菌;FS1代表磁珠吸附后上清液中的乳杆菌;T1代表唾液中磁珠吸附的乳杆菌;TS1代表磁珠吸附后上清液中的乳杆菌;其中*表示与空白组相比有显著差异,P<0.05;**表示与空白组相比有极显著差异,P<0.01;#表示与LPS阴性对照组相比有显著差异,P<0.05;##表示与LPS阴性对照组相比有极显著差异,P<0.01;
图5为TNF-α/IL-10(e)、IL-6/IL-10(f)和IL-12/IL-10(g);其中,LPS代表脂多糖;F1代表粪便中磁珠吸附的菌;FS1代表磁珠吸附后上清液中的菌;T1代表唾液中磁珠吸附的菌;TS1:磁珠吸附后上清液中的菌;其中*表示与空白组相比有显著差异,P<0.05;**表示与空白组相比有极显著差异,P<0.01;#表示与LPS阴性对照组相比有显著差异,P<0.05;##表示与LPS阴性对照组相比有极显著差异,P<0.01。
具体实施方案
下面将结合实施案例,对本发明进一步说明;下述实施例是说明性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。
实施例1:链霉亲和素磁珠的制备
按照以下方法制备链霉亲和素磁珠
(1)氨基化的Fe3O4纳米磁珠的制备
①将圆底烧瓶、转子和反应釜内胆都在王水中过夜浸泡,然后用洗洁精清洗干净,再用去离子水清洗后放入烘箱中烘干。
②向放有转子的圆底烧瓶中加入30mL乙二醇,加入6.5g 1,6-己二胺,再加入2.0g无水醋酸钠,最后加1.0g FeCl3·6H2O。
③将圆底烧瓶在50℃中油浴加上回流装置,并磁力搅拌大概0.5h-1h。反应至烧瓶内的溶液均匀。
④将圆底烧瓶内的溶液小心地转移至四氟乙烯内衬的高压反应釜内胆中,并将反应釜拧紧,放置在198℃高温下反应6h,结束后后自然冷却至室温(隔夜冷却)。
⑤将反应釜中液体的用玻璃棒搅匀,小心地倒入250mL烧杯中,用无水乙醇多次冲洗反应釜,清洗液也一并倒入烧杯中。
⑥利用超声将烧杯中的黑色磁性颗粒分散(大约5min),从超声水池将烧杯拿下来放在磁铁上,利用磁分离收集,黑色颗粒就会被吸在杯底,带着磁铁将烧杯中的溶液倒出,剩余的液体用移液枪吸出来。
⑦交替使用40mL去离子水和无水乙醇清洗,利用超声将烧杯中的黑色磁性颗粒分散(大约5min),从超声水池将烧杯拿下来放在磁铁上,利用磁分离收集,黑色颗粒就会被吸在杯底,带着磁铁将烧杯中的溶液倒出,剩余的液体用移液枪吸出来。
⑧重复步骤7两次。
将得到的黑色固体放置在50℃条件下干燥10h。
⑨干燥的黑色固体颗粒用玛瑙研钵中研磨成粉末,即得到氨基化的Fe3O4纳米磁珠,置于4℃储存备用。
(2)在氨基化磁珠中连接戊二醛
称取上述制好的氨基化磁珠2mg于离心管中,加入戊二醛/PBS缓冲溶液(体积比为5%)2mL,37℃摇床中反应2h,利用吸铁石的磁力吸住磁珠,用PBS缓冲溶液反复清洗5次以上,除去未结合的戊二醛。
(3)链霉亲和素磁珠
连接上戊二醛的氨基化磁珠中加2mLPBS缓冲溶液,然后再加入1mg/mL的链霉亲和素250uL,37℃摇床中反应12h,利用外加磁场用PBS缓冲液反复清洗5次以上,除去未结合的链霉亲和素,收集沉淀,即得到链霉亲和素化的纳米磁珠。磁珠清洗后放置在4℃环境中保存备用。
实施例2:使用链霉亲和素磁珠技术从人粪便中分离筛选免疫调节乳杆菌
该实施例为使用链霉亲和素磁珠技术从人粪便中分离筛选免疫调节乳杆菌,图1为定向分离高亲和性IgA结合乳杆菌的流程图。
具体包括以下步骤:
采用链霉亲和素磁珠法从粪便中分离筛选IgA包裹乳杆菌:
①称取1g健康人的粪便,加入10mL灭菌的蛋白胨缓冲液,漩涡混匀5min。
②在1000rpm下离心5min,取上清液,大的碎片和上清液通过无菌的200目的细胞过滤网过滤到一个新的管子里。
③将过滤的得到的离心管在10000rpm下离心5min,倒掉上清液。加入5mL的蛋白胨缓冲液,吹打混匀,10000rpm下离心5min,倒掉上清液,再重复一次。
④再将沉淀重悬在5mL蛋白胨缓冲液中,加入5%的山羊血清,冰浴15min。加入的生物素标记的兔抗人IgA,冰浴20min。然后入链霉亲和素标记的纳米免疫磁珠(即链霉亲和素磁珠),冰浴20min。
⑤用吸铁石在管子底部吸附,将上清液倒在一个新的灭菌管子中。之后用灭菌的蛋白胨缓冲液清洗3次菌体。
⑥最后将免疫磁珠吸附的菌体重悬在蛋白胨缓冲液中,进行下一步的实验。
在上一步骤中得到的IgA包裹菌在富集培养基上富集培养6-8h,然后在LAMVAB特异性培养基平板上进行划线培养,37℃培养48h,随后在每个平板上挑选具有特异性的,菌落形态各不相同的4株菌,然后将这4株菌分别接种到MRS液体培养基中,37℃培养24h,再在LAMVAB特异性培养基平板上进行划线纯化,挑单菌落培养,如此纯化3次,得到几十株菌。
富集培养基的基本成分为:阿拉伯糖20mM;核糖20mM;MgSO41mM;MnSO40.1mM;FeSO45uM。
MRS液体培养基扩大培养后,提取菌株细菌组DNA提取:
乳杆菌特异性PCR:
为证明上述分离的菌株是否为sIgA包裹乳杆菌,使用上述得到的纯化菌株的DNA进行乳杆菌特异性PCR。
PCR反应体系25uL:10buffer-MgCl2 2.5uL;MgCl2 2uL;dNTP 0.5uL;上游引物0.5uL;下游引物0.5uL;模板DNA 3uL;Taq酶0.5uL;DEPC水13.5uL。
PCR扩增程序为:94℃预变性5min;94℃变性30s,64℃退火30s,72℃延伸60s,30个循环;72℃延伸15min,冷却至12℃。
PCR结束后,在1%的琼脂糖凝胶电泳,剔除未跑出条带的菌株,从而得到从粪便中筛选的sIgA包裹乳杆菌。
实施例3:使用链霉亲和素磁珠技术从唾液中分离筛选免疫调节乳杆菌
该实施例为使用链霉亲和素磁珠技术从唾液中分离筛选IgA包裹乳杆菌。
一种基于链霉亲和素磁珠技术分离IgA包裹乳杆菌的方法具体包括以下步骤:
链霉亲和素磁珠的制备:与实施例1中相同。
采用链霉亲和素磁珠法从唾液中分离筛选IgA包裹乳杆菌:
①吸取1mL健康人的唾液,加入9mL灭菌的蛋白胨缓冲液,漩涡混匀5min。
②混匀后在10000rpm下离心5min,倒掉上清液。加入5mL灭菌的蛋白胨缓冲液,吹打混匀,10000rpm下离心5min,倒掉上清液,再重复一次。
④再将沉淀重悬在5mL蛋白胨缓冲液中,加入5%的山羊血清,冰浴15min。加入的生物素标记的兔抗人IgA,冰浴20min。然后入链霉亲和素标记的纳米免疫磁珠,冰浴20min。
⑤用吸铁石在管子底部吸附,将上清液倒在一个新的灭菌管子中。之后用灭菌的蛋白胨缓冲液清洗3次菌体。
⑥最后将免疫磁珠吸附的菌体重悬在蛋白胨缓冲液中,进行下一步的实验。
在上一步骤中得到的IgA包裹菌在富集培养基中富集培养6-8h,然后在LAMVAB特异性培养基平板上进行划线培养,37℃培养48h,随后在每个平板上挑选具有特异性的,菌落形态各不相同的4株菌,然后将这4株菌分别接种到MRS液体培养基中,37℃培养24h,再在LAMVAB特异性培养基平板上进行划线纯化,挑单菌落培养,如此纯化3次,得到几十株菌。
MRS液体培养基扩大培养后,一部分于40%的甘油冷冻保存菌体,一部分用于提取细菌基因组DNA。
纯化菌株细菌组DNA提取:
使用Ezup柱式细菌基因组DNA抽提试剂盒提取纯化菌株基因组DNA。
乳杆菌特异性PCR:
为证明上述分离的菌株是否为IgA包裹乳杆菌,使用上述得到的纯化菌株的DNA进行乳杆菌特异性PCR。
PCR反应体系25uL:10buffer-MgCl2 2.5uL;MgCl2 2uL;dNTP 0.5uL;上游引物0.5uL;下游引物0.5uL;模板DNA 3uL;Taq酶0.5uL;DEPC水13.5uL。
PCR扩增程序为:94℃预变性5min;94℃变性30s,64℃退火30s,72℃延伸60s,30个循环;72℃延伸15min,冷却至12℃。
PCR结束后,在1%的琼脂糖凝胶电泳,剔除未跑出条带的菌株,从而得到从唾液中分离筛选的sIgA包裹乳杆菌。
图2-3为从粪便和唾液中筛选的IgA包裹乳杆菌的乳杆菌特异性PCR后的电泳图。如图2所示F6、F7、F21没有条带,剩余的就为IgA包裹乳杆菌;如图3所示T2未跑出条带,剩余的就为IgA包裹乳杆菌。
实施例4:细胞实验
将上述实施例2-3得到的从粪便和唾液中得到的乳杆菌进行细胞实验,验证得到的乳杆菌体外诱导细胞因子产生的能力。
小鼠腹腔巨噬细胞Raw264.7与上述筛选出的细菌和磁珠吸附之后的上清液菌株进行共培养,将实验分为以下四组:
(1)空白组:加入100uL PBS;
(2)实验组:加入100uL浓度为1×105(CFU)/mL的F1(粪便中磁珠吸附的乳杆菌),F1上清液(磁珠吸附后上清液中的乳杆菌),T1(唾液中磁珠吸附的乳杆菌),T1上清液(磁珠吸附后上清液中的乳杆菌);
(3)阳性对照组:加入100uL浓度为1×105(CFU)/mL的L.rhamnosus GG(LGG)(阳性对照);
(4)阴性对照组:1μg/mL LPS;将小鼠腹腔巨噬细胞Raw264.7的浓度调至5×105(CFU)/mL。
37℃,5%CO2细胞培养箱培养12h,离心收集上清,严格按照ELISA试剂盒说明书要求,测定小鼠腹腔巨噬细胞Raw264.7中IL-6、TNF-α、IL-12和IL-10的水平。
由图4和图5中可看出LPS会显著上调IL-6、TNF-α和IL-12等炎性细胞因子的表达量,IL-6、TNF-α和IL-12的分泌量与空白组相比LPS组达到极显著差异(P<0.01);但是从图4中可得到F1和T1较FS1和TS1的IL-6、TNF-α和IL-12等炎性细胞因子的表达量低,但对IL-10的表达并没有影响,说明在本发明中初步验证了免疫调节性乳杆菌免疫调节性能;同样,在图5中TNF-α/IL-10的比值升高代表细胞因子分泌的不协调,会导致炎症反应,LPS、FS1和TS1的TNF-α/IL-10都显著高于空白组,TNF-α/IL-10与空白组相比LPS、FS1和TS1组达到显著差异(P<0.05)。基于上述结论,本发明方法可以分离筛选得到肠道免疫调节性乳杆菌。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
<110> 江南大学
<120> 一种定向分离免疫调节性肠道乳杆菌的方法
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 21
<212> DNA
<213> 人工序列
<400> 1
ctcaaaacta aacaaagttt c 21
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<400> 2
cttgtacaca ccgcccgtca 20
- 还没有人留言评论。精彩留言会获得点赞!