蛋白质GmGATA44在调控植物粒重中的应用的制作方法
本发明涉及生物
技术领域:
,具体涉及蛋白质GmGATA44在调控植物粒重中的应用。
背景技术:
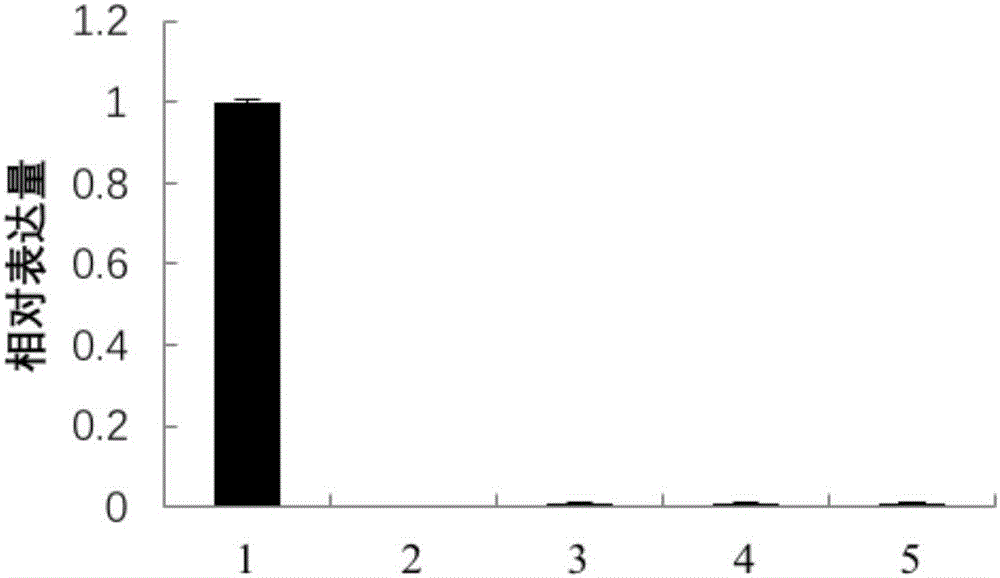
:大豆(Glycinemax(L.)Merr.)是优质的植物蛋白资源,也是健康的食用植物油源。目前,我国大豆平均亩产120公斤,而美国平均亩产214公斤,巴西平均亩产191公斤,阿根廷平均亩产185公斤。我国居民对高蛋白食品需求日益增加,国产大豆是食用大豆的主体。为了满足居民对植物蛋白的需求,提高国内大豆产量势在必行。提高大豆产量主要是通过提高单株粒数和百粒重来实现(刘玉库等,2006),其中百粒重是影响大豆单产的重要农艺性状。因此,挖掘调控植物百粒重的基因对大豆育种具有重要的意义。技术实现要素:本发明所要解决的技术问题是如何提高植物粒重。为解决上述技术问题,本发明首先提供了蛋白质GmGATA44在调控植物粒重中的应用;所述蛋白质GmGATA44可为a1)或a2)或a3):a1)氨基酸序列是序列表中序列2所示的蛋白质;a2)在序列表中序列2所示的蛋白质的N端或/和C端连接标签得到的融合蛋白质;a3)将序列表中序列2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与植物粒重相关的蛋白质。其中,序列表中序列2由314个氨基酸残基组成。为了使a1)中的蛋白质便于纯化,可在序列表中序列2所示的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。表1标签的序列标签残基序列Poly-Arg5-6(通常为5个)RRRRRFLAG8DYKDDDDKStrep-tagII8WSHPQFEKc-myc10EQKLISEEDL上述a3)中的蛋白质,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过10个氨基酸残基的取代和/或缺失和/或添加。上述a3)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。上述a3)中的蛋白质的编码基因可通过将序列表中序列1所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。编码所述蛋白质GmGATA44的核酸分子在调控植物粒重中的应用也属于本发明的保护范围。编码所述蛋白质GmGATA44的核酸分子可为如下b1)或b2)或b3)或b4)所示的DNA分子:b1)编码区如序列表中序列1所示的DNA分子;b2)核苷酸序列是序列表中序列1所示的DNA分子;b3)与b1)或(b2)限定的核苷酸序列具有75%或75%以上同一性,且编码所述蛋白质GmGATA44的DNA分子;b4)在严格条件下与(b1)或(b2)限定的核苷酸序列杂交,且编码所述蛋白质GmGATA44的DNA分子。其中,所述核酸分子可以是DNA,如cDNA、基因组DNA或重组DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。其中,序列表中序列1由945个核苷酸组成,序列表中序列1的核苷酸编码序列表中序列2所示的氨基酸序列。本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码所述蛋白质GmGATA44的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的所述蛋白质GmGATA44的核苷酸序列75%或者更高同一性的核苷酸,只要编码所述蛋白质GmGATA44,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列表的序列2所示的氨基酸序列组成的蛋白质GmGATA44的核苷酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。上述应用中,所述调控植物粒重可为增加植物粒重。上述应用中,所述粒重可为百粒重。为解决上述技术问题,本发明还提供了一种培育转基因植物的方法。本发明所提供的培育转基因植物的方法,可包括向受体植物中导入编码所述蛋白质GmGATA44的核酸分子,得到转基因植物的步骤;所述转基因植物与所述受体植物相比粒重增加。上述方法中,编码所述蛋白质GmGATA44的核酸分子可为如下b1)或b2)或b3)或b4)所示的DNA分子:b1)编码区如序列表中序列1所示的DNA分子;b2)核苷酸序列是序列表中序列1所示的DNA分子;b3)与b1)或(b2)限定的核苷酸序列具有75%或75%以上同一性,且编码所述蛋白质GmGATA44的DNA分子;b4)在严格条件下与(b1)或(b2)限定的核苷酸序列杂交,且编码所述蛋白质GmGATA44的DNA分子。其中,所述核酸分子可以是DNA,如cDNA、基因组DNA或重组DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。其中,序列表中序列1由945个核苷酸组成,序列表中序列1的核苷酸编码序列表中序列2所示的氨基酸序列。为解决上述技术问题,本发明还提供了一种植物育种方法。本发明所提供的植物育种方法,可包括如下步骤:增加植物中所述蛋白质GmGATA44的含量或活性,从而增加植物的粒重。上述任一所述方法中,所述粒重可为百粒重。上述任一所述方法中,所述植物可为如下c1)至c6)中的任一种:c1)双子叶植物;c2)单子叶植物;c3)豆科植物;c4)大豆;c5)大豆品种天隆一号;c6)大豆耐低氮品种坡黄。实验证明,将编码蛋白质GmGATA44的基因导入天隆一号,获得的转GmGATA44基因大豆。与天隆一号相比,转GmGATA44基因大豆的T3代种子的百粒重显著提高。因此,蛋白质GmGATA44在调控大豆粒重中具有重要的应用价值。附图说明图1为组织表达模式分析结果。图2为亚细胞定位分析结果。图3为转GmGATA44基因大豆的检测结果。图4为百粒重的统计结果。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。大豆耐低氮品种坡黄记载于如下文献中:郝青南,王程,陈水莲等.大豆苗期氮高效和氮敏感资源的筛选研究.大豆科学,2011,30(6):910-920。大豆耐低氮品种坡黄在下文中简称坡黄。大豆品种天隆一号记载于如下文献中:王瑞珍,杨中路,周新安等.高产优质春大豆天隆一号的引种与推广应用.大豆科技,2015,5:6-10.,其母本为中豆32,父本为中豆29,为中国农业科学院油料作物研究所经有性杂交和系谱法选育而成。大豆品种天隆一号在下文中简称天隆一号。载体pMD18-T为TaKaRa公司的产品,产品目录号为6011。SYBRPremixExTaqII试剂盒为TaKaRa公司的产品,产品目录号RR820A。2×SYBRPremixExTaqII和50×ROXReferenceDyeII均为SYBRPremixExTaqII试剂盒中的组件。载体pBI221-GFP记载于如下文献中:HuangWJ,SunW,LvHYetal.AR2R3-MYBtranscriptionfactorfromEpimediumsagittatumregulatestheflavonoidbiosyntheticpathway.PLoSOne,2013,8(8):e70778.doi:10.1371.入门载体pGWC记载于如下文献中:ChenQJ,ZhouHM,ChenJetal.UsingamodifiedTAcloningmethodtocreatentryclones.AnalyicalBiochemistry,2006,358(1):120-125.载体pB2GW7记载于如下文献中:KarimiM,InzéD,DepickerA.GATEWAYvectorsforAgrobacterium-mediatedplanttransformation.TrendsinPlantScience,2002,7(5):193-195.实施例1、GmGATA44基因的克隆1、提取坡黄叶片组织的总RNA,然后将该总RNA用逆转录酶反转录出第一链cDNA,即得到坡黄叶片组织的cDNA。2、以步骤1得到的坡黄叶片组织的cDNA为模板,以5’-GTGTTTTTATGTGTGTTCTCCCA-3’和5’-GTGAAGCGGTGGTAGCTCTAG-3’为引物进行PCR扩增,得到约1kb的PCR扩增产物。3、将步骤2得到的PCR扩增产物和载体pMD18-T连接,得到重组质粒pMD18-T-GmGATA44。对重组质粒pMD18-T-GmGATA44进行测序。测序结果表明,重组质粒pMD18-T-GmGATA44中含有序列表中序列1所示的DNA分子(以下命名为GmGATA44基因)。实施例2、组织表达模式分析1、提取处于成株期的坡黄材料(坡黄根、坡黄茎、坡黄幼嫩叶片、坡黄成熟花或坡黄幼嫩种子)的总RNA,将该总RNA用逆转录酶反转录出第一链cDNA,得到坡黄材料的cDNA。2、以步骤1得到的坡黄材料的cDNA为模板,使用SYBRPremixExTaqII试剂盒检测坡黄材料中GmGATA44基因的相对表达量(以GmACT11基因作为内参基因)。检测GmGATA44基因的引物为正向引物1:5’-GTCGCTTTGCAATGCCTGC-3’和反向引物1:5’-GCTTCCACAATAACTGCTCCATC-3’,目的片段如序列表中序列1自5’末端起第591位至第692位所示。检测GmACT11基因的引物为正向引物2:5’-ATCTTGACTGAGCGTGGTTATTCC-3’和反向引物2:5’-GCTGGTCCTGGCTGTCTCC-3’。反应体系为20μL,由10μL2×SYBRPremixExTaqII、0.6μL浓度为10μM的正向引物、0.6μL浓度为10μM的反向引物、0.4μL50×ROXReferenceDyeII、2μL坡黄材料的cDNA和6.4μL无核酸酶水组成。荧光定量PCR检测的反应程序为:95℃预变性15min;95℃变性10sec,60℃退火15sec,72℃延伸20sec,40个循环。以坡黄幼嫩叶片中GmGATA44基因的相对表达量作为1,其它坡黄材料中GmGATA44基因的相对表达量见图1(1为坡黄幼嫩叶片,2为坡黄根,3为坡黄茎,4为坡黄成熟花,5为坡黄幼嫩种子)。结果表明,GmGATA44基因在坡黄幼嫩叶片中的相对表达量较高,在坡黄根、坡黄茎、坡黄成熟花和坡黄幼嫩种子中的相对表达量均极低。实施例3、亚细胞定位分析一、重组质粒pBI221-GmGATA44的构建1、以实施例1步骤3得到的重组质粒pMD18-T-GmGATA44为模板,以5’-CGGGATCCATGATTCCAGCCTATCGCCA-3’(下划线为限制性内切酶BamHI的识别位点)和5’-GCGTCGACATGAACAAGGCCATAAGATAA-3’(下划线为限制性内切酶SalI的识别位点)为引物进行PCR扩增,得到约960bp的PCR扩增产物。2、用限制性内切酶BamHI和SalI双酶切步骤1得到的PCR扩增产物,回收约960bp的片段甲。3、用限制性内切酶BamHI和SalI双酶切载体pBI221-GFP,回收约4.5kb的载体骨架甲。4、将片段甲和载体骨架甲连接,得到重组质粒pBI221-GmGATA44。根据测序结果,对重组质粒pBI221-GmGATA44进行结构描述如下:向载体pBI221-GFP的BamHI和SalI酶切位点之间插入核苷酸序列是序列表中的序列1自5’末端起第1位至第942位所示的DNA分子。二、亚细胞定位分析1、用镊子剥取洋葱内表皮,分割成小块(1cm×1cm),然后置于MS固体培养基上。2、完成步骤1后,采用基因枪介导的遗传转化方法(ZhengLL,GaoZ,WangJ,etal.MolecularcloningandfunctionalcharacterizationofanovelCBL-interactingproteinkinaseNtCIPK2inthehalophyteNitrariatangutorum[J].GeneticsandMolecularResearch,2014,13(3):4716-4728.),将重组质粒pBI221-GmGATA44转化洋葱内表皮。3、完成步骤2后,取所述洋葱内表皮,置于MS固体培养基上25℃暗培养24h;然后置于载玻片上,在激光共聚焦显微镜下观察;待观察到荧光后,在所述洋葱内表皮上滴加0.5mol/L的NaCl水溶液(目的为进行质壁分离),然后继续在激光共聚焦显微镜下观察。按照上述方法,将重组质粒pBI221-GmGATA44替换为载体pBI221-GFP,其它步骤均不变,在共聚焦显微镜下观察,作为对照。实验结果见图2(a和b为白光,c和d为紫外光,e和f为白光和紫外光的叠加,a、c和e为重组质粒pBI221-GmGATA44,b、d和f为载体pBI221-GFP):载体pBI221-GFP转化洋葱内表皮后,在细胞核、细胞质和细胞膜上均可观察到绿色荧光;重组质粒pBI221-GmGATA44转化洋葱内表皮后,仅在细胞核上观察到绿色荧光。因此,GmGATA44蛋白定位在细胞核。实施例4、转GmGATA44基因大豆的获得及其鉴定一、重组质粒pB2GW7-GmGATA44和重组农杆菌的构建1、重组质粒pB2GW7-GmGATA44的构建(1)以实施例1步骤3中的重组质粒pMD18-T-GmGATA44为模板,以5’-ATGATTCCAGCCTATCGCC-3’和5’-TCAATGAACAAGGCCATAAGATA-3’为引物,进行PCR扩增,得到约950bp的PCR扩增产物。(2)用限制性内切酶AhdI酶切入门载体pGWC,回收约2500bp的载体骨架1。(3)完成步骤(2)后,将步骤(1)得到的PCR扩增产物和载体骨架1连接,得到重组质粒pGWC-GmGATA44。(4)完成步骤(3)后,将重组质粒pGWC-GmGATA44和载体pB2GW7进行LR重组反应,得到重组质粒pB2GW7-GmGATA44。对重组质粒pB2GW7-GmGATA44进行测序。测序结果表明,重组质粒pB2GW7-GmGATA44中含有序列表中序列1所示的DNA分子,表达序列表中序列2所示的蛋白质(以下命名为GmGATA44蛋白或蛋白质GmGATA44)。2、重组农杆菌的构建将重组质粒pB2GW7-GmGATA44导入根癌农杆菌EHA105,得到重组农杆菌,命名为EHA105/pB2GW7-GmGATA44。将载体pB2GW7导入根癌农杆菌EHA105,得到重组农杆菌,命名为EHA105/pB2GW7。二、T0代拟转GmGATA44基因大豆的获得采用农杆菌介导的大豆子叶节遗传转化方法(PazM,MartinezJC,KalvigABetal.ImprovedcotyledonarynodemethodusinganalternativeexplantderivedfrommatureseedforefficientAgrobacterium-mediatedsoybeantransformation.PlantCellReports,2006,25(3):206-213),将EHA105/pB2GW7-GmGATA44转化天隆一号(转化过程中,用除草剂进行筛选),获得T0代拟转GmGATA44基因大豆。按照上述方法,将EHA105/pB2GW7-GmGATA44替换为EHA105/pB2GW7,其它步骤均不变,得到T0代转空载体大豆,以下简称转空载体大豆。三、拟转GmGATA44基因大豆的检测1、分子水平检测随机选取4个T0代拟转GmGATA44基因大豆植株(分别命名为植株1、植株2、植株3和植株4)进行分子水平检测。待测大豆为植株1、植株2、植株3、植株4、天隆一号或转空载体大豆。以待测大豆叶片组织的基因组DNA为模板,以5’-CATTTGGAGAGGACTCCGG-3’和5’-CCTATAAGAACCCTAATTCC-3’为引物进行PCR扩增,得到PCR扩增产物,然后进行如下判断:如果PCR扩增产物中含有大小为1.4kb的条带,则待测大豆即为转GmGATA44基因大豆;如果PCR扩增产物中不含有大小为1.4kb的条带,则待测大豆即为非转GmGATA44基因大豆。按照上述方法,将待测大豆叶片组织的基因组DNA替换为重组质粒pB2GW7-GmGATA44,其它步骤均不变,作为阳性对照。部分实验结果见图3中a(M为DNA分子Marker,1为植株1,2为植株2,3为植株3,4为植株4,5为天隆一号,6为重组质粒pB2GW7-GmGATA44)。结果表明,转空载体大豆和天隆一号的PCR扩增产物中均不含有大小为1.4kb的条带,植株1、植株2、植株3和植株4的PCR扩增产物中均含有大小为1.4kb的条带。2、蛋白水平检测完成步骤1后,采用Bar免疫检测试剂盒对植株1、植株2、植株3和植株4进行蛋白水平检测。Bar免疫检测试剂盒为美国Envirologix公司的产品,产品目录号为AS013LS。检测试纸条、离心管、研磨棒和EB2抽屉缓冲液均为Bar免疫检测试剂盒中的组件。(1)处理液的获得待测大豆为植株1、植株2、植株3、植株4、天隆一号或转空载体大豆。取待测大豆的叶片0.1g,置于离心管中,先用力旋转研磨棒20-30s(目的为捣碎叶片),然后加入500μLEB2抽提缓冲液,用力旋转研磨棒20-30s,得到处理液。(2)检测将检测试纸条恢复至室温,然后垂直插入处理液(浸入深度约为0.5cm),10min后取出放平阅读检测结果。(3)结果判断检测线及对照线一般可在3-7min内出现,检测标准为:在检测试纸条上仅出现一条紫红色条带,即一条紫红色质控线,为阴性结果;在检测试纸条上出现两条紫红色条带,一条为紫红色检测线,一条为紫红色质控线,此为阳性结果。凡能得到两条紫红色条带的待测大豆即为转GmGATA44基因大豆;凡能得到一条紫红色条带的待测大豆即为非转GmGATA44基因大豆。部分实验结果见图3中b(WT为天隆一号,1为植株1,2为植株2,3为植株3,4为植株4)。结果表明,转空载体大豆和天隆一号在检测试纸条上均仅出现一条紫红色条带,植株1、植株2、植株3和植株4在检测试纸条上均出现两条紫红色条带。上述结果表明,植株1、植株2、植株3和植株4均为转GmGATA44基因大豆植株。每个转GmGATA44基因大豆植株及其后代均为一个株系。将植株1及其后代的株系命名为GATA44OX-1,将植株2及其后代的株系命名为GATA44OX-2。将植株1经连续两代自交,获得T2代GATA44OX-1的纯合株系。将植株2经连续两代自交,获得T2代GATA44OX-2的纯合株系。将转空载体大豆经连续两代自交后,获得T2代纯合转空载体大豆。四、转GmGATA44基因大豆植株的实时定量PCR检测待测大豆为GATA44OX-1的T2代纯合植株、GATA44OX-2的T2代纯合植株、天隆一号或T2代纯合转空载体大豆。1、提取处于幼苗期的待测大豆叶片组织的总RNA,将该总RNA用逆转录酶反转录出第一链cDNA,得到待测大豆的cDNA。2、以步骤1得到的待测大豆的cDNA为模板,使用SYBRPremixExTaqII试剂盒检测待测大豆中GmGATA44基因的相对表达量(以GmACT11基因作为内参基因)。检测GmGATA44基因的引物为正向引物1:5’-GTCGCTTTGCAATGCCTGC-3’和反向引物1:5’-GCTTCCACAATAACTGCTCCATC-3’,目的片段如序列表中序列1自5’末端起第591位至第692位所示。检测GmACT11基因的引物为正向引物2:5’-ATCTTGACTGAGCGTGGTTATTCC-3’和反向引物2:5’-GCTGGTCCTGGCTGTCTCC-3’。反应体系为20μL,由10μL2×SYBRPremixExTaqII、0.6μL浓度为10μM的正向引物、0.6μL浓度为10μM的反向引物、0.4μL50×ROXReferenceDyeII、2μL坡黄材料的cDNA和6.4μL无核酸酶水组成。荧光定量PCR检测的反应程序为:95℃预变性15min;95℃变性10sec,60℃退火15sec,72℃延伸20sec,40个循环。以天隆一号中的GmGATA44基因的相对表达量作为1,GATA44OX-1的T2代纯合植株、GATA44OX-2的T2代纯合植株或T2代纯合转空载体大豆中GmGATA44基因的相对表达量部分结果见图3中c(WT为天隆一号)。结果表明,与天隆一号相比,GATA44OX-1的T2代纯合植株和GATA44OX-2的T2代纯合植株中GmGATA44基因的相对表达量显著提高,T2代纯合转空载体大豆中GmGATA44基因的相对表达量无显著差异。五、统计转GmGATA44基因大豆的百粒重将30株待测大豆材料(T2代GATA44OX-1纯合株系、T2代GATA44OX-2纯合株系、天隆一号或T2代纯合转空载体大豆)种植于中国农业科学院油料作物研究所转基因圃(株距10cm,行距40cm),成熟后将种子收获并晾干。随机取100粒成熟种子作为样品1。随机取100粒成熟种子作为样品2。随机取100粒成熟种子作为样品3。将样品1、样品2和样品3先分别称重,再取平均值,得到待测大豆材料种子的百粒重。实验结果见图4(WT为天隆一号)。结果表明,与天隆一号种子相比,T2代GATA44OX-1纯合株系的种子和T2代GATA44OX-2纯合株系的种子的百粒重显著提高(分别增加了12.9%和33.3%),T2代纯合转空载体大豆的种子的百粒重无显著差异。上述结果表明,蛋白质GmGATA44在调控大豆粒重(如百粒重)中具有重要的应用价值。<110>中国农业科学院油料作物研究所<120>蛋白质GmGATA44在调控植物粒重中的应用<160>2<170>PatentInversion3.5<210>1<211>945<212>DNA<213>大豆(Glycinemax(L.)Merr.)<400>1atgattccagcctatcgccactcagtatcttctgttatgcctctggatcttaatgaagat60caaaaccacgagttcttcagtccaattcatcacccttcctcttcgttttcttctctatct120tcatcatatcctattctcttcaacccgccaaatcaagatcaagaagctcgatcatacgac180tgggaaacaacaaagcacttaccaagtcatgaagaagaggctgagaagattatccctact240agtggatcatggggtcactcggtggaagaaagtgagcataaggtgacagtttggagaaaa300gaagagaggaatgaaaatcttgctgaagatggttcggtgaagtggatgccttcgaagatg360agaattatgcggaagatgttggtgtccaatcaaactgatgcatacacttcagacaacaac420actacgcacaagtttgatgatcataaacaacaactgtcgtcaccgcttggaattgatgat480aacagcagcaacaactattcagacaaaagtaacaacagtattgttagggtttgttctgat540tgccacaccaccaagactcctctatggaggagtggaccaagaggccccaagtcgctttgc600aatgcctgcggaattcgacaaaggaaggcaagacgagccatggcagctgctgcggcggca660gcattgggagatggagcagttattgtggaagctgagaaatctgtgaagggaaagaagttg720cagaagaagaaagagaagaagacaagaattgagggtgcagctcagatgaaaatgaagcgg780aagcttggagttggagcaaaggcatcacaaagtagaaacaagtttggttttgaggatttg840acattgcgcttgagaaagaacttggctatgcatcaagttttccctcaggacgagaaggag900gctgcgatcctcctcatggctttatcttatggccttgttcattga945<210>2<211>314<212>PRT<213>大豆(Glycinemax(L.)Merr.)<400>2MetIleProAlaTyrArgHisSerValSerSerValMetProLeuAsp151015LeuAsnGluAspGlnAsnHisGluPhePheSerProIleHisHisPro202530SerSerSerPheSerSerLeuSerSerSerTyrProIleLeuPheAsn354045ProProAsnGlnAspGlnGluAlaArgSerTyrAspTrpGluThrThr505560LysHisLeuProSerHisGluGluGluAlaGluLysIleIleProThr65707580SerGlySerTrpGlyHisSerValGluGluSerGluHisLysValThr859095ValTrpArgLysGluGluArgAsnGluAsnLeuAlaGluAspGlySer100105110ValLysTrpMetProSerLysMetArgIleMetArgLysMetLeuVal115120125SerAsnGlnThrAspAlaTyrThrSerAspAsnAsnThrThrHisLys130135140PheAspAspHisLysGlnGlnLeuSerSerProLeuGlyIleAspAsp145150155160AsnSerSerAsnAsnTyrSerAspLysSerAsnAsnSerIleValArg165170175ValCysSerAspCysHisThrThrLysThrProLeuTrpArgSerGly180185190ProArgGlyProLysSerLeuCysAsnAlaCysGlyIleArgGlnArg195200205LysAlaArgArgAlaMetAlaAlaAlaAlaAlaAlaAlaLeuGlyAsp210215220GlyAlaValIleValGluAlaGluLysSerValLysGlyLysLysLeu225230235240GlnLysLysLysGluLysLysThrArgIleGluGlyAlaAlaGlnMet245250255LysMetLysArgLysLeuGlyValGlyAlaLysAlaSerGlnSerArg260265270AsnLysPheGlyPheGluAspLeuThrLeuArgLeuArgLysAsnLeu275280285AlaMetHisGlnValPheProGlnAspGluLysGluAlaAlaIleLeu290295300LeuMetAlaLeuSerTyrGlyLeuValHis305310当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1