一种猪霍乱沙门氏菌减毒载体菌及其构建方法与流程
本发明属于动物细菌基因工程技术领域。
背景技术:
基因工程方法致弱的鼠伤寒沙门氏菌作为载体表达外源基因,广泛用于人类和动物的各种疾病的治疗研究,取得了良好效果。但是在许多报道中的沙门氏菌载体,要么使减毒载体过度减毒,失去了免疫原性,或者虽保留了良好的免疫原性,但是载体菌株却减毒不够,缺乏安全性。
猪霍乱沙门氏菌是猪的重要病原菌。关于以猪霍乱沙门氏菌为载体递送猪的其他病原抗原的研究,在国内外已有少量报道,如:华中农业大学的陈焕春院士实验室以猪霍乱沙门氏菌中国弱毒疫苗标准株C500为载体递送猪肺炎支原体抗原;军事医学科学院军事兽医研究所的涂长春实验室利用猪霍乱沙门氏菌中国弱毒疫苗标准株C500为载体递送猪瘟病毒的抗原。这些研究结果都有如下的共同点:一是这些候选疫苗株对猪霍乱沙门氏强毒株的攻毒(攻毒剂量>10×LD50)可以产生100%的保护;二是对外源病原的攻毒虽然有一定的作用,但是保护效率不够理想。其原因可能是使用了猪霍乱沙门氏菌弱毒疫苗标准株C500为载体,虽然猪霍乱沙门氏菌弱毒疫苗标准株C500对宿主足够减毒,但是其产生的免疫原性似乎还不足以诱导理想的针对外源抗原的免疫反应。因此迫切需要研制一种疫苗载体,既要使疫苗载体足够减毒,保证动物完全的安全性,又要使疫苗载体能诱导出优秀免疫原性,高质量地抗击载体菌和其携带的外源抗原的病原感染。
本实验室在前期研究过程中发现,用阿拉伯糖调控猪霍乱沙门氏菌的crp毒力基因所产生的减毒载体菌(中国专利申请CN 104498418A)可以诱导出对成年BALB/c小鼠较好的免疫原性,但是减毒株免疫后,用高剂量20×LD50的野生型猪链球菌2型(SS2)比用10×LD50的SS2攻毒的保护效率低,同时减毒株在小鼠的肝脏和脾脏仍然有减毒菌株的复制,表明作为减毒株的安全性和免疫原性还存在一定的风险和不足。
sopB 基因是由沙门氏菌SPI-1编码,该基因的敲除能够减少鼠伤寒沙门氏菌引起宿主肠道的炎性反应,减少鼠伤寒沙门氏菌对宿主免疫系统的应激,减轻对宿主免疫系统的损伤,从而提高对宿主的安全性,同时,可以提高宿主对鼠伤寒沙门氏菌和其携带的外源抗原的免疫原性。不同动物有不同易感的沙门氏菌,反之,同一种沙门氏菌对于不同动物也有不同的致病性,其所含的毒力基因的作用也会不同。在猪霍乱沙门氏菌中缺失sopB基因,是否会达到相同的降低猪霍乱沙门氏菌感染导致的炎症反应,提高猪霍乱沙门氏菌对猪的免疫原性,到目前为止国内外还未见报过。
技术实现要素:
针对现有技术缺陷,本发明目的在于提供一种具有安全性较高和免疫原性较强的特点的猪霍乱沙门氏菌减毒载体菌。
本发明所述减毒载体菌为缺失了ΔmanA、Δcrp::TT araC PBAD、ΔrelA::araCPBADlacI TT、ΔsopB和ΔasdA基因的C78-3猪霍乱沙门氏菌,命名为rSC0016。
rSC0016保藏在位于中国北京市朝阳区北辰西路1号院3号的中国普通微生物菌种保藏管理中心(CGMCC),保藏日为2016年6月20日,保藏编号为CGMCC NO.12645,该生物材料的分类命名为:减毒猪霍乱沙门氏菌,拉丁文学名为:Salmonella choleraesuis。
本发明以C78-3猪霍乱沙门氏菌为母体,在阿拉伯糖调控猪霍乱沙门氏菌载体毒力基因表达的基础上,由于敲除了猪霍乱沙门氏菌中的sopB 基因,使载体菌具备减毒的安全特性时,提高载体菌诱导宿主的免疫原性的能力,使载体菌成为安全和高效保护性的疫苗株;同时敲除了载体菌的asd 基因,使载体菌与其携带的原核表达外源抗原的asd+ 载体形成致死平衡系统,避免使用具有抗生素标记的原核表达载体。
本发明达到了如下的有益效果:
1、免疫原性强:
将阿拉伯糖调控猪霍乱沙门氏菌载体毒力基因延迟缺失和延迟表达外源抗原的技术与敲除猪霍乱沙门氏菌引起宿主炎症的sopB基因方法相结合,使载体菌具备减毒的安全特性时,提高载体菌诱导宿主的免疫原性。实验证明,含有ΔsopB突变的rSC0016株比不含有ΔsopB 的rSC0011株(ΔmanA、Δcrp::TT araC PBAD、ΔrelA::araC PBADlacI TT和ΔasdA)所诱导的免疫应答更好。例如:携带猪链球菌2型的SaoA蛋白的rSC0016(pS-SaoA),可以100%抵抗高剂量的野生型猪链球菌2型的攻击,证明了rSC0016能够诱导出完美的免疫原性,这对于猪的各种疾病具有极大的市场应用性和创造出显著的经济效益。
以上不含有ΔsopB 的rSC0011株(ΔmanA、Δcrp::TT araC PBAD、ΔrelA::araCPBADlacI TT和ΔasdA)公布于2015年(Zhenying Jib, Jing Shangb, Yuan Li, Shifeng Wang, Huoying Shi, Live attenuated Salmonella enterica serovar Choleraesuis vaccinevector displaying regulated delayed attenuation and regulateddelayed antigen synthesis to confer protection againstStreptococcus suis in mice, Vaccine 33 (2015) 4858–4867)。
2、更高安全性:
相比于不含有ΔsopB 突变的rSC0011株(ΔmanA、Δcrp::TT araC PBAD、ΔrelA::araCPBADlacI TT和ΔasdA),本发明含有ΔsopB 突变的rSC0016更加减毒,因而具有更高的安全性,适合作为疫苗载体免疫刚断奶的仔猪。
本发明另一目的在于提供上述猪霍乱沙门氏菌减毒载体菌的构建方法。
本发明构建方法包括以下步骤:
1)构建含ΔsopB突变基因的自杀载体:
以猪霍乱沙门氏菌C78-3的基因组为模板,通过引物扩增同源臂片段,敲除猪霍乱沙门氏菌C78-3的基因序列中的sopB 基因片段,并将敲除猪霍乱沙门氏菌C78-3的基因序列中的sopB 基因片段后的片段基因连接至自杀质粒pRE112中,取得缺失ΔsopB 基因序列自杀质粒;再将缺失ΔsopB 基因序列自杀质粒转化至工程菌大肠杆菌χ7213中,制得含ΔsopB突变基因的自杀载体,命名为χ7213(pS006);
2)构建引入ΔsopB突变基因的rSC0013株:
以缺失了ΔmanA、ΔPcrp::TT araC PBADcrp和ΔrelA::araC PBADlacI TT基因的C78-3猪霍乱沙门氏菌为受体菌,以含ΔsopB突变基因的自杀载体为供体菌,将供体菌和受体菌进行接合,经培养、纯化,取得引入ΔsopB突变基因的rSC0013株(ΔmanA,ΔPcrp::TT araC PBADcrp,ΔrelA::araC PBADlacI TT,ΔsopB);
3)构建猪霍乱沙门氏菌减毒载体菌rSC0016:
以引入ΔsopB突变基因的rSC0013株为受体菌,以含ΔasdA自杀载体χ7213(pS004)为受体菌,将供体菌和受体菌进行接合,经培养、纯化,取得猪霍乱沙门氏菌减毒载体菌rSC0016。
本发明采用无抗性标记的自杀载体作为构建猪霍乱沙门氏菌载体的方法,可以避免使用抗生素标记的载体,可以安全使用在临床实践中;此外采用致死平衡系统携带外源抗原,可以保证只有携带外源抗原的疫苗株才能在生产疫苗和进入宿主体内存活,提高疫苗的免疫效率。
进一步地,本发明所述步骤1)中,以猪霍乱沙门氏菌C78-3的基因组为模板,由引物P1和P2经PCR扩增得pipC同源臂基因序列;以猪霍乱沙门氏菌C78-3的基因组为模板,由引物P3和P4经PCR扩增得pipD基因的同源臂序列;将pipC同源臂基因序列和pipD基因的同源臂序列以碱基长度1:1的比例混合制得混合产物;以混合产物作为模板,利用引物P1和引物P4进行Overlap PCR扩增得到长度为493bp的同源臂片段,并将该同源臂片段连接至pM18T克隆载体,转化之JM109感受态细胞,提取上述细菌质粒,再经KpnI和SacI酶切,连接至具有氯霉素和蔗糖筛选标记的自杀质粒载体pRE112中,得到缺失ΔsopB基因序列的pRE112载体。
所述引物P1、P2、P3和P4的核苷酸序列分别为:
P1:5’- CGCAGAGCTCATATCACCTATAATTATC - 3’;
P2:5’- CATATAGTTACCTCAAGACAGCGTTTTTAATATTCCTG - 3’;
P3:5’- CAGGAATATTAAAAACGCTGTCTTGAGGTAACTATATG - 3’;
P4:5’- ATTAGGTACCAGCAGTATTGTCTGCGTCAGC - 3’。
所述步骤2)中,取缺失了ΔmanA、ΔPcrp::TT araC PBADcrp和ΔrelA::araC PBADlacI TT基因的C78-3猪霍乱沙门氏菌于LB液体培养基中,经10-12小时培养,制得受体菌菌液;将含ΔsopB突变基因的自杀载体于LB液体中,经10-12小时培养,制得供体菌培养菌液;所述用于培养含ΔsopB突变的自杀载体的LB液体中,2,6-二氨基庚二酸(DAP)含量为50ug/mL,氯霉素含量为25mg/mL。
所述步骤2)中,纯化后,挑取单菌落于LB液体培养基中培养至云雾状,10倍系列稀释涂布于LB固体培养基中;从固体培养基挑取单菌落分别于LB板、含氯霉素的LB板划线,于37℃环境下经10-12小时培养,然后挑取只在LB中生长的引入ΔsopB突变的rSC0013株。
所述步骤3)中,取rSC0013株于LB液体培养基中,经10-12小时培养,制得制得受体菌菌液;取含ΔasdA自杀载体χ7213(pS004) 于LB液体培养基中,经10-12小时培养,制得供体菌培养菌液;所述用于培养含ΔasdA自杀载体χ7213(pS004)的LB液体培养基中,2,6-二氨基庚二酸(DAP)含量为50ug/mL,氯霉素含量为25mg/mL。
试验证明,本发明在阿拉伯糖调控毒力基因延迟减毒和延迟表达外源抗原的载体上构建的含有ΔsopB突变基因的猪霍乱沙门氏菌载体,能够降低猪霍乱沙门氏菌减毒株的毒力,减轻减毒株引起的炎性反应对宿主的损伤作用,显著提高猪霍乱沙门氏菌所携带的外源抗原诱导宿主的免疫原性,从而使含有sopB突变基因的携带猪链球菌SaoA蛋白的猪霍乱沙门氏菌疫苗候选株rSC0016(pS-SaoA)能够对SS2及SS7野毒株的感染提供完全的保护和交叉保护作用。
附图说明
图1是ΔsopB基因缺失构建图。
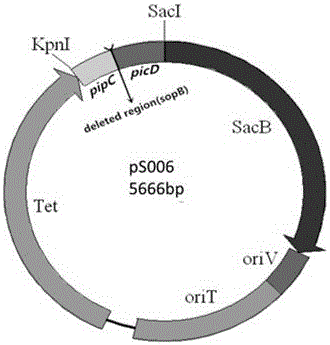
图2是ΔsopB突变自杀载体图。
图3是含ΔsopB突变的χ7213(pS006)的PCR鉴定电泳图。其中,泳道1:DL2000 DNA marker;泳道2-7:阳性结果(即:鉴定为突变阳性的样品进一步纯化后随机抽取菌落的PCR电泳图;以下出现的“阳性结果”,除非特殊说明,均为这种情况)。
图4是含ΔsopB突变的rSC0013的PCR鉴定电泳图。其中,泳道1:DL2000 DNA marker;泳道2-3:rSC0017阳性结果;泳道4-6:rSC0013阳性结果。
图5是含ΔasdA突变rSC0016的PCR鉴定电泳图。其中,泳道1:DL2000 DNA marker;泳道2-6:rSC0016阳性结果。
图6是不同毒株感染兔回肠的炎性分泌物体积和接种后时间关系图。图中,##:与野毒株C78-3株比较(p<0.01),**:与LB空白对照组比较(P<0.01)。
图7是不同毒株感染兔回肠的炎性分泌物细菌总数。图中, #:与野毒株C78-3株比较(p<0.05),**:与LB空白对照组比较(P<0.01)。
图8是接种野毒株 C78-3后兔回肠的病理变化(H.E染色)图片。
图9是接种rSC0016后兔回肠的病理变化(H.E染色)图片。
图10是接种LB后兔回肠的病理变化(H.E染色)图片。
图11是扩增saoA基因的PCR鉴定电泳图。其中,泳道1:DL2000 DNA Marker;泳道2-6:扩增saoA基因PCR电泳图。
图12是pS-SaoA重组表达质粒的酶切鉴定电泳图。其中,泳道1:DL10000 DNA Marker;泳道2-4:阳性结果酶切电泳图。
图13是重组质粒的酶切鉴定电泳图。其中,泳道1:DL10000 DNA Marker;泳道2:rSC0016(pS-SaoA);泳道3:rSC0011(pS-SaoA);泳道4:rSC0018(pS-SaoA)。
图14是Western-blot检测SaoA在rSC0016(pS-SaoA)、rSC0018(pS-SaoA)、rSC0011(pS- SaoA)菌株中的表达电泳图。其中,泳道1:蛋白Marker;泳道2:rSC0011(pS-SaoA);泳道3:rSC0016(pS- SaoA);泳道4:rSC0018(pS-SaoA)。
图15是pS-SaoA质粒在rSC0016(pS-SaoA)中传10-50代酶切电泳图。其中,泳道1:DL10000 DNA marker;泳道2-6:rSC0016(pS-SaoA)10-50代。
图16是减毒株在BALB/c小鼠肝脏中定植能力比较实验图。
图17是减毒株在BALB/c小鼠脾脏中定植能力比较实验图。
图18是减毒株在BALB/c小鼠肠道派伊尔氏结中定植能力比较实验图。
图19是免疫减毒株BALB/c小鼠血清中抗SaoA的IgG图。
图20是免疫减毒株BALB/c小鼠血清中抗沙门氏菌OMPs的IgG图。
图21是免疫减毒株BALB/c小鼠阴道冲洗液中抗SaoA的IgA图。
图22是ELISA检测免疫减毒株BALB/c小鼠肺和脾中细胞因子IFN-γ含量的图。
图23是ELISA检测免疫减毒株BALB/c小鼠肺和脾中IL-4含量的图。
图24是ELISA检测免疫减毒株BALB/c小鼠血清中细胞因子IFN-γ含量的图。
图25是ELISA检测免疫减毒株BALB/c小鼠血清中IL-4含量图。
图26是ELISA检测免疫减毒株试验猪血清中针对猪链球菌SS2 SaoA蛋白的抗体IgG水平图。
图27是ELISA检测免疫减毒株试验猪血清中针对猪霍乱沙门氏菌外膜蛋白OMPs抗体IgG水平图。
图28是ELISA检测免疫减毒株试验猪鼻腔棉拭子中针对猪链球菌SS2SaoA的粘膜抗体IgA水平图。
图29是ELISA检测免疫减毒株试验猪肺和脾中细胞因子IFN-γ含量的图。
图30是ELISA检测免疫减毒株试验猪肺和脾中细胞因子IL-4含量的图。
图31是ELISA检测免疫减毒株试验猪肺和脾中细胞因子IL-17含量的图。
图32是ELISA检测免疫减毒株试验猪血清中细胞因子IFN-γ含量的图。
图33是ELISA检测免疫减毒株试验猪肺和脾中细胞因子IL-4含量的图。
图34是ELISA检测免疫减毒株试验猪肺和脾中细胞因子IL-17含量的图。
图35是免疫减毒株试验猪经SS2攻毒的存活率比较的图。
图36是PBS对照组试验猪经SS2攻毒脑组织病理变化照片。
图37是PBS对照组试验猪经SS2攻毒肺组织病理变化照片。
图38是免疫rSC0018(pYA3493)株试验猪经SS2攻毒脑组织病理变化照片。
图39是免疫rSC0018(pYA3493)株试验猪经SS2攻毒肺组织病理变化照片。
图40是免疫rSC0018(pS-SaoA)株试验猪经SS2攻毒脑组织病理变化照片。
图41是免疫rSC0018(pS-SaoA)株试验猪经SS2攻毒肺组织病理变化照片。
图42是免疫rSC0016(pYA3493)株试验猪经SS2攻毒脑组织病理变化照片。
图43是免疫rSC0016(pYA3493)株试验猪经SS2攻毒肺组织病理变化照片。
图44是免疫rSC0016(pS-SaoA)株试验猪经SS2攻毒脑组织照片。
图45是免疫rSC0016(pS-SaoA)株试验猪经SS2攻毒肺组织照片。
图46是经SS2攻毒后时间与体温的变化关系图。
具体实施方式
为了阐明本发明的技术方案及技术目的,下面结合附图及具体实施方式对本发明做进一步的介绍。
一、构建猪霍乱沙门氏菌减毒载体:
1、构建含ΔsopB突变基因的自杀载体及鉴定:
根据Genbank中猪霍乱沙门氏菌的全基因序列,找到其中ΔsopB基因全基因序列及其上下游序列,根据该基因上下游基因设计引物P1、P2、P3和P4,以上下游基因的300bp左右的片段为同源臂,敲除sopB基因(ATG到TAA),如图1所示。
具体步骤如下:以猪霍乱沙门氏菌C78-3的基因组为模板,由引物P1和P2经PCR扩增得pipC同源臂基因序列,称为片段1;以猪霍乱沙门氏菌C78-3的基因组为模板,由引物P3和P4经PCR扩增得pipD基因的同源臂序列,称为片段2。将片段1和片段2按照碱基长度1:1混合,将上述混合产物作为模板,利用引物P1和引物P4进行Overlap PCR扩增得到长度为493bp的同源臂片段。回收该同源臂片段连接至pM18T克隆载体,转化之JM109感受态细胞,提取上述细菌质粒,再经KpnI和SacI酶切,连接至具有氯霉素和蔗糖筛选标记的自杀质粒载体pRE112中(图2),经酶切鉴定与序列测定,将正确缺失ΔsopB基因序列的pRE112载体(命名为pS006)电转化至工程菌大肠杆菌χ7213中,命名为:χ7213(pS006),于-20℃备用。
引物P1、P2、P3和P4的核苷酸序列分别为:
P1:5’- CGCAGAGCTCATATCACCTATAATTATC - 3’。
P2:5’- CATATAGTTACCTCAAGACAGCGTTTTTAATATTCCTG - 3’。
P3:5’- CAGGAATATTAAAAACGCTGTCTTGAGGTAACTATATG - 3’。
P4:5’- ATTAGGTACCAGCAGTATTGTCTGCGTCAGC - 3’。
使用引物P1和P4通过PCR鉴定含ΔsopB突变的自杀载体χ7213(pS006),含ΔsopB突变的PCR阳性片段大小为493bp,由图3可见:含ΔsopB突变基因的自杀载体χ7213(pS006)构建成功。
2、构建引入ΔsopB突变基因的rSC0013株:
分别用野生型猪霍乱沙门氏菌C78、缺失了ΔmanA、ΔPcrp::TT araC PBADcrp和ΔrelA::araC PBADlacI TT基因的C78-3猪霍乱沙门氏菌为受体菌,供体菌为步骤1)中所制得的χ7213(pS006)(含ΔsopB突变基因的自杀载体)。在缺失了ΔmanA、ΔPcrp::TT araC PBADcrp和ΔrelA::araC PBADlacI TT基因的C78-3猪霍乱沙门氏菌中引入ΔsopB突变,构建取得rSC0013株。
具体方法如下:
按照中国专利文献CN 104498418A的说明书第0040至0101段中方法制备取得缺失了ΔmanA、ΔPcrp::TT araC PBADcrp和ΔrelA::araC PBADlacI TT基因的C78-3猪霍乱沙门氏菌,命名为猪霍乱沙门氏菌rSC0010。
制备受体菌菌液:挑取猪霍乱沙门氏菌rSC0010于5mL的LB液体培养基中,经10-12小时培养。
制备供体菌菌液:将含ΔsopB突变基因的自杀载体χ7213(pS006)置于5mL的LB液体中(其中含50ug/mL 2,6-二氨基庚二酸(DAP),25mg/mL的氯霉素,经10-12小时培养。
将供体菌和受体菌进行接合,并经10-12小时培养,再纯化至单菌落。
挑取单菌落于LB液体培养基中培养至云雾状,10倍系列稀释涂布于LB(含5%蔗糖)固体培养基中;从固体培养基挑取单菌落分别于LB板、含氯霉素的LB(含25mg/mL的氯霉素)板划线,于37℃过夜培养,然后挑取只在LB中生长的单菌落。
根据以上引物P1和P4进行菌落PCR鉴定ΔsopB突变。ΔsopB缺失株阳性菌的PCR片段大小为493 bp,将C78-3(ΔsopB)和构建成的引入ΔsopB突变基因 (ΔPcrp::TT araCPBADcrp,ΔmanA ,ΔrelA::araC PBADlacI TT + ΔsopB)分别命名为rSC0017株和rSC0013株。
由图4可见:rSC0017株(图4中2-3电泳道)和rSC0013株(图4中4-6电泳道)中成功引入ΔsopB突变。对PCR鉴定结果正确的菌株进行纯化再鉴定。对再鉴定正确的菌株PCR扩增其sopB基因上下游序列,并送南京金斯瑞公司进行序列测定,将测序结果正确的菌株保存。
3、构建减毒猪霍乱沙门氏菌rSC0016:
在rSC0013(ΔmanA,ΔPcrp::TT araC PBADcrp,ΔrelA::araC PBADlacI TT,ΔsopB)中引入ΔasdA突变基因。
具体如下:
制备受体菌菌液:挑取rSC0013单菌落于5mL的LB液体培养基中,经10-12小时培养。
按照中国专利文献CN 104498418A的说明书中第0066~0071段方法取得含ΔasdA自杀载体χ7213(pYAs004)。
制备供体菌菌液:挑取含ΔasdA自杀载体χ7213(pYAs004)于5 mL的LB液体培养基(含50 µg/mL 2,6-二氨基庚二酸,25 mg/mL 氯霉素)中,经10-12小时培养。
取供体菌和受体菌的菌液各100 µL涂布接合于LB固体培养基(含50 mg/mL 2,6-二氨基庚二酸)中,37℃恒温培养箱培养过夜;刮取菌苔转接种于LB固体培养基(含50 µg/mL 2,6-二氨基庚二酸 ,25 mg/mL氯霉素),在37℃环境下经10-12小时培养;纯化至接合菌在LB固体培养基(含50 µg/mL 2,6-二氨基庚二酸 ,25 mg/mL 氯霉素)上长出单菌落,挑取几个单菌落于LB(含50 µg/mL 2,6-二氨基庚二酸)液体培养基中,37℃、220 rpm振荡培养至菌液呈云雾状;取100 µL菌液,连续10倍稀释至合适的浓度涂布于LB固体培养基(含50 mg/mL 2,6-二氨基庚二酸,5% 蔗糖)中;挑取单菌落分别于普通LB固体培养基、含氯霉素的LB固体培养基(含25 mg/mL 氯霉素)、含氯霉素和2,6-二氨基庚二酸的LB固体培养基(含50 mg/mL 2,6-二氨基庚二酸,25 mg/mL 氯霉素)中鉴别培养,挑取只在含有2,6-二氨基庚二酸的LB固体培养基中生长的单菌落。
用公开发表的引物ΔasdA-F和ΔasdA-R进行菌落PCR鉴定ΔasdA突变。ΔasdA缺失株阳性菌的PCR片段大小为633bp,由图5说明:rSC0013(ΔmanA ΔPcrp::TT araC PBADcrp ΔrelA::araC PBADlacI TT ΔsopB)引入ΔasdA突变已构建成功。对再鉴定正确的菌株PCR扩增其asdA基因上下游序列,并送南京金斯瑞公司进行序列测定,将测序结果正确的菌株命名为rSC0016。
引物ΔasdA-F:TGCTCTAGATGTGCATGGCAATCGCCCAAC。
引物ΔasdA-R:TCCCCCGGGTATCTGCGTCGTCCTACCTTC。
rSC0016保藏在位于中国北京市朝阳区北辰西路1号院3号的中国普通微生物菌种保藏管理中心(CGMCC),保藏日为2016年6月20日,保藏编号为CGMCC NO.12645,该生物材料的分类命名为:减毒猪霍乱沙门氏菌,拉丁文学名为:Salmonella choleraesuis。
二、对构建的减毒猪霍乱沙门氏菌rSC0016进行表型鉴定:
1、rSC0016中ΔsopB突变的表型鉴定:
取健康的8周龄的新西兰大白兔隔夜禁食,气管注射异氟烷麻醉,使回肠暴露,每隔5-6cm用线结扎,间隔1cm,共计结扎3个肠段。每段回肠分别注射1mL总细菌数为1×109CFU的猪霍乱沙门氏菌C78-3、rSC0017(C78-3(ΔsopB),来源于实施例1步骤2)制备所得)和LB液体培养基为空白对照。缝合腹部肌肉组织和皮肤,新西兰大白兔用毛毯维持体温在37℃左右。手术8小时后,新西兰大白兔用戊巴比妥钠气管注射实施安乐死。重新打开兔子腹部,收集每段回肠中的分泌物,并比较它们的体积;然后将上述分泌物稀释至合适的稀释度后于麦康凯琼脂培养基涂布分离试验菌株,计算回肠分泌物中细菌总量;同时取各段回肠用福尔马林溶液固定制作组织病理切片,观察不同菌株对新西兰兔子肠道的炎症反应。结果显示含ΔsopB突变的rSC0017感染的回肠中炎性分泌物及细菌总量显著少于野毒株C78-3株(如图6和图7,##:p<0.01;#:p<0.05),但是都显著多于LB空白对照组(如图6和图7,**:P<0.01);HE染色结果也显示含ΔsopB突变的rSC0017株肠组织内炎性细胞明显少于C78-3野毒株,肠绒毛较野毒株组更整齐。证明ΔsopB突变能明显降低猪霍乱沙门氏菌野毒株引起的肠道炎性反应,如图8、9、10所示。实验结果为三次实验重复的平均。图8为接种野毒株C78-3后,肠黏膜炎性细胞浸润;图9为接种rSC0016后,肠黏膜绒毛完整;图10为接种LB,肠黏膜绒毛完整。
2、rSC0016中ΔasdA突变的表型鉴定:
在中国标准弱毒株C500(购自中检所)中通过上述同源重组的方法引入ΔasdA 突变,命名为rSC0018,作为在下面的实验中没有阿拉伯糖调控延迟减毒和没有sopB基因缺失的阴性对照毒株。
挑取rSC0016、rSC0018单菌落分别接种5 mL LB液体培养基和含2,6-二氨基庚二酸的LB液体培养基(含50 µg/mL 2,6-二氨基庚二酸)中,于37 ℃恒温摇床220rpm振荡培养过夜,观察该菌在两种不同营养条件中培养的生长状态。结果可见ΔasdA突变的菌株在无外源2,6-二氨基庚二酸的环境下不生长,LB液体培养基清亮透明。该结果表明,rSC0016、rSC0018只有在含有2,6-二氨基庚二酸的LB液体培养基中才能生长,在LB液体培养基中不能生长,因而rSC0016、rSC0018株的ΔasdA突变成功。
三、应用:
猪链球菌病是一种重要人畜共患传染病,不仅影响着养猪业健康发展,还严重危害着人类的健康。目前我国的猪用商品化链球菌疫苗还存在着诸多不完善的方面。
在本实施例中,选择大多数猪链球菌血清型菌株都有的Sao(surface antigen one)作为减毒株的异源抗原,克隆到原核表达载体pYA3493中,称为含有saoA基因的原核表达质粒pS-SaoA。将pS-SaoA转化至含有阿拉伯糖调控的延迟减毒和延迟表达外源抗原系统和sopB和asdA基因缺失的霍乱沙门氏菌减毒株rSC0016中,形成疫苗候选株rSC0016(pS-SaoA)菌株,并在BALB/c小鼠和断奶仔猪中进行了毒力和免疫保护效率的评价,为猪病的防控提供新的思路。
1、构建rSC0016(pS-SaoA)、SC0011(pS-SaoA)、rSC0018(pS-SaoA)菌株:
1)构建asd+的表达SaoA蛋白原核表达质粒pS-SaoA:
参照GenBank中猪链球菌2型菌设计扩增saoA基因的引物saoA-F和saoA-R,以CVCC3928猪链球菌2型为模板,PCR扩增saoA基因777bp(见图11)。将测序正确的saoA基因,与原核表达载体Asd+ pYA3493经双酶切后回收产物,并连接,转化至工程菌χ7213中。使用表3中saoA-F,saoA-R引物进行菌落PCR和酶切鉴定,最终获得PCR和酶切鉴定皆阳性的χ7213(pS-SaoA)菌株,其中pYA3493片段大小3133 bp,saoA片段大小777 bp(如图12),再次测序鉴定saoA基因,结果正确。
扩增saoA所用的引物saoA-F和saoA-R序列:
saoA-F:ATGGATCCCAACCTGATGGGGGAC;
saoA-R:GCGTCGACCATTGCTTCCTTAGAG。
2)构建rSC0016(pS-SaoA)、rSC0011(pS-SaoA)、rSC0018(pS-SaoA)、rSC0016(pYA3493)、rSC0011(pYA3493)、rSC0018(pYA3493)菌株:
提取χ7213(pS-SaoA)和χ7213(pYA3493)菌株的质粒,即表达SaoA蛋白的asd+ 原核表达质粒pS-SaoA和空载体质粒pYA3493。将pS-SaoA和pYA3493质粒通过热激法转化入减毒猪霍乱沙门氏菌rSC0016、rSC0011和rSC0018感受态细胞中。
具体操作为:无菌条件下取适量pS-SaoA或pYA3493质粒分别与rSC0016、rSC0011、rSC0018感受态菌;混匀后冰浴30min,42℃热激90s,加入700μL LB液体培养基,于37℃恒温摇床100rpm振荡培养45min;取上述菌液200μL,涂布于LB固体培养基,于37℃恒温培养箱培养24h;挑取表面光滑呈灰白色的单菌落,使用表3中saoA-F,saoA-R引物进行菌落PCR鉴定,通过提质粒和酶切鉴定;对PCR阳性菌进行纯培养再酶切鉴定,酶切结果见pYA3493空载体是3113bp,saoA基因是777bp(如图13所示)。最终获得PCR和酶切鉴定皆阳性的rSC0016(pS-SaoA)、rSC0016(pYA3493)、rSC0018(pS-SaoA)、rSC0018(pYA3493)、rSC0011(pS-SaoA)和rSC0011(pYA3493)株。
2、检测rSC0016(pS-SaoA)、rSC0011(pS-SaoA)、rSC0018(pS-SaoA)菌株SaoA蛋白表达及表达量比较:
挑取上步过程中鉴定结果正确的rSC0016(pS-SaoA)、rSC0011(pS-SaoA)、rSC0018(pS- SaoA)菌株的单菌落,分别于5毫升LB液体培养基中220rpm 37℃震荡培养至OD600值均为0.8时离心收集菌体,加1mL PBS重悬。用超声细胞裂解仪裂解上述菌体至菌液澄清透亮,12000rpm离心取上清。取等量的该上清液进行Western Blot鉴定。将rSC0016(pS-SaoA)、rSC0018(pS-SaoA)、rSC0011(pS-SaoA)菌株的超声裂解液进行Western Blot鉴定。结果如图14,可见三种菌株均能表达SaoA蛋白,且在相同OD值的情况下,等量rSC0016(pS-SaoA)菌液(图14中标号3)中表达的SaoA蛋白量略高于rSC0011(pS-SaoA),显著高于rSC0018(pS-SaoA)(图14中标号2和4)表达的量。
3、 pS-SaoA质粒在rSC0016(pS-SaoA)中的稳定性测定:
挑取鉴定完全正确的rSC0016(pS-SaoA)单菌落接种于2mL LB液体培养基,于37℃恒温摇床振荡培养。以12h为一代,将菌液按照1:100接种新鲜的LB液体培养基,如此连续传至50代。分别挑取10、20、30、40、50代单菌进行双酶切鉴定。结果显示,双酶切后出现pYA3493和saoA的条带,与预期结果相符合,如图15所示。结果表明pS-SaoA重组质粒能在rSC0016中稳定复制传代。
4、 rSC0016(pYA3493)、rSC0018(pYA3493)、rSC0011(pYA3493)和C78-3的定植实验:
挑取rSC0016(pYA3493)、rSC0018(pYA3493)和rSC0011(pYA3493)和C78-3于5 mL的LB液体培养基,于37℃震荡培养12h,按体积比1:100接种于50 mL的LB液体培养基,于37℃恒温摇床上振荡培养至菌液的OD600值为0.9左右,离心收集菌体,加入PBS重悬沉淀,连续10倍稀释。取100μL连续10倍稀释至合适的稀释度并于麦康凯培养基上计数,另外一部分菌液用于接种小鼠。48只6周龄雌性BALB/c小鼠分为4组,每组12只,每组分别口服接种1×109的rSC0016(pYA3493)、rSC0018(pYA3493)、rSC0011(pYA3493),C78-3(野毒株);在接种后第3d,7d,14d,21d无菌剖取3只小鼠的肝、脾、肠道派伊尔氏淋巴小结,称重、研磨,10倍稀释组织匀浆液,取100μL的菌液计数。肝、脾匀浆液涂布LB固体培养基,肠系膜淋巴小结匀浆液涂布麦康凯培养基,于37℃恒温培养24h;根据相应培养基上菌落生长结果,计算脏器中细菌含量。结果显示,由于C78-3是猪霍乱沙门氏菌强毒株,在接种第3d,在肝脏、脾脏和肠道派伊尔氏淋巴小结中可以分离到比减毒株多很多的C78-3菌株(图16、17、18中,$$,p<0.01),第5d,所有接种C78-3的小鼠全部死亡;而3个减毒株随着接种时间的增长,各减毒株在各脏器上的菌量逐渐减少。 rSC0016(pYA3493) 在小鼠肝脏及脾脏中的定植数量与rSC0018(pYA3493)菌株的定植数量相似,并都显著低于rSC0011(pYA3493) 菌株的定植数量(图16、17中,##,p<0.01),表明rSC0016(pYA3493)和rSC0018(pYA3493) 的毒力低于rSC0011。但在肠道派伊尔氏淋巴小结,口服后7d-21d, rSC0016(pYA3493)和rSC0011(pYA3493)的定植能力相似,都显著强于rSC0018(pYA3493)株的定植能力(图18中,**, p<0.01),表明rSC0016(pYA3493)在淋巴组织的定居能力与rSC0011(pYA3493)株的定植能力一样强。
四、对疫苗候选株进行在BALB/c小鼠中的免疫效果评价:
挑取rSC0016(pS-SaoA)、rSC0016(pYA3493)、rSC0018(pS-SaoA)、rSC0018(pYA3493)、rSC0011(pS-SaoA)、rSC0011(pYA3493)于5 mL的LB液体培养基,于37 ℃震荡培养12h,按体积比1:100接种于50 mL的LB液体培养基,于37℃恒温摇床上振荡培养至菌液的OD600值为0.9左右,离心收集菌体,加入PBS重悬沉淀,连续10倍稀释。取100μL连续10倍稀释至合适的稀释度并于麦康凯培养基上计数,另外一部分菌液用于免疫小鼠。
105只6周龄的BALB/c小鼠分为7组,每组15只小鼠。其中1组口服PBS作为阴性对照组。另外6组分别口服免疫109CFU/20μL的rSC0016(pS-SaoA)、rSC0016(pYA3493)、rSC0018(pS-SaoA)、rSC0018(pYA3493)、rSC0011(pS-SaoA)、rSC0011(pYA3493)菌液。首免后3周加强免疫一次。于首免后3周、5周从小鼠的颌下静脉采血,同时用PBS冲洗阴道,收集阴道黏膜冲洗液。将收集到的血液于4 ℃过夜制得血清。用间接ELISA检测血清和阴道粘膜冲洗液针对猪链球菌2型的SaoA蛋白的IgG和IgA抗体效价。在二免后0.5d、3d和5d,各组从小鼠颌下静脉采血收集血清,并在二免后7d时各组安乐死5只小鼠,取脾脏,肺脏制成匀浆离心取上清,由细胞因子IFN-γ及IL-4的检测试剂盒检测由各毒株诱导小鼠的细胞和体液免疫应答水平;在首免后5周,对各组剩下的10只小鼠,用30×LD50的SS2毒株通过腹腔注射途径进行攻毒,观察21天并记录小鼠存活情况。
1、各减毒株免疫BALB/c小鼠后诱导的针对SaoA蛋白IgG和黏膜免疫抗体IgA的测定:
用纯化的SaoA蛋白包被酶标版,间接ELISA的方法检测首次免疫3周、5周血清中针对SaoA的IgG效价以及阴道冲洗液中IgA效价,用C78-3外膜蛋白OMPs包被酶标版,间接ELISA的方法检测血清中诱导的针对猪霍乱沙门氏菌外膜蛋白OMPs的IgG效价,每个样品重复检测3次。结果见图19、20、21所示,所有免疫含有SaoA蛋白的减毒株诱导的针对SaoA蛋白的血清IgG和阴道黏膜抗体IgA的效价都显著高于不含有SaoA蛋白的空载体减毒株诱导的抗体效价(见图19和21,**,P<0.01);在首免后第3周和第5周,免疫rSC0016(pS-SaoA)株和rSC0011(pS-SaoA)株小鼠产生的针对SaoA的血清抗体IgG水平及粘膜抗体IgA水平明显高于免疫rSC0018(pS-SaoA)株(见图19和21,#,P<0.05;##,p<0.01);首免后第5周,免疫rSC0016(pS-SaoA)株或rSC0016(pYA3493)株的小鼠产生的针对猪霍乱沙门氏菌的OMPs的血清抗体IgG水平明显高于免疫rSC0018(pYA3493)株的小鼠(见图20,#,P<0.05)。
2、各减毒株免疫BALB/c小鼠后诱导的IFN-γ及IL-4的水平测定:
取二免后7d的BALB/c小鼠,剖取整脾及整肺,制成匀浆。反复冻融后12000rpm离心1min取上清。取二次免疫后0.5d、3d和5d,颌下静脉采血收集血清。
将上述组织匀浆上清以及血清作为样品,用ELISA测定小鼠IL-4、IFN-γ的试剂盒测定小鼠细胞因子水平,二免后7d的结果见图22、23、24、25所示,免疫rSC0016(pS-SaoA)、rSC0011(pS-SaoA)和rSC0018(pS-SaoA)的小鼠产生的IFN-γ和IL-4水平都显著高于免疫含有空载体的减毒株诱导的水平(图22、23、24、25,**,P<0.01);免疫rSC0016(pS-SaoA)小鼠肺脏和脾脏中细胞因子IFN-γ水平显著高于免疫rSC0011(pS-SaoA)或免疫rSC0018(pS-SaoA)组小鼠肺脏和脾脏中细胞因子IFN-γ水平(图22,#,p<0.05;##,P<0.01);且免疫rSC0016(pS-SaoA)及rSC0011(pS-SaoA)株小鼠肺脏及脾脏中细胞因子IFN-γ及IL-4的水平均显著高于免疫rSC0018(pS-SaoA)株的组(图22、23,#,p<0.05;##,P<0.01)。
免疫小鼠的血清中细胞因子的检测结果见图24、25所示,免疫rSC0016(pS-SaoA)、rSC0011(pS-SaoA)和rSC0018(pS-SaoA)的小鼠产生的IFN-γ和IL-4水平都显著高于免疫含有空载体的减毒株诱导的水平(图24、25,*,p<0.05;**,P<0.01);免疫rSC0016(pS-SaoA)组的小鼠血清中IFN-γ及IL-4的浓度在二免后12小时达到最高峰值,在加强免疫后72h内明显高于免疫rSC0011(pS-SaoA)、rSC0018(pS-SaoA)组(图24、25,#,p<0.05;##,P<0.01);免疫rSC0011(pS-SaoA)组的小鼠血清IFN-γ和IL-4浓度在二免后72h内浓度均明显高于免疫rSC0018(pS-SaoA)组(图24、25,##,P<0.01)。
3、免疫小鼠的攻毒:
在首免后5周,对各组剩下的10只小鼠,用30×LD50的SS2毒株通过腹腔注射途径进行攻毒,观察21天并记录小鼠存活情况。攻毒后,口服免疫rSC0016(pS-SaoA)的小鼠在21d的观察期内均存活,口服免疫rSC0011(pS-SaoA)的小鼠的存活率是40%,而口服免疫rSC0018(pS-SaoA)、rSC0016(pYA3493)、rSC0011(pYA3493)、rSC0018(pYA3493)和对照组的小鼠在24h-48h内全部死亡,如下表所示。
SS2攻毒保护效力表:
五、对疫苗候选株进行在断奶仔猪中的免疫效果评价:
1、疫苗候选株的准备和仔猪的免疫:
挑取rSC0016(pS-SaoA)、rSC0016(pYA3493)、rSC0018((pS-SaoA)、rSC0018(pYA3493)于5 mL的LB液体培养基,于37 ℃震荡培养8h,按体积比1:100接种于100 mL的LB液体培养基,于37 ℃恒温摇床上振荡培养至菌液的OD600值为0.9左右,离心收集菌体,加入PBS重悬沉淀,连续10倍稀释。取100μL连续10倍稀释至10-7、10-8、10-9,并于LB固体培养基上计数,剩余菌液用于免疫仔猪。
65只21日龄的断奶仔猪分为5组,每组13只;一组作为空白对照组;其余4组经口服分别灌服109CFU的rSC0016(pS-SaoA)、rSC0016(pYA3493)、rSC0018(pS-SaoA)、rSC0018(pYA3493)株;各组首免3周后加强免疫一次,于首免后3周、5周从仔猪的前腔静脉采血,同时收集免疫猪的鼻腔黏膜拭子。将收集到的血液于4 ℃过夜制得血清;在二免后0.5d、3d和5d,各组从仔猪的前腔静脉采血收集血清;在二免后7d时各组安乐死3只仔猪,取脾脏,肺脏制成匀浆离心取上清,对免疫猪的血清和脾脏、肺脏组织匀浆上清,用猪细胞因子IFN-γ、IL-4及IL-17检测试剂盒检测由各毒株诱导免疫猪的细胞和体液免疫应答水平;在首免后5周,各组中分别取5只免疫猪用5.0×108剂量的SS2,取5只免疫猪用1.0×1010SS7毒株,经耳静脉注射攻毒,观察14天并记录仔猪临床症状及存活情况,对死亡猪进行剖解,采集病死猪的脑和肺组织进行病理变化的观察。
2、免疫后仔猪产生的针对SaoA蛋白的抗体水平检测:
首免后3周、5周在前腔静脉采血制成血清,同时取鼻腔棉拭子。用纯化的SaoA蛋白包被酶标板,间接ELISA检测血清中针对猪链球菌SaoA蛋白的IgG和鼻腔粘膜中IgA抗体效价,针对猪霍乱沙门氏菌载体OMPs的IgG效价。结果如图26、27、28所示。首免3周和5周后,免疫rSC0016(pS-SaoA)株和rSC0018(pS-SaoA)株的仔猪产生的针对SaoA的血清抗体IgG效价和粘膜抗体IgA效价均显著高于免疫空载体组(图26、28,**,P<0.01);免疫rSC0016(pS-SaoA)株组产生的针对SaoA的血清抗体IgG效价和粘膜抗体IgA效价均显著高于免疫rSC0018(pS-SaoA)株组(图26、28,#,p<0.05;##,P<0.01);免疫rSC0016株组的仔猪产生的针对载体菌OMPs的血清抗体IgG水平也明显高于免疫rSC0018株组(图27,#,P<0.05;##,P<0.01)。
3、免疫后仔猪IFN-γ及IL-4、IL-17的水平测定:
分别在加强免疫后0.5d、3d和5d,经前腔静脉采血收集血清;并于7d时每组各剖杀3只仔猪,取脾脏,肺脏制成匀浆。经猪细胞因子ELISA试剂盒检测血清和组织匀浆中细胞因子IFN-γ、IL-4、IL-17的水平。结果如图29、30、31、32、33、34所示:二免7天后,在仔猪脾脏和肺脏中,免疫rSC0016(pS-SaoA)和rSC0018(pS-SaoA)诱导的IFN-γ、IL-4和IL-17水平都显著高于免疫空载体的菌株(图29、30、31,**,p<0.01);在肺脏中,免疫rSC0016(pS-SaoA)组产生的IFN-γ、IL-4和IL-17水平都显著高于免疫传统减毒株rSC0018(pS-SaoA)组(图29、30、31,#,p<0.05;##,P<0.01);在脾脏中,免疫rSC0016(pS-SaoA)减毒株组血清中的细胞因子IFN-γ、IL-4的浓度均明显高于免疫传统弱毒疫苗株rSC0018(pS-SaoA)疫苗株组图29、30、31,#,p<0.05;##,P<0.01)。
免疫仔猪血清中细胞因子的检测结果(见图20)显示,在加强免疫后72h内,免疫rSC0016(pS-SaoA)和rSC0018(pS-SaoA)的仔猪产生的IFN-γ和IL-4 IL-17水平都显著高于免疫含有空载体的减毒株诱导的水平(图32、33、34,*,p<0.05;**,P<0.01);在加强免疫后48h内,免疫rSC0016(pS-SaoA)和rSC0018(pS-SaoA)的仔猪产生的IL-17水平都显著高于免疫含有空载体的减毒株诱导的水平(图34,*,p<0.05;**,P<0.01);在加强免疫后72h内,免疫rSC0016(pS-SaoA)组的仔猪血清中IFN-γ、IL-4和IL-17的浓度明显高于免疫rSC0018(pS-SaoA)组(图32、33、34,#,p<0.05;##,P<0.01)。
4、免疫仔猪的攻毒:
为评价ΔsopB在提高猪霍乱沙门氏菌的免疫原性,检测其对猪链球菌2及7型攻击的保护力,对口服免疫rSC0016(pS-SaoA) 、rSC0016(pYA3493)、rSC0018((pS-SaoA)、rSC0018(pYA3493)及口服等量PBS的空白对照组的所有仔猪进行猪链球菌2及7型的攻毒实验。首免后5周各免疫组取5只仔猪,分别用5.0×108剂量的SS2及1.0×1010SS7毒株进行耳静脉注射攻毒,观察14天并记录仔猪临床症状及存活情况。
1 )SS2攻毒后仔猪存活率和病理特征:
免疫rSC0016(pS-SaoA)株的仔猪经耳静脉攻毒5.0×108剂量的SS2后,个别仔猪在攻毒后48h内有轻微精神沉郁现象,72h后明显好转,随后无明显的病理症状,免疫猪存活率为100%;免疫rSC0018(pS-SaoA)株、rSC0016(pYA3493)株和rSC0018(pYA3493)株和PBS组的仔猪在108h内全部死亡(如图35所示)。
免疫rSC0016(pS-SaoA)株的猪没有任何病理症状,猪行动自如,而免疫rSC0018(pS-SaoA)株的大多数仔猪在攻毒后24h内表现出嗜睡、不食,攻毒后72h开始有便秘,转圈、前肢爬行、四肢游泳状、呼吸困难,关节肿胀,有跛行;口服PBS空白对照组和rSC0016(pYA3493)、rSC0016(pYA3493)组的仔猪经SS2攻毒后,出现的临床症状更加严重;对空白对照组、rSC0018(pS-SaoA)、rSC0018(pYA3493)、 rSC0016(pYA3493)株的死亡猪剖解发现,病死猪的肺部有严重的纤维素性样变、肺脏出血,脑膜出血等,与免疫rSC0016(pS-SaoA)株的猪攻毒后未见脑的病变和轻微肺炎形成显著反差。取病死猪肺,肝组织分离SS2,均能分离到攻毒所用的SS2;攻毒后14天,扑杀所有免疫rSC0016(pS-SaoA)株的存活猪,剖检取肝、脾、肺、脑组织,没有分离到攻毒株SS2。
采集死亡猪和存活猪的肺脏和脑组织制作病理切片,显微镜下观察可见对照组仔猪与免疫rSC0018(pS-SaoA)株、rSC0018(pYA3493)、rSC0016(pYA3493)株的猪脑膜血管充血,水肿,炎性细胞浸润。肺淤血,肺泡壁增厚,肺泡内大量炎性渗出,血管周围大量炎性细胞浸润见图36-图45所示。图36和37可见对照组仔猪经野生型猪链球菌2型攻毒后脑组织严重出血,肺组织淤血、出血和炎性渗出;图38和39是免疫化学致弱株rSC0018携带的空载体仔猪经野生型猪链球菌2型攻毒后脑组织也严重出血,肺组织淤血、出血和炎性渗出;图40和41是免疫化学致弱株rSC0018携带表达猪链球菌的SaoA蛋白载体仔猪经野生型猪链球菌2型攻毒后脑组织出血,肺组织淤血、出血和炎性渗出;图42和43是减毒株rSC0016携带的空载体仔猪经野生型猪链球菌2型攻毒后脑组织出血,肺组织淤血、出血和肺泡中炎性渗出;而免疫rSC0016(pS-SaoA)组大部分仔猪的脑组织和肺中未出现明显病理变化如图44-图45所示。
2)SS7攻毒后仔猪存活率和病理特征:
各减毒株免疫后第5周,取5只免疫猪,以1.0×1010剂量的SS7经耳静脉攻毒。结果显示,口服免疫rSC0016(pS-SaoA)组在7天的观察期内无明显临床症状,而体温保持正常水平。而免疫rSC0018(pS-SaoA)、rSC0018(pYA3493)、 rSC0016(pYA3493) 株的猪均出现了体温升高(如图46所示),并且出现了厌食,精神沉郁,气喘等症状,持续5天后这些症状消失,体温恢复至正常水平。
综上所述,本发明在阿拉伯糖调控毒力基因延迟减毒和延迟表达外源抗原的载体上构建的含有ΔsopB突变基因的猪霍乱沙门氏菌载体,能够降低猪霍乱沙门氏菌减毒株的毒力,减轻减毒株引起的炎性反应对宿主的损伤作用,显著提高猪霍乱沙门氏菌所携带的外源抗原诱导宿主的免疫原性,从而使含有sopB突变基因的携带猪链球菌SaoA蛋白的猪霍乱沙门氏菌疫苗候选株rSC0016(pS-SaoA)能够对SS2及SS7野毒株的感染提供完全的保护和交叉保护作用。
<110> 扬州大学
<120>一种猪霍乱沙门氏菌减毒载体菌及其构建方法
<160> 8
<210> 1
<211> 28
<212> DNA
<213> 人工序列
<400> 1
cgcagagctc atatcaccta taattatc
<210> 2
<211> 38
<212> DNA
<213> 人工序列
<400> 2
catatagtta cctcaagaca gcgtttttaa tattcctg
<210> 3
<211> 38
<212> DNA
<213> 人工引物
<400> 3
caggaatatt aaaaacgctg tcttgaggta actatatg
<210> 4
<211> 31
<212> DNA
<213> 人工引物
<400> 4
attaggtacc agcagtattg tctgcgtcag c
<210> 5
<211> 30
<212> DNA
<213> 人工序列
<400> 5
tgctctagat gtgcatggca atcgcccaac
<210> 6
<211> 30
<212> DNA
<213> 人工引物
<400> 6
tcccccgggt atctgcgtcg tcctaccttc
<210> 7
<211> 24
<212> DNA
<213> 人工序列
<400> 7
atggatccca acctgatggg ggac
<210> 8
<211> 24
<212> DNA
<213> 人工序列
<400> 8
gcgtcgacca ttgcttcctt agag
<110> 扬州大学
<120>一种猪霍乱沙门氏菌减毒载体菌及其构建方法
<160> 8
<210> 1
<211> 28
<212> DNA
<213> 人工序列
<400> 1
cgcagagctc atatcaccta taattatc
<210> 2
<211> 38
<212> DNA
<213> 人工序列
<400> 2
catatagtta cctcaagaca gcgtttttaa tattcctg
<210> 3
<211> 38
<212> DNA
<213> 人工序列
<400> 3
caggaatatt aaaaacgctg tcttgaggta actatatg
<210> 4
<211> 31
<212> DNA
<213> 人工序列
<400> 4
attaggtacc agcagtattg tctgcgtcag c
<210> 5
<211> 30
<212> DNA
<213> 人工序列
<400> 5
tgctctagat gtgcatggca atcgcccaac
<210> 6
<211> 30
<212> DNA
<213> 人工引物
<400> 6
tcccccgggt atctgcgtcg tcctaccttc
<210> 7
<211> 24
<212> DNA
<213> 人工序列
<400> 7
atggatccca acctgatggg ggac
<210> 8
<211> 24
<212> DNA
<213> 人工序列
<400> 8
gcgtcgacca ttgcttcctt agag
- 还没有人留言评论。精彩留言会获得点赞!