三芳胺类化合物及其制备方法、在制备太阳能电池上的应用与流程
本发明涉及太阳能电池材料技术领域,具体地,涉及三芳胺类化合物及其制备方法、制备太阳能电池上的应用。
背景技术:
为了减缓气候变化,解决世界能源危机,去寻找一个合适的能源来替代化石燃料是一个全球性的需求。太阳能是一种取之不尽用之不竭的无污染能源,其通常转化为电能来被使用,因此太阳能电池的开发已经得到相当的重视。在过去的十年中,染料敏化太阳能电池(DSSC)由于易制作,效率高,成本低,而被认为是传统的昂贵和低效率的基于硅的太阳能电池的较好替代品。
染料敏化剂是影响DSSC光电转换效率的主要因素。国内外染料敏化剂的研究主要分两类,一类为有机金属配合物,典型结构为功能性多吡啶钌化合物,第二类为非金属有机染料。其中非金属的有机染料具有较高的消光系数、简单的制备和纯化过程以及低成本等优点,较含金属有机染料受到更多关注。根据给体的不同,已有香豆素型、吲哚啉型、咔唑型、三芳胺型等非金属染料敏化剂得以设计和开发。
但目前开发得到的非金属有机染料也面临着容易在半导体表面聚集,电子重组率较高和较低的捕光能力等挑战。通常非金属有机染料具有D-π-A结构,其中D是给体,π是桥键,A是受体。这种推拉结构可以有效促进电荷的分子内电荷转移(ICT)。目前非金属有机染料的设计开发,大多集中在延伸分子的π共轭桥,以期使最大吸收波长发生红移,增强摩尔吸光系数,扩大光谱吸收范围,从而增强染料的捕光能力,提高光电转化效率。
技术实现要素:
解决上述问题所采用的技术方案是三芳胺类化合物及其制备方法、制备太阳能电池上的应用。
本发明提供的三芳胺类化合物,分别具有下述结构式:
优选的,所述式HJ-4、式HJ-5、式HJ-6和式HJ-7中给体均为三苯胺,式HJ-8中给体为带有醛基的三苯胺,式HJ-9中给体为带有氰基丙烯酸的三苯胺;
式HJ-4、式HJ-5和式HJ-6中桥键分别为苯基联噻唑联噻吩联苯基、苯基联噻唑联噻吩联噻吩基和苯基联噻唑联噻吩联呋喃基;式HJ-7、式HJ-8和式HJ-9中桥键为苯基联噻唑联噻吩;
HJ-4、式HJ-5、式HJ-6、式HJ-7和式HJ-8的受体均为氰基丙烯酸,式HJ-9的受体含两个氰基丙烯酸。
本发明的目的还在于提供一种三芳胺类化合物的制备方法,包括以下步骤:
将式IVa-IVe所示的化合物分别与式V所示的化合物用作为有机溶剂的氯仿进行溶解;
在作为碱性物质的哌啶的作用下,在氮气保护下,加热回流搅拌反应;
反应完成后,旋干溶剂,残余物用洗脱剂进行硅胶柱层析,分别获得式HJ-4-HJ-9所示的三芳胺类化合物;
优选的,所述的加热回流搅拌反应的反应时间为5-8h。
优选的,所述洗脱剂为氯仿或二氯甲烷,和甲醇或乙醇,及醋酸的混合溶剂。
优选的,所述洗脱剂为二氯甲烷、甲醇和醋酸的混合溶剂;其体积比为400:4:1。
优选的,式IVa-IVe化合物与式V化合物和碱性物质的物质的量之比为:1:2.1:5-10。
优选的,有机溶剂体积用量分别以式IVa-IVe化合物的物质的量计为38mL/mmol。
本发明的目的还在于提供一种上述三芳胺类化合物在制备太阳能电池上的应用。
本发明提供的一种三芳胺类化合物及其制备方法、制备太阳能电池上的应用。使用三芳胺作为染料敏化剂的给体是由于它具有优秀的电荷传输性能、较低的离子化电位、较高的空穴迁移率(一般约在10-3-10-4cm2/Vs)、较好的溶解性与无定形成膜性、较强的荧光性能与光稳定性;本发明以三芳胺为给体,含噻唑的共轭芳环作为桥键,氰乙酸作为受体,合成得到了六个三芳胺类染料敏化剂;该类化合物作为染料敏化剂组装成的染料敏化太阳能电池具有较好的光电转换效率,为染料敏化剂的筛选增添了新的可应用物质。
附图说明
图1是实施例中化合物式HJ-4的合成路线图;
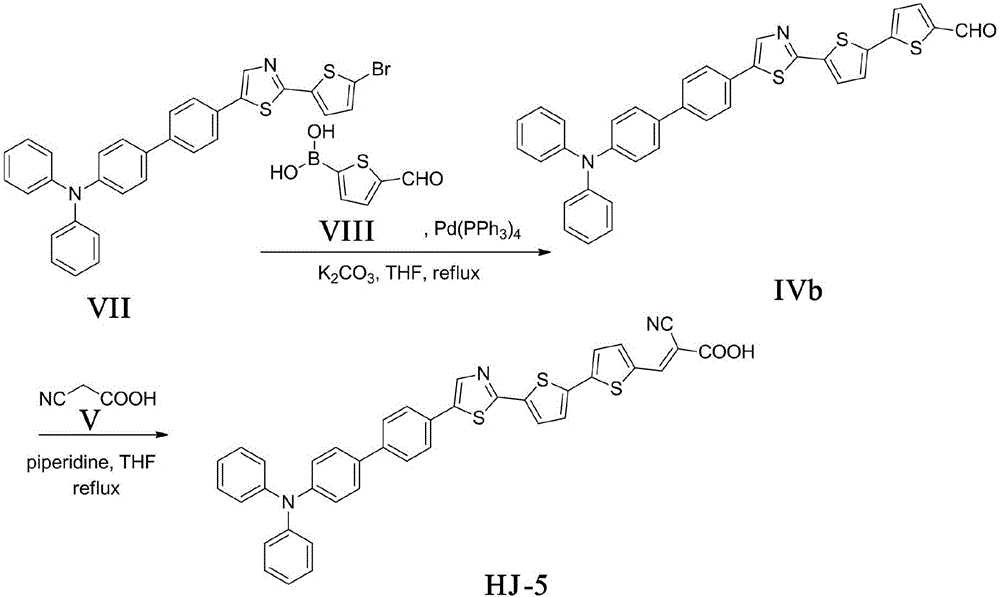
图2是实施例中化合物式HJ-5的合成路线图;
图3是实施例中化合物式HJ-6的合成路线图;
图4是实施例中化合物式HJ-7的合成路线图;
图5是实施例中化合物式HJ-8的合成路线图;
图6是实施例中化合物式HJ-9的合成路线图;
图7是实施例中化合物式HJ-4-HJ-9敏化的太阳能电池的电流-电压曲线图。
具体实施方式
为使本领域技术人员更好地理解本发明的技术方案,下面结合附图和具体实施方式对本发明作进一步详细描述。
实施例1化合物式HJ-4的合成
1.化合物式IVa的合成
将化合物式VII(1.13g,2.0mmol)、Pd(PPh3)4(0.23g,0.2mmol)、化合物式IX(0.45g,3.0mmol)、碳酸钾水溶液(5mL,2mol/L)溶于四氢呋喃(30mL),N2保护下反应约10小时。反应液用二氯甲烷萃取三次,用水洗有机层,无水硫酸钠干燥,旋干溶剂,柱分离(VCH2Cl2:VPE=1:1)得黄色固体0.35g,收率为30%。m.p.:210-212℃;1H NMR(500MHz,CDCl3)δ10.06(s,1H,CHO),8.04(d,J=8.0Hz,2H),7.95(d,J=8.0Hz,2H),7.76(d,J=8.3Hz,2H),7.68(d,J=8.5Hz,2H),7.61-7.55(m,5H),7.45-7.43(m,2H),7.34(t,J=7.5Hz,2H),7.25-7.21(m,6H),7.14-7.11(m,2H);HREIMS m/z 591.1570[M+H]+,cacld C38H26N2OS2for:590.1487.
2.化合物式HJ-4的合成
将化合物式IVa(0.24g,0.4mmol)、氰基乙酸V(0.07g,0.84mmol)、哌啶(0.20mL)溶于氯仿(15mL),在氮气保护下回流8小时。反应液冷至室温,旋干溶剂,柱分离(VHAc:VMeOH:VCH2Cl2=1:4:400)得深红色化固体0.22g,收率为85%。m.p.164-166℃;1H NMR(500MHz,DMSO)δ13.98(bs,1H,COOH),8.34(s,1H,CH=C),8.17(s,1H),8.13(d,J=8.2Hz,2H),8.07(d,J=8.1Hz,2H),7.90(d,J=8.2Hz,2H),7.79-7.77(m,5H),7.75-7.72(m,3H),7.40(t,J=7.7Hz,2H),7.21(t,J=4.0Hz,1H),7.18-7.15(m,5H),7.12(d,J=8.5Hz,2H);HREIMS m/z 656.1464[M-H]-,cacld C41H27N3O2S2for:657.1545.
实施例2化合物式HJ-5的合成
1.化合物式IVb的合成
将化合物式VII(1.13g,2.0mmol)、Pd(PPh3)4(0.23g,0.2mmol)、化合物式VIII(0.47g,3.0mmol)、碳酸钾水溶液(5mL,2mol/L)溶于四氢呋喃(30mL),N2保护下反应约10小时。反应液用二氯甲烷萃取三次,用水洗有机层,无水硫酸钠干燥,旋干溶剂,柱分离(VCH2Cl2:VPE=1:1)得橘黄色固体0.25g,收率为21%。m.p.:117-119℃;1H NMR(500MHz,CDCl3)δ9.88(s,1H,CHO),8.04(d,J=8.3Hz,2H),7.74(d,J=3.9Hz,1H),7.68(d,J=8.3Hz,2H),7.63-7.55(m,5H),7.44(d,J=6.5Hz,2H)7.34(dd,J=8.7,6.2Hz,3H),7.22(t,J=7.7Hz,4H),7.16-7.12(m,4H).HREIMS m/z 597.1110[M+H]+,cacld C36H24N2OS3for:596.1051.
2.化合物式HJ-5的合成
将化合物式IVb(0.24g,0.4mmol)、氰基乙酸V(0.07g,0.84mmol)、哌啶(0.20mL)溶于氯仿(15mL),在氮气保护下回流8小时。反应液冷至室温,旋干溶剂,柱分离(VHAc:VC2H6O:VCHCl3=1:4:400)得黑色固体0.24g,收率为92%。m.p.259-261℃;1H NMR(500MHz,DMSO)δ13.63(s,1H,COOH),8.48(s,1H,CH=C),8.17(s,1H),8.08(d,J=8.3Hz,2H),8.01(d,J=4.0Hz,1H),7.80-7.77(m,3H),7.76-7.72(m,5H),7.67(d,J=4.0Hz,1H),7.41(t,J=7.8Hz,2H),7.22-7.18(m,6H),7.12-7.07(m,2H);HREIMS m/z 662.1050[M-H]-,cacld C39H25N3O2S3for:663.1109.
实施例3化合物式HJ-6的合成
1.化合物式IVc的合成
将化合物式VII(1.13g,2.0mmol)、Pd(PPh3)4(0.23g,0.2mmol)、化合物式X(0.42g,3.0mmol)、碳酸钾水溶液(5mL,2mol/L)溶于四氢呋喃(30mL),N2保护下反应约10小时。反反应液用二氯甲烷萃取三次,用水洗有机层,无水硫酸钠干燥,旋干溶剂,柱分离(VCH2Cl2:VPE=1:1)得橘黄色固体0.46g,收率为40%。m.p.:117-119℃;1H NMR(500MHz,CDCl3)δ9.62(s,1H,CHO),8.04(d,J=8.4Hz,2H),7.71(d,J=8.8Hz,2H),7.68(d,J=8.4Hz,2H),7.62-7.58(m,3H),7.45-7.43(m,2H),7.35(d,J=8.3Hz,2H),7.33(d,J=3.6Hz,2H),7.23-7.20(m,4H),7.17-7.14(m,3H),7.12(dd,J=5.0,3.7Hz,1H);HREIMS m/z 581.1340[M+H]+,cacld C36H24N2O2S2for:580.1279.
2.化合物式HJ-6的合成
将化合物式IVc(0.23g,0.4mmol)、氰基乙酸V(0.07g,0.84mmol)、哌啶(0.20mL)溶于氯仿(15mL),在氮气保护下回流8小时。反应液冷至室温,旋干溶剂,柱分离(VHAc:VMeOH:VCH2Cl2=1:4:400)得暗红色固体0.22g,收率为85%。m.p.241-243℃;1H NMR(500MHz,DMSO)δ13.47(s,1H,COOH),8.17(s,1H,CH=C),8.07(d,J=8.4Hz,2H),8.04(d,J=4.0Hz,1H),7.83(d,J=8.8Hz,2H),7.80-7.73(m,6H),7.55(d,J=3.8Hz,1H),7.41(t,J=7.9Hz,2H),7.24(d,J=3.7Hz,1H),7.23-7.17(m,6H,Ar-H),7.08(d,J=8.8Hz,2H);HREIMS m/z 646.1254[M-H]-,cacld C39H25N3O3S2for:647.1337.
实施例4化合物式HJ-7的合成
1.化合物式IVd的合成
将重蒸的DMF(1.5mL)在0℃下搅拌0.5h,将POCl3(0.75mL)加入到DMF在0℃下搅拌1h制得Vilsmeier试剂,再将式VI(0.73g,1.5mmol)倒进Vilsmeier试剂,然后补加DMF(10mL),70℃下搅拌6h。把反应液倒入到冰水中,有大量固体析出,抽滤,水洗,柱分离(VCH2Cl2:VPE=1:1)得到黄色固体0.39g,收率为50%。m.p.167-168℃;1H NMR(500MHz,CDCl3)δ9.85(s,1H,CHO),8.05(d,J=10Hz,2H),7.73(d,J=8.5Hz,2H),7.68(d,J=8.5Hz,2H),7.63(d,J=9Hz,2H),7.59(dd,J=3.7,1.1Hz,1H),7.45-7.43(m,2H),7.39(t,J=8.5Hz,2H),7.27-7.20(m,5H),7.13-7.10(m,3H);HREIMS m/z515.1232[M+H]+,cacld C32H22N2OS2for:514.1174.
2.化合物式HJ-7的合成
将化合物式IVd(0.21g,0.4mmol)、氰基乙酸V(0.07g,0.84mmol)、哌啶(0.20mL)溶于氯仿(15mL),在氮气保护下回流8小时。反应液冷至室温,旋干溶剂,柱分离(VHAc:VMeOH:VCH2Cl2=1:4:400)得红色固体0.18g,收率为80%。m.p.255-257℃;1H NMR(500MHz,DMSO)δ13.63(s,1H,COOH),8.19(s,1H,CH=C),8.17(s,1H),8.09(d,J=8.4Hz,2H),7.96(d,J=9.0Hz,2H),7.82-7.77(m,5H,Ar-H),7.75(dd,J=3.6,0.9Hz,1H),7.46(t,J=7.9Hz,2H,Ar-H),7.30-7.26(m,5H),7.21(dd,J=5.0,3.8Hz,1H),6.98(d,J=8.9Hz,2H);HREIMS m/z 580.1173[M-H]-,cacld C35H23N3O2S2for:581.1232.
实施例5化合物式HJ-8的合成
1.化合物式IVe的合成
将重蒸的DMF(1.5mL)在0℃下搅拌0.5h,将POCl3(0.75mL)加入到DMF在0℃下搅拌1h制得Vilsmeier试剂,再将式VI(0.73g,1.5mmol)倒进Vilsmeier试剂,然后补加DMF(10mL),70℃下搅拌6h。把反应液倒入到冰水中,有大量固体析出,抽滤,水洗,柱分离(VCH2Cl2:VPE=2:1)得到黄色固体0.24g,收率为30%。m.p.117-119℃;1H NMR(500MHz,CDCl3)δ10.08(s,1H,CHO),9.86(s,1H,CHO),7.88(d,J=8.5Hz,2H),7.77(d,J=1.7Hz,1H),7.76-7.74(m,3H),7.73(d,J=1.9Hz,1H),7.64(d,J=9.0Hz,2H),7.58(dd,J=5.0,1.1Hz,1H),7.42-7.38(m,2H),7.29(d,J=1.9Hz,1H),7.25-7.22(m,4H),7.18(dd,J=5.0,3.8Hz,1H),7.13(d,J=8.7Hz,1H);HREIMS m/z 543.1195[M+H]+,cacld C33H22N2O2S2for:542.1123.
2.化合物式HJ-8的合成
将化合物式IVe(0.22g,0.4mmol)、氰基乙酸V(0.14g,1.68mmol)、哌啶(0.40mL)溶于氯仿(15mL),在氮气保护下回流8小时。反应液冷至室温,旋干溶剂,柱分离(VHAc:VMeOH:VCH2Cl2=1:4:400)得红色固体0.049g,收率为20%。m.p.125-127℃;1H NMR(500MHz,DMSO)δ10.02(s,1H,CHO),8.12(s,1H,CH=C),8.02-7.98(m,3H),7.97-7.94(m,3H),7.89(d,J=8.3Hz,2H),7.83(d,J=8.6Hz,2H),7.47(t,J=7.8Hz,2H),7.31-7.26(m,6H),7.00(d,J=8.9Hz,2H);HREIMS m/z 608.1114[M-H]-,cacld C36H23N3O3S2for:609.1181.
实施例6化合物式HJ-9的合成
将化合物式IVe(0.22g,0.4mmol)、氰基乙酸V(0.14g,1.68mmol)、哌啶(0.40mL)溶于氯仿(15mL),在氮气保护下回流8小时。反应液冷至室温,旋干溶剂,柱分离(VHAc:VMeOH:VCH2Cl2=1:20:400)得深红色固体0.21g,收率为78%。m.p.186-188℃;1H NMR(500MHz,DMSO)δ8.12(s,1H,CH=C),7.96-7.85(m,5H),7.83-7.78(m,4H),7.69(d,J=8.0Hz,2H),7.42(t,J=7.7Hz,2H),7.28-7.17(m,6H),7.02(d,J=8.5Hz,2H);HREIMS m/z 337.0550[M-H]-,cacld C39H24N4O4S2for:676.1239.
实施例7三芳胺类化合物作为染料敏化剂的应用
利用丝网印刷制备的双层TiO2纳米粒子膜作为光电极:首先在导电玻璃FTO上印一层12μm厚的20nm的TiO2粒子,450℃下马弗炉内煅烧30min。在浸染料之前将烧好的膜浸入0.04mol·L-1的TiCl4水溶液70℃预处理30min,然后分别用水和乙醇冲洗,电吹风吹干。经马弗炉450℃下再次煅烧30min后,冷却至80℃后浸入3×10-4mol·L-1染料的乙腈与DMSO溶液室温24h敏化。对电极的制备:采用丝网印刷方法,将一定浓度的H2PtCl6溶液印刷在FTO导电玻璃上,然后400℃马弗炉烧结20min。吸附染料的TiO2电极和铂对电极组装成三明治结构,并在边缘滴入电解质(含0.07mM/LI-),利用毛细管渗透原理引入电池内部。于100mW/cm2光强照射下,测定光电压-电流特性曲线。其中,上述光电压-电流特性曲线的测试仪器如下:电池光伏性能测试是采用日本的Peccell-L15太阳光模拟器,在AM 1.5G光照下,使用USA的Keithley 2601仪器。入射光强度校准使用标准硅太阳能电池(BS-520,日本)。
其结果如图7和表1所示,由结果可知,与文献相似化合物相比,HJ系列化合物的光电转换效率有极大提高。
表1三芳胺组装得到的DSSC性能参数
注:其中,化合物A来自文献Dyes and Pigments 2012,94,512-524。
可以理解的是,以上实施方式仅仅是为了说明本发明的原理而采用的示例性实施方式,然而本发明并不局限于此。对于本领域内的普通技术人员而言,在不脱离本发明的精神和实质的情况下,可以做出各种变型和改进,这些变型和改进也视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!