Fc融合高亲和力IgE受体α链的制作方法
本发明涉及一种用作药物的fc融合高亲和力ige受体α链(fc-fusedhighaffinityigereceptorα-chain)。
更详细而言,本发明涉及一种在低ph值下具有优异稳定性的fc融合高亲和力ige受体α链、以及其药物用途。
背景技术:
免疫球蛋白e(ige)是负责过敏反应的免疫球蛋白类之一。由b细胞分泌、或在b细胞表面上表达的ige会与肥大细胞以及嗜碱性粒细胞等表面上已知的高亲和力ige受体(fcεri)结合。当抗原蛋白与肥大细胞表面受体上的ige结合时,则形成ige与抗原发生交联的形态。之后,细胞内颗粒中储存的组织胺和血清素等化学介质等会被释放出来。其结果会诱发炎症反应,引起毛细血管扩张、血管通透性亢进等i型过敏症状(非专利文献1)。
因此,抑制ige与fcεri结合的化合物或蛋白由于会抑制ige与肥大细胞以及嗜碱性粒细胞等表面上已知的fcεri结合,而作为支气管哮喘、过敏性鼻炎、过敏性结膜炎等i型过敏性疾病的治疗剂受到期待(非专利文献2)。
近年来,除了开发以现有的低分子化合物为有效成分的药物以外,还开发了较强地与生物体内的特定受体等结合,并表现出优异的治疗效果的蛋白药物。例如,作为类风湿性关节炎的治疗剂,已知有依那西普。依那西普是在生物体内以肿瘤坏死因子(tnf)可溶性受体发挥抑制tnf作用的效果为目的而开发出的全人源性可溶性tnfα/ltα受体制剂。
蛋白药物可以期待较高的治疗效果,但另一方面,在其制造工序中,也可能会产生蛋白药物所特有的问题。
通常在将抗体和fc融合蛋白制成药物时,会使用利用蛋白a(proteina)的纯化方法。在该方法中,为了洗脱与蛋白a结合的目的蛋白,会使用低ph值的缓冲液。另外,为了使病毒灭活,希望对目的蛋白在一定时间内及低ph值下进行处理。
在低ph值下稳定性差的蛋白容易产生聚集体。当聚集体的比例较高时,在蛋白药物的制造中会导致纯化效率及产量降低。另外,药物中混入聚集体,也可能会引起免疫反应,导致过敏反应等严重副作用。
因此,在蛋白药物的制造中,在低ph值下目的蛋白的不稳定性成为了问题。
专利文献1记载了一种包含免疫球蛋白和细胞外区域而成的多肽(免疫黏附素)。专利文献1中,作为免疫黏附素的示例之一,记载有高亲和力ige受体。但是,上述文献中并未具体记载高亲和力ige受体与免疫球蛋白的融合蛋白。
非专利文献3记载了高亲和力ige受体α链(fcεriα-chain,以下称作“fcer1a”)与免疫球蛋白g1(igg1)的融合蛋白(以下称作“融合蛋白a”(fusionproteina))。但是,上述文献中记载的融合蛋白a与本发明的蛋白相比,fcer1a与igg1(fc)的结合形式大不相同。即,本发明的蛋白,在其fcεri与igg1之间的接头片段区域中具有特征性氨基酸序列。
专利文献2记载了高亲和力ige受体(fcεri)的水溶性片段与人fc区域通过连接肽连接而成的融合蛋白(npb301)。但是,本发明的蛋白并不包含专利文献2中记载的连接肽。另外,专利文献2并未记载及暗示本发明的接头片段区域的特征性氨基酸序列。
专利文献3记载了fcer1a与免疫球蛋白g2(igg2)的融合蛋白。但是,该融合蛋白与上述igg2的融合蛋白和本发明的蛋白相比,在接头片段区域和fc区域中,氨基酸序列有所不同。
专利文献4记载了非人灵长类fcer1a与igg1的融合蛋白。另外,专利文献5~7记载了fcer1a与igg1的融合蛋白。但是,上述文献并未记载及暗示本发明的接头片段区域的特征性氨基酸序列。
上述非专利文献3和专利文献1~7并未记载及暗示本发明的蛋白。
现有技术文献
专利文献
专利文献1:美国专利第5,565,335号说明书
专利文献2:国际公开第2012/169735号
专利文献3:中国专利申请公开第101633698号说明书
专利文献4:国际公开第2008/028068号
专利文献5:国际公开第2011/056606号
专利文献6:国际公开第2008/099178号
专利文献7:国际公开第2008/099188号
非专利文献
非专利文献1:罗智靖,“アレルギーの分子細胞機構”bioindustry,2008年,第25卷,第9号,p.23-39
非专利文献2:chiseira等,“internationalimmunology”,1993年,第5卷,第1号,p.47-54
非专利文献3:m.haak-frendscho等,“journalofimmunology”,1993年,第151卷,第1号,p.351-358
技术实现要素:
发明所要解决的课题
本发明的课题在于提供一种在低ph值下具有优异稳定性的fc融合高亲和力ige受体α链。
解决课题的手段
为了获得针对低ph值及热的稳定性高的fc融合高亲和力ige受体α链,本发明人进行了潜心研究。结果发现,在包含高亲和力ige受体α链与igg1的fc区域的融合蛋白中,通过使用包含3个cys的接头片段,能够获得稳定性高的fc融合高亲和力ige受体α链,从而完成了本发明。即,本发明如下。
本发明涉及以下〔1〕~〔5〕等。
〔1〕一种fc融合蛋白,其特征在于,含有:
(i)高亲和力ige受体α链,以及
(ii)igg1的fc区域,
并且所述(i)和(ii)之间的接头片段区域为seqidno:2的氨基酸序列。
〔2〕一种fc融合蛋白,其为权利要求1所述的fc融合蛋白,其特征在于,所述蛋白为包含seqidno:3的氨基酸序列的蛋白;或者其为包含seqidno:3的氨基酸序列c末端缺失赖氨酸(k)而成的氨基酸序列的fc融合蛋白。
〔3〕根据〔1〕或〔2〕的fc融合蛋白,其为二聚体。
〔4〕根据〔3〕的fc融合蛋白,其中,接头片段区域的半胱氨酸残基相互形成3个二硫键。
〔5〕一种药物组合物,其含有〔1〕~〔4〕中任一项的fc融合蛋白作为有效成分。
本说明书包含作为本申请的优先权基础的日本专利申请号2015-032231号、2015-252231号的公开内容。
发明效果
本发明的蛋白在低ph值下具有优异稳定性。另外,本发明的蛋白具有针对ige的优异中和活性。因此,本发明的蛋白能够用作预防和治疗由ige介导的i型过敏性疾病的蛋白药物。
附图说明
图1表示针对人ige的结合抑制活性。图中,横轴表示各药物的浓度(mol/l),纵轴表示以添加了一定量的ige时的结合量为基准,将对与固定在孔板上的蛋白1(protein1)结合的ige的量表示为百分率的值(游离ige(相对于对照的%))。图中,圆圈表示蛋白1,方块表示奥马珠单抗(omalizumab)的值。
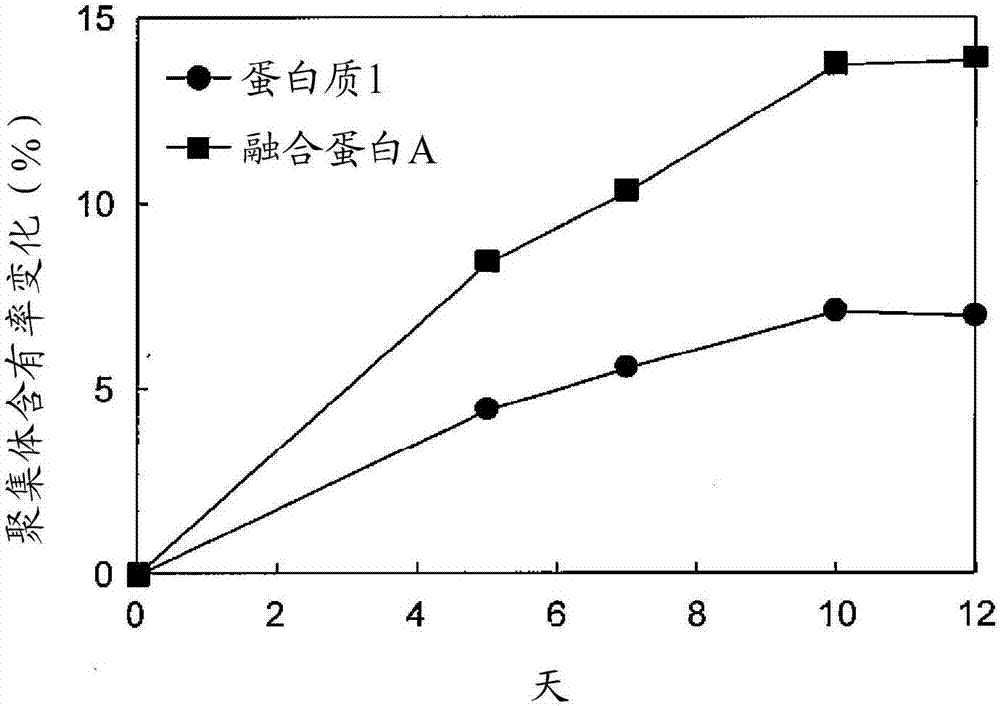
图2表示在低ph值下聚集体含有率变化(%)的推移。图中,横轴表示天数(天),纵轴表示聚集体含有率的变化(%)。图中,圆圈表示蛋白1,方块表示融合蛋白a(fusionproteina)的值。
图3表示热处理下的聚集体含有率变化(%)的推移。图中,横轴表示天数(天),纵轴表示聚集体含有率的变化(%)。图中,圆圈表示蛋白1,方块表示融合蛋白a的值。
具体实施方式
下面对本发明的实施方式进行详细说明。
本发明中,只要没有特别说明,各术语则具有以下含义。
本发明中,“高亲和力ige受体α链(fcer1a)”是指包含高亲和力ige受体的细胞外区域即α链部分的蛋白。高亲和力ige受体α链,例如是指以下seqidno:1所示的蛋白。
seqidno:1:
vpqkpkvslnppwnrifkgenvtltcngnnffevsstkwfhngslseetnsslnivnakfedsgeykcqhqqvnesepvylevfsdwlllqasaevvmegqplflrchgwrnwdvykviyykdgealkywyenhnisitnatvedsgtyyctgkvwqldyeseplnitvikaprekywl
上述高亲和力ige受体α链中,包括对于seqidno:1所示的氨基酸序列,例如使用blast(basiclocalalignmentsearchtoolatthenationalcenterforbiologicalinformation(美国国家生物技术信息中心的基本局部比对搜索工具))等(例如,使用默认即初始设置的参数)计算时,包含具有90%以上、95%以上、97%以上、或99%以上同一性的氨基酸序列,且具有针对ige的结合能力的蛋白。另外,包括对于seqidno:1所示的氨基酸序列,包含取代、缺失和/或添加1个或多个或数个(1~10个,优选为1~5个、更优选为1个或2个)氨基酸的氨基酸序列,且具有针对ige的结合能力的蛋白。
本发明中,“igg1的fc区域”是指免疫球蛋白g1的fc片段,即,天然免疫球蛋白g1的ch2和ch3恒定区。所述igg1的fc区域中,包括天然突变体、人工变异体、以及截短的形态中任一个。
本发明中,“高亲和力ige受体α链和igg1的fc区域的接头片段区域”是指从上述高亲和力ige受体α链与上述igg1的fc区域的连接点起沿fc区域方向的14个氨基酸残基的区域。
本发明中,“fc融合蛋白”是指包含高亲和力ige受体α链和免疫球蛋白的fc片段的重组蛋白。
本发明蛋白的特征在于,其高亲和力ige受体α链和igg1的fc区域之间的接头片段区域为以下seqidno:2所示的氨基酸序列。
seqidno:2:
epkscdkthtcppc
本发明的蛋白优选为包含以下seqidno:3所示的氨基酸序列的fc融合蛋白(以下称作“蛋白1”(protein1))。
seqidno:3:
vpqkpkvslnppwnrifkgenvtltcngnnffevsstkwfhngslseetnsslnivnakfedsgeykcqhqqvnesepvylevfsdwlllqasaevvmegqplflrchgwrnwdvykviyykdgealkywyenhnisitnatvedsgtyyctgkvwqldyeseplnitvikaprekywlepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
seqidno:3所示的氨基酸序列,具有按照如下顺序将seqidno:1所示的氨基酸序列(seqidno:3所示的氨基酸序列中从第1位的val至第179位的leu)、seqidno:2所示的氨基酸序列(seqidno:3所示的氨基酸序列中从第180位的glu至第193位的cys)、以及免疫球蛋白的fc片段的氨基酸序列(seqidno:3所示的氨基酸序列中从第194位的pro至第411位的lys)融合而成的序列。该fc融合蛋白,包括对于seqidno:3所示的氨基酸序列中除了相当于seqidno:2的氨基酸序列的从第180位的glu至第193位的cys的氨基酸序列以外的氨基酸序列,例如使用blast(basiclocalalignmentsearchtoolatthenationalcenterforbiologicalinformation(美国国家生物技术信息中心的基本局部比对搜索工具))等(例如,使用默认即初始设置的参数)计算时,包含具有90%以上、95%以上、97%以上、或99%以上同一性的氨基酸序列,且具有针对ige的结合能力的蛋白。另外,包括对于seqidno:3所示的氨基酸序列中除了相当于seqidno:2的氨基酸序列的从第180位的glu至第193位的cys的氨基酸序列以外的氨基酸序列,包含取代、缺失和/或添加1个或多个或数个(1~10个,优选为1~5个、更优选为1个或2个)氨基酸的氨基酸序列,且具有针对ige的结合能力的蛋白。
在制造重组抗体时,c末端的赖氨酸可能会因翻译后修饰而缺失。因此,本发明的蛋白也可以是包含上述蛋白1的c末端缺失赖氨酸(k)而成的氨基酸序列的fc融合蛋白。例如,包含seqidno:3所示蛋白的蛋白1的c末端缺失赖氨酸(k)而成的氨基酸序列的fc融合蛋白,是由seqidno:3所示的氨基酸序列第1位至第410位的氨基酸序列组成的。
本发明的蛋白,其高亲和力ige受体α链和igg1的fc区域既包含通过由seqidno:2的氨基酸序列组成的接头片段而成的fc融合蛋白的单体,也包含二聚体。上述接头片段区域中存在3个cys残基(seqidno:3所示的氨基酸序列第184位、第190位和第193位的cys),通过二硫键可以形成二聚体。通常,2个fc融合蛋白单体会通过上述3个cys在相同位置的cys之间相互形成3个二硫键来形成二聚体。上述3个二硫键使得二聚体变得稳定,对于低ph值、热具有较高的稳定性。对低ph值、热的稳定性高,例如是指在低ph值条件下、加热下很少形成聚集体。例如,在低ph值处理或加热处理后,可以通过利用凝胶过滤层析测定聚集体的含量来确认。例如,即使将本发明的fc融合蛋白在2~8℃、优选4℃的低温下;在ph值1~5、优选ph值2~4下保存1天~1个月、优选1天~14天、更优选5~12天,或者在25~45℃、优选30~40℃下保存1天~1个月、优选1天~14天、更优选1天~7天,聚集体含有率变化也很少。例如,当根据凝胶过滤层析的峰面积计算本发明蛋白的聚集体含有率变化时,为10%以下,优选8%以下。另外,作为接头片段,与具有含有2个以下cys的接头片段的fc融合蛋白相比,本发明蛋白的聚集体含有率变化较小。
本发明的蛋白,例如可以按照以下方法或者以其为基准的方法、或文献中记载的方法或者以其为基准的方法制造。
本发明的蛋白可以使用本领域技术人员公知的基因重组技术来制造。例如,制备编码本发明蛋白的dna,构建含有该dna的表达载体。然后,可以使用所述载体对原核或真核细胞进行转化或转染,从获得的细胞的培养上清液中分离或纯化出目的蛋白。
本发明的蛋白可以使用本领域技术人员公知的蛋白表达细胞制造。例如,在将编码seqidno:3的氨基酸序列的cdna转入到哺乳类表达质粒载体中制备蛋白表达质粒后,导入到中国仓鼠卵巢细胞(cho)等动物细胞中,建立稳定表达细胞株。培养该细胞,可以从培养上清液中获得本发明的蛋白。
根据需要,本发明的蛋白可以通过本领域技术人员公知的分离和纯化方法来分离和纯化。例如,作为分离和纯化方法,列举有:亲和层析、离子交换层析、凝胶过滤层析、疏水层析、混合模式层析、透析、分步沉积法、电泳等。也可以将这些方法适当组合,来分离或纯化本发明的蛋白。
本发明的蛋白也可以进行本领域技术人员公知的化学修饰。例如,化学修饰可以列举:糖基化、聚乙二醇(peg)化、乙酰化、酰胺化等。
本发明的蛋白由于具有针对ige的优异中和活性,因此可以用作由ige介导的各种疾病的预防或治疗药。例如,本发明的蛋白能够用作与支气管哮喘、嗜酸性粒细胞性中耳炎、嗜酸性粒细胞性鼻窦炎、过敏性结膜炎、过敏性鼻炎、花粉症、食物过敏、蜱过敏疾病、荨麻疹、过敏性休克等i型过敏相关的疾病等的预防或治疗药。
本发明的蛋白具有针对ige的优异亲和力。因此,像抗体药物偶联物(adc)那样,本发明的蛋白也可以作为利用了该亲和力的“蛋白药物偶联物”而使用。例如,列举有“蛋白1-药物”、“蛋白1-接头-药物”等使用方式。作为药物可以使用抗过敏剂等,偶联物可以使用本领域技术人员公知的方法来制造。
根据用法,本发明的药物组合物使用各种剂型的组合物。例如,作为口服剂,列举有:片剂、散剂、颗粒剂、细粒剂、胶囊剂等。作为非口服剂,可列举:注射剂、吸入粉末剂、吸入液剂、滴眼剂、液剂、洗剂、喷雾剂、滴鼻剂、点滴剂、软膏剂、栓剂、贴剂等。
根据用法,本发明的药物组合物使用各种给药方法。例如,列举有:经口给药、静脉内给药、腹腔内给药、皮下给药、局部给药、肌肉内给药等。
本发明的药物组合物使用本发明的蛋白和至少一种药物添加剂来制备。根据其剂型,本发明的药物组合物可以通过制剂学的公知方法来制备。例如,作为药物添加剂,列举有:赋形剂、崩解剂、粘合剂、润滑剂、稀释剂、缓冲剂、等张化剂、防腐剂、稳定剂、助溶剂等药物添加剂。所述药物添加剂中也含有生理盐水、注射用水等。本发明的药物组合物可以通过与所述药物添加剂混合、稀释或溶解来制备。
当本发明的药物组合物用于预防或治疗时,其有效成分即本发明蛋白的给药量要根据患者的年龄、性别、体重、疾病程度、剂型、给药途径等适当确定。对于成人的给药量,在经口给药的情况下,例如可在0.1μg/kg~1000mg/kg/天的范围内确定。根据剂型,经口给药的1天给药量优选为0.1mg/kg~10mg/kg/天的范围。也可以将1天给药量分为1次、2次或3次给药。另外,对于成人的给药量,在非经口给药的情况下,也可以在0.01μg/kg~1000mg/kg/天的范围内确定。根据剂型,非经口给药的1天给药量优选为0.1μg/kg~10μg/kg/天、1μg/kg~100μg/kg/天、或10μg/kg~1000μg/kg/天的范围。
实施例
下面通过以下实施例和试验例对本发明的内容进行更加详细的说明。但是,本发明并不限于这些内容。
实施例1
蛋白1的表达及制备
(1)蛋白1表达载体的制备
将编码seqidno:3的氨基酸序列的cdna转入到哺乳类表达质粒载体中,制备蛋白1表达质粒。
(2)蛋白1表达细胞的制备
将蛋白1表达质粒导入到中国仓鼠卵巢细胞(cho)中,建立蛋白1的稳定表达细胞株。通过sds-page确认蛋白1在培养上清液中的分泌。
试验例1
ige结合抑制活性(ige中和活性)
(1)酶联板的制备
将蛋白1溶解在包被缓冲液中,并向微孔板中添加一定量。在4℃下放置18小时以上后,用洗涤缓冲液(pbs-tween20)洗涤,添加封闭液(assaydiluent)(bd生物科学公司)。在室温下放置1小时后除去封闭液,用洗涤缓冲液洗涤,以用于结合抑制活性测定。
(2)结合抑制活性的测定方法
用奥马珠单抗(抗人ige抗体)作为阳性对照,通过以下方法测定蛋白1的ige结合抑制活性。
将一定量的人ige(antibodyshop公司)与任意浓度的蛋白1或奥马珠单抗(诺华公司)混合,添加到上述(1)中制备的孔板上,在室温下放置约2小时。弃去混合液后,用洗涤缓冲液洗涤,添加hrp标记抗人ige抗体(bd生物科学公司),在室温下放置约1小时。弃去抗体液后,用洗涤缓冲液洗涤。添加tmb(3,3',5,5'-四甲基联苯胺)溶液,在一定时间后加入磷酸使显色反应停止。之后,用读板仪测定吸光度(od450)。根据与固定在孔板上的蛋白1结合的ige量,对蛋白1和奥马珠单抗的ige结合抑制活性(ige中和活性)进行评价(图1)。
(3)结果
本发明的蛋白1浓度依赖性地抑制ige与fcer1a的结合。
试验例2
低ph值下的稳定性试验
(1)样本的制备
纯化操作使用aktaexplorer10s(gehealthcare公司)来实施。通过与实施例1中记载的方法相同的方法来表达蛋白1,将其培养上清液用d-pbs(-)(dulbecco’s磷酸缓冲盐溶液)进行2倍稀释,加载到hitraprproteinaff(gehealthcare公司,17-5079-01)。用d-pbs(-)洗涤所述层析柱后,用100mm甘氨酸-盐酸缓冲液(ph值2.2)洗脱,以1.0ml/管的量分离蛋白a吸附级分。将峰级分混合,作为低ph值处理样本(ph值2.9)。将所述低ph值处理样本在4℃下保存,将这种样本作为评价用样本。在规定时间内(自4℃保存起5天~12天后)从评价用样本中取样0.25ml,加入0.05ml的1mtris-hcl缓冲液(ph值9.0)进行中和,获得中和处理样本。
作为比较对照,使用非专利文献3中记载的融合蛋白a。通过与实施例1相同的方法表达融合蛋白a,通过与上述方法相同的方法获得中和处理样本。需要说明的是,本试验所使用的融合蛋白a是以下seqidno:4的氨基酸序列所示的蛋白。seqidno:4的氨基酸序列包含由从第180位的asp至第188位的cys组成的接头片段,该接头片段中所包含的cys的数量为2个。
seqidno:4:
vpqkpkvslnppwnrifkgenvtltcngnnffevsstkwfhngslseetnsslnivnakfedsgeykcqhqqvnesepvylevfsdwlllqasaevvmegqplflrchgwrnwdvykviyykdgealkywyenhnisitnatvedsgtyyctgkvwqldyeseplnitvikaprekywldkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
(2)聚集体含量的分析方法
聚集体的分析操作使用aktaexplorer10s(gehealthcare公司),通过使用流动相为d-pbs(-)的superdex20010/300gl(gehealthcare公司,17-5175-01)进行凝胶过滤层析来确认。计算出洗脱位置为单体的峰面积,以及在高分子区域洗脱的聚集体峰面积,对蛋白1和融合蛋白a在低ph值处理的聚集体含有率变化(%)推移进行评价(图2)。
(3)结果
本发明的蛋白与融合蛋白a相比,随着低ph值处理时间延长形成聚集体的增加量大幅减少,表现出暴露在低ph值下的高稳定性。因此,本发明的蛋白在低ph值下稳定性优异,可以期待在制造工序中提高纯化效率和产率。
试验例3
对热的稳定性试验
(1)样本的制备
纯化操作使用aktaexplorer10s(gehealthcare公司)来实施。通过与实施例1中记载的方法相同的方法来表达蛋白1,将其培养上清液加载在hitrapmabselectsure(gehealthcare公司,17-0034-94)。用d-pbs(-)和100mm柠檬酸缓冲液(ph值4.0)洗涤所述层析柱后,用100mm甘氨酸-盐酸缓冲液(ph值3.3)洗脱蛋白a吸附物。在回收的级分中加入1/10容量的1mtris-hcl缓冲液(ph值9.0)进行中和,获得蛋白a纯化蛋白。将该蛋白a纯化蛋白用1n的hcl调整为ph值4.0,加载到填充有疏水相互作用阳离子交换的混合模式树脂的层析柱。用50mm醋酸缓冲液(ph值4.0)洗涤非吸附蛋白后,进行50mmtris-hcl缓冲液(ph值9.0)的100%线性梯度洗脱,回收峰级分,获得纯化蛋白。对于获得的蛋白,使用流动相为d-pbs(-)的hiload16/60superdex200prepgrade(gehealthcare公司,17-1069-01)进行凝胶过滤分离。回收相当于单体的峰级分,获得凝胶过滤纯化样本。使用d-pbs(-)再次制备该凝胶过滤纯化样本并分注到微型管中,将在37℃下温育的样本作为评价用样本。在规定时间内(自37℃保存起1天~7天后)从评价用样本中进行取样,获得热处理样本。
作为比较对照,使用非专利文献3中记载的融合蛋白a。通过与实施例1相同的方法表达融合蛋白a,通过与上述方法相同的方法获得热处理样本。需要说明的是,试验所使用的融合蛋白a是与试验例2所使用的蛋白为相同的氨基酸序列的蛋白。
(2)聚集体含有量的分析方法
聚集体的分析操作使用aktaexplorer10s(gehealthcare公司),通过使用流动相为d-pbs(-)的superdex20010/300gl(gehealthcare公司,17-5175-01)进行凝胶过滤层析来确认。计算出洗脱位置为单体的峰面积,以及在高分子区域洗脱的聚集体峰面积,对蛋白1和融合蛋白a在热处理下的聚集体含有率变化(%)推移进行评价(图3)。
(3)结果
本发明的蛋白与融合蛋白a相比,在37℃下保存时聚集体含量的增加较少,表现出对暴露在37℃下时更加稳定。因此,本发明的蛋白除了在低ph值下稳定性优异以外,对热的稳定性也很优异,可以期待在制造工序中提高纯化效率和生产率。
工业实用性
本发明的蛋白由于具有针对ige的优异中和活性,因此可以用作由ige介导的各种疾病的预防或治疗用的蛋白药物。
序列表自由文本
seqidno:2合成
本说明书中所引用的全部刊物、专利以及专利申请通过直接引用而并入本说明书中。
序列表
<110>橘生药品工业株式会社
<120>fc融合高亲和力ige受体α链
<130>ph-6451-pct
<150>jp2015-032231
<151>2015-02-20
<150>jp2015-252231
<151>2015-12-24
<160>4
<170>patentinversion3.5
<210>1
<211>179
<212>prt
<213>智人(homosapiens)
<400>1
valproglnlysprolysvalserleuasnproprotrpasnargile
151015
phelysglygluasnvalthrleuthrcysasnglyasnasnphephe
202530
gluvalserserthrlystrpphehisasnglyserleusergluglu
354045
thrasnserserleuasnilevalasnalalysphegluaspsergly
505560
glutyrlyscysglnhisglnglnvalasnglusergluprovaltyr
65707580
leugluvalpheserasptrpleuleuleuglnalaseralagluval
859095
valmetgluglyglnproleupheleuargcyshisglytrpargasn
100105110
trpaspvaltyrlysvaliletyrtyrlysaspglyglualaleulys
115120125
tyrtrptyrgluasnhisasnileserilethrasnalathrvalglu
130135140
aspserglythrtyrtyrcysthrglylysvaltrpglnleuasptyr
145150155160
glusergluproleuasnilethrvalilelysalaproargglulys
165170175
tyrtrpleu
<210>2
<211>14
<212>prt
<213>人工的
<220>
<223>合成的
<400>2
gluprolyssercysasplysthrhisthrcysproprocys
1510
<210>3
<211>411
<212>prt
<213>智人(homosapiens)
<400>3
valproglnlysprolysvalserleuasnproprotrpasnargile
151015
phelysglygluasnvalthrleuthrcysasnglyasnasnphephe
202530
gluvalserserthrlystrpphehisasnglyserleusergluglu
354045
thrasnserserleuasnilevalasnalalysphegluaspsergly
505560
glutyrlyscysglnhisglnglnvalasnglusergluprovaltyr
65707580
leugluvalpheserasptrpleuleuleuglnalaseralagluval
859095
valmetgluglyglnproleupheleuargcyshisglytrpargasn
100105110
trpaspvaltyrlysvaliletyrtyrlysaspglyglualaleulys
115120125
tyrtrptyrgluasnhisasnileserilethrasnalathrvalglu
130135140
aspserglythrtyrtyrcysthrglylysvaltrpglnleuasptyr
145150155160
glusergluproleuasnilethrvalilelysalaproargglulys
165170175
tyrtrpleugluprolyssercysasplysthrhisthrcyspropro
180185190
cysproalaprogluleuleuglyglyproservalpheleuphepro
195200205
prolysprolysaspthrleumetileserargthrprogluvalthr
210215220
cysvalvalvalaspvalserhisgluaspprogluvallyspheasn
225230235240
trptyrvalaspglyvalgluvalhisasnalalysthrlysproarg
245250255
glugluglntyrasnserthrtyrargvalvalservalleuthrval
260265270
leuhisglnasptrpleuasnglylysglutyrlyscyslysvalser
275280285
asnlysalaleuproalaproileglulysthrileserlysalalys
290295300
glyglnproarggluproglnvaltyrthrleuproproserargasp
305310315320
gluleuthrlysasnglnvalserleuthrcysleuvallysglyphe
325330335
tyrproseraspilealavalglutrpgluserasnglyglnproglu
340345350
asnasntyrlysthrthrproprovalleuaspseraspglyserphe
355360365
pheleutyrserlysleuthrvalasplysserargtrpglnglngly
370375380
asnvalphesercysservalmethisglualaleuhisasnhistyr
385390395400
thrglnlysserleuserleuserproglylys
405410
<210>4
<211>406
<212>prt
<213>智人(homosapiens)
<400>4
valproglnlysprolysvalserleuasnproprotrpasnargile
151015
phelysglygluasnvalthrleuthrcysasnglyasnasnphephe
202530
gluvalserserthrlystrpphehisasnglyserleusergluglu
354045
thrasnserserleuasnilevalasnalalysphegluaspsergly
505560
glutyrlyscysglnhisglnglnvalasnglusergluprovaltyr
65707580
leugluvalpheserasptrpleuleuleuglnalaseralagluval
859095
valmetgluglyglnproleupheleuargcyshisglytrpargasn
100105110
trpaspvaltyrlysvaliletyrtyrlysaspglyglualaleulys
115120125
tyrtrptyrgluasnhisasnileserilethrasnalathrvalglu
130135140
aspserglythrtyrtyrcysthrglylysvaltrpglnleuasptyr
145150155160
glusergluproleuasnilethrvalilelysalaproargglulys
165170175
tyrtrpleuasplysthrhisthrcysproprocysproalaproglu
180185190
leuleuglyglyproservalpheleupheproprolysprolysasp
195200205
thrleumetileserargthrprogluvalthrcysvalvalvalasp
210215220
valserhisgluaspprogluvallyspheasntrptyrvalaspgly
225230235240
valgluvalhisasnalalysthrlysproargglugluglntyrasn
245250255
serthrtyrargvalvalservalleuthrvalleuhisglnasptrp
260265270
leuasnglylysglutyrlyscyslysvalserasnlysalaleupro
275280285
alaproileglulysthrileserlysalalysglyglnproargglu
290295300
proglnvaltyrthrleuproproserargaspgluleuthrlysasn
305310315320
glnvalserleuthrcysleuvallysglyphetyrproseraspile
325330335
alavalglutrpgluserasnglyglnprogluasnasntyrlysthr
340345350
thrproprovalleuaspseraspglyserphepheleutyrserlys
355360365
leuthrvalasplysserargtrpglnglnglyasnvalphesercys
370375380
servalmethisglualaleuhisasnhistyrthrglnlysserleu
385390395400
serleuserproglylys
405
- 还没有人留言评论。精彩留言会获得点赞!