杂合四芳基乙烯化合物、聚合物及其制备方法与应用与流程
本发明涉及有机光学材料化合物技术领域,具体涉及一种具有光致变色和聚集诱导发光性能的杂合四芳基乙烯化合物及其制备方法与应用,以及杂合四芳基乙烯聚合物及其制备方法与应用。
背景技术:
二十一世纪是新材料的世纪。如今,有机发光和变色功能材料的发展日新月异,其应用需求也与日俱增。所以各种不同的变色和发光材料的结构设计和研究蒸蒸日上。近年来,我们一直在关注研究二芳烯变色材料的制备和性能研究,并且,对四芳烯的性能开发和结构设计也进行了不少探索。我们知道,从结构设计的角度看,无论是四芳基乙烯衍生物还是二芳烯衍生物都含有一个核心结构那就是乙烯双键桥结构。但是四芳基乙烯衍生物和二芳烯衍生物在功能材料运用方面却截然不同,前者因为它的聚集诱导发光性能(aie)受到很大关注,而后者却由于经常被用作光致变色材料而闻名。
自从irie和他的同事第一次报道了第一代的热稳定的光致变色二芳烯化合物,之后一系列以环烯烃双键为桥连接两个杂化芳烃的二芳基乙烯体系的杂环二芳烯衍生物被合成报道出来,它们都具有卓越的性能,在信息存储,成像技术,以及分子开关方面具有广泛的应用。
作为二芳烯体系中性能尤为优异的二噻吩乙烯衍生物,通过它与荧光基团的连接可以被设计成为各式各样的荧光分子开关,化学传感器,生物传感器。这一些化合物绝大部分在溶液状态下有很明显的荧光,但是在固体状态下,或者聚集状态下其荧光强度会很大程度的降低甚至荧光完全淬灭。与此相反,四芳基乙烯衍生物却在固体状态和聚集状态下有较强的荧光而在溶液状态下却几乎没有荧光,发生这种现象的原因是由于四芳基乙烯化合物具有聚集诱导发光性质(aie),其在固体状态和聚集状态下分子内旋转受阻。四芳基乙烯化合物这种聚集诱导发光性质能使他们在分子荧光开关,荧光探针,生物传感器,光电功能材料方面具有很大的应用前景。
基于以上所述的二芳烯衍生物和四芳基乙烯衍生物的各种优异性能,近些年来很多将二芳烯片段和四苯乙烯片段连接起来的多功能分子已经被报道。它们通常是通过偶联反应将两个独立的分子片段简单的连接起来,然后在进行相关的修饰。但是,有些时候不同的片段结构单元之间会相互的影响,从而降低了分子的整体性能。还有很重要的一点是这些化合物的化学结构一般很复杂,分子结构很大,使得合成路线都很长,合成方法很繁琐,产率很低。
技术实现要素:
本发明的第一目的在于提供一种具有光致变色和聚集诱导发光性能的杂合四芳基乙烯化合物,其结构为
其中,ar1为苯基或六元杂芳基,ar4为五元杂芳基,ar2和ar3分别独立地为苯基、六元杂芳基或五元杂芳基。各所述的六元杂芳基的芳环上分别独立地含有至少1个氮;各所述的五元杂芳基的芳环上分别独立地含有至少1个氮、氧、硫或硅。各所述的苯基上具有0~5个取代基,各所述六元杂芳基上具有0~4个取代基,各所述五元杂芳基上具有0~3个取代基。
本发明的杂合四芳基乙烯化合物的较佳实施例中,其结构如式(ⅰ)所示,
其中,ar1为苯基或六元杂芳基,ar2和ar3分别独立地为苯基、六元杂芳基或五元杂芳基,x为氮、氧、硫或硅;
各所述的六元杂芳基的芳环上分别独立地含有至少1个氮;各所述的五元杂芳基的芳环上分别独立地含有至少1个氮、氧、硫或硅;
各所述的苯基上具有0~5个取代基,各所述六元杂芳基上具有0~4个取代基,各所述五元杂芳基上具有0~3个取代基;各所述的取代基分别独立地为氟,氯,溴,碘,甲基,乙基,丙基,异丙基,正丁基,异丁基,叔丁基,甲氧基,乙氧基,氨基,羟基,羧基,硝基,磺酸基,三氟甲基,苯基,苄基,苯甲酰基,对溴苯基,对碘苯基,对氟苯基,噻吩,吡啶或冠醚;
r1、r2和r3分别独立地为氢,氟,氯,溴,碘,甲基,乙基,丙基,异丙基,正丁基,异丁基,叔丁基,甲氧基,乙氧基,氨基,羟基,羧基,硝基,磺酸基,三氟甲基,苯基,苄基,苯甲酰基,对溴苯基,对碘苯基,对氟苯基,噻吩,吡啶或冠醚。
本发明的一些较佳实施例中,式(ⅰ)变为式(ⅰ-1)或(ⅰ-2),
式(ⅰ-1)和(ⅰ-2)中,ar1为苯基或六元杂芳基(包括取代的和未取代的),ar2和ar3为苯基、六元杂芳基或五元杂芳基(包括取代的和未取代的);x为氮、氧、硫或硅;各r1分别独立地为甲基,乙基,丙基或异丙基;各r2分别独立地为氢,氟,氯,溴,碘,甲基,乙基,丙基,异丙基,正丁基,异丁基,叔丁基,甲氧基,乙氧基,氨基,羟基,羧基,硝基,磺酸基,三氟甲基,苯基,苄基,苯甲酰基,对溴苯基,对碘苯基,对氟苯基,噻吩,吡啶或冠醚。
进一步的,式(ⅰ-1)优选为左右对称的结构,其中两个r1相同,两个r2相同,两个x均为s,ar1和ar2也相同;式(ⅰ-2)优选为中心对称的结构,其中两个r1相同,两个r2相同,两个x均为s,ar1和ar3也相同;
更进一步的,ar2和ar3为苯基或吡啶芳基;x为硫;r1为甲基。
一些具体的较佳实施例为下列化合物a~i中的一种,
上述左右对称或中心对称的化合物a~i可由两分子的二芳基酮在锌和四氯化钛催化下,通过麦克默里反应即可得到,制备时副反应相对要少,可大大简化合成步骤并有效提高收率。
本发明的另一些较佳实施例中,ar1为未取代的苯基,x为硫,式(ⅰ)变为式(ⅰ-3)或(ⅰ-4),
式(ⅰ-3)和(ⅰ-4)中,各r1分别独立地为甲基,乙基,丙基或异丙基;各r2分别独立地为氢,氟,氯,溴,碘,甲基,乙基,丙基,异丙基,正丁基,异丁基,叔丁基,甲氧基,乙氧基,氨基,羟基,羧基,硝基,磺酸基,三氟甲基,苯基,苄基,苯甲酰基,对溴苯基,对碘苯基,对氟苯基,噻吩,吡啶或冠醚。
本发明的第二目的在于提供制备所述的杂合四芳基乙烯化合物的方法,其包括步骤:由二芳基酮a和b,在锌和四氯化钛催化下,通过麦克默里反应得到杂合四芳基乙烯化合物,反应式如下:
其中r1、r2、r3、ar1、ar2、ar3的定义如前所述。
上述制备方法的一些较佳实施例中,二芳基酮b为二芳基酮a,即两分子的二芳基酮a在锌和四氯化钛催化下,通过麦克默里反应得到左右对称或中心对称的杂合四芳基乙烯化合物。
较佳的,上述制备方法中,二芳基酮a可由芳基甲酰氯和五元杂芳环化合物通过傅-克酰基化反应合成得到,反应式如下:
其中alcl3为傅-克酰基化反应的催化剂,cs2为溶剂。
本发明的第三目的在于提供一种杂合四芳基乙烯聚合物,其结构如式(ia)、(ib)、(ic)或(id),
其中r1、r2、r3、ar1、ar2、ar3的定义如前所述;n=8-10;式(ia)、(ib)、(ic)或(id)的聚合物的两端端部基团为氢、卤素、硼酸或硼酸甲酯。
本发明的杂合四芳基乙烯聚合物的较佳实施例为下列化合物j~n中的一种,
化合物j~n两端端部基团为溴或硼酸甲酯。
制备所述的杂合四芳基乙烯聚合物的方法包括步骤:由二芳基酮c或c’和d,在锌和四氯化钛催化下,反应得到杂合四芳基乙烯单体e或e’,其中一部分单体e在正丁基锂和硼酸三甲酯的作用下变成有双硼酸酯取代的单体f或f’,单体e或e’和单体f或f’通过suzuki偶联反应得到杂合四芳基乙烯聚合物,合成路线为:
其中y为cl或br。
本发明的第四目的在于提供所述的杂合四芳基乙烯化合物及所述杂合四芳基乙烯聚合物在光学领域中的应用,其包括在变色材料,荧光开关,信息存储,防伪材料,光学器件材料以及自显影全息照相中的应用。
所述的应用包括所述杂合四芳基乙烯化合物在溶液、聚合物薄膜、固态粉末和单晶状态下的应用,其应用的是所述杂合四芳基乙烯化合物在溶液、聚合物薄膜、固态粉末和单晶状态下的变色和发光性能。
所述的变色和发光性能具体的包括:
所述的杂合四芳基乙烯的pmma薄膜、单晶及其固体具有优异的光致变色性能,对光响应敏感;
所述的杂合四芳基乙烯的pmma薄膜、单晶及其固体具有明显的荧光;
所述的杂合四芳基乙烯溶解在良溶剂中(二氯甲烷,四氢呋喃,乙酸乙酯)几乎没有荧光,而分散在不良溶剂中(水)具有明显荧光;
所述的杂合四芳基乙烯的pmma薄膜、单晶及其固体在紫外光照射下,可以发生明显的荧光淬灭现象。
本发明的有益效果在于:
1、本发明的杂合四芳基乙烯化合物将二芳烯和四芳基乙烯有机镶嵌在一起。在该结构中,两个五元杂芳环(尤其是噻吩杂芳环)作为光致变色二芳烯结构的部分,两个苯环作为四芳基乙烯的部分,这两者巧妙地共用同一个乙烯桥。这个结构的独特优势在于,一方面两个五元杂芳环(尤其是噻吩杂芳环)和两个苯环共同构成了具有聚集诱导发光性能(aie)的新型杂合四芳基乙烯体系;另一方面在双键两侧不同空间配置的五元杂芳环(尤其是噻吩杂芳环)和苯环可以形成多种光致变色二芳烯单元。这种独特设计赋予本发明设计的杂环四芳基乙烯化合物性能独特,不仅具有良好的光致变色性能、光响应灵敏、量子效率高,同时还具备优异的聚集诱导发光性能。而且,实验结果显示,该材料实用性强,适用领域广泛,在溶液、聚合物薄膜、固态粉末和单晶状态下都能表现出优异的变色和发光性能。
2、本发明通过的傅-克酰基化反应制得二芳基酮中间体,再通过麦克默里反应制备杂合四芳基乙烯化合物,该制备方法具有很高的原子经济性,后处理方便,而且可以极大简化合成过程。以最基础的工业原料为初始原料在温和的条件下,通过两步反应,一锅法即可简单快捷的同时得到顺式、反式杂合四芳基乙烯化合物。
附图说明
图1是化合物a的四氢呋喃溶液的紫外-可见吸收光谱;
图2是化合物d的四氢呋喃溶液的紫外-可见吸收光谱;
图3是化合物a的pmma薄膜的紫外-可见吸收光谱;
图4是化合物d的pmma薄膜的紫外-可见吸收光谱;
图5是化合物a在不同比例的混合溶液中荧光发射光谱;
图6是化合物d在不同比例的混合溶液中荧光发射光谱。
具体实施方式
以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
实施例1化合物a和b的制备
化合物a和b的合成路线
中间体a1的合成
在氩气保护条件下,称取alcl3(2.67g,20mmol)于圆底烧瓶中,往其中加入二硫化碳20ml,保持25℃搅拌10min,加入2,5-二甲基噻吩(1.12g,10mmol),苯甲酰氯(1.40g,10mmol)升温回流搅拌反应6h,将反应液倒入到2n的盐酸中,用二氯甲烷萃取3次,无水硫酸钠干燥,浓缩,柱层析分离得到棕色油状液体,即中间体a1(1.6g,产率74%)。
化合物a和b的合成
在氩气保护条件下,称取锌粉(1.25g,19mmol)于反应瓶中,氮气保护,加入20ml无水四氢呋喃,降温到-15℃,滴加ticl4(1.5ml),滴加完毕,保持-15℃反应10min,升温回流反应3h,加入中间体a1(1.6g,7.4mmol)的四氢呋喃溶液,回流反应4h,将反应液倒入100ml饱和na2co3水溶液中,过滤,滤液用乙酸乙酯萃取3次,无水硫酸钠干燥,浓缩,柱层析分离得到均为黄色固体的两种异构体化合物,即化合物a(0.4g,产率27%)和化合物b(0.4g,产率27%)。
化合物a:1hnmr(400mhz,cdcl3,ppm):δ=7.14-7.08(m,6h),7.01-6.99(m,4h),6.25(s,2h),2.29(s,6h),1.83(s,6h).hrms(esi):m/z[c26h24s2]calcdfor[m+h]+:401.1398,found401.1384.
化合物b:1hnmr(400mhz,cdcl3,ppm):δ=7.24-7.10(m,6h),7.00-6.98(m,4h),6.35(s,2h),2.20(s,6h),1.80(s,6h).hrms(esi):m/z[c26h24s2]calcdfor[m+h]+:401.1398,found401.1394.
实施例2化合物c和d的制备
化合物c和d的合成路线
中间体a2的合成
在氩气保护条件下,称取alcl3(2.67g,20mmol)于圆底烧瓶中,往其中加入二硫化碳20ml,保持25℃搅拌10min,加入2-甲基-5-苯基噻吩(1.74g,10mmol),苯甲酰氯(1.40g,10mmol)升温回流搅拌反应6h,将反应液倒入到2n的盐酸中,用二氯甲烷萃取3次,无水硫酸钠干燥,浓缩,柱层析分离得到棕色油状液体,即中间体a2(1.9g,产率68%)。
化合物c和d的合成
在氩气保护条件下,称取锌粉(1.25g,19mmol)于圆底烧瓶中,氮气保护,加入20ml四氢呋喃,降温到-15℃,滴加ticl4(1.5ml),滴加完毕,保持-15℃反应10min,升温回流反应3h,加入中间体a2(1.9g,6.8mmol)的四氢呋喃溶液,回流反应4h,将反应液倒入100ml饱和na2co3水溶液中,过滤,滤液用乙酸乙酯萃取3次,无水硫酸钠干燥,浓缩,柱层析得到均为黄色固体的两种异构体,即化合物c(0.6g,产率33.7%)和化合物d(0.7g,收率39.3%)。
化合物c:1hnmr(400mhz,cdcl3,ppm):δ=7.39-7.38(m,4h),7.28(s,1h),7.24(s,1h),7.20-7.07(m,14h),6.81(s,2h),2.03(s,6h).hrms(esi):m/z[c36h28s2]calcdfor[m+h]+:525.1711,found:525.1702.
化合物d:1hnmr(400mhz,cdcl3,ppm):δ=7.42-7.38(m,4h),7.25(s,1h),7.20(s,1h),7.20-7.07(m,14h),6.78(s,2h),2.23(s,6h).hrms(esi):m/z[c36h28s2]calcdfor[m+h]+:525.1711,found:525.1712.
实施例3化合物e的制备
化合物e的合成路线
中间体a3的合成
在氩气保护下,称取alcl3(2.64g,20mmol)与圆底烧瓶中,往其中加入二硫化碳20ml,保持25℃搅拌10min,加入2-甲基-5-氯噻吩(1.32g,10mmol),苯甲酰氯(1.40g,10mmol)升温回流搅拌反应6h,将反应液倒入到2n的盐酸中,用二氯甲烷萃取数次,无水硫酸钠干燥,浓缩,柱层析得到棕色油状液体,即中间体a3(1.7g,收率72%)。
化合物e的合成
在氩气保护条件下,称取锌粉(1.25g,19mmol)于圆底烧瓶中,氮气保护,加入20ml四氢呋喃,降温到-15℃,滴加ticl4(1.5ml),滴加完毕,保持-15℃反应10min,升温回流反应3h,加入中间体a3(1.7g,7.2mmol)的四氢呋喃溶液,回流反应4h,将反应液倒入100ml饱和na2co3水溶液中,过滤,将滤液用乙酸乙酯萃取3次,无水硫酸钠干燥,浓缩,柱层析得到黄色固体,即化合物e(230mg,收率14.6%)。1hnmr(400mhz,cdcl3,ppm):δ=7.17-7.10(m,6h),7.11-6.99(m,4h),6.32(s,2h),2.40(s,6h).hrms(esi):m/z[c26h24s2]calcdfor[m+h]+:441.0305,found:441.0310.
实施例4化合物f的制备
化合物f的合成路线
中间体a4的合成
称取alcl3(2.64g,20mmol)与圆底烧瓶中,往其中加入20ml二硫化碳,保持25℃搅拌10min,加入2-甲基-5-硝基基噻吩(1.43g,10mmol),苯甲酰氯(1.40g,10mmol)升温回流搅拌反应6h,将反应液倒入到2n的盐酸中,二氯甲烷萃取,干燥,浓缩,柱层析得到棕色油状液体,即中间体a4(1.6g,收率64%)。
化合物f的合成
称取锌粉(1.25g,19mmol)于反应瓶中,氮气保护,加入20ml四氢呋喃,降温到-15℃,滴加ticl4(1.5ml),滴加完毕,保持-15℃反应10min,升温回流反应3h,加入中间体a4(1.6g,6.4mmol)的四氢呋喃溶液,回流反应4h,将反应液倒入100ml饱和na2co3水溶液中,过滤,滤液用乙酸乙酯萃取,干燥,浓缩,柱层析得到黄色固体,即化合物f(130mg,收率9%)。1hnmr(400mhz,cdcl3,ppm):δ=7.18-7.08(m,6h),7.01-6.99(m,4h),6.28(s,2h),2.36(s,6h).hrms(esi):m/z[c26h24s2]calcdfor[m+h]+:463.0781,found:463.0782.
实施例5化合物g的制备
化合物g的合成路线
中间体a5的合成
称取alcl3(2.64g,20mmol)与圆底烧瓶中,往其中加入20ml二硫化碳,保持25℃搅拌10min,加入2,5-二甲基噻吩(1.12g,10mmol),对氯苯甲酰氯(1.73g,10mmol)升温回流搅拌反应8h,将反应液倒入到2n的盐酸中,二氯甲烷萃取,干燥,浓缩,柱层析得到棕色油状液体,即中间体a5(1.56g,收率62.4%)。
化合物g的合成
称取锌粉(1.25g,19mmol)于反应瓶中,氮气保护,加入20ml四氢呋喃,降温到-15℃,滴加ticl4(1.5ml),滴加完毕,保持-15℃反应10min,升温回流反应3h,加入中间体a5(1.3g,5.2mmol)的四氢呋喃溶液,回流反应6h,将反应液倒入100ml饱和na2co3水溶液中,过滤,滤液用乙酸乙酯萃取,干燥,浓缩,柱层析得到黄色固体,即化合物g(220mg,收率18%)。1hnmr(400mhz,cdcl3,ppm):δ=7.49-7.44(m,8h),6.40(s,2h),2.47(s,6h),2.36(s,6h).hrms(esi):m/z[c26h22cl2s2]calcdfor[m+h]+:469.0540,found469.0544.
实施例6化合物h的制备
化合物h的合成路线
中间体a6的合成
称取alcl3(2.64g,20mmol)与圆底烧瓶中,往其中加入20ml二硫化碳,保持25℃搅拌10min,加入2,5-二甲基噻吩(1.12g,10mmol),吡啶酰氯(1.40g,10mmol)升温回流搅拌反应6.5h,将反应液倒入到2n的盐酸中,二氯甲烷萃取,干燥,浓缩,柱层析得到棕色油状液体,即中间体a6(1.50g,收率69.1%)。
化合物h的合成
称取锌粉(1.25g,19mmol)于反应瓶中,氮气保护,加入20ml四氢呋喃,降温到-15℃,滴加ticl4(1.5ml),滴加完毕,保持-15℃反应10min,升温回流反应3h,加入中间体a6(1.4g,6.5mmol)的四氢呋喃溶液,回流反应6h,将反应液倒入100ml饱和na2co3水溶液中,过滤,滤液用乙酸乙酯萃取,干燥,浓缩,柱层析得到黄色固体,即化合物h(320mg,收率24.6%)。1hnmr(400mhz,cdcl3,ppm):δ=8.54-8.36(m,8h),6.20(s,2h),2.36(s,6h),2.26(s,6h).hrms(esi):m/z[c24h22n2s2]calcdfor[m+h]+:403.1303,found403.1306.
实施例7化合物i的制备
化合物i的合成路线
中间体a6的合成
称取alcl3(2.64g,20mmol)与圆底烧瓶中,往其中加入20ml二硫化碳,保持25℃搅拌10min,加入2,5-二甲基呋喃(0.96g,10mmol),苯甲酰氯(1.40g,10mmol)升温回流搅拌反应10h,将反应液倒入到2n的盐酸中,二氯甲烷萃取,干燥,浓缩,柱层析得到棕色油状液体,即中间体a7(1.20g,收率60.0%)。
化合物i的合成
称取锌粉(1.25g,19mmol)于反应瓶中,氮气保护,加入20ml四氢呋喃,降温到-15℃,滴加ticl4(1.5ml),滴加完毕,保持-15℃反应10min,升温回流反应3h,加入中间体a6(1.0g,5.0mmol)的四氢呋喃溶液,回流反应6h,将反应液倒入100ml饱和na2co3水溶液中,过滤,滤液用乙酸乙酯萃取,干燥,浓缩,柱层析得到白色固体,即化合物i(270mg,收率29%)。1hnmr(400mhz,cdcl3,ppm):δ=7.54-7.36(m,6h),7.16-7.10(m,4h)6.17(s,2h),2.32(s,6h),2.17(s,6h).hrms(esi):m/z[c26h24o2]calcdfor[m+h]+:369.1855,found369.1858.
实施例8聚合物j的制备
化合物j的合成路线
中间体a8.1的合成
称取alcl3(2.64g,20mmol)与圆底烧瓶中,往其中加入20ml二硫化碳,保持25℃搅拌10min,加入2,5-二甲基噻吩(1.12g,10mmol),间溴苯甲酰氯(2.17g,10mmol)升温回流搅拌反应10h,将反应液倒入到2n的盐酸中,二氯甲烷萃取,干燥,浓缩,柱层析得到棕色油状液体,即中间体a8.1(2.50g,收率89.9%)。
中间体a8.2的合成
称取锌粉(1.25g,19mmol)于反应瓶中,氮气保护,加入20ml四氢呋喃,降温到-15℃,滴加ticl4(1.5ml),滴加完毕,保持-15℃反应10min,升温回流反应3h,加入中间体a8.1(2.24g,7.6mmol)的四氢呋喃溶液,回流反应6h,将反应液倒入100ml饱和na2co3水溶液中,过滤,滤液用乙酸乙酯萃取,干燥,浓缩,柱层析得到白色固体,即化合物a8.2(770mg,收率37%)。1hnmr(400mhz,cdcl3,ppm):δ=7.34-7.28(m,4h),7.20-7.16(m,4h)6.26(s,2h),2.43(s,6h),2.27(s,6h).hrms(esi):m/z[c26h22br2s2]calcdfor[m]+:554.9446,found554.9448.
中间体a8.3的合成
称取反应原料a8.2(350mg,0.6mmol)于三口反应瓶中,氮气保护加入10ml无水四氢呋喃,冰盐浴降温,缓慢往其中滴加正丁基锂(1ml,2mmol)滴加完毕保持冰盐浴搅拌反应30min,升高温度到室温继续搅拌反应30min。往其中滴加硼酸三甲酯(1ml)保持室温搅拌反应3h留待后续下步反应。
聚合物j的制备
称取反应中间体a8.2(350mg,0.6mmol)和a8.3,氮气保护加入25ml无水四氢呋喃,k2co3(3g),pd(pph3)4(100mg),h2o(3ml)升温回流搅拌反应48h。将反应液倒入水中,分出有机相,水相用25ml二氯甲烷反复萃取3次,硫酸镁干燥,除溶剂后,残留物用索氏提取器提取24h得到聚合物j(平均分子量mw=3584)。
实施例9化合物a~d的四氢呋喃溶液的光致变色实验
分别配制化合物a~d的1×10-5mol/l四氢呋喃溶液,进行光致变色实验。
在紫外光照射前,化合物a的四氢呋喃溶液是无色的,在400nm-700nm的可见光波长范围内没有吸收,经过254nm的紫外光(uv)照射后在463nm处出现了一个新的吸收峰,并且随着照射时间的加长,吸收增强。在经过180s的紫外光照射后达到光稳态,溶液变为橙色,继续用紫外光照射没有新的吸收峰出现。用500nm的可见光(vis)照射溶液颜色由橙色逐渐褪为无色,同时在463nm处的吸收峰逐渐减弱(详见图1)。
在紫外光照射前,化合物b的四氢呋喃溶液是无色的,在400nm-700nm的可见光波长范围内没有吸收,经过254nm的紫外光照射后在462nm处出现了一个新的吸收峰,并且随着照射时间的加长,吸收增强。在经过240s的紫外光照射后达到光稳态,溶液变为黄色,继续用紫外光照射没有新的吸收峰出现。用500nm的可见光照射溶液颜色由黄色逐渐褪为无色,同时在462nm处的吸收峰逐渐减弱。
在紫外光照射前,化合物c的四氢呋喃溶液是无色的,在400nm-700nm的可见光波长范围内没有吸收,经过254nm的紫外光照射后在502nm处出现了一个新的吸收峰,并且随着照射时间的加长,吸收增强。在经过70s的紫外光照射后达到光稳态,溶液变为粉红色,继续用紫外光照射没有新的吸收峰出现。用500nm的可见光照射溶液颜色由粉红色逐渐褪为无色,同时在502nm处的吸收峰逐渐减弱。
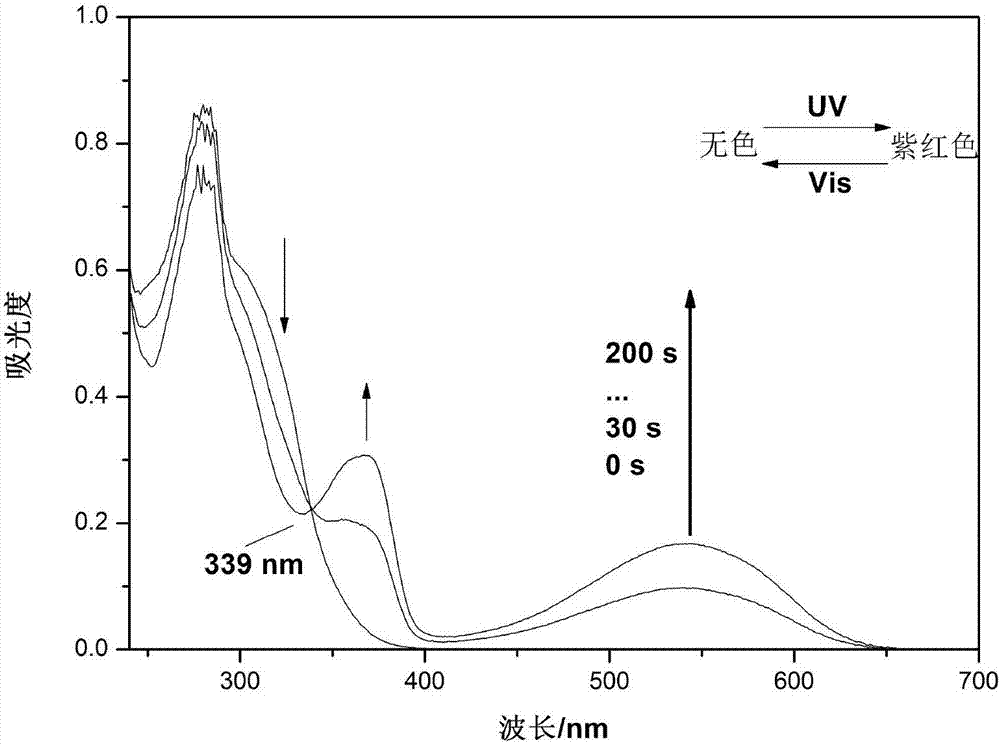
在紫外光照射前,化合物d的四氢呋喃溶液是无色的,在400nm-700nm的可见光波长范围内没有吸收,经过254nm的紫外光照射后在542nm处出现了一个新的吸收峰,并且随着照射时间的加长,吸收增强。在经过200s的紫外光照射后达到光稳态,溶液变为紫红色,继续用紫外光照射没有新的吸收峰出现。用500nm的可见光照射溶液颜色由紫红色逐渐褪为无色,同时在542nm处的吸收峰逐渐减弱(详见图2)。
实施例10化合物a~d的pmma薄膜的光致变色实验
分别将pmma固体溶解在含化合物a~d的1×10-3mol/l的二氯甲烷溶液中,通过旋涂的方法制备含有化合物a~d的pmma薄膜,进行光致变色试验。
在紫外光照射前,含化合物a的pmma薄膜是无色的,在400nm-700nm的可见光波长范围内没有吸收,经过254nm的紫外光照射后在470nm处出现了一个新的吸收峰,并且随着照射时间的加长,吸收增强。在经过160s的紫外光照射后达到光稳态,溶液变为橙色,继续用紫外光照射没有新的吸收峰出现。用500nm的可见光照射溶液颜色由橙色逐渐褪为无色,同时在470nm处的吸收峰逐渐减弱(详见图3)。
在紫外光照射前,含化合物b的pmma薄膜是无色的,在400nm-700nm的可见光波长范围内没有吸收,经过254nm的紫外光照射后在467nm处出现了一个新的吸收峰,并且随着照射时间的加长,吸收增强。在经过230s的紫外光照射后达到光稳态,溶液变为黄色,继续用紫外光照射没有新的吸收峰出现。用500nm的可见光照射溶液颜色由黄色逐渐褪为无色,同时在467nm处的吸收峰逐渐减弱。
在紫外光照射前,含化合物c的pmma薄膜是无色的,在400nm-700nm的可见光波长范围内没有吸收,经过254nm的紫外光照射后在504nm处出现了一个新的吸收峰,并且随着照射时间的加长,吸收增强。在经过140s的紫外光照射后达到光稳态,溶液变为粉红色,继续用紫外光照射没有新的吸收峰出现。用500nm的可见光照射溶液颜色由粉红色逐渐褪为无色,同时在504nm处的吸收峰逐渐减弱。
在紫外光照射前,含化合物d的pmma薄膜是无色的,在400nm-700nm的可见光波长范围内没有吸收,经过254nm的紫外光照射后在543nm处出现了一个新的吸收峰,并且随着照射时间的加长,吸收增强。在经过160s的紫外光照射后达到光稳态,溶液变为紫红色,继续用紫外光照射没有新的吸收峰出现。用500nm的可见光照射溶液颜色由紫红色逐渐褪为无色,同时在543nm处的吸收峰逐渐减弱(详见图4)。
实施例11化合物a~d的聚集诱导发光性质测试实验
分别配制化合物a~d的1×10-5mol/l四氢呋喃溶液,逐次加入不良溶剂水,进行聚集诱导发光性质测试。
化合物a~d在纯的四氢呋喃溶液中在330nm的激发波长下,荧光发射强度几乎为零,随着不良溶剂水的不断加入,化合物a~d荧光发射强度均逐渐增加,在水的含量达到80%的时候,荧光发射强度急剧增加,其中化合物a和d荧光谱图分别如图5和6所示。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 可聚合化合物和其在液晶显示器中的用途的制作方法与工艺
- 可聚合化合物及其在液晶显示器中的用途的制作方法与工艺
- 能聚合的液晶化合物,用于光学膜的组合物,以及光学膜、补偿膜、抗反射膜和显示装置的制作方法
- 对非酚类聚合物使用酚类脂肪酸化合物的方法与流程
- 化合物、聚合物、着色剂、感光性树脂组成物、感光性树脂层以及彩色滤光片的制造方法与工艺
- 包含改性的二有机硅氧烷聚合物的化合物的制造方法与工艺
- 用于氯乙烯聚合物树脂的新型偶联尿嘧啶化合物的制造方法与工艺
- 聚合性化合物、组合物、聚合物、光学各向异性体、液晶显示元件和有机EL元件的制造方法与工艺
- 可聚合的化合物和其在液晶显示器中的用途的制造方法与工艺
- 免疫调节剂‑聚合物化合物的制造方法与工艺