人类亲权鉴定用多重PCR引物组及检测方法与流程
本发明涉及医疗检测领域,通过使用特定的snp标记组合对人类亲权关系进行检测,具体涉及表一中部分或全部核苷酸序列以及检测方法。
背景技术:
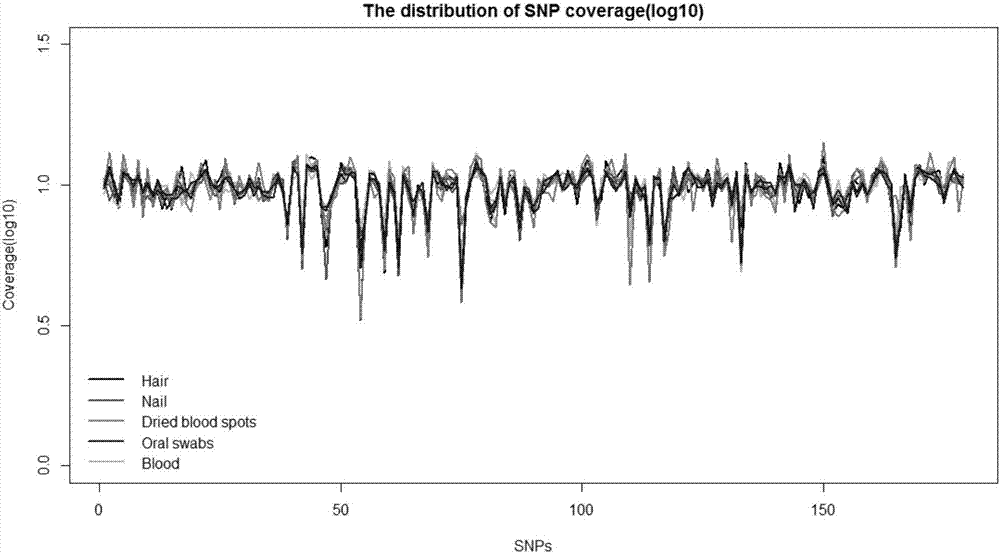
:亲权鉴定是指通过对人类遗传标记的检测,根据遗传规律分析,对个体之间血缘关系的鉴定。目前用于亲权鉴定的方法是dna分析,由于最早时的第一代遗传标记--限制性片段长度多态性(rflp)具有自身的局限性,检测过程费时费力,且一次仅能检测一个位点,多态性程度较低,因此在亲权鉴定中的应用逐渐减少;此后以第二代遗传标记--短串联重复序列(str)为主的分型技术成为个体识别与亲权鉴定研究中使用频率最高的分子标记,它具有信息量大、分布广泛、易于检测、多态性程度高且遵循孟德尔共显性遗传等特点。在应用str进行亲权鉴定时,检测的基因座需要达到15-20个,若出现3个及3个以上违反遗传规律的基因座,则可排除亲权关系。然而,近年来发现str标记判型错误率较高,重复性差,会直接影响亲权鉴定的准确性和可重复性。单核苷酸多态性(snp)作为继rflp和str后的第三代遗传标记,越来越多地受到人们的关注。目前大量的snp标记已经被应用于基因功能研究和疾病的关联分析中,并已逐渐取代str,成为首选的遗传标记,snp标记因其具有分布广泛,数量丰富,遗传稳定,高通量检测快速准确等其他标记无法比拟的优势,因此在无创亲子鉴定领域中成为新兴热门的鉴定方法。起初,孕妇怀孕期间,但又不确定怀孕的胎儿父亲是谁,能解决的方法是在怀孕期间进行绒毛膜取样或羊膜穿刺,但这会带来流产的风险,另外的一种方法是等胎儿出生后再去鉴定生父。直到1997年,lo等人研究证实,孕妇的血液中存在胎儿游离dna,这为无创亲子鉴定提供了技术依据。随着高通量测序技术的发展,基于snp标记位点对在怀孕期间对胎儿进行无创亲子鉴定成为亲权鉴定的主要发展方向。但用于无创鉴定的胎儿游离dna数量有限,snp标记分布众多,富集过程容易导致测序结果读取(reads)数目分布差异较大,背景噪音引起结果偏差,基因组突变差异对snp遗传差异造成较大干扰,容易造成怀孕早期无创检测结果的准确性降低。技术实现要素:有鉴于此,本发明创造旨在提出一组人类亲权鉴定用多重pcr引物组及检测方法,能够克服怀孕早期无创亲子鉴定的不足,准确度高,可应用于司法鉴定以及法医学研究中。本发明创造提供的人类亲权鉴定用多重pcr引物组,所涉及的snp位点及引物满足以下条件:t1:常染色体上snp位点的maf值大于0.4;t2:x染色体上snp位点的maf值大于0.3;t3:y染色体上snp位点的maf值大于0.1;t4:maf的频率在北京人种和亚洲人种中同时要满足上述t1,t2,t3频率要求;t5:所选的snp位点不能位于人类常见cnv区域;t6:所选snp位点与其相邻3bp组成的区域不能是3个或3个以上相同的碱基重复序列;t7:所选snp位点与其左右50bp组成的区域不能存在循环(repeat)序列;t8:所选snp位点上已知的基因型不能超过两种;t9:所选snp位点之间的距离要大于4,000,000bp;t10:对snp左右75bp进行发夹结构,二聚体的预测,去除存在发夹结构或二聚体的snp位点;t11:把snp左右50bp的序列切割成30bpk-mer,重新比对到基因组,比对质量相加,最大者优先选择;t12:对上述所选snp位点进行高通量测序,进行重复测序实验(优选为重复10组实验),计算每个snp位点测得的reads数目中位数,计算这些中位数的标准差,去除中位数大于或小于标准差3倍的snp位点。其中,所述多重pcr引物组中所涉及的snp位点不少于150个,优选地不少于179个,更优选地不少于400个。根据上述条件,筛选并建立了一组由snp遗传标记位点组成的多重pcr引物组,具体见后面表一所示。其中,所述多重pcr引物组优选地由表一中的任意150对以上的引物组构成,更优选地由表一中的任意179对以上的引物组构成,还优选地由表一中的任意400对以上的引物组构成,进一步优选地由表一中的前179对以上的引物组构成,最优选地由表一中的前415对以上的引物组构成。本发明还提供了采用上述多重pcr引物组进行人类亲权鉴定的检测方法,包括下述步骤:s1:提取孕妇新鲜外周血浆中的胎儿游离dna;提取基因组dna,包括孕妇dna、疑似父亲dna、随机未知父亲(例如,可以为亚洲任一随机男子)dna;s2:利用上述多重pcr引物组进行多重pcr扩增,分别对随机未知父亲dna、疑似父亲dna、孕妇dna和胎儿游离dna进行富集;s3:分别对扩增后的pcr产物进行文库构建、稀释后,采用高通量测序方法进行测序;s4:根据测序结果对疑似父亲、孕妇、胎儿的snp位点对应的基因型进行比对,进行亲权关系推断。其中,所述疑似父亲dna可以包括从外周血中提取的gdna、从干血片中提取的gdna、从口腔上皮细胞中提取的gdna、从毛发(带毛囊)中提取的gdna、或从指甲中提取的gdna。其中,所述步骤s3中,高通量测序可采用新一代高通量测序仪,如ionproton平台或illumina平台进行上机测序。其中,所述步骤s4中,所述亲权关系推断步骤包括:s4-1:选取测序深度大于200的snp位点;s4-2:选取孕妇snp位点中最大等位基因reads频率大于99%的位点;s4-3:计算父亲指数paternityindex(pi)和累计亲权指数combinedpaternityindex(cpi),pi=x/yx=pr(plasma|mother,t)代表嫌疑父亲为胎儿生物学父亲的概率;y=pr(plasma|mother,r)随机未知父亲为胎儿生物学父亲的概率;根据贝叶斯模型:一般当cpi值大于10000时,我们认为检测的疑似父亲和孕妇所怀的胎儿有生物学上亲子关系。相对于现有技术,本发明创具有以下优势:本发明通过高通量测序技术检测snp多态性并对亲权关系进行推断及验证,无论是二联体亲子鉴定还是三联体亲子鉴定,其亲权关系都是极为显著的,并且实验鉴定结果与实际亲权关系相吻合;本发明提供的多重pcr引物组的筛选条件,以及根据该条件确认的由表一中部分或全部snp遗传标记位点组成的多重pcr引物组,能够在怀孕10周即可进行无创检测,同时能够消除富集过程导致的测序结果reads数目分布差异,降低背景噪音,减少基因组突变干扰,有效提高怀孕早期无创检测结果的准确性,当多重pcr引物组中所涉及的snp位点不少于150个时,基本能够保证十万分之一的检测精度。附图说明图1为本发明多重pcr引物组进行无创亲子鉴定检测的不同样本类型分析图。具体实施方式下面结合具体实施例来详细说明本发明创造。但不用于限定本发明。本文中,“以上”的表述包括本数。一、采用表一所示的部分或全部snp遗传标记位点组成的多重pcr引物组进行人类亲权检测,以下为具体步骤。a.提取dna本实验的孕妇样本是采用ardent采血管采集的全血,通过两步离心法获得血浆,具体操作如下:4℃,1600g,离心10min,吸取上清到新的2mlep管中。收集到的上清液再在4℃条件下,16000g,离心10min,同样吸取上清到新的2mlep管中,备用。(1)提取胎儿游离dna1)取2ml血浆,平衡至室温,加入30ulproteinasek(浓度为20mg/ml),100ul20%的sds溶液,振荡混匀后,短暂离心,于60℃孵育20min。反应完成后,冰上孵育5min。2)将30ulcellfreednamagneticbeads加入到2.5ml的cellfreednalysis/bindingsolution中,振荡混匀,配制成混合液,加入到第一步反应液中,充分涡旋混匀,使用垂直混匀仪摇匀10min。3)取下离心管,将其置于磁力架上,静置5min,待溶液澄清后弃上清。4)取下离心管,加入1mlcellfreednawashsolution,重悬磁珠,短暂离心后置于磁力架上,2min后溶液澄清,弃上清。5)重复步骤4)一次。6)取下离心管,加入1ml当天配制的80%酒精,重悬磁珠,短暂离心后置于磁力架上,2min后溶液澄清,弃上清。7)重复步骤6)一次。8)继续将离心管置于磁力架上,开盖晾干10min。9)待磁珠晾干后,加入25ulcellfreednaelutionsolution,涡旋混匀5min,短暂离心。10)再次将离心管放置于磁力架上,2min后溶液澄清,转移上清液到新的1.5mlep管中,并做好标记。11)使用qubit2.0定量cfdna浓度后可立即做后续实验或存放于-20℃保存。(2)提取孕妇gdna1)取1.5mlep管,依次加入20ulqiagenprotease、200ul全血,200ulbufferal,涡旋混匀15s。2)将ep管于56℃,孵育10min。3)短暂离心后加入200ul乙醇(96-100%)至上述反应液中,再次涡旋混匀15s,短暂离心。4)转移反应液于吸附柱中,8000rpm离心1min,弃掉废液,将吸附柱放置于干净的2ml收集管中。5)加入500ulbufferaw1于吸附柱中,8000rpm离心1min,弃掉废液,将吸附柱放置于干净的2ml收集管中。6)加入500ulbufferaw2于吸附柱中,14000rpm离心3min,弃掉废液,将吸附柱放置于干净的2mlep管中,再次14000rpm离心1min。7)取下吸附柱,放置于干净的1.5mlep管中,加入200ulbufferae,室温孵育5min。8)8000rpm离心1min,收集到的溶液即为最终的gdna。9)使用nanodrop和qubit2.0定量gdna浓度后可立即做后续实验或存放于-20℃保存。(3)提取疑似父亲gdna(口腔拭子,随机未知父亲的相关dna提取方法相同)1)将口腔拭子取出放入2ml离心管中,依次加入400ulpbs、20ulqiagenprotease、400ulbufferal,涡旋混匀15s。2)将离心管于56℃,孵育10min。3)短暂离心后加入400ul乙醇(96-100%)至上述反应液中,再次涡旋混匀15s,短暂离心。4)转移反应液于吸附柱中,8000rpm离心1min,弃掉废液,将吸附柱放置于干净的2ml收集管中。5)重复步骤4)一次。6)加入500ulbufferaw1于吸附柱中,8000rpm离心1min,弃掉废液,将吸附柱放置于干净的2ml收集管中。7)加入500ulbufferaw2于吸附柱中,14000rpm离心3min,弃掉废液,将吸附柱放置于干净的2mlep管中,再次14000rpm离心1min。8)取下吸附柱,放置于干净的1.5mlep管中,加入150ulbufferae,室温孵育5min。9)8000rpm离心1min,收集到的溶液即为最终的gdna。10)使用nanodrop和qubit2.0定量gdna浓度后可立即做后续实验或存放于-20℃保存。(4)提取疑似父亲gdna(干血片,随机未知父亲的相关dna提取方法相同)1)用打孔器从干血片中切出3~5片直径为3mm的带血圆片,并转移至1.5ml离心管中。2)依次加入200ulbufferatl、20ulproteinasek,于55℃振荡孵育1h。3)加入220ulbufferal至上述反应液中,于70℃振荡孵育15min。4)10000g,离心3min,收集管中液体,并将其转移至新的干净的1.5ml离心管中。5)依次加入20ulmagbindparticles、400ulbuffermbd,振荡混匀6min。6)短暂离心,将离心管置于磁力架,2min后溶液澄清,弃上清。7)加入500ulbuffergw1,振荡混匀1min。8)短暂离心,将离心管置于磁力架,2min后溶液澄清,弃上清。9)重复步骤7)~8)一次。10)加入500ul75%乙醇,振荡混匀1min。11)短暂离心,将离心管置于磁力架,2min后溶液澄清,弃上清。12)重复步骤10)~11)一次。13)继续将离心管置于磁力架上,晾干磁珠6min。14)加入30ulbufferae于上述晾干的磁珠中,于60℃振荡孵育10min。15)短暂离心,将离心管置于磁力架,2min后溶液澄清,收集上清液并转移至干净的1.5ml离心管中。16)使用nanodrop和qubit2.0定量gdna浓度后可立即做后续实验或存放于-20℃保存。(5)提取疑似父亲dna(其他,随机未知父亲的相关dna提取方法相同)其他疑似父亲dna样本可采用常规方法获得。为验证疑似父亲dna样本不同来源对检测结果的影响,分析了上述表一中全部snp遗传标记位点分别在不同来源dna样本中的分布情况(图1),可以看出,不同dna样本来源中,上述snp覆盖率的分布基本相同,确保了不同样本来源检测结果的一致性和准确性。b.多重pcr扩增1)将多重pcr引物panel、gdna于冰上解冻,备用。2)多重pcr扩增的反应体系如下:componentvolume(ul)5xionampliseqtmhifimix4ulprimerpool10ul模板dna(5~18ng)≤6ulnuclease-freewaterto20ul枪头吹打混匀后,短暂离心,将pcr反应管置于pcr仪上反应,反应程序如下:反应结束后,取出pcr管短暂离心。c.文库构建采用文库构建试剂盒对扩增后的多重pcr产物进行文库构建。1)部分消化引物序列加入2ulfupareagent到每个样本中,此时总体积为22ul。枪头吹打混匀后,短暂离心,将pcr反应管置于pcr仪上反应,反应程序如下:反应结束后,取出pcr管短暂离心。2)连接接头首先按照p1adapter:barcodex:nuclease-freewater=1:1:2的比例稀释接头。之后按照如下反应体系依次加入每个样本中:componentvolume(ul)switchsolution4ul稀释好的接头2uldnaligase2ultotal30ul枪头吹打混匀后,短暂离心,将pcr反应管置于pcr仪上反应,反应程序如下:temperaturetime22℃30min72℃10min10℃hold(最多1小时)反应结束后,取出pcr管短暂离心。3)纯化上述dna片段dna纯化磁珠在使用前需平衡30min至1h。①吸取dna纯化磁珠,吸取的量为1.5~3倍样本体积,用同一枪头吹打混匀,室温静置5min。②将pcr管放在96孔磁力架上,5min后溶液变澄清,弃去上清液。③吸取150ul当天配制的70~75%乙醇于上述反应磁珠中;在磁力架中来回移动pcr管的位置使磁珠得到充分洗脱,弃去上清液。④重复步骤③一次。⑤尽量吸去残留溶液后,将磁珠暴露空气中,室温晾干磁珠5min。⑥配制pcr反应混合液,反应体系如下:⑦吸取配制好的反应混合液52ul于上步晾干的磁珠中,用同一枪头吹打混匀后,静置反应5min。⑧将pcr管置于磁力架上,待溶液澄清后将全部上清液(约52ul)吸取至新的pcr管中,pcr反应程序如下:反应结束后,取出pcr管短暂离心。4)文库扩增后的片段筛选及纯化①吸取dna纯化磁珠,吸取量为0.5~2倍样本体积,用同一枪头吹打混匀,室温静置5min。②将pcr管放在96孔磁力架上,5min后溶液变澄清,转移上清液至新的pcr管中。③吸取dna纯化磁珠,吸取量为1.2~2.5倍样本体积,加到上清液中,用同一枪头吹打混匀,室温静置5min。④将pcr管放在96孔磁力架上,5min后溶液变澄清,弃去上清液。⑤吸取150ul当天配制的70~75%乙醇于上述反应磁珠中;在磁力架中来回移动pcr管的位置使磁珠得到充分洗脱,弃去上清液。⑥重复步骤⑤一次。⑦尽量吸去残留溶液后,将磁珠暴露空气中,室温晾干磁珠5min。⑧取下pcr管,并加入50ullowte至晾干的磁珠中,用枪头吹打混匀,室温放置5min。⑨重新将pcr管放回96孔磁力架上,溶液澄清后,转移上清50ul到干净的1.5mlep管中,做好标记。⑩制备好的文库可存放于-20℃保存。d.文库质控采用qubit2.0和agilent2100对构建好的文库进行质控,并将文库稀释至100~200pm之间,准备上机测序。e.测序应用新一代高通量测序仪,如ionproton平台或illumina平台进行上机测序。f.数据分析通过软件对上机测序的结果进行生物信息学分析,对疑似父亲、孕妇以及胎儿的snp位点对应的基因型进行比对,通过计算亲权指数,进一步得到父权相对机会,以此进行亲权关系推断。二、检测结果的验证为了验证所筛选的snp遗传标记位点组成的多重pcr引物组在实际家庭中进行亲权鉴定的可行性和准确性,本实施例从中山开发区医院采集了20组样本(孕妇孕周均为10周-12周)进行无创亲子鉴定的验证实验,其中有10组是夫妻关系明确的家庭组合,剩余10组为无关未知男性与任一孕妇配对组合。将这20组样本分别编号为ky-family1~ky-family20。通过实施例1中的检测方法对20组样本进行亲缘关系的推断,179个snp遗传标记位点组成的多重pcr引物组(表一中的前179对引物组)和415个snp遗传标记位点组成的多重pcr引物组(表一中的前415对引物组)相比较的鉴定结果见表二。表二注:父权相对机会(rcp):由于亲权指数是实数,由数字不易看出父权的机会,习惯上将父权指数换算成一个条件概率,即父权相对机会,也是亲子关系概率,代表了判断疑似父亲是孩子生父的把握度大小。由表二可以看出,本发明提供的筛选条件及其筛选出的多重pcr引物组用于无创亲子鉴定时,其亲权关系显著,179个snp遗传标记位点组成的多重pcr引物组鉴定亲权关系时其父权相对机会可达99.999%以上,能够对亲权关系作出准确地区分。但增加位点数至415时,父权相对机会能够达到99.999999%以上,且多位点分析时结果更接近真实情况,因此,本发明优选地采用415位点组成的多重pcr引物panel进行无创亲子鉴定,结果准确性高,鉴定结果与实际亲权关系完全吻合;利用新一代高通量测序技术检测snp多态性,以此进行无创产前亲子鉴定,具有安全、快速、准确、低成本、高通量等诸多优势,并且相比于目前已有的检测方法,该发明在孕妇怀孕的早期孕周10周时即可进行检测,且胎儿浓度可达到6%以上,除此之外,整个检测过程只需采集孕妈外周血,安全无创伤,为更多的家庭或个人提供巨大的便利和价值,同时也可将该方法应用于法学研究的亲权鉴定中,具有很大的应用前景和经济效益。表一以上所述仅为本发明创造的较佳实施例而已,并不用以限制本发明创造,凡在本发明创造的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明创造的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1