增强整合素受体亲和力及靶细胞摄取能力的结构分子及其应用的制作方法
本发明属于生物医药领域,具体涉及一种对靶细胞中的基因进行调控的技术。
背景技术:
小干扰rna分子(sirna)是rna干扰(rnai)理论的效应分子,可以特异性沉默引起或促进肿瘤增殖、侵袭和转移的基因,故sirna分子作为一种新型的癌症治疗候选药物,具有极大的应用潜力。
然而,sirna分子的分子量大,且带负电荷,该特性与细胞膜的负电性和脂溶性的性质相互排斥,缺乏有效的递释系统,使其难以通过细胞膜直接进入细胞内,限制了sirna分子进入靶细胞内部而阻碍了其临床应用。目前,常见临床前研究的sirna分子递释系统包括病毒类和非病毒类系统。病毒类递释系统因其免疫原性及致瘤性而不适合临床应用;非病毒类递释系统如阳离子聚合物纳米粒、及纳米脂质体制剂存在制备工艺复杂、制备成本高、制剂不稳定、及体内应用毒性大等缺陷,直接制约了sirna分子纳米粒给药系统的临床转化。具有临床转化价值的sirna分子高效递释系统,应该具有能够容易制备、成本低、制剂稳定性好、毒副作用低、临床顺应性强、高效递释sirna分子进入靶细胞内、易于从细胞内体中释放、及确保不妨碍sirna分子的基因沉默活性等特点(leesh,kangyy,jangh,mokh.currentpreclinicalsmallinterferingrna(sirna)-basedconjugatesystemsforrnatherapeutics[j].advanceddrugdeliveryreviews,2016,104:78-92.)。
整合素αvβ3受体仅在新生血管内皮细胞及部分肿瘤细胞膜(如恶性胶质瘤、黑色素瘤、卵巢癌、乳腺癌、直肠癌和前列腺癌等)有高水平表达,该受体可与精氨酸-甘氨酸-天冬氨酸三肽序列(简称rgd)结合(barczykm,carracedos,gullbergd.integrins[j].cellandtissueresearch,2010,339(1):269-280.),其中cyclo(-rgdfk)寡肽(简称crgd)是其特异性配体之一,crgd可将所携带的其它分子经αvβ3受体介导的内吞机制带入细胞内(hwangr,varnerj.theroleofintegrinsintumorangiogenesis[j].hematoloncolclinnortham,2004,18(5):991-1006)。
中国专利申请号为2013100198709的发明属于生物工程制药、蛋白质多肽类药物及生物医学工程领域,涉及对整合素受体αvβ3具有高亲和力的多肽及其应用,多肽序列为:arg-trp-arg或arg-lys-tyr。该发明的多肽比传统的rgd肽对于整合素αvβ3具有更强的亲和力,可用于癌症诊断和治疗中。中国专利申请号为2013100693674的发明公开了一种癌细胞靶向性结构分子及其应用,它是将摘要附图所示的分子与含有羧基结构和马来酐亚胺基团的连接分子反应,利用单个crgd连接sirna分子,使氨基和羧基脱水缩合,而得到癌细胞靶向性结构分子。这两个专利缺乏在靶向细胞体内发生作用的机理,对于sirna等的摄取和释放能力未有能力或者能力太弱。
技术实现要素:
本发明第一个目的:
提供一种能够显著提高靶细胞中基因沉默效率的增强αvβ3受体亲和力及靶向细胞摄取能力的结构分子。
第一技术方案:
本发明的增强整合素受体(本文中特指整合素αvβ3,是一种跨膜的异质二聚体,它由两个非共价结合的跨膜亚基,即α和β亚基所组成)亲和力及靶向细胞摄取能力的结构分子具有如式(i)所示的分子结构。
其中x基团的结构为
y基团的结构为
z基团为能够与两个x基团、一个y基团同时链接的有机基团,优选具有如式(ii)或者式(iii)或者式(iv)所示的结构:
其中1代表x基团的连接位置,2代表y基团的连接位置。
本发明所述的结构分子含有精氨酸-甘氨酸-天冬氨酸(rgd)三肽序列,能与特异性表达整合素αvβ3受体的细胞结合,呈现出较强的亲和力。
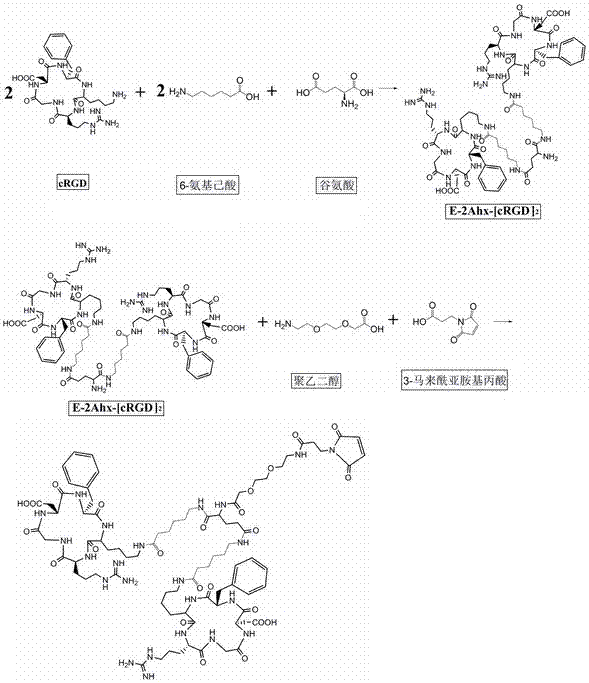
本发明中,当n=1、m=1及z的结构如式(ii)所示时,所述的结构分子简写式为e-2ahx-[crgd]2-peg-mpa,其中e为谷氨酸的简称,ahx为6-氨基己酸的简称,crgd为cyclo(-rgdfk)寡肽的简称,peg为二氧杂辛酸的简称,mpa为3-马来酰亚胺基丙酸的简称;在所述的结构分子中它们均以基团的形式连接在一起。
当n=1、m=1及z的结构如式(iii)式(iv)所示时,得到的结构分子简写式为e-2r-2ahx-[crgd]2-peg-mpa,其中r为精氨酸的简称,在所述的结构分子中它以基团的形式连接在其中。
这两种结构分子的结构式比较简单,合成路径简便,易于制备,成本较低,被靶向细胞摄取穿越细胞膜的能力更强。
本发明的增强αvβ3受体靶向亲和力及摄取的结构分子的制备过程:
由两个cyclo(-rgdfk)寡肽与6-氨基己酸(简称ahx)、谷氨酸或及精氨酸寡肽(也可两种均有)、8-氨基-3,6-二氧杂辛酸或者3-马来酰亚胺基丙酸等物质反应,使氨基和羧基脱水缩合得到,构建而成双价crgd分子,即两个crgd连接后形成的双价结构birgd。
在制备过程中,cyclo(-rgdfk)寡肽与6-氨基己酸(简称ahx)、谷氨酸或精氨酸寡肽先进行反应,制备中间体;再将中间体与8-氨基-3,6-二氧杂辛酸或者3-马来酰亚胺基丙酸,在聚乙二醇溶剂(具有参与反应和溶解或分散剂的作用,减少团聚现象,增加亲和力和摄取能力)中进行化合反应为成品。分步完成,制成的成品纯度较高,副产物较少。
如背景文献可知crgd、birgd的特点是可以经avb3受体介导内吞进入细胞浆内。
由于sirna分子的分子量大,且带负电荷,该特性与细胞膜的负电性和脂溶性的性质相互排斥,使其难以通过细胞膜直接进入细胞内。
而本发明的结构分子能与带巯基(-sh)修饰的核苷酸分子连接,形成birgd-sirna分子、或者birgd-寡核苷酸分子,等等。利用此特性,连接上sirna分子、寡核苷酸分子或者其它化合物分子后,可将所携带的分子一并带入细胞内,促进sirna分子、寡核苷酸分子或者其它化合物分子的靶细胞摄取,具有了较强的摄取能力。也即提高sirna递释系统与整合素αvβ3受体的靶向亲和力,增强肿瘤部位靶向,提高肿瘤细胞及其附属的新生血管内皮细胞的摄取量。同时利用质子海绵效应,促进sirna递释系统从内体中释放至细胞质中,实现细胞给药,甚至是细胞核内给药的目的。
本发明的发明人研究发现birgd,与αvβ3受体的细胞的亲和力更高,更容易使更多的被携带分子进入αvβ3受体表达的细胞内,可以减少给药剂量而且能够达到同等疗效的目的。当birgd-sirna整个结构通过αvβ3受体(细胞膜上的结构)介导进入靶细胞后,在细胞浆中形成一个新的复合结构:birgd-sirna。
这也是三种基团z结构的区别所在,即式(ii)结构的作用仅是简单的起连接两个crgd的作用;式(iii)和式(iv)结构中不仅能连接两个crgd,还多了“两个精氨酸”基团结构。精氨酸为含碱性的氨基酸,可中和细胞浆中内体所含的酸性环境,从而破坏细胞内体结构,促使更多的birgd-sirna分子从体内中释放出来,使birgd-sirna在细胞浆中发挥rna干扰作用。同时具备了增强αvβ3受体亲和力、靶向细胞摄取能力、细胞浆内体中释放能力的多重生物学功能。
本发明第二目的:
将上述结构分子应用于制备肿瘤靶向性治疗药物或示踪剂。
第二技术方案:
所述的治疗药物或示踪剂的制备原理及工艺过程如下:
上述的增强αvβ3受体靶向亲和力及摄取的结构分子与巯基醇类(巯基乙醇、巯基丙醇、巯基丁醇、巯基戊醇或巯基己醇)、含核苷酸分子的物质三者进行化合反应;优选先与巯基醇类结合反应,再与含核苷酸分子的物质结合反应,减少副反应产物,提供纯度。该结构分子的马来酰亚胺基团能够与上述醇类的巯基进行接枝反应形成巯醚键,核苷酸类分子的3’端的核苷酸单元内戊糖3位的磷酸基团或核苷酸类分子的5’端的核苷酸单元内戊糖5位的磷酸基团能够与巯基醇类的羟基进行接枝反应,三者连接形成的较大分子可以用于制备肿瘤靶向性治疗药物或示踪剂。
本发明还可以用于制备靶向抑制血管过度生长的药物如治疗老年黄斑病变(amd)、治疗疤痕、及其它血管增生型疾病的药物。这些疾病共同的特点是疾病部位的血管内皮细胞高表达αvβ3受体。
所述的核苷酸分子包括小干扰rna分子(sirna)和单链寡核苷酸分子;单链寡核苷酸分子包括反义寡核苷酸、mirna、其他可以和核酸类结构分子结合后起调控功能的核酸类似物。
本发明的增强αvβ3受体靶向亲和力及摄取的结构分子,在不使用巯基醇类物质的时候,能与含巯基(-sh)的轻烃类物质(巯基乙基-ch2ch2sh、巯基丙基-ch2ch2ch2sh、巯基丁基-ch2ch2ch2ch2sh、巯基戊基-ch2ch2ch2ch2ch2sh或巯基己基-ch2ch2ch2ch2ch2ch2sh)所修饰的核苷酸分子、示踪结构分子、其它化合物,通过巯基和马来酰亚胺基团的双键反应,形成巯醚键,从而使增强肿瘤部位靶向亲和力及摄取的结构分子能够与含巯基修饰的核苷酸分子连接,达到与上述物质类似的有益效果。所述的核苷酸分子包括小干扰rna分子(sirna)和单链寡核苷酸分子;单链寡核苷酸分子包括反义寡核苷酸、mirna、以及其他可以和核酸类结构分子结合后起调控功能的核酸类似物。
有益效果:
由于本发明的结构分子能与特异性表达整合素αvβ3受体的细胞结合,如肿瘤部位的新生血管和一些实体瘤(恶性胶质瘤、黑色素瘤、卵巢癌、乳腺癌、直肠癌和前列腺癌),通过含巯基(-sh)修饰的核苷酸分子与本发明的增强肿瘤部位靶向亲和力及摄取的结构分子相连,可将所携带的核苷酸分子经αvβ3受体介导的内吞方式带入细胞内。
本发明可在肿瘤诊断、肿瘤治疗、及靶向性给药载体设计方面,可得到广发的应用。因此可将本发明的增强肿瘤部位靶向亲和力及摄取的结构分子在制备抗肿瘤药物中应用。
所以,本发明的增强αvβ3受体靶向亲和力及摄取的结构分子,可用于经血管途径或局部直接给药,可将所携带的功能性分子如核酸类分子递送至靶细胞中。可以针对不同的靶基因设计不同的sirna分子,发挥核酸类分子对基因的调控或沉默功能,用于沉默靶基因,减小或者消灭肿瘤细胞活性,可以从基因水平对疾病进行治疗。
目前的研究发现αvβ3受体仅表达于新生血管(肿瘤的生长伴随着新生血管的生成)、及部分肿瘤细胞表面(可作为该治疗方法适用于何种肿瘤的分子标记物--检测该肿瘤细胞是否表达αvβ3受体),其它正常细胞及成熟血管不表达avb3受体。当然,在皮肤受伤时的修复过程中,也会伴随新血管的生成,此时不宜用该结构进行这类病人的肿瘤治疗。
本发明利用优化后的双价crgd基团还可以增加偶联物分子与αvβ3受体亲和力,以提高细胞的摄取效率及核苷酸分子的释放或转染效率;利用多个精氨酸提供的质子海绵效应以增加核苷酸分子从细胞内体的逃逸量,从而增强核苷酸分子的生物学活性,减少体内使用量、降低可能产生的毒副作用。
本发明可以避免纳米脂质体制剂制备工艺复杂、制备成本高、制剂不稳定、及体内应用毒性大等缺陷;具有容易制备、成本低、制剂稳定性好、毒副作用低、临床顺应性强等特点,适合临床示踪诊断和治疗疾病。
附图说明
图1、增强肿瘤部位靶向亲和力及摄取的结构分子(e-2ahx-[crgd]2-peg-mpa)(简称birgd)分子)合成路线图。
图2、增强肿瘤部位靶向亲和力及摄取的结构分子(e-2r-2ahx-[crgd]2-peg-mpa)(简称birgd2)分子)合成路线图。
图3、增强肿瘤部位靶向亲和力及摄取的结构分子与核酸类分子的5’端的核苷酸单元内戊糖5位的磷酸基团反应连接合成路线图。
图4、增强肿瘤部位靶向亲和力及摄取的结构分子与核酸类分子的3’端的核苷酸单元内戊糖3位的磷酸基团反应连接合成路线图。
图5、qrt–pcr验证xrgd-siactb介导的基因沉默效率(不同浓度的birgd2-siactb及birgd-siactb在u87mg基因沉默效率,或者说抑制β-actin信使rna的表达水平。其中control表示正常细胞,即与正常细胞进行比较。
具体实施方式
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1,采用如下操作步骤:
1.1.合成不同的增强肿瘤部位靶向亲和力及摄取的结构分子结构e-2ahx-[crgd]2-peg-mpa(简称birgd)及e-2r-2ahx-[crgd2-peg-mpa(简称birgd2):
birgd1及birgd2的合成步骤如图1及图2所示,两个单价crgd模体中的赖氨酸与6-氨基己酸、谷氨酸和/或精氨酸、8-氨基-3,6-二氧杂辛酸脱水缩合,得到e-2ahx-[crgd]2-peg或e-2r-2ahx-[crgd]2-peg,然后peg的氨基与3-马来酰亚胺基丙酸的羧基脱水缩合,得到e-2ahx-[crgd]2-peg-mpa及e-2r-2ahx-[crgd]2-peg-mpa。
1.2.合成含巯基(-sh)修饰的正义链rna:
针对siactb为沉默人β-actinmrna、经过常规稳定性修饰的sirna分子;sinc为与人和小鼠中的mrna均无同源性的经过常规稳定性修饰的sirna分子;sivegfr2(即血管内皮细胞生长因子受体2)为沉默人vegfr2mrna、经过常规稳定性修饰的sirna分子;sipik3cb为沉默人pik3cbmrna、经过常规稳定性修饰的sirna分子。
以本专业公知的方法在sirna正义链的3’端的核苷酸单元内戊糖3位的磷酸基团或核苷酸类分子的5’端的核苷酸单元内戊糖5位的磷酸基团通过巯基己醇修饰的巯基己基,如图3所示。由此得到巯基的(-sh)修饰的正义链rna。
1.3.合成birgd-siactb、birgd-sinc、birgd2-siactb、birgd2-sinc、birgd-sivegfr2、birgd-sipik3cb等分子:
巯基(-sh)修饰的核酸单链同过量的e-2ahx-[crgd]2-peg-mpa或e-2r-2ahx-[crgd]2-peg-mpa溶于缓冲溶液中,4℃均匀混合震荡反应12小时。经20%聚丙烯酰胺凝胶电泳检测,溶液中巯基修饰的正义链rna转化为birgd-ssrna或birgd2-ssrna,超滤浓缩后,用hplc反相色谱纯化,冻干后得到白色粉末状固体birgd1-ssrna或birgd2-ssrna,如图4所示。
2.1.流式细胞术检测birgd1-sirna及birgd2-sirna在huvec及u87mg细胞的摄取量:
按照公知的细胞生物学的方法,把birgd1-sirna或birgd2-sirna、crgd-sirna(背景技术2013100693674制成的冻干粉)直接加入细胞培养基中,在没有额外载体材料或者脂质体等转染试剂的辅助下,birgd1-sirna、birgd2-sirna和crgd-sirna(均被cy5标记)均可被αvβ3受体表达量为97.47%的u87mg细胞及αvβ3受体表达量为86.75%的huvec细胞摄取,其中birgd-sirna摄取量最高。
2.2.qrt-pcr验证birgd1-sirna及birgd2-sirna的基因沉默效率
按照公知的细胞生物学的方法,把birgd1-sirna、birgd2-sirna或crgd-sirna直接加入细胞培养基中,在没有额外载体材料或者脂质体等转染试剂的辅助下,在rna水平,birgd2-siactb可显著性抑制β-actinmrna的表达,birgd2-siactb为基因沉默活性最佳的结构,如图5所示。
2.3.westernblot验证birgd1-sirna及birgd2-sirna的基因沉默效率
按照公知的细胞生物学的方法,把birgd1-sirna、birgd2-sirna或crgd-sirna直接加入细胞培养基中,在没有额外载体材料或者脂质体等转染试剂的辅助下,在蛋白质水平,birgd1-siactb能显著沉默β-actin蛋白的表达,实验结果显示,birgd1-siactb为基因沉默活性最佳的结构。
2.4.birgd1-sirna及birgd2-sirna在细胞内的摄取及其转运过程
按照公知的细胞生物学的方法,把birgd-sirna或birgd2-sirna、crgd-sirna直接加入细胞培养基中,在没有额外载体材料或者脂质体等转染试剂的辅助下,共聚焦显微镜发现birgd-sirna可被huvec细胞摄取,其摄取强度高于同浓度的crgd-sirna。此外,转染6小时及12小时后,有大量的birgd-sirna分子到达反式高尔基体,说明birgd-sirna分子具有从内体逃逸,到达反式高尔基体,从而进一步被释放到细胞质中的能力。
3.建立皮下及原位荷瘤裸鼠模型,体内观察birgd2-sirna分子的体内分布,结果说明双价birgd2-sirna能大大增强sirna分子对肿瘤组织的亲和性。建立颅内原位荷瘤裸鼠模型并观察了birgd2-sirna的体内分布,说明本发明的birgd-sirna具有透过血脑屏障及脑肿瘤血管屏障,进入肿瘤间质的能力。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶细胞的定向细胞溶解、引起细胞溶解的试剂和组合物以及可用于制备这些试剂的化合物的制作方法
- 用于将治疗活性物质转移到靶细胞中的组合物及其在基因治疗中的应用的制作方法
- 杀死不想要的靶细胞的方法
- 艾滋病病毒靶细胞cd4+t细胞抵抗和清除hiv-1的特异表达基因群的制作方法
- 艾滋病病毒靶细胞cd4+t细胞抵抗和清除hiv-1的极端表达基因群的制作方法
- 艾滋病病毒靶细胞cd4+t细胞易感和支持hiv-1的极端表达基因群的制作方法
- 艾滋病病毒靶细胞cd4+t细胞易感和支持hiv-1的特异表达基因群的制作方法
- 艾滋病病毒靶细胞CD4+T细胞易感和支持HIV-1的特异表达miRNA群的制作方法
- 艾滋病病毒靶细胞CD4+T细胞抵抗和清除HIV-1的特异表达miRNA群的制作方法
- 使用移植细胞产生的激素改善鱼卵和/或精子的发育和成熟的手段和方法