分离有核细胞和有核细胞群的方法及其应用与流程
本申请要求2016年4月7日提交的美国临时申请62/319,523号的优先权,其内容通过引用整体并入本文。
2.
背景技术:
回收在外周血中循环的有核细胞(nc)(例如,在母体血液中循环的胎儿细胞,在临床缓解的患者的血液中循环的癌细胞,干细胞,内皮细胞和/或其他非常罕见的细胞)的主要障碍是单次血液收集物中这些细胞的总数非常低。
获得nc的第一个挑战是外周血和非外周血中无核红细胞(rbc)的数量超过非常需要的nc。例如,每1ml母体血液中的胎儿细胞数为2-6,这是1000000-3000000个有核母体细胞中有1个胎儿细胞,和1000000000-2000000000个红细胞中有1个胎儿细胞的比例。krabchi等,2001,clin.genet.60:145-150。在诸如脐带血(ucb)等非外周血中,nc与rbc的比率为约1000比1。
已经设计了许多方法旨在获得稀有的nc母体血液。然而,在血液中存在的大量细胞中发现稀有的nc具有挑战性,特别是以保持其功能的方式。
大多数nc富集方法的第一步需要从含有nc的血液样品中去除rbc。通常,为了减少封闭或开放系统中rbc的数量和血浆体积,进行涉及添加或不添加外源介质的手动或半自动离心的方法,所述介质例如蔗聚糖(ficoll)、胶体二氧化硅颗粒(percoll)、羟乙基淀粉(hes)、葡聚糖、聚明胶肽(poligeline)和明胶。然而,这些方法在最终产物体积、残余rbc、细胞活力以及nc回收、单个核细胞(mnc)、cd34+细胞、集落形成单位细胞(cfu)和长期培养起始细胞(ltc-ic)方面差别很大,更不用说方法的复杂性和所需的处理时间。参见tsang等,2001,transfusion41:344-352;pilarsolves等,2005,transfusion45:867-873。
用于将无核细胞与有核细胞分离的经典且最简单的方法是通过密度梯度离心。密度梯度离心基于细胞密度分离细胞。可以使用密度梯度材料(例如ficoll、ficoll-hypaque、histopaque、nycodenz和polymorphprep)对血液样品进行密度梯度离心,所述密度梯度材料都是含有红细胞凝集剂的溶液。离心后,外周血样品形成上清液层,其含有血浆和血小板;在血液样品和分离介质之间的界面处的有核细胞层;和离心管底部的凝结沉淀物,其含有无核红细胞和一些有核细胞。有核细胞层可以与其他层分离,以产生从其中已经大量除去了无核细胞的有核细胞富集样品。然而,与其他方法一样,在密度梯度离心中nc通常以不可接受的高比率丧失。
除去rbc后,目前使用的nc富集方法包括不连续密度梯度离心、荧光激活细胞分选(fags)、磁激活细胞分选(macs)、电荷流分离、显微操作、亲和素-生物素柱磁性含铁流体。这些不同方法的比较分析已经成为几篇综述的主题(ho等,2003,ann.acad.medsingap.32:560-597;mcewan,2005,maternalmedicinereview16:151-177;kavanagh等,2010,journalofchromatographyb,878:1905-1911)。虽然已经从母体血液中分离出各种胎儿细胞类型,如滋养细胞、白细胞、有核红细胞、血小板和造血祖细胞,但母体血液中存在的大多数类型胎儿细胞或胎儿细胞组合的可靠和可再现的分离似乎是难以实现的目标。
因此,本领域需要一种简单且可靠的,优选高产率的方法,以用于从血液样品中去除rbc,同时保留基本上所有的nc,并随后以可再现的方式将目标nc富集至高纯度。还需要从一个样品共分离/共富集至少两种不同类型的nc,例如胎儿细胞类型,例如胎儿有核红细胞和胎儿间充质干细胞。在某些情况下,本领域还需要一种确保nc功能损失最小的方法。
3.
技术实现要素:
本公开内容提供用于将含有目标有核细胞和无核红细胞的样品中存在的目标有核细胞(特别是间充质干细胞(msc)、有核红细胞和cd34+干细胞)的群与无核红细胞分离的方法。该方法包括使样品进行针对目标细胞的阴性选择,针对目标细胞的阳性选择和密度梯度离心中的至少一种。示例性的方法描述于下面的5.2节和实施方式1至54。
本公开内容还提供了通过本公开内容的方法可获得的目标有核细胞的群。在一些实施方式中,所述群包含胎儿间充质干细胞(msc)、胎儿有核红细胞(nrbc)和胎儿cd34+干细胞中的一种、两种或全部三种。示例性的细胞群描述于下面的5.3节和实施方式55至57。
本公开内容还提供了使用本公开内容的所述群和来自所述群的一种或多种细胞来检测胎儿异常的方法。所述群和细胞的示例性诊断方法和应用描述于下面的5.4.1节和实施方式58-69。
本公开内容还提供了本公开内容的目标有核细胞的群的治疗应用。示例性的治疗应用描述于下面的5.4.2节和实施方式70-79。
4.附图说明
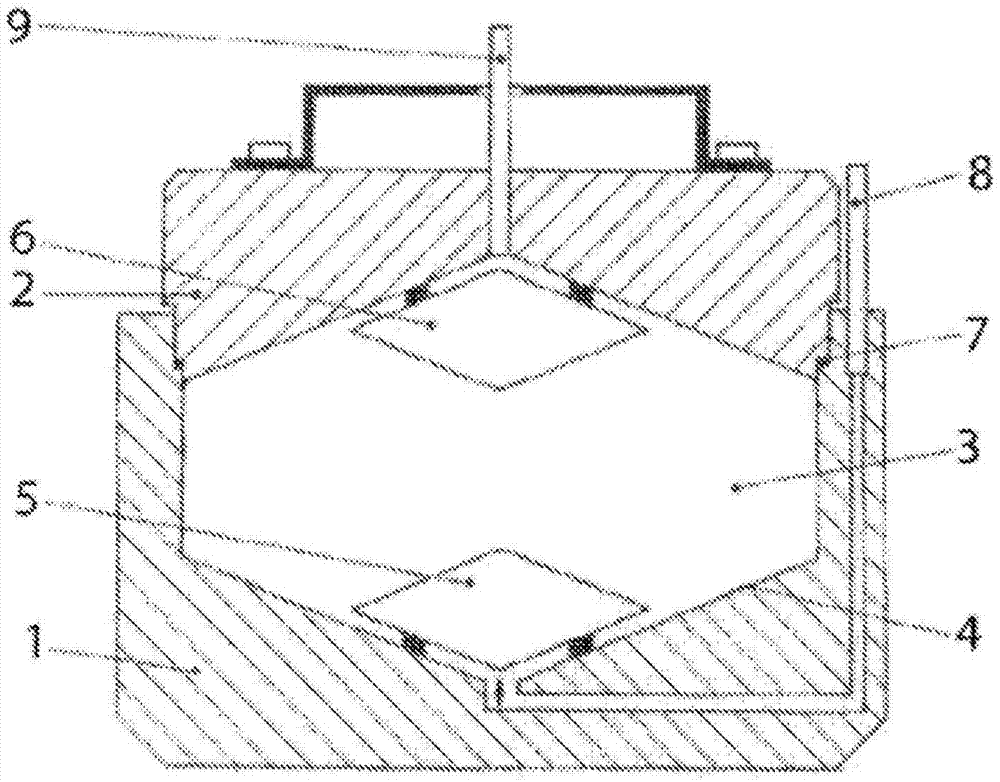
图1:示例性分离装置的示意图。
图2a-2b:在体外扩增三天(图2a)和一周(图2b)后的从母体血液中分离的胎儿有核细胞。
图3:来自使用图2b所示的细胞进行的rt-pcr的oct4(1)、nanog(2)、sox2(3)和gapdh(4)扩增产物。
图4a-4c:培养3天(图4a)、6天(图4b)和9天(图4c)后成像的胎儿间充质干细胞。
图5:使用x和y染色体杂交探针通过荧光原位杂交(fish)分析并用dapi复染色的fmsc。
5.具体实施方式
5.1定义
凝集剂是促进包含无核红细胞的组合物中的无核红细胞凝集的试剂。
抗体是能够通过位于免疫球蛋白分子的可变区中的至少一个抗原识别位点特异性结合靶(例如碳水化合物、多核苷酸、脂质、多肽等)的免疫球蛋白分子。如本文所用,该术语不仅包括完整的多克隆抗体或单克隆抗体,还包括其任何抗原结合片段(即“抗原结合部分”)或其单链,包含抗体的融合蛋白,以及包含抗原识别位点的免疫球蛋白分子的任何其他修饰构造,包括例如但不限于,单链(scfv)和域抗体(例如,人、骆驼或鲨鱼域抗体)、巨型抗体(maxibodies)、微型抗体、胞内抗体、双抗体、三抗体、四抗体、vnar和bis-scfv(参见例如,hollinger和hudson,2005,naturebiotech23:1126-1136)。抗体包括任何类别的抗体,例如igg、iga或igm(或其亚类),并且抗体不需要是任何特定类别。取决于其重链恒定结构域的抗体氨基酸序列,可以将免疫球蛋白分成不同的类别。存在五种主要类型的免疫球蛋白:iga、igd、ige、igg和igm,并且这些中的几个可以进一步分为亚类(同种型),例如igg1、igg2、igg3、igg4、iga1和iga2。“抗体”还包括各前述抗体/免疫球蛋白类型中的任何一种,其已被修饰以促进分选和检测。
如本文所用,抗体的抗原结合部分是指完整抗体的一个或多个片段,其保留特异性结合给定抗原(例如,靶x)的能力。抗体的抗原结合功能可以通过完整抗体的片段进行。
如本文所用,血液来源的有核细胞富集级分是指包含来自血液样品的有核细胞但含有不超过20%的来自血液样品的无核红细胞的组合物。术语“血液来源的有核细胞富集级分”包括由针对目标有核细胞类型富集血液来源的有核细胞富集级分产生的组合物。
如本文所用,血液级分是包含全血的一些但非全部组分的组合物,并且其可以包含非血液组分,例如缓冲液或细胞培养基。
如本文关于抗体所使用的竞争是指第一抗体或其抗原结合部分以与第二抗体或其抗原结合部分足够类似的方式结合表位,使得在存在第二抗体时第一抗体与其关联表位的结合结果与在不存在第二抗体时第一抗体的结合相比,可检测地降低。在存在第一抗体时第二抗体与其表位的结合也可检测地降低的替代方案可以但不一定是这种情况。也就是说,第一抗体可以抑制第二抗体与其表位的结合,而第二抗体不抑制第一抗体与其各自表位的结合。然而,当每种抗体可检测地抑制另一种抗体与其关联表位或配体的结合时,无论程度相同、更大的还是更小,抗体对于与它们各自表位的结合称为彼此“交叉竞争”。竞争性和交叉竞争抗体都包括在本公开内容中。
当在用于从包含有核细胞、无核红细胞和凝集剂的混合物中分离有核细胞富集级分和无核红细胞富集级分的方法中使用时,重质液体是指密度大于包含有核细胞、无核红细胞和凝集剂的混合物中液体的密度的液体。
关于含有无核红细胞的样品,血细胞比容是指无核红细胞的体积与样品的给定体积的比率。典型的样品是含有无核红细胞和其他细胞类型(例如血液)的混合物。
阴性选择是指从混合细胞群中消除目标靶细胞以外的细胞。阴性选择可以基于靶细胞中不存在(或在其中或其上不可检测)的标志物。阴性选择也可以基于其他标准,例如尺寸、形态或其他物理特征。
阴性免疫选择是指利用抗体消耗细胞,例如,选择性结合除目标靶细胞以外的一种或多种细胞类型但不特异性结合靶细胞的抗体。
阴性免疫选择性抗体是可以用于阴性免疫选择的抗体,例如,是与在靶标细胞以外的一种或多种细胞类型上或中存在但在靶细胞中不存在的标志物结合的抗体。抗体可以与细胞表面上的标志物或内部标志物结合,但是标志物优选是表面标志物以避免细胞固定的需要。
阳性选择是指从混合细胞群中选择含有目标靶细胞的细胞(例如,用于富集和/或分离目的)。阳性选择可以基于靶细胞上或靶细胞中存在的标志物。在一些实施方式中,标志物在待分离或富集的靶细胞的群(例如,生物样品)(例如当靶细胞是fnrbc时,母体血液或一部分母体血液)中(除了靶细胞之外)的一种或多种细胞类型中不存在(或在其中或其上不可检测)。在进一步的实施方式中,标志物在待分离或富集靶细胞的群中除目标靶细胞之外的任何细胞类型中不存在(或在其中或其上不可检测)。阳性选择还可以基于其他标准,例如尺寸、形态或其他物理特性(例如,与塑料的粘附)。
阳性免疫选择是指利用抗体(例如与目标靶细胞上或目标靶细胞中存在的标志物结合并因此可用于阳性选择的抗体)选择细胞。
阳性免疫选择性抗体是可以用于阳性免疫选择的抗体,例如,是与靶细胞上或靶细胞中存在的标志物结合的抗体。在一些实施方式中,抗体选择性结合靶细胞但不特异性结合可存在于靶细胞所存在的细胞群中的一种或多种其他细胞类型。抗体可以与细胞表面上的标志物或内部标志物结合,但是标志物优选是表面标志物以避免细胞固定的需要。
关于特定细胞的选择性结合是指抗体与标志物的特异性或优先结合,所述标志物存在于混合细胞群(例如,有核细胞富集级分)中的至少一种细胞类型中或至少一种细胞类型上,但在所述群中的至少一种其他细胞类型中或其他细胞类型上不存在(或不可检测)。举例来说,如果在含有a、b、c、d和e细胞类型的混合细胞群中,抗体仅特异性结合细胞类型a或细胞类型a和e,则该抗体被认为选择性地结合细胞类型a或分别选择性地结合细胞类型a和e。
如果抗体以比其与其他物质结合的更大亲和力、亲合力、更容易和/或更长的持续时间结合,则抗体特异性结合或优先结合靶标。例如,与fnrbc上存在的标志物特异性或优先结合的抗体是以比与其他标志物结合更大的亲和力、亲合力、更容易和/或持续时间更长地结合该标志物的抗体。特异性结合或优先结合不一定需要(尽管它可以包括)排他性结合。通常但不是必须地,提及“结合”意指优先结合。
5.2获得目标有核细胞的群的方法
本公开内容提供了从含有目标有核细胞(特别是间充质干细胞(msc)、有核红细胞和cd34+干细胞)的混合物(例如,血液,例如母体外周血)中获得目标有核细胞(特别是间充质干细胞(msc)、有核红细胞和cd34+干细胞)群的方法。
在一个方面,本公开内容提供了用于将血液来源的有核细胞富集级分中存在的目标有核细胞的群与无核红细胞分离的方法,所述有核细胞富集级分含有不超过20%、不超过15%、不超过10%、不超过5%、或不超过1%的来自血液的无核红细胞,所述方法包括使有核细胞富集级分进行针对目标有核细胞的阴性选择、针对目标有核细胞的阳性选择和密度梯度离心中的一种、两种或全部三种。获得血液来源的有核细胞富集级分的方法描述于5.2.1节。用于在本公开内容的方法中的阴性选择方法描述于5.2.2.1节,用于在本公开内容的方法中的阳性选择方法描述于5.2.2.2节,可用于进行阴性和阳性选择的免疫选择方法描述于5.2.2.3节,并且可用于本公开内容的方法中的密度梯度分离方法描述于5.2.2.3节。
5.2.1有核细胞与无核红细胞的分批分离(bulkseparation)
通过重力沉降方法可以获得血液来源的有核细胞富集级分,其中有核细胞与在包含有核细胞和无核红细胞的混合物(例如血液)中的大多数(例如,80%以上)无核细胞分离开。
在一个方面,可以通过将包含有核细胞和无核红细胞的样品与凝集剂或包含凝集剂的溶液合并来形成混合物。凝集剂促进被称为叠连体(rouleaux)的红细胞凝集体的形成,所述凝集体具有比有核细胞大的沉降速率。示例性的凝集剂描述于以下5.2.1节。不受理论的束缚,据认为作为沉降装置内腔中局部重力作用下的叠连体沉降物,它们在内腔中顶替向上的rbc耗尽相,形成富含rbc的下层和富含有核细胞的上层相。进一步认为,再次不受理论束缚,顶替叠连体沉降物向上移位的液体将拉动较慢沉降的有核细胞,促进混合物分离成有核细胞富集级分和无核红细胞富集级分。然而,在凝集的rbc形成叠连体时有核细胞可陷入凝集的rbc内,或者有核细胞随着凝集的rbc沉降可陷入叠连体中,显著地减少了有核细胞富集级分中有核细胞的产率。在某些情况下,例如,在可获得大量供体血液的输血血液学领域,有核细胞的显著损失是可接受的,但当样品量有限和/或样品含有稀有目的细胞类型(例如胎儿细胞或干细胞)时,这是不可接受的。
本文所述的分离方法通过在允许叠连体比传统沉降方法更快地沉降的条件下分离容器内腔中的有核细胞和无核细胞来解决该问题。发现所述容器的内腔的尺寸使得混合物在分离期间在内腔中具有与传统沉降方法相比降低的高度,则当在容器的内腔中分离混合物时,有核细胞产率显著增加。
作为包含有核细胞、无核红细胞和凝集剂的混合物中的叠连体沉降物,混合物的密度朝向内腔底部增加,因为密度是血细胞比容依赖性的。随着密度的增加,叠连体的沉降速度降低。据认为,在传统的沉降方法中,由于叠连体的沉降速度降低,由沉降中的叠连体引起的液体(血浆)的向上流动变得不足以将有核细胞从沉降中的叠连体中拉出。再次不受任何理论的束缚,据认为,与传统的沉降方法相比,当混合物的高度降低时,在较大部分的分离时间内,由沉降中的叠连体引起的向上液体流速超过了有核细胞的沉降速度,这允许更多数量的有核细胞被从沉降中的叠连体中拉出。在一些实施方式中,内腔中混合物的平均高度小于4cm,小于3.5cm,小于3cm,小于2cm,小于1.5cm,或小于1cm。在一些实施方式中,内腔中混合物的平均高度为1cm,1.5cm,2cm,2.5cm,3cm,3.5cm或4cm。在其它实施发生中,内腔中混合物的平均高度是在任一对上述值之间的范围内,如1-4cm,1-3cm,1.5-2.5cm,2-3.5cm,或1-2cm。优选地,腔中混合物的平均高度为1.5-2cm。
5.2.1.1包含有核细胞和无核红细胞的混合物
分离成有核细胞富集级分和无核细胞富集级分的混合物包含有核细胞、无核红细胞和一种或多种凝集剂。在一些实施方式中,通过将包含有核细胞和无核红细胞的样品与凝集剂或包含凝集剂的溶液合并来获得混合物。
可以进行本文所述的分离方法以将血液中的有核细胞与无核细胞分离。血液可以是例如外周血(例如,从妊娠雌性、患有癌症的受试者或健康受试者获得的外周血样品)或脐带血(ucb)。血液可以来自任何哺乳动物来源,例如家养动物(例如猫或狗)、家畜(例如牛)、研究动物(例如小鼠,大鼠或黑猩猩),并且最优选是人。
血液可以是全血(即,直接从受试者抽取的血液)或经处理的血液。经处理的血液可以是用水性溶液或血液级分稀释的全血。在一些实施方式中,样品是已经过处理以去除一些或所有血浆的血液级分。例如,通过将全血离心以形成含有有核细胞和无核红细胞的沉淀物并除去一些或全部包含血浆的上清液,可以从全血中除去血浆。然后可以将沉淀物重悬浮在水性溶液中以提供血液级分,然后根据本公开的方法分离血液级分。在一些实施方式中,血液级分通过如下制备:用水性溶液稀释血液,将经稀释的血液离心以形成含有核细胞和无核红细胞的细胞沉淀物,并在去除一些血浆后将细胞沉淀物重悬于水性溶液中以提供包含有核细胞、无核红细胞和血浆的血液级分。在一些实施方式中,血液级分含有用于制备血液级分的全血中存在的至少5%、至少10%、至少20%、至少30%、至少40%、至少50%或大于50%的血浆。在一些实施方式中,血液级分含有用于制备血液级分的全血中存在的5-10%、10-20%、20-30%、20-50%或50-100%的血浆,或任何由选自5%、10%、20%、30%、40%、50%、60%、70%、80%、90%和100%的下限和上限限定的其它范围。
适用于本公开内容的方法的水性溶液(例如,用于稀释包含有核细胞和无核红细胞的样品,制备血液级分和/或制备凝集剂的溶液)包括生理学溶液,即具有与血液相似的ph和渗透压和/或张度(tonicity)的溶液,例如组织培养基。示例性的生理学溶液包括roswellparkmemorialinstitute(rpmi)培养基、dulbecco磷酸盐缓冲盐水、kreb’s-ringer碳酸氢盐缓冲液、puck’盐水、earle培养基和hanks平衡盐溶液。血浆以及血浆与第二生理学溶液的混合物也可以在本公开内容的方法中用作水性溶液。
本公开内容的方法特别适用于从血液中分离稀有有核细胞,例如从成体外周血中分离干细胞或循环癌细胞,或从妊娠女性的外周血中分离胎儿细胞,将其分离成含有大多数稀有有核细胞的有核细胞富集级分以及含有大多数无核红细胞和少量(如果有的话)稀有有核细胞的无核红细胞富集级分。对于诊断测试,外周血样品通常为25-30ml,特别是来自妊娠女性,以确保胎儿不会因母体血液量减少而受到伤害。本公开内容的方法还允许从其更普遍的样品(例如干细胞脐带血)中提高目标有核细胞的产率。从脐带可获得的血液量是可变的,并且在最近的一项研究中发现其范围为72至275ml。nunes等,2015,brazilianjournalofhematologyandhemotherapy37(1):38-42。本公开内容的方法可以使用全部或部分外周血或脐带血样品进行,例如10-20ml,20-30ml,20-50ml,50-100ml,100-150ml,或超过150毫升,如果可获得的话。可以基于可获得的血液量和目标有核细胞的数量和/或类型来选择使用的血液量。
在容器内腔中分离的混合物的体积可以根据用于形成混合物的样品类型而变化。例如,如果通过相同的方法制备,由从妊娠女性获得的25ml外周血制备的混合物的体积可以是由100ml脐带血制备的混合物体积的四分之一。在一些实施方式中,混合物的体积小于500ml,小于400ml,小于300ml,小于200ml,小于100ml,小于75ml,小于50ml,小于40ml,小于30ml,或小于25ml。在一些实施方式中,混合物的体积为25ml至50ml,50ml至100ml,100ml至200ml,或200ml至400ml。
将混合物分离成有核细胞富集级分和无核细胞富集级分所需的时间量取决于混合物的密度和高度,并且可以由本领域技术人员凭经验确定。优选选择混合物的密度和高度,使得混合物分离成有核细胞富集级分和无核细胞富集级分在2至15分钟或甚至更长时间内基本完成。在各种实施方式中,分离在2至10分钟,2至5分钟,3至6分钟,4至12分钟,5至10分钟,2至8分钟,4至10分钟,3至7分钟,6至10分钟,5到8分钟,或从2分钟,3分钟,4分钟,5分钟,6分钟,7分钟,8分钟,9分钟,10分钟,11分钟,12分钟,13分钟,14分钟和15分钟中选择的下限和上限限制的任何其它范围内完成。
可以通过调节混合物的血细胞比容和通过使用不同密度的水性溶液来调节混合物的密度。相对于高密度混合物,低密度混合物提供更快的叠连体沉降和更大的有核细胞向上牵拉。混合物的血细胞比容可以例如通过以下调节:在形成混合物之前调节包含有核细胞和无核细胞的样品的血细胞比容,调节凝集剂溶液中凝集剂的浓度使得需要更多或更少的凝集剂溶液,向混合物中加入一定量的水性溶液,或其组合。在一些实施方式中,混合物的血细胞比容值低于全血的血细胞比容值,例如,血细胞比容值是全血血细胞比容值的一半。在一些实施方式中,混合物的血细胞比容(以混合物中无核红细胞的体积百分比测量)为10-45%、10-30%、10-20%、15-45%、15-30%、15-20%、20-45%、20-30%、25%-45%、20-30%、5%、10%、15%、20%、25%、30%、35%、40%或45%。
5.2.1.2凝集剂
凝集剂可以是本领域已知的凝集剂,例如美国专利号5,482,829和美国专利申请公开号2004/0142463中描述的那些,各自通过引用并入本文。示例性的凝集剂包括葡聚糖、羟乙基淀粉(hes)、明胶、喷他淀粉(pentastarch)、蔗聚糖(ficoll)、阿拉伯胶、聚乙烯吡咯烷酮、ficolltm-hypaque、
当与包含有核细胞和无核红细胞的样品合并时,凝集剂通常但不一定在水性溶液中。合适的水性溶液包括5.2.1.1节中确定的那些。在优选的实施方式中,凝集剂是溶解在rmpi培养基中的葡聚糖。在一些实施方式中,使用相同的水性溶液来制备包含有核细胞和无核血液细胞的样品,和制备包含凝集剂的溶液。举例来说,可以通过用rpmi培养基稀释一定量的血液来制备包含有核细胞和无核红细胞的样品,并且可以通过将一定量的葡聚糖溶解在rpmi培养基中来制备包含凝集剂葡聚糖的溶液。然后可以通过将样品与一定量的葡聚糖溶液合并来形成待分离的混合物。
混合物中凝集剂的浓度可影响叠连体形成及其沉降速率。本领域(例如,美国专利号4,111,199,其通过引用并入本文)中描述了凝集剂的合适浓度,并且其还可以凭经验确定。在一些实施方式中,混合物中凝集剂的量为0.1-20%、0.1-1%、1-10%、1-5%、1%、2%、3%、4%或5%(w/v)。在优选的实施方式中,混合物包含1%葡聚糖(w/v)。
5.2.1.3有核细胞富集级分
通过本文所述的分批分离(bulkseparation)方法获得的有核细胞富集级分可以包含稀有细胞类型,例如干细胞、循环癌细胞,或在母体血液中的胎儿有核细胞(包括胎儿干细胞)。有核细胞富集级分耗尽了大多数无核红细胞。在一些实施方式中,有核细胞富集级分含有不超过15%,不超过10%,不超过9%,不超过8%,不超过7%,不超过6%,不超过5%,不超过4%,不超过3%,不超过2%,不超过1%的在用于制备有核细胞富集级分的混合物中的无核红细胞。有核细胞富集级分包含了混合物中的大部分有核细胞。在一些实施方式中,有核细胞富集级分含有至少80%,至少85%,至少90%,至少95%,至少96%,至少97%,至少98%,至少99%或大于99%的在混合物中的有核细胞。在一些实施方式中,有核细胞富集级分中有核细胞的存活率(viability)大于90%,大于95%,大于96%,大于97%,大于98%或大于99%。
通过本文所述方法获得的有核细胞富集级分可以根据5.2.1节所述的方法,通过使有核细胞富集级分进行一次、两次、三次、四次或更多次分离而进一步耗尽无核红细胞,以获得有核细胞富集级分,其更高度地富集有核细胞并耗尽无核红细胞。在重复分离步骤时,从第一次分离获得的有核细胞富集级分可用于形成用于第二次分离的混合物。
5.2.1.4用于将有核细胞与无核红细胞分离的装置
本文所述的用于分批去除(bulkremoval)无核红细胞的方法可以使用包含内腔的分离装置进行,包含有核细胞和无核红细胞的混合物可以在所述内腔中分离。在优选实施方式中,内腔包括圆柱形部分,但是也可以设想其它几何形状的非圆柱形部分,例如,由连接的多边形形成的多面体部分。在一些实施方式中,圆柱形或非圆柱形部分在其底端连接至漏斗形部分,例如圆锥形部分,和/或在其顶端连接至倒置的漏斗形部分。分离装置可具有一个或多个入口/出口,其允许在内腔引入和/或移除液体,所述一个或多个入口/出口优选位于内腔的顶部和底部。当存在入口/出口时,偏流器可定位在内腔内,以偏转通过入口/出口引入的流体,从而防止内腔内的流体混合。
图1中示出了示例性分离装置。图1所示的分离装置包括两个圆柱形部分(1,2),其例如由透明聚碳酸酯制成。其中设置有圆柱形腔室(3),其底部在内部呈圆锥形(4)。锥形偏流装置(5)位于圆柱形腔室上方。在该实施方式中还提供了圆柱形盖(2),其内表面也是圆锥形的并且设置有锥形偏流装置(6)。腔室的盖和底部可以通过螺丝彼此连接,并且可以通过o形环(7)密封。偏流装置优选布置和安装成使得流入或流出(在顶部和底部)的液体必须流过偏流装置和锥形腔室壁之间的狭窄间隙。因此,最初的高流速减小,从而允许例如在没有流动扰动的情况下填充腔室。入口/出口优选地在腔室(8,9)中心管连接。
可以基于待分离混合物的体积和内腔中混合物的所需高度来确定合适的分离装置的尺寸。在一些实施方式中,分离装置的尺寸设置为使得内腔中被分离的混合物的体积具有的高度为4cm、小于4cm、小于3.5cm、小于3cm、小于2cm、小于1.5cm或小于1cm。在一些实施方式中,分离装置的尺寸设置为使得内腔中混合物的平均高度为1cm、1.5cm、2cm、2.5cm、3cm、3.5cm或4cm。在其它实施方式中,分离装置的尺寸设置为使得腔内混合物的平均高度为1-4cm、1-3cm或1-2cm。优选地,该分离装置的尺寸设置为使得内腔中混合物的平均高度为1.5-2cm。
为了在内腔的圆柱形部分中分离混合物,合适尺寸内腔的直径可以通过以下公式计算:
对于25至80ml的混合物,5至10的圆柱体直径可能是合适的。对于20至60ml,特别是45至55ml的混合物,大于5cm,例如6cm至12cm,7cm至9cm或8cm的直径可能是特别合适的。对于较大体积的混合物,例如,80ml至250ml,10至20cm的圆柱直径可能是合适的。在一些实施方式中,本发明的分离装置包括具有圆柱形部分的内腔,所述内腔的直径为1至20cm、3至8cm、4至9cm、5至20cm、5至10cm、6至12cm、7至14cm、8至12cm、8至16cm、10至15cm、10至20cm,并且在特定实施方式中,直径为1cm、2cm、3cm、4cm、5cm、6cm、7cm、8cm、9cm、10cm、11cm、12cm、13cm、14cm、15cm、16cm、17cm、18cm、19cm或20cm。
当使用如本文所述的分离装置时,在分离包含有核细胞、无核红细胞和凝集剂的混合物之前,可以将重质液体添加到分离装置的内腔的底部。在一些实施方式中,重质液体是水可混溶性液体。重质液体的密度为至少1.05g/ml、至少1.1g/ml、至少1.2g/ml、至少1.5gg/ml、1.75g/ml或至少2g/ml,并且可以在高达2.5g/ml、3g/ml或甚至更高。在特定实施方式中,密度范围在任何一对前述值之间,例如,1.05g/ml至1.1g/ml、1.05g/ml至1.2g/ml、1.05g/ml至1.5g/ml、1.5g/ml至2.5g/ml、1.2g/ml至2g/ml,等等。合适的重质液体包括全氟三丁胺(例如,fluorinerttmfc-43,3m)和ficoll溶液(例如,密度为1.077g/ml或1.085g/ml的ficoll溶液)。如果存在的话,重质液体可以通过入口/出口引入内腔。如果内腔具有下部漏斗形部分,则重质液体的量优选填充至少下部漏斗形部分,更优选地填充整个内腔,如果下部漏斗形部分存在入口/出口的话。如果重质液体不填充整个下部漏斗形部分,则混合物在被引入内腔时将在周边处具有与在中心处不同的高度,并且可能需要计算平均高度。在引入重质液体之后,将混合物引入位于重质液体顶部的内腔。如果内腔完全充满重质液体,则当混合物被引入内腔时,允许重质液体从下部漏斗形部分中的入口/出口排出。然后使混合物在局部重力下分批分离成有核细胞富集级分和无核红细胞富集级分。
分离后,可以从分离装置收集有核细胞富集级分和/或无核红细胞富集级分。如果分离装置在内腔的顶部具有入口/出口并且在内腔的底部具有入口/出口,则可以通过经由底部入口/出口引入另外的重质液体而从顶部入口/出口收集有核细胞富集级分,从而允许有核细胞富集级分得到手机且不会显著干扰有核细胞富集级分和无核红细胞富集级分之间的界面。当存在时,偏流器有助于防止在有核细胞富集级分和无核红细胞富集级分之间的界面处混合。
5.2.2目标有核细胞富集
对于有核细胞富集的级分,例如,通过根据5.2.1节中描述的方法对血液样品或经处理的血液样品进行一次或多次分离而获得的有核细胞富集级分,可以进一步富集一种或多种目标有核细胞类型,例如msc、有核红细胞(nrbc)和cd34+干细胞。当从母体血液或脐带血制备有核细胞富集级分时,优选的目标有核细胞类型包括一种或多种胎儿细胞类型,例如胎儿msc、胎儿nrbc和胎儿cd34+干细胞。进一步富集可以包括针对目标有核细胞的阴性选择、针对目标有核细胞的阳性选择和密度梯度离心中的至少一种(例如,一种、两种或全部三种)。例如,富集步骤可以从阴性选择、阳性选择和密度梯度离心的以下组合中选择:
(1)针对目标有核细胞的阴性选择,然后是针对目标有核细胞的阳性选择;
(2)针对目标有核细胞的阴性选择,然后是密度梯度离心;
(3)针对目标有核细胞的阳性选择,然后是针对目标有核细胞的阴性选择;
(4)针对目标有核细胞的阳性选择,然后是密度梯度离心;
(5)密度梯度离心,然后是针对目标有核细胞的阴性选择;
(6)密度梯度离心,然后是针对目标有核细胞的阳性选择;
(7)针对目标有核细胞的阴性选择,然后是针对目标有核细胞的阳性选择,然后是密度梯度离心;
(8)针对目标有核细胞的阴性选择,然后是密度梯度离心,然后是针对目标有核细胞的阳性选择;
(9)针对目标有核细胞的阳性选择,然后是密度梯度离心,然后是针对目标有核细胞的阴性选择;
(10)针对目标有核细胞的阳性选择,然后是针对目标有核细胞的阴性选择,然后是密度梯度离心;
(11)密度梯度离心,然后是针对目标有核细胞的阴性选择,然后是针对目标有核细胞的阳性选择;和
(12)密度梯度离心,然后是针对目标有核细胞的阳性选择,然后是针对目标有核细胞的阴性选择。
也可以使用大于一个的阴性选择步骤和/或大于一个的阳性选择步骤(例如,对于由目标细胞类型表达的不同细胞表面标志物)来富集目标有核细胞。每个阴性选择步骤、阳性选择步骤和密度梯度离心步骤可以独立地可选地在一个或多个洗涤步骤之前或之后进行。洗涤步骤可以例如包括将从阳性选择步骤、阴性选择步骤或密度梯度离心步骤获得的有核细胞富集级分与缓冲液或培养基合并,然后离心以沉淀有核细胞。然后可将细胞沉淀重悬于合适的缓冲液或培养基中以供进一步使用或处理。
5.2.2.1阴性选择
通常,本公开内容的方法的阴性选择步骤利用一种或多种不识别目标细胞的试剂。阴性选择试剂可以是可用于将血液来源的有核细胞富集级分中的除目标细胞以外的细胞与目标细胞分离的任何试剂。
在某些方面,试剂是阴性免疫选择性抗体。因此,阴性免疫选择可包括以下步骤:(a)使血液来源的有核细胞富集级分与阴性免疫选择性抗体在流体培养基中接触,其中阴性免疫选择性抗体相对于目标细胞选择性地结合生物样品中的其它细胞;和(b)选择未与所述阴性免疫选择性抗体结合的细胞。在一些实施方式中,阴性选择(如果进行的话)可以在阳性免疫选择之前、之后或同时进行,并且可以在密度梯度离心之前或之后进行。
当血液来源的有核细胞富集级分来源于母体血液时,试剂优选是抗体,所述抗体结合在母体细胞(即成熟细胞)的细胞表面上存在、但在胎儿目标细胞的细胞表面上不存在的抗原。
当目标细胞包含msc(例如,胎儿msc)时,可以使用针对不由msc表达的选择的细胞表面标志物的一种或多种抗体。示例性的细胞表面标志物包括cd2、cd3、cd10、cd11b、cd14、cd15、cd16、cd19、cd31、cd34、cd35、cd38、cd44、cd45、cd49、cd49d、cd56、cd61、cd62(e)、cd66b、cd68、cd79α、cd104、cd106、cd117、hla-dr和血型糖蛋白a。在优选实施方式中,针对msc的阴性免疫选择使用针对cd3、cd14、cd19、cd38、cd66b和血型糖蛋白a中的一种、两种、三种、四种、五种或六种的一种或多种抗体。可用于进一步就msc富集有核细胞富集级分的示例性试剂盒是rosetteseptm人间充质干细胞富集混合试剂(stemcelltechnologies),其包括识别cd3、cd14、cd19、cd38、cd66b和血型糖蛋白a的四聚体抗体复合物。
当目标细胞包含fnrbc时,可以使用一种或多种阴性免疫选择性抗体,优选针对一种或多种造血细胞表面标志物的阴性免疫选择性抗体。示例性的细胞表面标志物包括:(a)t淋巴细胞表面标志物,例如cd3、cd4或cd8;(b)b淋巴细胞表面标志物,例如cd19、cd20或cd32;(c)泛淋巴细胞(panlymphocyte)标志物,例如cd45;(d)nk细胞表面标志物,例如cd56;(e)树突细胞表面标志物,例如cd11c或cd23;(f)巨噬细胞或单核细胞表面标志物,例如cd14或cd33;和(g)“i”抗原。在具体实施方式中,使用至少两种、三种、四种、五种或六种阴性免疫选择性抗体。
5.2.2.2阳性选择
本公开内容的阳性选择试剂可以是可用于将血液来源的有核细胞富集级分中的目标细胞(例如,胎儿msc、nrbc和/或cd34+干细胞)与样品中至少一种其它类型的细胞区分开的任何试剂。
目标细胞富集的优选方法是使用在流体培养基中进行的阳性免疫选择方法。通常,阳性免疫选择方法利用阳性免疫选择性抗体。在某些方面,在阳性免疫选择步骤中使用多种阳性免疫选择性抗体。因此,阳性免疫选择可包括以下步骤:(a)使血液来源的有核细胞富集级分与阳性免疫选择性抗体在流体培养基中接触,其中阳性免疫选择性抗体相对于血液来源的有核细胞富集级分中的一种或多种其它细胞类型选择性地结合目标细胞;和(b)选择与所述阳性免疫选择性抗体结合的细胞。
针对msc的阳性选择标志物包括cd73、cd90、cd105、cd166、cd200、cd271、stro-1和“i”抗原。特别地,从脐带血分离的msc是“i”-抗原阳性的(hirvonen等,2102,stemcelldev.,21(3):455-64)。针对“i”抗原的单克隆抗体是本领域已知的(hirvonen等,2013bioresopenaccess,2(5):336-45)。凝集素也可用于“i”阳性细胞的阳性选择。在优选的实施方式中,抗cd73和/或抗-i抗体用于阳性选择msc。
针对ffnrbc的阳性选择标志物包括血型糖蛋白a(也被称为cd235a)、“i”抗原、cd36、cd71和核标志物。在下游分析允许细胞固定(例如,fish)的情况下,胎儿血红蛋白可以是阳性选择标志物。表达标志物血型糖蛋白a、“i”抗原、cd36、cd71和胎儿血红蛋白的细胞可以使用针对标志物的抗体进行选择(例如,分选或富集)。与母体红细胞相反,fnrbc是有核的并且可以使用核染料选择,核染料例如hoechst33342、lds751、to-pro、dc-ruby和dapi。
在一些实施方式中,使用单克隆抗体4b9选择ffnrbc。产生抗体4b9的杂交瘤以保藏号dsmacc2666fnrbc保藏在deutschesammlungvonmikroorganismenandzelkulturengmbh(参见hollmann等的美国专利号7,858,757b2和8,563,312b2)。在其它实施方式中,使用与4b9竞争结合fnrbc表面的抗体选择fnrbc。举例来说,单克隆抗体4b8与4b9竞争结合fnrbc(参见hollmann等的美国专利号7,858,757b2和8,563,312b2)。
在优选实施方式中,使用抗-i抗体和/或4b9抗体来阳性选择fnrbc。
5.2.2.3免疫选择技术
免疫选择的步骤可以利用免疫密度分离,例如,使用将非目标细胞交联至颗粒(例如另一非目标细胞)的双特异性四聚体抗体复合物(tacs)、流式细胞术或磁性分离(例如,使用涂布有抗体的磁珠)。有利地,使用包含双特异性tac(其将有核细胞富集级分中存在的非目标有核细胞交联至无核红细胞)的混合试剂进行的免疫密度分离,可用于从有核细胞富集级分中去除不需要的有核细胞和无核红细胞。可用于阴性选择msc的示例性tac混合试剂是rosetteseptm人间充质干细胞富集混合试剂(stemcelltechnologies)。流式细胞术技术可以通过使用例如荧光激活细胞分选仪提供精确分离,其可以具有不同程度的复杂性,例如多个颜色通道、低角度和钝光散射检测通道、阻抗通道等。
在一些实施方式中,使用免疫密度分离的阴性选择和使用facs的阳性选择都在本公开的方法中用于分离目标有核细胞的群。
抗体可以缀合有标签,例如磁珠和荧光染料,以允许容易地将目标细胞与其它细胞类型分离。荧光染料可与荧光激活细胞分选仪一起使用。多色分析可以与facs一起使用,或者与免疫磁性分离和流式细胞术组合使用。多色分析对于基于多种表面抗原的细胞分离是有意义的。可用于多色分析的荧光染料包括藻胆蛋白,例如藻红蛋白和别藻蓝蛋白;荧光素和德克萨斯红。阴性标识表示染色水平等于或低于同种型匹配阴性对照的亮度。淡弱的标识表示染色水平可能接近阴性染色水平,但也可能比同种型匹配对照更亮。本公开内容的阳性免疫选择性抗体优选地针对目标细胞产生“明亮”标识,并且相对于一种或多种(并且在一些实施方式中所有)可存在于有核细胞富集级分中的其它细胞类型给出“阴性”或“淡弱”标识,所述有核细胞富集级分中存在目标细胞。本公开内容的阴性免疫选择性抗体优选地针对目标细胞产生“阴性”或“淡弱”标识,并且相对于可存在于有核细胞富集级分中的一种或多种其它细胞类型具有“明亮”标识,所述有核细胞富集级分中存在靶细胞。
在一个实施方式中,免疫选择性抗体是单特异性或双特异性tac的一部分。例如,可以使用包含靶向无核红细胞的两种抗体的单特异性tac来使两个无核红细胞彼此交联。可以使用包含靶向无核红细胞的抗体和靶向非目标有核细胞的抗体的双特异性tac来将无核红细胞交联至非目标有核细胞。在一些实施方式中,使用包含靶向不同非目标细胞类型的双特异性tac和靶向无核血液细胞的单特异性tac的混合试剂来阴性选择目标细胞类型。可以通过密度梯度离心将交联的无核红细胞和非目标有核细胞的复合物与目标有核细胞分离。
在另一个实施方式中,免疫选择性抗体直接或间接缀合至磁性试剂,例如超顺磁微粒(微粒)。如本领域已知的,通过使用各种化学连接基团实现与磁性颗粒的直接缀合。抗体可以通过侧链氨基或巯基和异功能交联剂与微粒偶联。大量的异功能化合物可用于连接实体。优选的连接基团是3-(2-吡啶基二硫代)丙酸n-羟基琥珀酰亚胺酯(spdp)或4-(n-马来酰亚胺甲基)-环己烷-1-羧酸n-羟基琥珀酰亚胺酯(smcc),其抗体上具有反应性巯基,并且在磁性颗粒上具有反应性氨基。
作为选择,免疫选择性抗体间接偶联至磁性颗粒。抗体与半抗原直接缀合,并且半抗原特异性第二级抗体与颗粒缀合。合适的半抗原包括地高辛、洋地黄毒苷、fitc、二硝基苯基、硝基苯基、亲和素、生物素等。用于将半抗原与蛋白质缀合的方法是本领域已知的,并且用于此类缀合的试剂盒是可商购获得的。
为了实施阳性免疫选择方法,将阳性免疫选择抗体加入至有核细胞富集级分。结合目标细胞所需的抗体量可以通过进行测试分离和分析来凭经验确定。将细胞和抗体温育足以形成复合物的一段时间,通常至少约5分钟,更通常至少约10分钟,通常不超过1小时,更通常不超过约30分钟。
有核细胞富集级分还可以与另外的本文所述的阳性和/或阴性免疫选择性抗体一起温育。根据特异性抗体制剂分离带标签的细胞。带荧光染料标签的抗体可用于facs分离、用于免疫磁选的磁性颗粒,特别是高梯度磁选(hgms)等。示例性的磁分离装置描述于wo90/07380、pct/us96/00953和ep438,520中。
可以使用其它自动化方法,如超滤或微流体分离来执行阳性免疫选择和/或阴性免疫选择。
5.2.2.4密度梯度离心
密度梯度分离是这样的技术:允许根据细胞的尺寸、形状和密度分离细胞。通过将不同密度的溶液分层并在离心管底部形成稠密端,在离心管中产生不连续的密度梯度。通常在相对低的离心速度下,在浅梯度的蔗糖或其它惰性碳水化合物上分离细胞。
不连续密度梯度离心常用于将外周血单核细胞与粒细胞和红细胞分离。例如,在所谓的ficoll密度分离中,将样品(例如全血)在ficoll-
有核细胞富集级分的密度梯度离心可通过在具有非生理条件的介质中温育有核细胞富集级分,以改变有核细胞富集级分中细胞的密度,从而允许改善目标细胞与非目标细胞的分离(参见,sitar等,2005,experimentalcellresearch302:153-161,将其全部内容通过引用并入本文)。非生理条件的使用对于就胎儿细胞(例如fnrbc、fmsc和cd34+胎儿干细胞)富集源自母体血液的有核细胞富集级分而言特别有用。非生理条件可以包括非生理ph和/或非生理渗透压。在一些实施方式中,具有非生理条件的介质可以具有6.1至6.9、6.2至6.8或6.3至6.7(例如,约6.1、约6.2、约6.3、约6.4、约6.5、约6.6、约6.7、约6.8或约6.9)的ph。在一些实施方式中,具有非生理条件的介质可具有270至370mosm/l,270mosm/l至280mosm/l,280mosm/l至290mosm/l,300mosm/l至310mosm/l,310mosm/l至320mosm/l,320mosm/l至330mosm/l,330mosm/l至340mosm/l,340mosm/l至350mosm/l,350mosm/l至360mosm/l,或360mosm/l至370mosm/l的渗透压。
可以通过将有核细胞富集级分与包含柠檬酸、柠檬酸钠和葡萄糖(acd)的介质(其可选地已经用nacl调节过其渗透压)合并而形成非生理条件。在优选实施方式中,acd介质的特征在于以下中一种、两种、三种、四种、五种、六种或七种:ph为6.4至6.6,渗透压为300至330mosm,钠浓度为150至170mmol/l,钾浓度为4.5至5.5mmol/l,氯化物浓度为100至115mmol/l,钙浓度为1至2.5mmol/l,葡萄糖浓度为400至500mg/dl。
5.3目标有核细胞的群
本公开内容提供通过本公开内容的方法得到的目标有核细胞的群。可以培养目标有核细胞的群以维持或扩增目标细胞群。可以使用标准细胞培养基和技术培养目标有核细胞的群。例如,可以使用mesenculttm-acf培养试剂盒(stemcelltechnologies)根据制造商说明来培养包含msc的群。在一些实施方式中,使用选择性培养基来维持或扩增目标细胞群,同时防止群中非目标细胞的扩增。例如,可以培养含有nrbc、msc和cd34+细胞的群,以通过向培养基中添加有利于目标细胞类型生长的生长因子来选择性地扩增所需的目标细胞类型。例如,可以通过在包含促红细胞生成素和fe2+的培养基中培养所述群来扩增nrbc。作为选择,可以通过分别在对msc或cd34+细胞具有特异性的生长因子存在下培养所述群来扩增msc或cd34+细胞。
在一些实施方式中,在培养期间向培养基添加血小板裂解物,以维持或扩增目标细胞群。
在一些实施方式中,在包含人干细胞因子(scf)、白细胞介素6(il-6)、fms样酪氨酸激酶3(flt-3)配体和巨核细胞生长发育因子(mgdf)的msc培养基中培养包含胎儿细胞的目标有核细胞的群,以促进msc的扩增。
在其它实施方式中,在包含红细胞生成素和fe2+的培养基中培养包含胎儿细胞的目标有核细胞的群,以促进fnrbc的扩增。在其它实施方式中,在包含红细胞生成素和血红素的培养基中培养包含fnrbc的目标有核细胞的群,以促进fnrbc的扩增。
在目标有核细胞的群中的目标有核细胞优选地占所述群中细胞的大多数,例如,60%至100%,60%至70%,70%至80%,80%至90%,或90%至100%。在一些实施方式中,所述群中至少70%、至少80%、至少90%或至少95%的细胞是目标细胞。
培养(例如,3至9天)后,可以对所述群中的单个细胞或在细胞组进行分析以确认其作为目标细胞的身份,和/或用于5.4节所述的诊断或治疗。在一些实施方式中,在分析和/或用于诊断或治疗之前3至14天(例如3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天,或前述天数的任何范围,例如3至7天,7至10天或10至14天)培养细胞或细胞组。
可以使用fish来验证通过本文描述的方法分离的细胞或细胞组是否是胎儿细胞。涉及例如使用短串联重复(str)分析、限制性片段长度多态性(rflp)分析或单核苷酸多态性(snp)分析产生遗传谱的遗传指纹法,也可用于验证胎儿细胞。通过将从分离的细胞产生的谱与由母体和可选的父体细胞产生的谱进行比较,可以验证分离细胞作为胎儿细胞的身份。用于产生遗传谱的合适试剂盒是可商购获得的。例如,来自promega的
5.4应用
5.4.1诊断应用
本公开内容的目标有核细胞的群和从目标有核细胞的群分离的个体细胞可用于基因测试。特别地,从母体血液样品分离的胎儿细胞(例如,胎儿msc、fnrbc和胎儿cd34+干细胞)或其子代可用于产前基因测试以鉴定胎儿异常。在一些实施方式中,用于产前基因测试的胎儿细胞包含从母体血液分离的胎儿msc、fnrbc和胎儿cd34+干细胞中的一种、两种或全部三种或其子代。
可以测试的异常的实例包括13三体、18三体、21三体、唐氏综合征、压力性麻痹神经病变(neuropathywithliabilitytopressurepalsies)、神经纤维瘤病、alagille综合征、软骨发育不全、亨廷顿病、α-甘露糖苷过多症、β-甘露糖苷过多症、异染性白细胞减少症、冯雷克林豪森病、结节性硬化症复合症(tuberoussclerosiscomplex)、肌强直性营养不良、囊性纤维化、镰状细胞病、tay-sachs病、β-地中海贫血、粘多糖贮积症、苯丙酮尿症、瓜氨酸尿症、半乳糖血症、半乳糖激酶和半乳糖4-差向异构酶缺陷、腺嘌呤磷酸核糖基、转移酶缺陷、甲基丙二酸尿症、丙酸血症(proprionicacademia)、farber's病、岩藻糖贮积症、神经节苷脂病、戈谢病、i细胞病、粘多糖贮积症iii、niemann-pick病、唾液酸贮积症(sialidosis)、wolman病、zellweger综合征、胱氨酸病、x因子缺陷、共济失调性毛细血管扩张症、布卢姆综合征、罗伯特综合征、着色性干皮病、脆性(x)综合征、性染色体非整倍性、克氏综合征、特纳综合征、xxx综合征、类固醇硫酸酯酶缺陷、线状皮肤缺损性小眼病、pelizaeus-merzbacher病、关于y的睾丸决定因子(testis-determiningfactorony)、鸟氨酸氨基甲酰转移酶缺乏症、葡萄糖6-磷酸脱氢酶缺乏症、lesch-nyhan综合征、anderson-fabry病、血友病a、血友病b、duchenne型肌营养不良症、becker型肌营养不良症、dup(17)(p11.2p11.2)综合征、16p11.2缺失、16p11.2重复、线粒体缺陷、dup(22)(q11.2q11.2)综合征、猫眼综合征、cri-du-chat综合征、wolf-hirschhorn综合征、williams-beuren综合征、charcot-marie-tooth病、染色体重排、染色体缺失、smith-magenis综合征、velocardiofacial综合征、digeorge综合征、1p36缺失、prader-willi综合征、无精子症(azospermia)(因子a)、无精子症(因子b)、无精子症(因子c)、脊柱裂、无脑畸形、神经管缺陷、小头畸形、脑积水、肾发育不全、kallmann综合征、肾上腺发育不良、angelman综合征、囊性肾、囊性水肿、胎儿水肿、脐疝和腹裂、膈疝、十二指肠闭锁、骨骼发育不良、唇裂、腭裂、精氨琥珀酸尿、krabbe病、高胱氨酸尿症、枫糖尿病、3-甲基巴豆酰辅酶a、羧化酶缺陷、糖原贮积症、肾上腺增生、低磷酸盐血症、胎盘类固醇硫酸酯酶缺陷、严重联合免疫缺陷综合征、t细胞免疫缺陷、ehlers-danlos综合征、成骨不全、成人多囊肾病、fanconi贫血症、大疱性表皮松解症、低汗外胚层发育不良、先天性肾病(芬兰型)和多发性内分泌肿瘤。
所述的诊断测定可以是核酸(例如,dna或rna)测定,蛋白质(例如,基于抗体的)测定,或组织学测定,或它们的组合。dna测定的实例包括fish、pcr和dna测序测定。rna测定的实例包括rt-pcr测定和fish测定。为了便于获得核酸,可以在进行诊断测试之前将目标细胞裂解或透化。可以在微阵列上进行dna、rna和蛋白质测定。说明性方法如下所述。
在一些实施方式中,可以通过全基因组扩增(wga)来扩增来自单种细胞或两种至四种以上细胞的组的基因组dna,以为分析提供足够的核酸。可以在不使用全基因组扩增(wga)的情况下分析含有5种以上胎儿细胞的细胞组。wga是指扩增个体的细胞或细胞组的整个基因组。例如,可以使用单个细胞的遗传物质(即,单个细胞全基因组扩增(scwga))扩增全基因组。在其它实施方式中,可以在分析dna之前扩增基因组的子集。
使用来自通过本公开内容的方法产生的裂解的胎儿nrbc的染色体或核酸,通过多种方法中的任一种,可检测染色体异常、单基因异常,等位基因变体和单核苷酸多态性(snp),所述多种方法包括荧光原位杂交(fish)、聚合酶链反应(pcr)、基于多重退火和环的扩增循环(malbac)、限制性片段长度多态性(rflp)分析和dna测序。pcr技术可以是简单的pcr扩增技术或定量pcr、实时pcr或逆转录酶pcr技术。其它有用的基因分析技术包括阵列比较基因组杂交(cgh)和dna微阵列中的分析。例如,可以在产前染色体微阵列中分析胎儿细胞。
单倍型是在一起出现并在染色体上相邻位置的等位基因组合。单倍型可以在单个基因座上或在几个基因座上发现。单倍型可以在整个染色体中发生。单倍型可包括任何数量的重组事件。单倍型也可以指一组相关的单核苷酸多态性。
当与正常(例如野生型)核苷酸序列存在一个核苷酸(例如,a、t、c或g)的变化时,出现单核苷酸多态性(snp)。例如,单核苷酸多态性可产生等位基因变体。给定的等位基因可以由单核苷酸多态性或多核苷酸变化来定义。
限制性片段长度多态性(rflp)是dna的同源序列的差异。它们可以通过使用特定限制性内切核酸酶或限制性内切核酸酶组合消化dna后发现的片段长度的差异而检测出。rflp可以通过凝胶电泳或蛋白质印迹而确定。
荧光原位杂交(fish)通过将荧光探针结合至与荧光探针互补的经固定的核酸序列的一部分而进行。fish可用于在核酸序列存在于较大核酸序列内时将rna或dna中的目标核酸序列在特定位置荧光标记。例如,fish可用于标记染色体上的目标序列。可以使用荧光显微镜观察荧光探针。
使用pcr来通过使用两个引物扩增特定核酸序列的一个或多个拷贝(即扩增子)。pcr方法很容易获得,并且通常用于诊断遗传性疾病。
定量pcr(qpcr)基于聚合酶链反应(pcr),并且用于扩增并同时定量拷贝的总数或核酸序列的拷贝的相对数量。qpcr的一个实例是实时pcr。在实时pcr中,实时检测由pcr产生的核酸拷贝的数量或相对数量。可以使用荧光染料产生的信号检测和定量由qpcr产生的拷贝的数量或相对数量。
逆转录聚合酶链反应(rt-pcr)是下述方法,其通过将rna分子转化成dna拷贝(cdna)并扩增所述dna,而可用于检测rna分子或用于确定特定rna序列的表达水平。rt-pcr可以通过一步法或两步法进行。
阵列比较基因组杂交(阵列cgh)是用于确定在全基因组规模上发生的染色体拷贝数变化的微阵列技术。阵列cgh将测试基因组与正常(例如,野生型)基因组进行比较,以检测甚至相对小(例如,200个碱基对)的结构变化。例如,阵列cgh可以检测缺失、扩增、断裂点或非整倍性。阵列cgh也可用于检测发展癌症的倾向。
基于多重退火和环化的扩增循环(malbac)是一种全基因组扩增方法。malbac可用于单个细胞、全基因组扩增。malbac可用于以准线性方式扩增基因组,并避免某些dna序列的优先扩增。在malbac中,扩增子可以具有互补末端,其在扩增子中形成环,因此防止扩增子的指数复制。扩增子环可以防止扩增偏差。malbac可用于使用单个胎儿细胞诊断胎儿异常,或可用于使用单个胎儿细胞鉴定发展癌症的胎儿倾向。
下一代测序(ngs)是可用于检测胎儿异常的一组高通量测序技术。ngs(例如,大规模平行测序)使用与小至单个细胞的细胞样品来测序大片段的核酸序列或整个基因组。例如,在ngs中,许多相对小的核酸序列可以同时由来自小片段(即读段(read))文库的基因组dna(gdna的)样品测序。然后可以重新组装读段以鉴定大的核酸序列或染色体的完整核酸序列。例如,在ngs中,可以平行运行多达500,000个测序操作。ngs是单个细胞、全基因组扩增(wga))的形式。例如,当继之传统pcr后,malbac可用于ngs。
大规模平行标记测序(mpss)是ngs的一个实例。mpss鉴定来自17-20个碱基对标记引物序列的mrna转录物。mpss可用于鉴定和定量样品中的mrna转录物(brenner等,2000,naturebiotechnology18(6):630-634)。
聚合酶克隆测序是ngs的另一实例。聚合酶克隆测序可用于平行读取数百万个固定的dna序列。聚合酶克隆测序是一种多重测序技术,已发现其非常准确(错误率低)(shendure等,2004.naturereviewsgenetics5(5):335-344,2004;shendure等,2008,naturebiotech26(10):1135-1145)。
454焦磷酸测序是ngs的另一实例。454焦磷酸测序利用荧光素酶检测添加到新生dna中的单个核苷酸。454焦磷酸测序扩增在油溶液中的水滴中含有的dna。每个水滴含有与经引物包被的珠连接的一个dna模板(vera等,2008,molecularecology17(7):1636-1647)。
illumina测序是ngs的另一实例。在illumina测序中,将dna分子和引物连接到载玻片上。通过聚合酶扩增dna分子并形成dna集落(dna簇)(shendure等,2008,naturebiotech26(10):1135-1145;meyer等,2010,coldsprhbrprotocols2010(6)):pdb-prot5448)。
通过寡核苷酸连接和检测测序(solid测序)是ngs的另一实例。solid测序是通过连接测序的方法。solid测序同时随机产生数千个小序列读段,并将dna片段固定在固相载体上以进行测序(shendure等,2008,naturebiotech26(10):1135-1145;meyer等,2009,newbiotechnology25(4):195-203)。
离子激流半导体测序是ngs的另一实例。离子激流半导体测序是一种合成测序方法,其可检测dna聚合过程中释放的氢离子。将脱氧核糖核苷酸三磷酸引入含有待测序的模板dna链的微孔中。当dntp与前导模板核苷酸互补时,dntp掺入互补dna链并释放氢离子(quail等,2012,bmcgenomics13(1):341)。
dna纳米球测序是ngs的另一实例。dna纳米球测序可用于确定生物体(例如新发现的生物体)的整个基因组序列。使用滚环复制来扩增基因组dna的小片段以形成dna纳米球。然后可以通过使用荧光探针作为指导来连接dna序列(ansorge等,2009,newbiotechnology25(4):195-203;drmanac等,2010,science327(5961):78-81)。
heliscope单分子测序是ngs的另一实例。heliscope单分子测序是一种直接测序方法,其不需要连接或pcr扩增。将dna剪切,用多聚a尾加尾,然后与寡(dt)杂交到流动池的表面。然后可以平行测序数十亿个分子(pushkarev等,2009,naturebiotechnology27(9):847-850)。
单分子实时(smrt)测序是ngs的另一实例。smrt测序是合成测序方法。dna在称为零模式波导(zmw)的小型孔状容器中合成。使用连接到zmw底部的未修饰的聚合酶来对在溶液中自由流动的dna以及带荧光标签的核苷酸进行测序。当核苷酸掺入dna链时,荧光标签与核苷酸脱离(flusberg等,2010,naturemethods7(6):461-465)。
超级深度测序是指从许多模板拷贝确定核酸序列的次数。超级深度测序可用于通过扩增可能含有稀有突变的相对小的目标核酸序列来鉴定稀有的基因突变。
dna微阵列可用于同时测量多个基因的表达水平。dna微阵列也可用于对基因组的多个区域进行基因分型。例如,产前染色体微阵列(cma)-可用于检测拷贝数变异,例如染色体中的非整倍性。产前cma可以检测全部或部分染色体的缺失或重复。
在某些方面,可以对单个细胞或细胞小组进行dna指纹分析,例如使用由treff等,2010,fertilityandsterility94(2):477-484描述的原理的snp微阵列,将其全部内容通过引用并入本文。用于这些方法的snp微阵列优选是全基因组snp阵列。在各种实施方式中,snp指纹包含至少50,000、至少100,000、至少150,000、至少200,000或至少250,000个snp。snp指纹可以从单个微阵列或多个微阵列产生。使用比较dna指纹,可以将胎儿细胞与母体细胞区分开来。在优选实施方式中,确定与母体细胞的匹配(例如,所检查的细胞是母体细胞而非胎儿细胞)基于至少1,000个,更优选至少1,500个,更优选至少2,000个信息性snp。母体指纹可以基于历史母体样品或与胎儿细胞平行运行的母体样品。指纹识别之前可以是对胎儿细胞和可选的母体样品进行的wga。snp指纹也可用于胎儿异常或其它特征。微阵列可以适于包括snp和胎儿特征和/或可能的胎儿细胞异常的标志物的组合,例如上述那些。在特定实施方式中,微阵列包括至少5、至少10、至少15、至少20、至少30或至少50个可能的胎儿细胞异常标志物和/或胎儿性别标志物,例如y染色体标志物。
5.4.2治疗应用
本公开内容还提供了用于子宫内干细胞治疗的方法,其包括将通过本公开内容可获得的胎儿干细胞(例如msc和/或cd34+干细胞)的群递送至子宫内胎儿。胎儿干细胞的群可用于治疗血液疾病(例如,α-地中海贫血(o'brien等2005,clinicalobstetricsandgynecology4:885-896))、代谢疾病、免疫疾病(例如,严重的组合免疫缺陷)、骨骼疾病(例如,成骨不全症(chan等,2014,frontiersinpharmacology5:223)、神经管缺陷(li等,2012,j.cell.mol.med.16(7):1606-1617),并纠正遗传缺陷(o'brien等,2005,clinicalobstetricsandgynecology4:885-896;chanetal.,2005,stemcells23:93-102)。
本发明还提供在需要干细胞疗法的幼体或成体个体中进行干细胞治疗的方法,所述方法包括向所述个体递送通过本公开内容的方法可获得的干细胞(例如mscs)的群。干细胞群可用于治疗创伤、骨科损伤,心血管疾病、自身免疫疾病、肝病、神经障碍、神经元变性、移植物抗宿主病、代谢疾病、肾梗塞、心肌梗塞、支持血液植活(engraftment)以及骨和/或软骨组织再生(farini等,2014,stemcellsinternational,articleid306573;kim等,2013,koreanj.intern.med.28:387-402;phinney等,2014,brainres.0:92-107;lange等,2007,j.cell.physiol.213:18-26)。
在一些实施方式中,用于干细胞治疗的干细胞的群包括同种异体干细胞。在其它实施方式中,用于干细胞治疗的干细胞的群包括通过引入胎儿、幼体或成体需要的基因而进行重组的自体干细胞(chan等,2008hum.reprod.,23(11):2427-2437)。
5.5示例性策略
5.5.1分批rbc去除
可以使用下面的分离策略来从全血获得有核细胞富集级分。
1.用水性溶液稀释一定量的血液。
2.将经稀释的血液离心以形成含有有核细胞和无核红细胞的细胞沉淀物,并去除部分或全部富含血小板的血浆。
3.将细胞沉淀物重悬于水性溶液中。
4.向重悬的细胞中加入预制的葡聚糖溶液,以形成含有例如葡聚糖的混合物,最终浓度为1%(w/v)。
5.将一定体积的混合物加入预先填充有重质液体的沉降分离装置中,以获得1.5-2cm的混合物柱高度,同时从装置中排出一定体积的重质液体,该体积等于混合物的体积。
6.使混合物分离成有核细胞富集级分和无核细胞富集级分。
7.从沉降分离装置中收集有核细胞富集级分。
5.5.2目标有核细胞富集
利用阴性选择和密度梯度离心,使用以下富集策略来富集有核细胞富集级分,例如通过5.5.1节的分批rbc去除策略针对目标有核细胞获得的有核细胞富集级分。
1.通过将有核细胞富集级分与生理溶液(例如rpmi)合并,然后离心所得混合物以沉淀细胞来洗涤有核细胞富集级分。
2.将细胞沉淀物重悬于水性溶液(例如无血小板血浆)中,然后离心所得混合物以沉淀细胞。
3.将来自步骤2的细胞沉淀物重悬于水性溶液中,例如在rbc分批去除期间分离的富含血小板的血浆。
4.将来自步骤3的重悬细胞与阴性选择试剂合并以进行温和旋转,从而促进阴性选择试剂与不需要的细胞的结合。
5.使步骤4混合物进行密度梯度离心(例如,密度截止(densitycut)为1.082)。
6.收集富含目标有核细胞的细胞级分。
7.以类似于步骤1和2的方式洗涤富含目标有核细胞的级分。
以上策略可以用于获得含有fnrbc、fmsc和cd34+干细胞中的一种、两种或全部三种的级分,这取决于阴性选择试剂的选择。
5.5.3细胞培养
使用以下细胞培养策略来培养间充质干细胞,例如通过5.5.2节的目标有核细胞富集策略获得的间充质干细胞。
1.在间充质干细胞培养基中重悬富含间充质干细胞的细胞沉淀物。
2.将细胞悬浮液转移到腔室载玻片或细胞培养皿中,并在37℃下温育载玻片或培养皿。
3.每三天更换培养基。
6.实施例
6.1实施例1:从母体血液中分离有核细胞
以fluorinerttmfc-43填充具有8cm直径内腔的图1中所示类型的分离装置。将从妊娠雌性获得的25ml外周血与25ml包含2%葡聚糖(w/v)的rpmi培养基合并,得到最终葡聚糖浓度为1%的混合物。将混合物通过顶部入口/出口引入分离装置的内腔的fc-43顶上,fc-43位于分离装置的圆柱形部分下部,并在局部重力下通过9分钟分离成有核细胞富集级分和无核红细胞富集级分。然后通过底部入口/出口将另外的fc-43引入内腔,而从顶部入口/出口收集有核细胞富集级分。
使用有核细胞富集级分进行第二次分离,以耗尽剩余的无核红细胞。在第一次分离后,将有核细胞富集级分与含有1%葡聚糖的rpmi培养基混合,并再次引入分离装置的内腔中(在第一次分离的红细胞除去后)并使其在局部重力下沉降,从而获得几乎完全不含红细胞的有核细胞富集级分。
在第一次分离和第二次分离后有核细胞富集级分中有核细胞和无核红细胞的回收百分比在以下表1中显示。
表1:进行两个分离循环的母体血液的细胞回收
6.2实施例2:分离目标有核细胞的群
如实施例1中所述,将来自11-14周妊娠正常的妊娠女性的母体血液样品如实施例1中所述进行处理,以获得有核细胞富集级分。然后使用rosetteseptm人间充质干细胞富集混合试剂(stemcelltechnologies)(stemcelltechnologies)继之以密度梯度离心、或非生理条件继之以密度梯度离心对有核细胞富集级分进行阴性选择,从而进一步富集胎儿有核细胞。用于非生理条件的介质含有柠檬酸钠、柠檬酸和葡萄糖,并具有310-320mmosm/l的渗透压。
表2:进行了rbc分批去除并进一步富集胎儿有核细胞的母体血液的细胞回收
然后如peters等,2010,plosone5(12):e15689所述,在包含人干细胞因子(scf)、白细胞介素6(il-6)、fms样酪氨酸激酶3(flt-3)配体和巨核细胞生长发育因子(mgdf)的选择性培养基中培养所富集的群。培养3天和1周的细胞分别显示在图2a-2b中。对培养一周的细胞进行的rt-pcr实验表达干细胞标志物oct4和nanog,如图3所示。
6.3实施例3:目标有核细胞培养和分析
将来自怀有双胞胎的11周孕雌性的母体血液样品根据5.5.1节的分批红细胞去除策略进行处理,以提供有核细胞富集级分。通过使用sry引物和探针的rt-pcr对母体血浆中存在的无细胞胎儿(cff)dna进行的分析已经事先确定两个胎儿中的至少一个是雄性。然后使用rosetteseptm人间充质干细胞富集混合试剂(stemcelltechnologies)和密度梯度离心,根据5.5.2节的目标有核细胞富集策略,对有核细胞富集级分进行阴性选择,以选择胎儿细胞。
然后根据5.5.3节的细胞培养策略培养所得到的细胞群。在第3天,收集细胞培养物上清液并用带荧光标签的抗cd45抗体、4b9、山羊抗小鼠igmalexafluor488和dc-ruby进行荧光标记以将上清液中存在的fnrbc染色,然后通过facs分选成8管,每管具有5个事件。在第9天,通过显微操作挑选10个msc并收集在单个管中。对于在第3天通过facs分选的细胞进行
在通过显微操作挑选的细胞中在facs分选的细胞中鉴定出父体等位基因(数据未显示)。通过fish观察到x和y染色体,表明存在雄性胎儿细胞(参见图5)。
7.具体实施方式
本公开内容通过以下具体实施方式来举例说明。
1.一种将血液来源的有核细胞富集级分中存在的目标有核细胞的群与无核红细胞分离的方法,所述有核细胞富集级分含有不超过20%的来自血液的无核红细胞,所述方法包括使所述有核细胞富集级分进行以下步骤中的至少一种:
a)针对所述目标有核细胞的阴性选择;
b)针对所述目标有核细胞的阳性选择;和
c)密度梯度离心,
从而分离目标有核细胞的群。
2.如实施方式1所述的方法,其中,所述有核细胞富集级分含有至少85%、至少90%、至少95%或至少99%的来自血液的有核细胞。
3.如实施方式1或实施方式2所述的方法,其中,所述有核细胞富集级分含有不超过15%、不超过10%、不超过5%或不超过1%的来自血液的无核红细胞。
4.如实施方式1至3中任一项所述的方法,其中,所述有核细胞富集级分是包括以下步骤的方法的产物:
a)在局部重力下在容器的内腔中将包含有核细胞、无核红细胞和凝集剂的混合物分离成有核细胞富集级分和无核红细胞富集级分,其中所述分离是分批进行的,并且其中
i.所述内腔中所述混合物的平均高度不超过4cm;和/或
ii.对所述内腔中所述混合物的平均高度进行选择,从而在不超过3轮、不超过2轮或不超过1轮分离之后,提供无核红细胞富集级分,其含有所述混合物中至少80%的所述无核红细胞和/或所述混合物中不超过20%的所述有核细胞;
b)可选地重复步骤(a)一次或多次;和
c)可选地洗涤所述有核细胞富集级分一次或多次。
5.如实施方式4所述的方法,其中,所述洗涤包括浓缩所述有核细胞富集级分的细胞,并将经浓缩细胞与包含血浆的溶液合并。
6.如实施方式5所述的方法,其中,其中所述血浆是自体血浆。
7.如实施方式4至6中任一项所述的方法,其中,所述内腔中所述混合物的平均高度为不超过4cm,不超过3.5cm,不超过3cm,不超过2.5cm,不超过2cm或不超过1.5cm。
8.如实施方式4至6中任一项所述的方法,其中,所述内腔中所述混合物的平均高度为不超过1cm。
9.如实施方式4至8中任一项所述的方法,其中,所述内腔中所述混合物的平均高度为至少0.5cm或至少1cm。
10.如实施方式4至9中任一项所述的方法,其中,所述混合物的体积为小于500ml,小于400ml,小于300ml,小于200ml,小于100ml,小于75ml,小于50ml,小于40ml,小于30ml或小于25ml。
11.如实施方式4至10中任一项所述的方法,其中,所述混合物的体积为至少5ml,至少10ml,至少20ml或至少25ml。
12.如实施方式4至9中任一项所述的方法,其中,所述混合物的体积为25ml至50ml,50ml至100ml,100ml至200ml或200ml至400ml。
13.如实施方式4至12中任一项所述的方法,其中,所述凝集剂是葡聚糖、羟乙基淀粉(hes)、明胶、喷他淀粉(pentastarch)、蔗聚糖(ficoll)、阿拉伯胶、聚乙烯吡咯烷酮、5-(n-2,3-二羟基丙基乙酰氨基)-2,4,6-三碘-n,n'-双(2,3二羟基丙基)间苯二甲酰胺或其任何组合。
14.如实施方式4至13中任一项所述的方法,其中,所述分离进行2至15分钟,2至10分钟,2至5分钟,3至6分钟,4至12分钟,5至10分钟,2至8分钟,4至10分钟,3至7分钟,6至10分钟或5至8分钟。
15.如实施方式4至14中任一项所述的方法,其中,所述容器的所述内腔具有固定体积。
16.如实施方式4至15中任一项所述的方法,其中,所述容器的所述内腔包括圆柱形部分或多面体部分。
17.如实施方式4至16中任一项所述的方法,其中,所述容器的所述内腔包括漏斗形部分。
18.如实施方式4至16中任一项所述的方法,其中,所述容器的所述内腔包括圆柱形部分或多面体部分,所述圆柱形部分或多面体部分(a)在底端连接至所述漏斗形部分;(b)在一个顶端连接至倒置的漏斗形部分;或(c)在底端连接至所述漏斗形部分;并且在顶端连接至倒置的漏斗形部分。
19.如实施方式4至18中任一项所述的方法,其中,容器包括可操作地连接至所述容器的内腔的一个或多个入口/出口。
20.如实施方式19所述的方法,其中,所述容器还包括位于所述容器的内腔内的一个或多个偏流器,以允许通过所述一个或多个入口/出口引入所述容器的内腔的流体的偏转,并提供流体层流(laminarfluidflow)。
21.如实施方式19或实施方式20所述的方法,其中,生产有核细胞富集级分的方法还包括通过位于所述内腔底部的第一入口/出口将重质液体引入所述容器的内腔,直到全部或一部分的有核细胞富集级分通过位于所述内腔顶部的第二入口/出口被迫排出所述内腔。
22.如实施方式21所述的方法,其中,在分离所述混合物期间,一定量的重质液体存在于所述容器的内腔中。
23.如实施方式21或实施方式22所述的方法,其中,所述重质液体包含全氟三丁胺(heptacosafluorotributylamine)、ficoll1.077g/ml、ficoll1.085g/ml,或其任何组合。
24.如实施方式22或实施方式23所述的方法,其中,在生产有核细胞富集级分的方法中,在将一定量的重质液体引入所述容器中之后将所述混合物引入所述容器的内腔中。
25.如实施方式24所述的方法,其中,生产有核细胞富集级分的方法包括在将所述混合物引入所述容器的内腔之前将一定量的重质液体引入所述容器中的步骤。
26.如实施方式4至25中任一项所述的方法,其中,生产有核细胞富集级分的方法包括将所述混合物引入所述容器的内腔中的步骤。
27.如实施方式4至26中任一项所述的方法,其中,所述混合物是包括将所述凝集剂或包含所述凝集剂的溶液与包含所述有核细胞和所述无核红细胞的样品合并的方法的产物。
28.如实施方式27所述的方法,其中,生产有核细胞富集级分的方法还包括形成所述混合物的步骤。
29.如实施方式27或实施方式28所述的方法,其中,所述样品是先前制备的有核细胞富集级分。
30.如实施方式27或实施方式28所述的方法,其中,所述样品包含全血。
31.如实施方式27或实施方式28所述的方法,其中,所述样品包含血液级分。
32.如实施方式31所述的方法,其中,所述血液级分含有用于制造所述血液级分的全血的量中存在的至少5%,至少10%,至少20%,至少30%,至少40%,至少50%或超过50%的血浆。
33.如实施方式31所述的方法,其中,所述血液级分含有用于制造所述血液级分的全血的量中存在的5-10%、10-20%、20-30%、20-50%或50-100%的血浆。
34.如实施方式31至33中任一项所述的方法,其中,所述血液级分是包括下述步骤的方法的产物:
(a)可选地,用水性溶液稀释血液;
(b)将来自步骤(a)的血液或经稀释血液离心以获得细胞沉淀物;和
(c)可选地,将所述沉淀物重悬于水性溶液中,该水性溶液具有与步骤(a)的水性溶液相同的组成或具有与步骤(a)的水性溶液不同的组成,
从而形成所述血液级分。
35.如实施方式27或实施方式28所述的方法,其中,所述样品包含用水性溶液稀释的血液。
36.如实施方式34至35中任一项所述的方法,其中,所述水性溶液包含血浆、细胞培养基、缓冲液或其组合。
37.如实施方式36所述的方法,其中,所述细胞培养基是roswellparkmemorialinstitute(rpmi)培养基、earle培养基或hanks平衡盐溶液。
38.如实施方式4至37中任一项所述的方法,其中,所述混合物与红细胞等渗。
39.如实施方式4至38中任一项所述的方法,所述方法还包括生产有核细胞富集级分的步骤。
40.如实施方式1至39中任一项所述的方法,其中,所述阴性选择包括阴性免疫选择。
41.如实施方式1至40中任一项所述的方法,其中,所述阳性选择包括阳性免疫选择。
42.如实施方式1至41中任一项所述的方法,所述方法包括使有核细胞富集级分接受阴性选择,然后进行密度离心。
43.如实施方式1至42中任一项所述的方法,其中,所述密度梯度离心之前是在具有非生理条件的介质中温育所述有核细胞富集级分的步骤。
44.如实施方式1至43中任一项所述的方法,其中,所述血液是外周血或脐带血。
45.如实施方式44所述的方法,其中,所述血液是来自妊娠雌性的外周血、患有癌症的受试者的外周血或获自健康个体的血液。
46.如实施方式45所述的方法,其中,血液是来自妊娠雌性的外周血,并且所述目标有核细胞包括胎儿细胞。
47.如实施方式1至46中任一项所述的方法,其中,所述目标有核细胞包含稀有有核细胞。
48.如实施方式47所述的方法,其中,所述稀有有核细胞包含干细胞或癌细胞。
49.如实施方式48所述的方法,其中,所述干细胞包含间充质干细胞。
50.如实施方式49所述的方法,其中,所述阴性选择包括利用针对一种或多种细胞表面标志物的一种或多种抗体的阴性免疫选择,其中至少一种所述细胞表面标志物选自cd2、cd3、cd10、cd11b、cd14、cd15、cd16、cd19、cd31、cd34、cd35、cd38、cd44、cd45、cd49、cd49d、cd56、cd61、cd62(e)、cd66b、cd68、cd79α、cd104、cd106、cd117、hla-dr和血型糖蛋白a。
51.如实施方式50所述的方法,其中:
a)所述阴性免疫选择利用针对一种或多种细胞表面标志物的一种或多种抗体,其中至少一种所述细胞表面标志物选自cd3、cd14、cd19、cd38、cd66b和血型糖蛋白a;
b)所述阴性免疫选择利用针对两种以上细胞表面标志物的一种或多种抗体,其中至少两种所述细胞表面标志物选自cd3、cd14、cd19、cd38、cd66b和血型糖蛋白a;
c)所述阴性免疫选择利用针对三种以上细胞表面标志物的一种或多种抗体,其中至少三种所述细胞表面标志物选自cd3、cd14、cd19、cd38、cd66b和血型糖蛋白a;
d)所述阴性免疫选择利用针对四种以上细胞表面标志物的一种或多种抗体,其中至少四种所述细胞表面标志物选自cd3、cd14、cd19、cd38、cd66b和血型糖蛋白a;
e)所述阴性免疫选择利用针对五种以上细胞表面标志物的一种或多种抗体,其中至少五种所述细胞表面标志物选自cd3、cd14、cd19、cd38、cd66b和血型糖蛋白a;或
a)所述阴性免疫选择利用针对六种以上细胞表面标志物的一种或多种抗体,其中至少六种所述细胞表面标志物选自cd3、cd14、cd19、cd38、cd66b和血型糖蛋白a。
52.如实施方式49至51中任一项所述的方法,其中,所述阳性选择包括利用针对一种或多种细胞表面标志物的一种或多种抗体的阳性免疫选择,其中至少一种所述细胞表面标志物选自cd73、cd90、cd105、cd166、cd200、cd271和stro-1。
53.如实施方式1至52中任一项所述的方法,所述方法还包括培养目标有核细胞的群。
54.如实施方式53所述的方法,其中,所述目标有核细胞包含间充质干细胞,并且培养包括在间充质干细胞培养基中培养目标有核细胞的群。
55.一种通过实施方式1至54中任一项所述的方法获得的目标有核细胞的群。
56.如实施方式55所述的目标有核细胞的群,其包含胎儿间充质干细胞。
57.如实施方式56所述的群,其中,所述群中至少70%、至少80%、至少90%或至少95%的细胞是胎儿间充质干细胞。
58.一种检测胎儿异常的方法,所述方法包括就胎儿异常分析来自实施方式56或实施方式57所述的群的至少一种胎儿间充质干细胞。
59.如实施方式58所述的方法,所述方法包括就胎儿异常分析单个间充质干细胞。
60.如实施方式58所述的方法,所述方法包括就所述胎儿异常分析一组间充质干细胞。
61.如实施方式59或实施方式60所述的方法,所述方法包括在所述分析之前进行全基因组扩增。
62.如实施方式59或实施方式60所述的方法,所述方法包括在所述分析之前扩增所述基因组的子集。
63.如实施方式58至62中任一项所述的方法,其中,所述分析包括定量pcr。
64.如实施方式58至63中任一项所述的方法,其中,所述分析在微阵列上进行。
65.如实施方式58至64中任一项所述的方法,其中,所述分析包括荧光原位杂交(fish)。
66.如实施方式58至65中任一项所述的方法,所述方法还包括验证所述间充质干细胞或作为胎儿细胞的间充质干细胞。
67.如实施方式66所述的方法,其中,验证包括进行荧光原位杂交(fish)、短串联重复(str)分析、遗传指纹分析、单核苷酸多态性(snp)分析或其任何组合。
68.如实施方式66或实施方式67所述的方法,其中,验证包括将间充质干细胞dna与母体dna比较。
69.如实施方式66或实施方式67所述的方法,其中,验证包括将间充质干细胞dna与母体和父体dna比较。
70.一种用于子宫内干细胞治疗的方法,所述方法包括向子宫内的胎儿递送实施方式56或实施方式57所述的目标有核细胞的群。
71.如实施方式70所述的方法,其中,所述胎儿具有神经管缺陷。
72.如实施方式70所述的方法,其中,所述胎儿具有导致疾病或病症的基因缺陷。
73.如实施方式72所述的方法,其中,所述疾病或病症是血液疾病、代谢疾病、免疫疾病或骨病症。
74.如实施方式72或实施方式73所述的方法,其中,所述目标有核细胞包含间充质干细胞,所述间充质干细胞包含所述胎儿所需的基因。
75.如实施方式74所述的方法,其中,所述间充质干细胞包含同种异体间充质干细胞。
76.如实施方式74所述的方法,其中,所述间充质干细胞包含通过引入所述胎儿所需的基因而重组制备的自体间充质干细胞。
77.一种治疗患有疾病或病症的受试者的方法,所述方法包括:
向所述受试者施用实施方式56或实施方式57所述的目标有核细胞的群,其中所述疾病或病症选自创伤、矫形外科损伤、心血管疾病、自身免疫疾病、肝病、神经障碍、神经元变性、移植物抗宿主病、代谢疾病、肾梗塞和心肌梗塞。
78.一种促进接受造血干细胞移植的受试者中造血细胞植活(engraftment)的方法,所述方法包括向所述受试者施用实施方式56或实施方式57所述的目标有核细胞的群。
79.一种在有需要的受试者中再生骨和/或软骨的方法,所述方法包括向所述受试者施用实施方式56或实施方式57所述的目标有核细胞的群。
8.参考文献的引用
为了所有的目的,本申请中引用的所有出版物、专利、专利申请或其它文献都全文并入本文作为参考,就象每个单独的出版物、专利、专利申请或其它文献为了所有目的被单独地提到需并入本文作为参考一样。在并入本文的一个或多个参考文献的教导和本公开内容之间存在不一致的情况下,以本说明书的教导为准。
- 还没有人留言评论。精彩留言会获得点赞!