犬I型腺病毒单克隆抗体/多克隆抗体、双抗夹心ELISA试剂盒和应用
本发明涉及犬腺病毒抗体,尤其涉及犬i型腺病毒单克隆抗体/多克隆抗体以及由此构建的犬i型腺病毒双抗夹心elisa检测试剂盒,属于犬i型腺病毒的elisa领域。
背景技术:
犬腺病毒(canineadenovirus,cadv)是双链dna病毒,包括ⅰ型和ⅱ型。犬ⅰ型腺病毒(canineadenovirustype1,cadv-1)主要引起急性败血性肝炎(犬)和脑炎(熊和狐)。cadv-1广泛分布于世界各地,其致病性强、感染谱广,除了犬和狐狸外,cadv-1还能对野生肉食哺乳动物(狼、棕熊、黑熊和水獭等)造成致死性感染。
cadv可跨物种传染,不仅可感染宠物犬,还能够感染狼、郊狼、臭鼬、狐狸、熊和狮子等野生动物。cadv-1感染对家犬和野生动物具有潜在的威胁。因此,建立高效、快速的检测方法是预防和及时发现疫情的关键措施。
夏咸柱等于1983年在中国首次从患有传染性肝炎的犬中分离得到cadv-1,并于1990年建立了cadv-1的系统性实验室诊断方法,证实cadv-1在中国养犬业中普遍存在(夏咸柱等,1984;夏咸柱等,1990)。钟志宏等于1989年分离得到中国第一株狐源cadv-1,范泉水等于1999在患支气管炎的犬中分离得到cadv-2(范泉水等,1999;钟志宏等,1990)。随后的几年,在灰熊、大熊猫、老虎等野生哺乳动物中也检测到cadv-1。cadv-1感染性强,致死率高,是影响中国经济动物养殖业发展的重要疫病之一(范泉水等,2005;李秦等,2000;刘大飞等,2010)。近年来,国内虽然没有出现有关cadv-1大规模爆发的情况,但国外多数国家持续的高感染率和高爆发率情况屡见不鲜,仍然要进一步加强对cadv-1的预防与监测力度。
血清中和试验(sn)是检测病毒血清中和抗体的传统方法之一,sn具有敏感性强、特异性和稳定性好等方面的优点,一直为国内外学者所认同(loeffen,2012;whetstone,1988)。sn一直作为cadv血清抗体检测的金标准用于评估cadv疫苗免疫效果和监测免疫动物血清中和抗体效价。姜莉莉等建立了针对cadv-1的微量血清中和试验,进一步优化了传统sn的检测效果(姜莉莉等,2011)。由于sn方法检测周期较长且操作复杂,在大规模的流行病学调查中已逐渐被其他方法代替。
elisa技术是利用有机材料(如聚苯乙烯)能有效吸附蛋白质等物质的特性,将有机材料制成的微孔板作为固相载体,将蛋白(抗原或抗体)包被在其中,依次将各反应物质加入到其中,每次必须洗脱掉未结合的成分,最后通过显色液与过氧化物酶的相互作用进行显色和结果判定(engvalletal.,1971)。elisa检测方法在cadv-1的血清学调查和临床诊断中扮演重要角色。张汇东和马志勇等建立了早期的斑点elisa检测方法用于cihv的检测(马志勇等,1992;张汇东等,1991);郑海发和姜莉莉等建立了针对狐狸脑炎的间接elisa检测方法(姜莉莉等,2008;郑海发等,1992);葛艳华等利用纯化后的cadv-2全病毒为包被抗原建立了针对cadv-2的间接elisa检测法,该方法对cadv-2具有高敏感性和特异性,但针对cadv-1的检测效果尚未报道(葛艳华等,2010);walker等在前人基础上利用纯化后的cadv-1和cadv-2细胞毒同时作为包被抗原,建立针对cadv的间接elisa检测方法(walkeretal.,2016)。以全病毒作为包被抗原的传统elisa方法,其病毒粒子大多是通过超速离心方式得到,病毒的浓度及纯度均较低,在一定程度上影响了elisa检测方法的敏感性和特异性。
自1915年建立杂交瘤技术以来,针对病毒结构蛋白、细菌以及细胞因子等的单克隆抗体(mab)不断出现。2015年,各国抗体药物成交总额超过了850亿美元。杂交瘤技术可结合b淋巴细胞与骨髓瘤细胞的优点,产生杂交瘤细胞具有双亲功能,既能合成抗体细胞又能分泌特定抗体,还可以在体外无限增殖。利用该技术仅使用少量抗原就能够产生大量抗体,且浓度很高。在传染病的防治和检测方面效果显著,具有其他方法不可比拟的优势。此外,单克隆抗体并不要求过高的抗原纯度,低纯度的抗原就可以产生高特异性的抗体。
由于双抗夹心elisa方法使用了两种抗体,因此,检测的准确性更高。但是建立检测犬i型腺病毒的双抗夹心elisa方法的前提是需要制备得到特异性强的犬i型腺病毒单克隆抗体及多克隆抗体。
技术实现要素:
本发明的目的之一是提供特异性的犬i型腺病毒单克隆抗体以及多克隆抗体;
本发明的目的之二是提供检测犬i型腺病毒的双抗夹心elisa检测试剂盒。
本发明的上述目的是通过以下技术方案来实现的:
本发明首先提供了一株分泌犬i型腺病毒抗体的杂交瘤细胞株,所述的杂交瘤细胞株命名为cadv-1-f1301-01a,其微生物保藏编号为cgmccno.19661;保藏时间:2020年4月8日,保藏单位是:中国微生物菌种保藏管理委员会普通微生物中心。
本发明进一步提供了特异性的犬i型腺病毒单克隆抗体,该犬i型腺病毒单克隆抗体由微生物保藏编号为cgmccno.19661的杂交瘤细胞株所分泌。
本发明进一步提供了犬i型腺病毒多克隆抗体,其制备方法包括:以犬i型腺病毒免疫原免疫兔子制备得到犬i型腺病毒多克隆抗体;更优选的,其制备方法包括:用弗氏完全佐剂充分乳化犬i型腺病毒免疫原后首免健康洁净级大白兔,2免、3免均用弗氏不完全佐剂与免疫原充分乳化,免疫剂量均为500μg/只,背部皮下多点注射,免疫间隔为14d。3免结束10天后对实验兔耳缘静脉采血并测定血清效价,得到特异性的犬i型腺病毒多克隆抗体。
本发明所提供的犬i型腺病毒单克隆抗体以及犬i型腺病毒多克隆抗体能够应用于检测犬i型腺病毒,譬如,应用犬i型腺病毒单克隆抗体采用westernblot、免疫荧光或elisa检测方法等检测样品中的犬i型腺病毒;或者是利用hrp标记犬i型腺病毒多克隆抗体,制备酶标抗体,采用获得的犬i型腺病毒单克隆抗体联合酶标多克隆抗体建立犬i型腺病毒双抗夹心elisa检测方法。
将犬i型腺病毒单克隆抗体包被在酶标板是双抗体夹心elisa中至关重要的一步。当抗体包被浓度过低时,不能完全覆盖固体载体表面,从而导致捕获抗体吸附的抗原量不足,有可能会出现假阴性;使用过高的抗体包被浓度时,容易导致抗体分子之间的相互作用。在洗涤时,这些抗体很容易被洗掉,影响实验的灵敏度。如果浓度过高,会增强非特异性反应,导致阳性结果过高,影响测量的灵敏度。因此,筛选抗体的包被浓度对于建立的elisa检测方法非常重要。
本发明进一步提供了一种cadv-1抗原检测elisa试剂盒,包括:一抗,酶标记的二抗,抗体稀释液、洗涤液、封闭液,显色液;其中,所述的一抗是微生物保藏编号为cgmccno.19661的杂交瘤细胞株所分泌的单克隆抗体,该抗体作为包被抗体;所述的二抗是犬i型腺病毒多克隆抗体,其通过用cadv-1抗原作为免疫原免疫兔制备得到犬i型腺病毒多克隆抗体;所述的酶标记是用hrp进行标记。
其中,所述的抗体稀释液优选为0.5%的bsa溶液,所述的洗涤液优选为pbst缓冲液,所述的封闭液优选为5%脱脂乳溶液,所述的显色液优选为tmb底物显色液,所述的终止液优选为2mol/l浓硫酸溶液。
本发明进一步提供了应用所述cadv-1抗原检测elisa试剂盒检测样品中cadv-1抗原的方法,包括:
(1)将单抗包被酶标板,4℃过夜,pbst洗板3次,加入5%的脱脂乳封闭2h;(2)加入待检测的抗原,37℃孵育1h,pbst洗板3次;(3)加入稀释的酶标多克隆抗体,37℃孵育1h;(4)tmb显色液显色15min。终止显色后,采用酶标仪在450nm检测od值;检测30份cadv-1阴性样品,记录30份样品od450的值,通过计算平均值为0.269,标准差为0.032,根据公式计算阴阳性样品的临界值(阴阳性临界值=mean+3sd)为0.366。
本发明通过大量的筛选试验发现,鼠源cadv-1单抗的最佳包被浓度为2.15μg/ml,hrp标记的兔源多抗的最佳稀释倍数为1:2000,包被条件为4℃包被过夜,选用5%的脱脂乳作为封闭液,最佳封闭时间为1h。抗原的最佳孵育时间是1h;酶标抗体的作用时间为1h;样品的阴阳性临界值为0.366。采用上述参数建立的双抗体夹心elisa方法,无论是在批内还是批间,都具有相对较好的重复性,该方法最低可检测到100个tcid50的病毒。当使用多种病毒对该方法进行检测时,只有cadv-1呈现阳性结果,说明该检测方法具有很好的特异性。与rt-pcr方法比较,该方法的敏感性为93.75%,特异性为90.9%,符合率为92.86%。
本发明用cadv-1作为免疫原分别免疫小鼠和家兔,分别制备得到特异性的鼠源cadv-1单克隆抗体和兔源多克隆抗体;采用westernblot鉴定获得的抗体,并鉴定单抗的类型,结果获得了1株igg1类型的单抗和兔源的多抗。本发明进一步利用hrp标记兔源多克隆抗体,制备酶标抗体。采用获得的鼠源cadv-1单克隆抗体和酶标抗体建立双抗夹心elisa检测方法,并摸索和筛选了最佳的反应条件。采用本发明所建立的双抗夹心elisa检测方法具有较好的批内和批间重复性,敏感性和特异性。与rt-pcr方法比较,该方法的敏感性为93.75%,特异性为90.9%,符合率为92.86%,表明本发明所建立的cadv-1抗原双抗体夹心elisa检测方法具有良好的敏感性、特异性和重复性,能用于cadv-1的临床检测。
附图说明
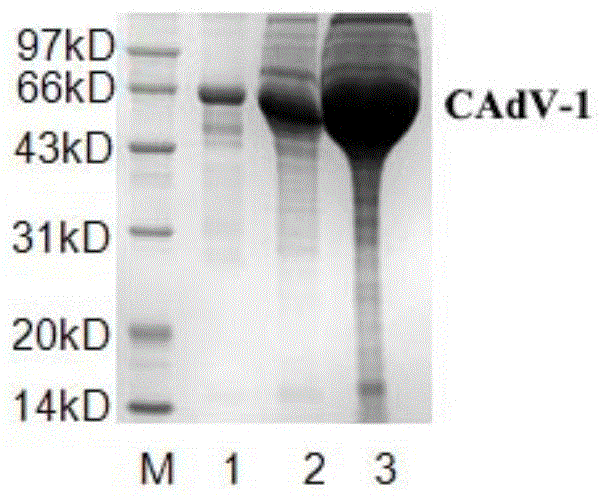
图1cadv-1抗原;m,marker;1,bsa(0.5mg/ml),2,cadv-1(7mg/ml),3,cadv-1(7mg/ml)。
图2单抗和多抗的westernblot鉴定结果。
图3最适包被条件筛选结果。
图4最佳封闭液的选择结果。
图5最佳封闭时间筛选结果。
图6最佳孵育时间的确定结果。
图7抗体最佳孵育作用时间筛选结果。
图8westernblot检测单克隆抗体结果。
图9免疫荧光检测结果。
图10组织免疫荧光检测结果。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但是应理解所述实施例仅是范例性的,不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改或替换均落入本发明的保护范围。
1.实验材料与统计分析方法
1.1血清、毒株、细胞和载体
细胞:mdck细胞均为本实验室保存。
毒株:cadv-1f1301株、cdv和cpv抗原由本发明人实验室保存。
样品:本发明人实验室保存的cadv-1阳性样品和阴性样品共70份。
1.2主要试剂和仪器
fastpfuhigh-fidelitydnapolymerase和t4dnaligase(lnvitrogen公司);his-bindpurificationkit(thermofisher公司);hitraprproteinaff:gehealthcare17-5079-01,goatanti-dogigg(abcom),0.45μm和0.22μm的滤器(millipore),imdm培养基,imdm完全培养基(含15%血清),细胞培养板(nest),50ml和15ml离心管(nest)和细胞培养瓶(康宁)。
37℃恒温细胞培养箱(thermo),凝胶成像系统(英国uvp),96孔酶标板洗板机(thermo),imagequant300凝胶成像仪(ge),mdf-u32v-80℃冰箱(thermo),中等结合力的elisa板(costar公司),蛋白电泳仪(bio-rad),070-851型pcr仪(appliedbiosystems公司),pt200系列pcr仪(bio-rad),倒置荧光显微镜(德国蔡司),pcr电泳系列的dyy-iii型电源和电泳槽(北京六一仪器厂),蛋白电泳垂直电泳槽和半干转印仪(bio-rad),用于细菌细胞壁破碎的jy92-2d型超声波仪(宁波新芝生物公司),高速离心机(beckman),milli-qii纯水仪(millipore),多功能酶标仪(bio-tek)。
偶联缓冲液:20mm磷酸钠缓冲液,ph7.0。
高盐偶联缓冲液(igg1):20mm磷酸钠缓冲液,加3mnacl,ph7.0,ph3.4。
洗脱缓冲液:0.1m柠檬酸钠缓冲液。
中和液:1mtris-hcl缓冲液,ph9.0。
0.01mpbs缓冲液,ph7.4。
1.3统计分析
数据采用平均数±标准差表示,相同字母表示没有差异,1个字母不同大小写表示差异显著(p<0.05),2个字母不同大小写表示差异极显著(p<0.01)。
实施例1犬i型腺病毒单克隆抗体/多克隆抗体的制备
1试验方法
1.1单抗的制备
(1)cadv-1灭活抗原免疫程序
采用超滤管浓缩cadv-1病毒,并通过sds-page检测浓缩结果。以spf级balb/c雌性小鼠作为试验动物,初次免疫剂量为60μg/只。连续免疫四次,加强免疫,每次剂量都相同,均为30μg/只。
(2)间接elisa方法的建立
为确定免疫小鼠的血清效价,使用cadv-1包板,建立间接elisa方法。用浓度为2μg/ml的cadv-1包板,4℃过夜。使用终浓度为2%的脱脂乳作为封闭液,最佳封闭温度为37℃,封闭2h。从200倍开始进行2倍梯度稀释血清,空白对照和阴性对照分别为pbs和200倍稀释的阴性血清,37℃孵育1h。加入tmb显色液显色,酶标仪450nm检测吸光度值(od)值。
(3)细胞融合实验
sp2/0细胞生长状态好时,用移液管将细胞从培养瓶转移至50ml离心管。免疫小鼠摘眼球取血,取血完成后,将小鼠拉颈处死并浸泡于75%的酒精中5min。取细胞筛、注射器内芯及少量不含血清的imdm于平皿中。取出小鼠的脾脏后在细胞筛上用注射器内芯碾碎,注意动作轻柔并充分碾碎。将得到的脾脏细胞移至装有sp2/0细胞的离心管中,1500rpm/min离心5min。取出小鼠的胸腺,用注射器内芯碾碎。将得到的的胸腺细胞移至15ml离心管中。倒掉上清液后,用移液管向离心管中移入无血清imdm,重悬细胞并吹打均匀,离心(1500r/min,5min)。倒掉上清,轻拍离心管底部重悬细胞,将离心管置于37℃温水中,缓慢加入1ml的peg(在1min内完成),温水中静置,时间1min。静置完成后向离心管中加入2ml的无血清imdm(在2min内完成,并注意动作缓慢),最后缓慢加入8ml无血清的imdm(在2min内完成)。离心1000rpm/min,5min。弃上清液,加入10ml的血清,用移液管重悬细胞并吹吸均匀,倒入处理好的胸腺细胞。向离心管中加入25ml无菌半固体培养基,将离心管中的细胞及培养基混匀后,均匀地分装到30个细胞培养皿中。将细胞培养皿移至湿盒中,并于培养箱中培养。
(4)阳性杂交瘤细胞的筛选
将半固体培养基上的单克隆挑至96孔培养板,并用“cadv-1”包板,对选取的克隆利用elisa的方法做初次筛选,结果表明,45株杂交瘤细胞株为阳性。通过上述方法再次筛选14株阳性细胞株,结果表明,其中5株为阳性。亚类鉴定表明,发现5株阳性细胞株中有3株igg类的阳性杂交瘤细胞株。对3株igg类的阳性杂交瘤细胞株进行大量培养及冻存,结果表明成功冻存1株细胞株。
(5)腹水的制备
1)调节恒温水浴箱温度至37℃-40℃。
2)将冻存于液氮罐中的所需细胞株取出,并立即置于37℃-40℃温水中快速晃动,直至液体完全溶化。
3)将融化的细胞冻存液移至离心管,向离心管中加入5ml完全培养基,吹打混匀,注意动作要轻柔。
4)将离心管中的细胞悬浮液离心(1000rpm/min,5min),弃上清液。
5)使用完全培养液将管底的细胞沉淀重悬,并吹打混匀,移至细胞培养皿中,于37℃恒温培养箱中培养。
6)取处于对数生长期的细胞,使用pbs洗涤并定量:每只小鼠注射的细胞量为5×105-9×105个/ml。
7)提前7天腹腔注射石蜡油,每只balb/c小鼠腹腔注射500μl。
8)将细胞悬液注射进入小鼠腹腔,每只注射1ml,确保细胞量达到5×105-9×105个/ml。
9)将杂交瘤细胞注射进入小鼠腹腔7天后,收集小鼠腹水。
10)对收集的腹水离心(5000rpm/min,10min),取上清,-20℃保存。
(6)抗体的纯化
1)样本预处理:用相应的偶联缓冲液以1:3稀释,4℃离心(12000rpm/min,10min),使用0.22μm滤膜滤除脂肪、破碎的细胞及小颗粒物质。
2)平衡:使用相应的10倍柱体积的偶联缓冲液平衡柱子,流速固定为1ml/min。
3)上样:以1ml/min的固定流速将样品从上端接口注入柱子,并收集流出液。
4)洗柱:以1ml/min的固定流速将5倍柱体积的偶联缓冲液过柱。
5)洗脱:以1ml/min的固定流速洗脱抗体,收集于ep管中。立即用1mph9.0的tris-hcl缓冲液调整ph值至7.0。
6)平衡:以1ml/min的固定流速,使用10倍柱体积的偶联缓冲液将柱子ph平衡至中性。
透析:采用0.01mpbs缓冲液将抗体透析过夜,换液3次。
(7)westernblot鉴定
收集cadv-1感染的mdck细胞,采用总蛋白提取试剂盒(博士德),与6×蛋白上样缓冲液混合均匀,然后在95℃沸腾5min,离心。上样进行sds-page电泳,电泳结束后将蛋白转印至pvdf膜上,以3%bsa进行封闭,37℃条件下孵育2h。以纯化抗体和cadv-1标准阳性血清(1∶500)作为一抗,孵育条件为4℃,12h。goatanti-dogigg(hrp)(1∶5000稀释)作为二抗,37℃,1h。滴加ecl显色液,采用化学发光成像仪检测条带。
(8)亚类测定方法
采用单抗亚类鉴定试剂盒(igg1\igg2a\igg2b\igg3\igm\iga)(北京博奥龙免疫技术有限公司,bf06001)鉴定杂交瘤细胞产生抗体的亚类。
(9)腹水效价测定
每孔加入100μlcadv-1抗原,4℃包被过夜。用pbst洗去未结合的抗体后加入3%bsa,于37℃恒温培养箱中孵育2h。pbst冲洗掉多余的封闭液后,每孔加入100μl杂交瘤上清,于37℃恒温培养箱中孵育1h。pbst洗3次。采用goatanti-dogigg(hrp)(1∶3000稀释)作为二抗,每孔0.1ml,37℃孵育1h。pbst洗3次;每孔加入50μltmb显色液,反应10分钟后测od(双波长450,630),记录数据。
1.2多克隆抗体的制备
(1)免疫动物
试验动物选用健康洁净级新西兰大白兔,均为3月龄(3只均购自长春宏达动物中心)。首免用弗氏完全佐剂充分乳化免疫原,2免、3免均用弗氏不完全佐剂与免疫原充分乳化,免疫剂量均为500μg/只,背部皮下多点注射,免疫间隔为14d。3免结束10天后对实验兔耳缘静脉采血并测定血清效价。比较各组血清的效价,选择效价高的实验兔的血清,开展后续实验。
(2)测定多克隆抗体效价
用间接elisa法检测多克隆抗体效价。用包被液将cadv-1加入elisa反应板,每孔50μl,4℃包被过夜。包被液弃掉后,用pbst洗板,连续5次,每次间隔5min,轻拍反应板至没有明显水珠,用脱脂奶粉和pbst配置浓度为5%的封闭液,每孔加入封闭液200μl,37℃恒温培养箱中封闭1h。孵育一抗:孵育一抗前先用pbst洗板,连续5次并拍干,用5%的脱脂乳稀释兔源多抗血清(稀释范围1:1000~1:128000),作为一抗,每个孔加入50μl稀释后的一抗,37℃恒温培养箱孵育30min,阴性对照采用未免疫的血清。洗板5次并拍干,去除多余pbst,将羊抗兔igg稀释至1:5000,每孔50μl,加入96孔板,37℃恒温培养箱中反应30min。pbst洗板,连续5次,轻轻拍板去除多余pbst,加入tmb显色液,每孔50μl,室温条件下避光反应10min。加入25μlh2so4(2mol/l)终止显色。采用酶标仪在450nm处测定od。
(3)兔源多克隆抗体(hrp)标记
采用hrp标记试剂盒(北京博奥龙免疫技术有限公司,bf06095-1000)。抗体调整到浓度2mg/ml,加入1/10体积的标记缓冲液,充分混匀,避免产生气泡。取等质量辣根过氧化酶到待标记物中,充分混匀,避免产生气泡,室温避光反应3小时。取适量的反应终止液加入标记反应管中,比例为每10μl反应液加入1μl反应终止液。充分混匀,室温放置1h。加入等体积的标记物保存液,充分混匀,置于-20℃保存。
2.试验结果
2.1cadv-1抗原的制备
cadv-1感染mdck后,连续传代,大量培养。病毒液经过超滤管浓缩,获得7mg/ml的蛋白,如图1所示,可用于免疫。
2.2血清效价
如表1所示,根据血清效价,选择效价最高的cadv-1-4#的小鼠进行细胞融合实验。
表1免疫后小鼠血清效价检测结果
2.3细胞株筛选结果
将14株阳性的细胞株,用cadv-1包板,采用elisa方法,再一次筛选,发现5株阳性细胞株(表2)。
表2细胞株筛选结果
2.4亚类测定结果
对5株阳性细胞株进行亚类鉴定,其中1株为igg1型杂交瘤细胞株(表3)。
表3细胞株亚型鉴定结果
2.5单抗和多抗的westernblot鉴定
本发明选择细胞编号为5的杂交瘤细胞株开展本实验。小鼠源单抗和兔源多抗均可与0h,12h,36h收集的cadv-1感染的细胞产生特异性条带(图2)。
试验例1双抗体夹心elisa检测犬i型腺病毒的检测方法的建立及检测条件的优化
1.cadv-1双抗体夹心elisa检测方法的建立
将单抗包被酶标板,4℃过夜。pbst洗板3次。加入5%的脱脂乳封闭2h。加入待检测的30份cadv-1阴性样品,37℃孵育1h。pbst洗板3次。加入稀释的酶标多克隆抗体,37℃孵育1h。tmb显色液显色15min。终止显色后,采用酶标仪在450nm检测od值
对实验条件进行优化后,检测30份cadv-1阴性样品,记录30份样品od450的值,通过计算平均值为0.269,标准差为0.032,根据公式计算阴阳性样品的临界值(阴阳性临界值=mean+3sd)为0.366。
1.2cadv-1双抗体夹心elisa反应条件的优化
(1)包被抗体和酶标抗体的最佳浓度筛选
采用方阵滴定法将单抗稀释至17μg/ml、8.6μg/ml、4.3μg/ml,2.15μg/ml,1.075μg/ml,0.5375μg/ml,0.26μg/ml共7个浓度,分别包被96孔板,以1:500,1:1000,1:2000,1:4000,1:8000的稀释度稀释酶标抗体。将不同梯度的单抗包被酶标板,4℃过夜。pbst洗板3次。加入5%的脱脂乳封闭2h。加入抗原,37℃孵育1h。pbst洗板3次。加入不同稀释度的酶标二抗,37℃孵育1h。tmb显色液显色15min。终止显色后,采用酶标仪在450nm检测od值,确定包被抗体和酶标抗体的最佳稀释度。
(2)最适包被时间的筛选
根据方法(1)确定的最佳抗体包被浓度,包被酶标板。包被时间分别选择2h,3h,4h和4℃过夜。加入抗原,37℃孵育1h。pbst洗板3次。根据方法(1)确定的最佳酶标抗体浓度,37℃孵育1h。tmb显色液显色15min。终止显色后,采用酶标仪在450nm检测od值,确定抗体的最佳包被时间。
(3)封闭液的选择
根据方法(1)确定的最佳单抗包被浓度,根据方法(2)确定的最佳包被时间,包被酶标板。选择3%bsa,1%明胶,1%酪蛋白和5%脱脂乳作为封闭液,37℃条件下作用2h。加入抗原,37℃孵育1h。pbst洗板3次。根据方法(1)确定的最佳酶标抗体浓度,37℃孵育1h。tmb显色液显色15min。终止显色后,采用酶标仪在450nm检测od值,确定最适封闭液。
(4)优化封闭时间
根据方法(1)确定的最佳单抗包被浓度,根据方法(2)确定的最佳包被时间,包被酶标板。根据方法(3)确定的最佳封闭液,选择0.5h、1h、1.5h和2h,37℃封闭。加入抗原,37℃孵育1h。pbst洗板3次。根据方法(1)确定的最佳酶标抗体浓度,37℃孵育1h。tmb显色液显色15min。终止显色后,采用酶标仪在450nm检测od值,确定最适封闭时间。
(5)抗原孵育时间的确定
根据方法(1)确定的最佳单抗包被浓度,方法(2)确定的最佳包被时间,包被酶标板。采用方法(3)确定的最佳封闭液,方法(4)确定的最佳封闭时间,37℃封闭。加入抗原,37℃孵育0.5h、1h、1.5h和2h。pbst洗板3次。根据方法(1)确定的最佳酶标抗体浓度,37℃孵育1h。tmb显色液显色15min。终止显色后,采用酶标仪在450nm检测od值,确定最适抗原孵育时间。
(6)酶标抗体反应条件
根据方法(1)确定的最佳单抗包被浓度,方法(2)确定的最佳包被时间,包被酶标板。方法(3)确定的最佳封闭液,方法(4)确定的最佳封闭时间,37℃封闭。根据方法(5)确定的最优抗原孵育时间,37℃孵育抗原。pbst洗板3次。根据方法(1)确定的最佳酶标抗体浓度,37℃孵育0.5h、1h、1.5h和2h。tmb显色液显色15min。终止显色后,采用酶标仪在450nm检测od值,确定酶标抗体的最适孵育时间。
(7)阴阳性临界值的确定
采用优化后的双抗夹心elisa方法检测30份cadv-1阴性样本,并计算30份样品od450的平均值(mean)和标准差(sd),根据公式计算阴阳性样品的临界值(阴阳性临界值=mean+3sd)。
(8)重复性试验
板间重复性实验:以同一批次纯化的cadv-1单抗包被的酶标板,采用优化后的实验条件,检测10份阳性和2份阴性样品,每份样品做3个平行对照,并分析所得数据,获得批内差异值。板内重复性实验:以不同批次纯化的cadv-1单抗包被酶标板,采用优化后的实验条件,检测10份阳性和2份阴性样品,每份样品做3个平行对照,对所得数据进行统计分析,获得批间差异值。变异系数(coefficientofvariation,cv)=(标准差/平均值)×100%。
(9)敏感性试验
根据筛选的elisa反应条件,将cadv-1f1301株10倍倍比稀释,每个稀释倍数设置3个重复,elisa检测均设置阴阳性对照,根据检测结果确定可检测cadv-1阳性样本的最大稀释倍数,从而对比两种检测方法的敏感性。
(10)特异性试验
采用优化后的双抗夹心elisa方法检测犬瘟热病毒(cdv)和犬细小病毒(mev)。每份样品设置3个重复,同时以cadv-1作为阳性对照,以pbs作为阴性对照。采用酶标仪在450nm检测od值。通过比较样品od450值与临界值的大小,判断检测样品的阴阳性。
(11)双抗夹心elisa检测方法与rt-pcr的对比试验
分别采用rt-pcr和优化后的cadv-1双抗夹心elisa方法检测本实验室保存的70份样品,计算cadv-1双抗夹心elisa法与rt-pcr法检测结果的特异性、符合率和敏感性。
2.试验结果
2.1捕获抗体和酶标抗体的最佳稀释浓度
经棋盘法测定,鼠源cadv-1单抗的最佳包被浓度为2.15μg/ml,hrp标记的兔源多抗的稀释倍数为1:2000,此时的p/n值为4.219(表4)。
表4抗体最佳工作浓度
2.2最适包被条件的确定
通过实验,如下表5所示,与包被4h,3h,2h的酶标板相比,4℃包被过夜的酶标板检测样品的p/n值较高。因此,确定包被条件为4℃包被过夜(表5,图3)。
表5最适包被条件
2.3确定最适封闭液和最佳封闭时间
比较5%的脱脂乳、3%的bsa、1%的酪蛋白和1%的明胶在相同的封闭时间内的封闭效果,结果表明,用5%的脱脂乳封闭时,检测样品的p/n值最大,达到10.49。因此,5%的脱脂乳的封闭效果最好(表6,图4),最佳封闭时间为1h(表7,图5)。
表6最佳封闭液的选择
表7最佳封闭时间筛选
2.4样品孵育时间的确定
如表8和图6所示,抗原的最佳孵育时间是1h。
表8最佳孵育时间的确定
2.5酶标抗体的最佳作用时间筛选
如表9和图7所示,随着酶标抗体孵育时间的增加,p/n值在0.5h-2h内先上升后下降。在1h时,p/n值达到最高。因此,酶标抗体的最适孵育时间为1h(表9,图7)。
表9抗体最佳作用时间筛选
2.6阴阳性临界值的确定
对实验条件进行优化后,检测30份cadv-1阴性样品,记录30份样品od450的值,通过计算平均值为0.269,标准差为0.032,根据公式计算阴阳性样品的临界值(阴阳性临界值=mean+3sd)为0.366。
2.7重复性试验
2.7.1批间重复性实验结果
取不同批次的5块elisa酶标板,加入cadv-1,同时设置阴性对照和空白对照各3孔,结果发现批间变异系数低于10%,具备较好的批间重复性(表10)。
表10批间重复性结果表
2.7.2批内重复性实验结果
取同一批次的5块elisa酶标板,加入cadv-1,同时设置空白对照和阴性对照。如表11所示,变异系数在批内小于5%,具有较好的批内重复性。
表11批内重复性实验结果
2.8敏感性试验
将tcid50为108的cadv-1,按照10-1,10-2,10-3,10-4,10-5,10-6,10-7稀释,检验已建立的双抗夹心elisa检测方法的敏感性,结果表明,最高稀释倍数为10-6,100个tcid50的病毒,结果如表12所示。
表12双抗夹心elisa检测方法的敏感性
2.9特异性试验
经过验证,结果表明只有cadv-1呈阳性,体现了该方法良好的特异性,结果如表所示(表13)。
表13双抗夹心elisa检测方法的特异性
2.10双抗夹心elisa结果与rt-pcr结果的符合率
为确定双抗夹心检测方法的准确率,以rt-pcr法验证双抗夹心elisa方法。结果显示,70份样品中,双抗夹心elisa法检测阳性47份,阴性23份,而rt-pcr检测的阳性样品为48份,阴性样品为22份。两者均检出47份,阴性为22份,敏感性为93.75%,特异性为90.9%,符合率为92.86%(表14)。体现了该方法较好的准确率,可用于临床样品的检测。
表14双抗夹心elisa结果与rt-pcr结果的符合率
试验例3单克隆抗体的应用试验
一.westernblot检测
1.收集蛋白样品
2.电泳
(1)sds-page凝胶配制
(2)样品处理
在收集的蛋白样品中加入适量浓缩的sds-page蛋白上样缓冲液。100℃或沸水浴加热3-5分钟,以充分变性蛋白。
(3)上样与电泳
冷却到室温后,把蛋白样品直接上样到sds-page胶加样孔内即可。通常电泳时溴酚蓝到达胶的底端处附近即可停止电泳。
3.转膜
选用pvdf膜。用bio-rad的半干转膜装置,电压24v,时间15min.
4.封闭
转膜完毕后,立即把蛋白膜放置到预先准备好的tbst中,漂洗1-2分钟,以洗去膜上的转膜液。加入5%的脱脂奶粉封闭液,4℃封闭过夜。
5.一抗孵育
将抗体按照1:100稀释一抗。tbst洗涤5-10分钟。共洗涤3次。
6.二抗孵育
山羊抗小鼠二抗,按照1:2000稀释,室温孵育1小时,tbst洗涤5-10分钟。
7.蛋白检测(detectionofproteins)
滴加ecl显色液,采用化学发光仪显色,检测蛋白,检测结果见图8。
二、免疫荧光
1.细胞种板与细胞爬片制备:
1)细胞密度在90%-95%左右,用预热胰酶消化细胞后重悬细胞于完全培养基中,充分吹打,使之成单细胞悬液,计数。
2)取细胞培养12孔板,在每个孔放爬片的位置根据爬片的大小,先在每个孔里准备放爬片的位置滴几滴培养基,然后将爬片置于液滴上,压紧,使爬片与培养皿靠培养基的张力粘合到一起,防止加细胞悬液时爬片漂起,造成双层细胞贴片。根据自己的需要选择合适的细胞密度种入12孔板培养板内。
3)24h后,根据细胞生长速度快慢,观察判断细胞密度,约90%时进行细胞免疫荧光。
2.细胞的固定及免疫荧光
1)吸除培养基,一般先加入pbs浸洗细胞3次,每次5min。
2)向孔内加入4%多聚甲醛1ml,进行细胞固定,室温固定20分钟。
3)吸去多聚甲醛,使用pbs浸洗3次,每次5min。
4)向孔内加入0.5%tritonx-100(pbs配制)室温通透20min,目的是使细胞通透。
5)除去tritonx-100,使用pbs浸洗3次,每次5min。
6)用10%的与二抗同源的山羊血清(pbs配制)或者5%bsa封闭2小时(选择的封闭液与后面操作过程中抗体稀释液一致)。封闭后不需要用pbs清洗。
7)吸去封闭液,向每孔滴加足够量适宜浓度的一抗(第一次使用抗体可以根据抗体说明书推荐浓度,后续实验可以摸索抗体的适宜浓度),4℃湿盒内孵育过夜。
8)吸去一抗,使用pbs浸洗3次,每次5min。
9)向孔内滴加足够量适宜浓度的二抗,37℃,室温避光孵育1小时。注意二抗带有荧光素标记,因此操作过程尽量在暗处进行。
10)吸去二抗,使用pbs浸洗3次,每次5min。
11)向玻片上滴加dapi,或者hoechst,复染细胞核,一般为蓝色荧光;避光孵育5-10min。
12)使用pbs轻洗细胞3次,每次5min,洗去多余的dapi。
13)取爬片时,由于爬片与培养皿底结合较紧,张力较大,可将注射器针头针尖向背面做个小钩,这样将爬片轻轻勾起,用小镊子取出即可。
14)用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,注意将爬片反过来贴于多聚赖氨酸载玻片上,然后在荧光显微镜下观察并采集图像,注意选择抗体对应的激发光源。
检测结果见图9。
三、组织免疫荧光检测
1.将湿纸巾铺于载玻片盒底部做成加湿盒,由冰冻切片仪中取出载有切片的载玻片,放入湿盒中(每边放6片),湿盒中的载玻片勿相互接触。
2.待载玻片达室湿且未干时,铺加pbs于切片上(勿溢出玻片)。
3.稀释的第一抗体于4℃用微量离心机以13500g离心2min(每一载玻片上加40~50μl抗体,应能盖住切片)。
4.用与泵相连的巴斯德吸管,在切片的一端吸去玻片上的pbs,并从另一端加上抗体,盖上加湿盒,室温温育1h。
5.以pbs洗玻片3次(5min/次),从切片一端加入新的pbs缓冲液,由另一端吸去旧的缓冲液。
6.稀释的第二抗体于4℃用微量离心机以13500g离心2min(每载玻片可加40~50μl抗体)。
7.将第二抗体加于切片上,置加湿盒中室温温育1h,以pbs洗玻片3次(5min/次)。
8.将盖玻片放于纸巾上,滴加1滴gelvatol于盖玻片中央。翻过载玻片放于盖玻片上(勿施压),将玻片置工作台上,用铝箔覆盖避光放置30min,使gelvatol凝结。
9.显微镜下观察结果,或置玻片盒中贮存于4℃冰箱。
检测结果见图10。
- 还没有人留言评论。精彩留言会获得点赞!