一种苯并呋喃类化合物的合成方法
1.本发明属于有机化学合成领域,具体涉及一种苯并呋喃类化合物的合成方法。
背景技术:
2.苯并呋喃骨架是许多具有生物活性的天然产物和治疗性产品中的一个常见部分。同时,含有苯并呋喃的骨架结构是药物研究的重要目标,经过不同取代基修饰之后可作为非常重要的杂环药效团,包括在临床和临床前研究中被定义的候选药物,可具有如抗hiv、抗癌、抗抑郁,抗心律失常等功效。鉴于杂环芳烃化合物起着重要的作用,对于合成具有生物活性如苯并呋喃类化合物的一般方法已经成为有机合成化学工作者关注的焦点。
3.硫叶立德由于其制备简单、操作安全等优点,在过渡金属催化下的有机转化中被广泛用作卡宾的替代物。硫叶立德参与的过渡金属催化c
‑
h活化和环化方面的反应备受关注。在铱、铑、钌、钴、钯和其他金属催化体系下,已开发出多种含卡宾的方法来实现芳烃的酰甲基化,合成多种如吲哚、喹啉、吡咯、嘧啶和其他杂环化合物。
4.经检索,发现以下文献涉及硫叶立德参与的环化偶联合成含氧杂环类化合物:
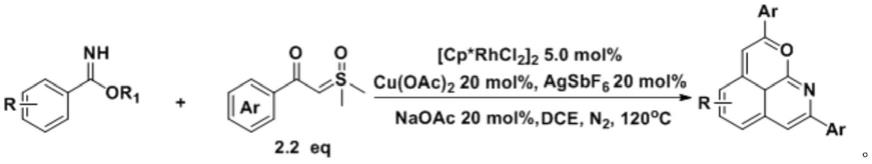
5.1.jiang cheng课题组(wu,x.p.;xiong,h.;sun,s.;cheng,j. rhodium
‑
catalyzed relay carbenoid functionalization of aromatic c
‑
h bonds toward fused heteroarenes[j].org.lett.2018,20,1396
‑
1399.)报道了一种铑催化的亚胺酸酯和硫叶立德的双官能化/环化反应。具体条件以五甲基环戊二烯基合铑(iii) 二聚体为催化剂,六氟锑酸银、无水醋酸铜及无水醋酸钠为辅助添加剂,1,2
‑ꢀ
二氯乙烷为溶剂,在氮气氛围120℃下反应。所得的c
‑
h官能化和双环化的吡喃[4,3,2
‑
ij]异喹啉具有良好的产率。因其目标产物为稠环化合物,硫叶立德用量较多,所需2.2个当量;
[0006][0007]
2.hequan yao课题组(cai,l.b.;zhu,x.y.;chen,j.y.;lin,a.j.;yao,h.q. rh(iii)
‑
catalyzed c
–
h activation/annulation of salicylaldehydes with sulfoxonium ylides for the synthesis of chromones[j].org.chem.front.2019,6,3688
‑
3692.)报道了rh(iii)催化水杨醛与硫叶立德c
‑
h活化/环化反应构建色酮类化合物的合成方法。该反应以硫叶立德及水杨醛为起始底物,二氯(五甲基环戊二烯基)合铑 (iii)二聚体为催化剂,三氟甲烷磺酸银为氧化剂,特戊酸为添加剂,在四氢呋喃溶剂中于100℃条件下反应7个小时,以较高收率得到色酮衍生物,缺点是要使用当量的添加剂;
[0008][0009]
3.lutz ackermann课题组(liang,y.f.;yang,l.;rogge,t.;ackermann,l. ruthenium(iv)intermediates in c
‑
h activation/annulation by weak o
‑
coordination [j].chem.eur.j.2018,24,16548
–
16552.)报道了钌(iv)中间体在c
‑
h活化/环化反应中的弱o
‑
配位作用。该方法采用水杨醛和硫叶立德为反应的起始底物,以二氯双(4
‑
甲基异丙基苯基)钌(ii)为催化剂,六氟锑酸银为氧化剂,三乙胺为辅助剂,在1,2
‑
二氯乙烷溶剂中于100℃下反应16小时,高效的得到香豆素内酯类化合物;
[0010][0011]
4.xingwei li课题组(wang,p.y.;xu,y.w.;sun,j.q.;li,x.w. rhodium(iii)
‑
catalyzed chemo
‑
divergent couplings of sulfoxonium ylides with oxa/azabicyclic olefins[j].org.lett.2019,21,8459
‑
8463.)报道了铑(iii)催化硫叶立德与氧代/氮杂双环烯烃的偶联反应。该方法运用铑(iii)络合物为催化剂,在二氯甲烷为溶剂,氮气氛围70℃条件下反应36小时可实现两底物的[4+2]环化反应;
[0012][0013]
5.kandikere,r.p.课题组(vinayak,h.;anil,k.;kandikere,r.p.synthesis of naphthols by rh(iii)
‑
catalyzed domino c
‑
h activation,annulation,and lactonization using sulfoxonium ylide as a traceless directing group[j].org.lett.2019,21, 8424
‑
8428.)报道了一种铑(iii)催化硫叶立德的定向c
‑
h活化、环化,旨在高效地合成萘酚的反应新策略。该反应通过4
‑
羟基
‑2‑
炔酸盐和硫叶立德为反应起始底物,以五甲基环戊二烯基合铑(iii)二聚体为催化剂,双三氟甲烷磺酰亚胺银盐、氯乙酸为辅助添加剂,在乙酸乙酯溶液中于80℃下反应16小时,该方法具有广范的底物普适性;
[0014][0015]
上述合成方法并没有涉及硫叶立德参与的苯并呋喃类化合物的合成且上述方法均采用贵金属催化剂,贵金属催化环化偶联给工业化生产增加了相应的运营成本,经济实用性受到了相应的限制。
技术实现要素:
[0016]
本发明的目的是为了克服现有技术存在的缺点和不足,而提供一种苯并呋喃类化合物的合成方法。
[0017]
本发明所采取的技术方案如下:一种苯并呋喃类化合物的合成方法,其化学反应式如下:
[0018][0019]
化学反应式中,(a)所示的化合物和(b)所示的化合物在过渡金属催化剂和碱的作用下在有机溶剂中反应;
[0020]
所述过渡金属催化剂为酞菁铁;
[0021]
所述碱为碳酸钾、碳酸钠、碳酸铯中的一种或多种;
[0022]
反应温度为80℃以上。
[0023]
所述酞菁铁的添加量为(a)所示的化合物的5mol%以上。
[0024]
所述酞菁铁的添加量为(a)所示的化合物的10mol%以上。
[0025]
所述碱为碳酸钾。
[0026]
所述碱的添加量为(a)所示的化合物的50mol%以上。
[0027]
所述碱的添加量为(a)所示的化合物的200mol%。
[0028]
所述溶剂为thf、dmf、dce、甲苯、丙腈、乙醇中的一种或多种。
[0029]
所述溶剂为thf。
[0030]
反应温度为100℃以上。
[0031]
本发明的有益效果如下:反应体系采用经济、高效的酞菁铁作为催化剂,具有起始原料廉价易得、反应条件温和、底物范围广具有广阔的工业应用前景等优点。
附图说明
[0032]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,根据这些附图获得其他的附图仍属于本发明的范畴。
[0033]
图1为本发明的化学反应式;
[0034]
图2为实施例1所制备产物的x
‑
衍射单晶结构。
具体实施方式
[0035]
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。以下所揭露的仅为本发明较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
[0036]
本发明提供了一种苯并呋喃类化合物的合成方法,其化学反应式如下:
[0037][0038]
化学反应式中,(a)所示的化合物和(b)所示的化合物在过渡金属催化剂和碱的作用下在有机溶剂中反应;
[0039]
所述过渡金属催化剂为酞菁铁;
[0040]
所述碱为碳酸钾、碳酸钠、碳酸铯中的一种或多种;
[0041]
反应温度为80℃以上。
[0042]
在本发明的一些实施例中和对比例中,分别采用酞菁铁、氯化铁、二茂铁、醋酸亚铁、乙酰丙酮亚铁、柠檬酸铁、酞菁铜,二氧化钛等金属催化剂和酞菁、曙红b、溶剂红43,荧光素等非金属催化剂进行反应,发现仅有酞菁铁可以使反应成功进而得到产物。
[0043]
在本发明的一些实施例中和对比例中,分别采用碳酸钾、碳酸锂、碳酸钠、碳酸铯、醋酸钠、叔丁醇钾、三乙胺及三乙烯二胺等碱进行反应,发现碳酸钠、碳酸铯的加入可以实现一定的收率,碳酸钾的加入可以实现较高的收率。
[0044]
在本发明的一些实施例中和对比例中,分别采用thf、dmso、dmf、dce、 toluene、etcn,etoh等溶剂进行反应,当用dmso作溶剂时,反应是失败的,以thf作为溶剂,收率最高,其余溶剂可以获得一定量的产物。
[0045]
在本发明的一些实施例中和对比例中,分别采用室温、80℃、90℃、100℃、120℃的条件进行反应,在80℃及室温下反应12h,无法获得产物,在80℃增加反应时间至24小时可以获得少量的产物,之后温度越高,收率越高,考虑溶剂的沸点较低,可以适当的降低反应的温度,相应的增加反应时间。在以下实施例中,反应容器设置在油浴锅中,在本文中,所述的温度指代反应容器外的温度,即为油浴锅的温度。
[0046]
在本发明的一些实施例中,分别采用5mol%、10mol%、20mol%、30mol%的酞菁铁,均可获得产物,酞菁铁的用量为10mol%,收率基本达到最高,再增加酞菁铁的用量不会明显增加产物的收率。
[0047]
在本发明的一些实施例中,分别采用0.5eq、1eq、2eq、3eq的碳酸钾,均可获得产物,碳酸钾的用量为2eq,收率基本达到最高,再增加碳酸钾的用量不会明显增加产物的收率。
[0048]
在本发明的一些实施例中,分别采用不同取代基的底物进行反应,均可获得产物,验证了本发明的技术方案具有底物范围广的特点。
[0049]
以下为本发明的一些实施例,具体操作如下:
[0050]
原料硫叶立德合成的操作步骤:
[0051][0052]
一般操作步骤:将叔丁醇钾(3.0g,27.2mmol)和thf(30ml)加入干燥的50ml圆底烧
瓶中,室温下搅拌10分钟后,添加碘化三甲基亚砜(5.0g, 20.6mmol),并在回流下搅拌所得混合物2h。随后,将反应冷却至0℃,并将酰氯(7mmol)逐滴添加到反应混合物中。反应在室温下进行,搅拌3h。反应完成后,在真空下蒸发溶剂,用水和乙酸乙酯萃取得到混合液。分离出的有机层先用饱和盐水洗涤然后再使用无水na2so4干燥。待溶剂挥发后,使用 etoac/meoh(95:5)的硅胶层析柱纯化粗品,得到相应的硫叶立德产物。
[0053]
fe]催化合成酰化苯并呋喃的操作步骤:
[0054][0055]
一般操作步骤:在干燥的schlenk管中加入水杨醛衍生物(0.2mmol),硫叶立德(0.24mmol),fe
ii
pc(10mol%),k2co3(2.0eq),thf(2.0ml)。然后,将此反应混合液放入100℃的油浴锅中搅拌18小时,反应结束后,tlc或gc
‑
ms 追踪反应情况,冷却至室温,加入适量的乙酸乙酯洗涤,有机相通过旋转蒸发仪减压蒸馏,使用100
‑
200目硅胶拌样,用200
‑
300目或300
‑
400目硅胶柱层析,干法上样,乙酸乙酯:石油醚=1:20淋洗,浓缩得到目标产物。
[0056]
以下实施例和对比例为以水杨醛1a与硫叶立德2a为反应的底物合成苯并呋喃类化合物的反应条件筛选。
[0057][0058]
反应条件如下:1a(0.2mmol),2a(0.24mmol),在催化剂和碱的作用下在溶剂中反应,反应在空气中进行,收率为通过gc
‑
ms检测产物浓度,然后基于化合物1a计算所得。
[0059]
[0060][0061]
以下实施例为采用不同官能团取代的水杨醛作为底物进行反应得到的产物及收率。反应条件为水杨醛类化合物(0.2mmol),硫叶立德(0.24mmol),fe
ii
pc (10mol%),k2co3(2.0eq),thf(2.0ml),100℃,18h。可以发现反应体系普适性较广,底物可以兼容不同官能团取代的水杨醛。当以水杨醛和硫叶立德为反应底物时,能以79%的收率得到目标产物3aa。而对于甲基、甲氧基取代的水杨醛,其相对应的产物收率均在80%以上(3ab
‑
3ad)。对于卤素取代的水杨醛,底物也能够较好的兼容(3ae
‑
3aj),其中5
‑
cl代水杨醛对应的目标产物(3ai) 的收率最高,最高可达91%。
[0062][0063][0064]
以下实施例为采用不同官能团取代的硫叶立德作为底物进行反应得到的产物及收率。反应条件为水杨醛(0.2mmol),硫叶立德类化合物(0.24mmol),fe
ii
pc (10mol%),k2co3(2.0eq),thf(2.0ml),100℃,18h。可以发现反应体系普适性较广,底物可以兼容各种官能团。供电基、吸电基、卤素、稠环及杂化硫叶立德均能高效的获得相应的目标产物。对于供电的邻、间、对位取代的甲基、甲氧基对位取代、氮氮二甲基取代的硫叶立德,相应的目标产物均有较高的收率 (3ba
‑
3be),空间位阻效应影响不大(3ba)。对于三氟甲基取代的硫叶立德其底物可兼容,但其收率不高(3bf)。卤素(f、cl、br)取代的硫叶立德以较高的收率得到相应的目标产物(3bh
‑
3bj)。苯基、α
‑
萘,噻吩取代的硫叶立德,底物的兼容性较广,均能以中等以上收率得到相对应的目标产物(3bk
‑
3bm)。
[0065][0066][0067]
[0068]
[fe]催化合成酰化苯并呋喃反应体系,该反应体系以水杨醛和硫叶立德衍生物为起始原料,酞菁铁(ii)为催化剂,碳酸钾为添加剂,在四氢呋喃中反应。反应体系采用经济、高效的酞菁铁作为催化剂,具有起始原料廉价易得、反应条件温和、底物范围广具有广阔的工业应用前景等优点。
[0069]
以下为上述反应所得产物的数据表征。
[0070][0071]
compound 3aa benzofuran
‑2‑
yl(phenyl)methanone.white solid.1h nmr(400mhz,cdcl3):δ 8.07
‑
8.01(m,2h),7.74
‑
7.70(m,1h),7.66
‑
7.61(m,2h),7.58
‑
7.48(m,4h),7.35
‑
7.30(m,1h);
13
c nmr(100mhz,cdcl3):δ184.4,156.1,152.2,137.3,133.0,129.5,128.5,128.4,127.0,124.0, 123.3,116.5,112.6.this compound is known:pashikanti,g.;lahu,n.c.;rambabu,c.;srivari,c.j.org. chem.2018,83,3325
‑
3332.
[0072][0073]
compound 3ab(5
‑
methylbenzofuran
‑2‑
yl)(phenyl)methanone.white solid.1h nmr(500mhz, cdcl3):δ8.03(d,j=8.5hz,2h),7.64(t,j=14.5hz,1h),7.54
‑
7.51(m,3h),7.48(s,1h),7.45(s, 1h),7.31(d,j=8.5hz,1h),2.46(s,1h).
13
c nmr(125mhz,cdcl3):δ184.5,154.7,152.6, 137.5,133.7,132.9,130.1,129.6,128.6,127.3,122.8,116.4,112.2,21.4.this compound is known:xuan,q.q.;kong,w.g.;song,q.l.j.org.chem.2017,82,7602
‑
7607.
[0074][0075]
compound 3ac(7
‑
methoxybenzofuran
‑2‑
yl)(phenyl)methanone.white solid.1h nmr(300 mhz,cdcl3):δ8.01(d,j=7.3hz,2h),7.68
‑
7.57(m,2h),7.52(t,j=7.5hz,2h),7.42(t,j= 8.2hz,1h),7.25(t,j=5.9hz,1h),6.69(d,j=8.0hz,1h),3.95(s,3h).
13
c nmr(75mhz, cdcl3)δ184.2,157.2,155.1,151.0,137.4,132.7,129.6,129.4,128.5,118.1,114.8,105.3,103.6, 55.7.this compound is known:xuan,q.q.;kong,w.g.;song,q.l.j.org.chem.2017,82, 7602
‑
7607.
[0076][0077]
compound 3ad(5
‑
methoxybenzofuran
‑2‑
yl)(phenyl)methanone.white solid.1h nmr(400 mhz,cdcl3):δ8.06(d,j=8.0hz,2h),7.63(t,j=8.0hz,1h),7.55
‑
7.51
(m,3h),7.48(s,1h), 7.14
‑
7.11(m,2h),3.87(s,3h).
13
c nmr(100mhz,cdcl3)δ184.2,156.7,153.0,151.2,137.3, 132.8,129.5,128.5,127.5,118.5,116.4,113.2,104.0,55.9.this compound is known:xuan,q.q.; kong,w.g.;song,q.l.j.org.chem.2017,82,7602
‑
7607.
[0078][0079]
compound 3ae(7
‑
fluorobenzofuran
‑2‑
yl)(phenyl)methanone.white solid.1h nmr(500mhz, cdcl3):δ8.09(d,j=7.0hz,2h),7.65(t,j=7.5hz,1h),7.59(d,j=2.5hz,1h),7.55(t,j=8.0 hz,2h),7.50(dd,j=7.5,0.5hz,1h),7.29
‑
7.21(m,2h).
13
c nmr(125mhz,cdcl3):δ183.9, 153.6,149.5,147.5,143.5,143.4,136.9,133.3,130.6,130.5,129.8,128.8,124.7,124.7,118.9, 118.9,116.0,114.2,114.1.this compound is known:xuan,q.q.;kong,w.g.;song,q.l.j. org.chem.2017,82,7602
‑
7607.
[0080][0081]
compound 3af(5
‑
fluorobenzofuran
‑2‑
yl)(phenyl)methanone.white solid.1h nmr(500mhz, cdcl3):δ8.0(d,j=7.0hz,2h),7.65(t,j=7.5hz,1h),7.6
‑
7.5(m,3h),7.50(s,1h),7.37(dd,j =8.0,2.5hz,1h),7.23(td,j=9.0,2.5hz,1h).
13
c nmr(125mhz,cdcl3):δ184.2,160.7, 158.8,153.9,152.4,137.1,133.2,129.6,128.7,127.9,127.8,116.9,116.7,116.2,116.1,113.7, 113.6,108.4,108.2.this compound is known:cheng,x.f.;peng,y.;wu,j.;deng,g.j.org. biomol.chem.2016,14,2819
‑
2823.
[0082][0083]
compound 3ag(7
‑
chlorobenzofuran
‑2‑
yl)(phenyl)methanone.white solid.1h nmr(500mhz, cdcl3):δ8,09(d,j=7.5hz,2h),7.64
‑
7.46(m,6h),7.23(d,j=7.5hz,1h).
13
c nmr(125mhz, cdcl3):δ184.3,153.9,152.5,137.5,133.9,130.4,129.3,129.2,128.7,125.5,122.4,118.7,116.7. this compound is known:cheng,x.f.;peng,y.;wu,j.;deng,g.j.org.biomol.chem. 2016,14,2819
‑
2823.
[0084][0085]
compound 3ah(6
‑
chlorobenzofuran
‑2‑
yl)(phenyl)methanone.white solid.1h nmr(500mhz, cdcl3):δ8.02(d,j=7.5hz,2h),7.64(d,j=8.0hz,3h),7.54(t,j=8.0hz,
2h),7.49(s,1h), 7.31(d,j=8.0hz,1h).
13
c nmr(125mhz,cdcl3):δ184.1,156.1,153.1,137.1,134.4,133.2, 129.6,128.7,125.8,125.2,124.0,116.0,113.1.this compound is known:varma,r.s.j. heterocyclic chem.1999,36,1565
‑
1571.
[0086][0087]
compound 3ai(5
‑
chlorobenzofuran
‑2‑
yl)(phenyl)methanone.white solid.1h nmr(cdcl3,500mhz):δ 8.03(d,j=7.5hz,2h),7.70(s,1h),7.65(t,j=7.5hz,1h),7.53
‑
7.58(m,3h),7.44
‑
7.46(m,2h).
13
c nmr (cdcl3,125mhz):δ184.2,154.4,153.6,137.1,133.3,129.8,129.6,128.8,128.8,128.4,122.7,115.4,113.8. this compound is known:shang,y.g.;wang,c.;he,x.w.;ju,k.;zhang,m.;yu,s.y.;wu.j.p.tetrahedron. 2010,66,9629
‑
9633.
[0088][0089]
compound 3aj(5
‑
bromobenzofuran
‑2‑
yl)(phenyl)methanone.white solid.1h nmr(cdcl3,500mhz):δ 7.95(d,j=8.0hz,1h),7.78(s,1h),7.57(t,j=8.0hz,1h),7.43
‑
7.51(m,4h),7.38(s,1h).
13
c nmr(cdcl3, 125mhz):δ184.1,154.7,153.4,137.0,133.3,131.4,129.6,129.0,128.6,125.9,117.2,115.3,114.2.this compound is known:shang,y.g.;wang,c.;he,x.w.;ju,k.;zhang,m.;yu,s.y.;wu.j.p.tetrahedron.2010, 66,9629
‑
9633.
[0090][0091]
compound 3ba benzofuran
‑2‑
yl(o
‑
tolyl)methanone.white solid.1h nmr(500mhz,cdcl3):δ7.68(d,j= 8.0hz,1h),7.62(d,j=8.5hz,1h),7.56(d,j=8.0hz,1h),7.49(td,j=8.5,1.0hz,1h),7.43(td,j=7.5,1.0 hz,1h),7.33
‑
7.28(m,4h),2.44(s,3h).
13
c nmr(125mhz,cdcl3):δ187.0,156.4,152.8,137.5,137.5,131.4, 131.0,128.7,127.2,125.4,124.1,123.5,117.4,112.7,19.8.this compound is known:xu,w.g.;li,q.c.;cao, c.p.;zhang,f.l.;zheng,hua.org.biomol.chem.2015,13,6158
–
6161.
[0092][0093]
compound 3bb benzofuran
‑2‑
yl(m
‑
tolyl)methanone.white solid.1h nmr(500mhz,cdcl3):δ7.82(d,j= 6.0hz,2h),7.71(d,j=8.0hz,1h),7.63(d,j=8.5hz,1h),7.49
‑
7.39(m,4h),7.31(t,j=7.5hz,1h),2.44(s, 1h).
13
c nmr(125mhz,cdcl3):δ184.6,156.0,152.4,138.5,137.4,133.7,129.9 128.4,128.345,127.1,126.7, 124.0,123.4,
116.5,112.6,21.4.this compound is known:xu,w.g.;li,q.c.;cao,c.p.;zhang,f.l.;zheng, hua.org.biomol.chem.2015,13,6158
–
6161.
[0094][0095]
compound 3bc benzofuran
‑2‑
yl(p
‑
tolyl)methanone.white solid.1h nmr(500mhz,cdcl3):δ7.97(d,j= 8.0hz,2h),7.72(d,j=8.0hz,1h),7.63(d,j=8.5hz,1h),7.51
‑
7.47(m,2h),7.33(d,j=7.5hz,3h),2.46(s, 3h).
13
c nmr(125mhz,cdcl3):δ184.1,156.0,152.6,143.9,134.7,129.8,129.3,128.3,127.2,124.0,123.3, 116.1,112.6,21.8.this compound is known:pashikanti g.,lahu n.c.,rambabu c.,srivari c.j.org.chem. 2018,83,3325
‑
3332.
[0096][0097]
compound 3bd benzofuran
‑2‑
yl(4
‑
methoxyphenyl)methanone.white solid.1h nmr(500mhz,cdcl3):δ 8.02(d,j=9.0hz,2h),7.63(d,j=8.0hz,1h),7.54(d,j=8.5hz,1h),7.43(s,1h),7.39(t,j=7.5hz,1h), 7.23(t,j=8.0hz,1h),6.93(t,j=8.5hz,2h),3.81(s,3h).
13
c nmr(125mhz,cdcl3):δ182.8,163.8,155.9, 152.9,132.1,130.0,128.1,127.2,124.0,123.2,115.5,114.0,112.6,55.6.this compound is known:pashikanti,g.; lahu,n.c.;rambabu,c.;srivari,c.j.org.chem.2018,83,3325
‑
3332.
[0098][0099]
compound 3be benzofuran
‑2‑
yl(4
‑
(dimethylamino)phenyl)methanone.white solid.1h nmr(500mhz, cdcl3):δ8.11(d,j=9.0hz,2h),7.71(d,j=8.0hz,1h),7.62(d,j=8.0hz,1h),7.49(s,1h),7.45(t,j= 7.5hz,1h),7.31(t,j=7.5hz,1h),6.73(d,j=9.0hz,2h),3.01(s,6h).
13
c nmr(125mhz,cdcl3):δ182.2, 155.8,153.8,153.7,132.3,127.5,127.4,124.7,123.8,123.0,114.2,112.5,111.0,40.2.this compound is known: pashikanti,g.;lahu,n.c.;rambabu,c.;srivari,c.j.org.chem.2018,83,3325
‑
3332.
[0100][0101]
compound 3bf benzofuran
‑2‑
yl(4
‑
(trifluoromethyl)phenyl)
methanone.white solid.(500mhz,cdcl3):δ8.16(d,j=8.0hz,2h),7.81(d,j=8.0hz,2h),7.74(d,j=8.0hz,1h),7.54(d,j=8.5hz,1h),7.58(s,1h), 7.53(t,j=8.0hz,1h),7.36(t,j=8.5hz,1h).
13
c nmr(125mhz,cdcl3):δ183.2,156.3,152.1,140.3,134.5, 134.2,129.9,129.0,127.0,125.8,125.7,125.7,125.7,124.9,124.4,123.6,122.7,117.1,112.8.this compound is known:pashikanti,g.;lahu,n.c.;rambabu,c.;srivari,c.j.org.chem.2018,83,3325
‑
3332.
[0102][0103]
compound 3bg benzofuran
‑2‑
yl(2
‑
fluorophenyl)methanone.white solid.1h nmr(500mhz, cdcl3)δ7.71
‑
7.67(m,2h),7.61(d,j=8.5hz,1h),7.56(q,j=6.5hz,1h),7.45(s,1h), 7.33
‑
7.28(m,2h),7.21(t,j=8.5hz,9.0hz,1h).
13
c nmr(125mhz,cdcl3):δ181.8,161.3, 159.7,156.4,152.5,133.7,133.6,130.7,130.7,128.9,127.2,126.6,126.5,124.4,124.4,124.2, 123.6,117.0,116.7,116.6,112.7.this compound is known:richter,peter h.et al.eur.pat.appl. 1997,11,778274.
[0104][0105]
compound 3bh benzofuran
‑2‑
yl(4
‑
fluorophenyl)methanone.white solid.1h nmr(500mhz,cdcl3):δ1h nmr(500mhz,cdcl3)δ8.13(dd,j=8.5,3.0hz,2h),7.74(d,j=7.5hz,1h),7.64(d,j=8.5hz,1h),7.55(s, 1h)7.51(t,j=7.5hz,1h),7.34(t,j=7.5hz,1h),7.22(t,j=8.0hz,2h).
13
c nmr(125mhz,cdcl3):δ 182.8,166.9,164.9,156.1,152.5,133.6,133.5,132.4,132.3,128.6,127.1,124.2,123.4,116.3,116.0,115.8, 112.7.this compound is known:pashikanti,g.;lahu,n.c.;rambabu,c.;srivari,c.j.org.chem.2018,83, 3325
‑
3332.
[0106][0107]
compound 3bi benzofuran
‑2‑
yl(4
‑
chlorophenyl)methanone.white solid.1h nmr(500mhz,cdcl3):δ7.61 (d,j=7.5hz,1h),7.54(d,j=8.5hz,1h),7.47
‑
7.39(m,4h),7.32(t,j=7.5hz,1h),7.25
‑
7.23(m,1h).
13
c nmr(125mhz,cdcl3):δ184.0,156.57,152.2,137.6,132.0,131.9,130.5,129.5,129.1,127.2,126.7,124.3, 123.7,117.7,112.9.this compound is known:pashikanti,g.;lahu,n.c.;rambabu,c.;srivari,c.j.org.chem. 2018,83,3325
‑
3332.
[0108][0109]
compound 3bj benzofuran
‑2‑
yl(4
‑
bromophenyl)methanone.white solid.1h nmr(500mhz,cdcl3)δ7.95 (d,j=8.0hz,2h),7.73(d,j=7.5hz,1h),7.68(d,j=7.5hz,1h),7.63(d,j=8.5,1h),7.55(s,1h),7.51(t,j =7.5hz,1h),7.34(t,j=7.5hz,1h).
13
c nmr(125mhz,cdcl3):δ183.2,156.2,152.3,136.1,132.0,131.2, 128.7,128.2,127.1,124.3,123.5,116.5,112.7.this compound is known:pashikanti,g.;lahu,n.c.;rambabu, c.;srivari,c.j.org.chem.2018,83,3325
‑
3332.
[0110][0111]
compound 3bk[1,1'
‑
biphenyl]
‑4‑
yl(benzofuran
‑2‑
yl)methanone.white solid.1h nmr(500mhz,cdcl3):δ 8.15(d,j=8.5hz,2h),7.66
‑
7.71(m,6h),7.59(s,1h),7.48
‑
7.53(m,3h),7.43(t,j=7.5hz,1h),7.35(t,j= 7.5,1h).
13
c nmr(125mhz,cdcl3):δ183.9,156.1,152.6,145.9,140.0,136.0,130.3,129.1,128.4,128.3, 127.4,127.3,127.2,124.1,123.4,116.3,112.7.this compound is known:pashikanti,g.;lahu,n.c.;rambabu, c.;srivari,c.j.org.chem.2018,83,3325
‑
3332.
[0112][0113]
compound 3bl benzofuran
‑2‑
yl(naphthalen
‑1‑
yl)methanone.white solid.1h nmr(500mhz, cdcl3):δ8.27
‑
8.26(m,1h),8.03(d,j=8.0hz,1h),7.92
‑
7.91(m,1h),7.84(d,j=7.0hz,1h), 7.65(t,j=7.0hz,2h),7.56
‑
7.53(m,3h),7.50(t,j=7.5hz,1h).
13
c nmr(125mhz,cdcl3):δ 186.2,156.5,153.2,135.3,133.9,132.2,130.9,128.8,128.5,128.0,127.7,127.2,126.8,125.4, 124.4,124.1,123.6,117.7,112.8.this compound is known:xuan,q.q.;kong,w.g.;song,q.l.j. org.chem.2017,82,7602
‑
7607.
[0114][0115]
compound 3bm benzofuran
‑2‑
yl(thiophen
‑2‑
yl)methanone.white solid.1h nmr(500mhz,cdcl3):δ 8.25(d,j=3.5hz,1h),7.64
‑
7.69(m,3h),7.56(d,j=8.0hz,1h),7.43(t,j=7.5hz,1h),7.26(t,j=7.5hz, 1h),7.17(t,j=4.5hz,1h).
13
c nmr(125mhz,cdcl3):δ175.2,160.0,152.8,142.5,134.7,134.6,128.5, 128.3,127.2,124.2,123.4,
114.7,112.5,7.this compound is known:pashikanti,g.;lahu,n.c.;rambabu,c.; srivari,c.j.org.chem.2018,83,3325
‑
3332。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1