一种利用亚硫酸盐促进曝气去除水中Mn2+的方法与流程
本发明属于水和废水处理领域,涉及一种利用亚硫酸盐促进曝气去除水中Mn2+的方法。
背景技术:
我国的水资源中地下水占比30.7%。从人们的日常生活到发展工业、农业以至国防建设,地下水都是重要的资源。而在东北、华北、西北地区,地下水源中铁、锰含量严重超标,部分水源的含锰量可达0.5~2.0mg/L,甚至2.0mg/L以上,被称为含锰地下水。锰超标所造成的色度比同等含量的铁所造成的色度约大10倍,锰污染问题会直接影响工农业和人民的正常生活:饮用水中锰超标会引起水的颜色、味道改变,家用器具会污染成棕色或黑色,洗涤衣物会有微黑色或浅灰色斑渍;对于工业用水而言,锰超标会损害纺织、造纸、酿造、食品等工业的产品质量。我国生活饮用水卫生标准(GB 5749-2006)中对锰的限值为最大允许含量为0.1mg/L(以锰计),超过标准限值的原水必须进行除锰处理,使水质达到标准。
水中溶解态锰主要是Mn2+,溶解的Mn2+具有较大的稳定性,在自然水体的pH下,除了强氧化条件外,Mn2+很难转化为难溶的二氧化锰。不同于元素周期表中相邻的铁元素,二价铁在水处理过程中,可以较容易地通过曝气固定为氧化物或氢氧化物被去除,而Mn2+在中性和酸性条件下,几乎无法通过单纯的曝气被氧化去除,在水溶液pH>9.0时,Mn2+的自然氧化速率才会稍有加快。若通过先加碱调高pH、曝气、再把pH调节至中性的方法,势必会造成水处理流程的复杂,且所需曝气时间较长,制水成本提高。
亚硫酸盐是一种化工生产中常用的化学药剂,在食品工业可用作漂白剂、防腐剂、疏松剂、抗氧化剂,还可用于医药合成。有文献报道Mn2+的存在可以大大促进氧气氧化亚硫酸根的速率,但是未见利用亚硫酸根来提升氧气氧化去除水中Mn2+的报道。
技术实现要素:
本发明的目的是提供一种利用亚硫酸盐促进曝气去除水中Mn2+的方法,该方法在常温常压下进行,易于操作,投加药剂少,仅需曝气设备即能达到对Mn2+较好的处理效果,为水环境中Mn2+污染问题的解决提供了一个有效的方法。
本发明的目的是通过以下技术方案实现的:
一、将受Mn2+污染的待处理水样调节pH至4.0及以上;
二、向待处理水中投加亚硫酸盐,控制亚硫酸盐和Mn2+的摩尔比为(0.5~2.0):1;
三、向待处理水中曝空气2~20min,使氧气进入水中发生反应;
四、水样进入后续的沉淀过滤设备进行有效的固液分离。
通过实验发现亚硫酸盐的加入可以促进氧气氧化Mn2+变为难溶的二氧化锰胶体,进而可以通过沉淀过滤从水中去除。其反应机理见方程式(1)~(8)。亚硫酸根在Mn2+的催化下被氧气氧化为亚硫酸根自由基亚硫酸根自由基很容易被氧气进一步氧化成过一硫酸根自由基会转化为和可以氧化Mn2+为二氧化锰,且速率高于氧气氧化Mn2+的速率。
链引发
链传递
链终止
因此,当利用亚硫酸盐促进曝气去除水中Mn2+时,可有效去除中性、碱性或者弱酸性水样中的Mn2+,且是一种经济的处理方法。待处理水中被氧化的Mn2+转化为二氧化锰胶体,二氧化锰胶体能够吸附水中的Mn2+和一些其它的污染物,一起通过沉淀过滤去除。
本发明中,所述亚硫酸盐可以是固体或者溶解好的亚硫酸盐溶液,所用溶剂为蒸馏水或自来水。
本发明中,所述亚硫酸盐为亚硫酸钠、亚硫酸钾、焦亚硫酸钠、焦亚硫酸钾或其他溶解能产生亚硫酸根的物质。
本发明中,所曝的气体为空气或氧气,使水体中的氧气浓度达到2~8mg/L。
本发明中,待处理水为地下水、地表水或废水。
本发明具有如下有益效果:
(1)本方法所耗药剂少,去除效果好,空气是免费的资源,曝气是唯一需要消耗电能的操作;
(2)整个反应所需的设备简单,操作易行,管理维护方便;
(3)本发明在常温常压下进行,条件温和,解决了以往在中性或偏酸性水中Mn2+难以去除的问题,有很大的应用潜力。
(4)反应后产物为二氧化锰,二氧化锰胶体具有吸附、助凝的作用,可以协助Mn2+的去除。
附图说明
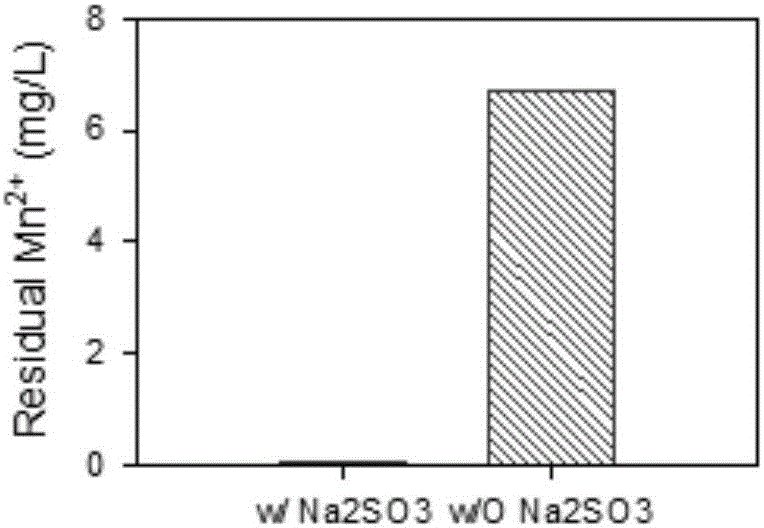
图1实施例一中残留的Mn2+浓度对比图。
图2实施例三中残留的Mn2+浓度对比图。
具体实施方式
下面对本发明的技术方案做进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围内。反应体系中,各个物质含量和添加量采用浓度来表征,为本技术领域常识。实例中,对于水样中Mn2+浓度小于1mg/L时采用火焰原子吸收分光光度法,对于水样中Mn2+浓度大于1mg/L时采用高碘酸钾分光光度法(GB/T11906-1989)检测出水中Mn2+浓度。
表1.实施例说明表格
注:1.表示的是亚硫酸根和Mn2+的摩尔浓度比
2.tmin表示曝气时间(分钟),所曝气体为空气或者一定纯度的氧气,详见实施例;
3.所加亚硫酸盐为能溶解产生亚硫酸根的亚硫酸钠、亚硫酸钾、焦亚硫酸钠、焦亚硫酸钾或其他溶解能产生亚硫酸根的物质,详见实施例;
4.Ce表示用本发明处理后,经过滤池出水中Mn2+的浓度。
实施例一
向含有10mg/L Mn2+(0.18mM),pH=4.0的给水厂原水中,加入0.36mM亚硫酸钠,亚硫酸钠与Mn2+的摩尔浓度比为2.0:1.0。向水中曝氧气20min,后续用砂滤池过滤,测得滤池出水中Mn2+浓度为0.09mg/L。
当单独采用曝氧气20min而不加亚硫酸钠处理时,滤池出水中Mn2+的浓度为8.8mg/L,部分去除是由于砂滤池的吸附作用,即氧气几乎无法氧化去除Mn2+。
具体结果见图1,进水Mn2+浓度为10mg/L、pH=4.0、在不投加亚硫酸钠和投加亚硫酸钠这两种情况下,曝空气20min,再经砂滤池过滤处理后出水中残留的Mn2+浓度比较。
实施例二
本实施例与实施例一不同的是:pH=7.0,亚硫酸钠投加量为0.27mM,亚硫酸钠与Mn2+的摩尔浓度比为1.5:1.0,曝空气15min处理,过滤后出水测得Mn2+浓度为0.09mg/L。
当在同样的水质条件下单独使用曝空气15min处理,经砂滤池过滤后的出水中Mn2+浓度为8.3mg/L。
实施例三
本实施例与实施例二不同的是:原水pH=9.0,经砂滤池过滤后,出水中Mn2+浓度为0.06mg/L。
当单独使用曝空气15min处理,经过砂滤池过滤后的出水中Mn2+浓度为6.7mg/L。
具体结果见图2,进水Mn2+浓度为10mg/L、pH=9.0、在不投加亚硫酸钠和投加亚硫酸钠这两种情况下,曝空气20min,再经砂滤池过滤处理后出水中残留的Mn2+浓度对比。
实施例四
本实施例与实施例一不同的是:Mn2+进水浓度为5mg/L(0.09mM),亚硫酸钠投加量为0.135mM,亚硫酸钠与Mn2+的摩尔浓度比为1.5:1.0,曝空气15min处理,系统出水测得Mn2+浓度为0.07mg/L。
当单独使用曝空气15min处理,经过砂滤池过滤后的出水中锰浓度为4.1mg/L。
实施例五
本实施例与实施例四不同的是:pH=7.0,所加的亚硫酸盐为亚硫酸钾,投加量为0.27mM,亚硫酸钾与Mn2+的摩尔浓度比为1.5:1.0,并用纯度60%的氧气进行曝气15min,系统出水测得Mn2+浓度为0.06mg/L。
实施例六
本实施例与实施例四不同的是:pH=9.0,所加的亚硫酸盐为焦亚硫酸钠,投加量为0.13mM,由于焦亚硫酸钠的分子式为Na2S2O6,其在溶液中易分解为两分子SO32-,故溶液中SO32-与Mn2+的摩尔浓度比为1.5:1.0。经系统处理后出水测得Mn2+浓度为0.03mg/L。
实施例七
本实施例与实施例一不同的是:Mn2+进水浓度为2mg/L(0.036mM),焦亚硫酸钠投加量为0.018mM(焦亚硫酸钠加到水中迅速水解,一个焦亚硫酸根分解为两个亚硫酸根),亚硫酸根与Mn2+的摩尔浓度比为1.0:1.0,曝空气10min处理,系统出水测得Mn2+浓度为0.08mg/L。
当单独使用曝空气15min处理,经过砂滤池过滤后的出水中锰浓度为1.69mg/L。
实施例八
本实施例与实施例七不同的是:进水pH=7.0,用本发明处理,系统出水中测得Mn2+浓度为0.05mg/L。
实施例九
本实施例与实施例七不同的是:进水pH=9.0,曝气时间为7min,过滤后出水测得Mn2+浓度为0.01mg/L。
实施例十
本实施例与实施例一不同的是:Mn2+进水浓度为0.2mg/L(0.0036mM),亚硫酸钠投加量为0.0018mM,亚硫酸钠与Mn2+的摩尔浓度比为0.5:1.0,曝空气2min处理,系统出水测得Mn2+浓度为0.05mg/L。
实施例十一
本实施例与实施例十不同的是:pH=7.0,系统出水测得Mn2+浓度为0.01mg/L。
实施例十二
本实施例与实施例十不同的是:pH=9.0,系统出水测得Mn2+浓度为0.01mg/L。
综上实例用于支持和再现本发明技术方案。
- 还没有人留言评论。精彩留言会获得点赞!