一种Fe3O4/壳聚糖共沉淀制备磁性壳聚糖吸附剂的方法与流程
本发明涉及磁性壳聚糖制备和应用的技术领域,确切地说是一种用于剧毒污染物Cr(VI)吸附的磁性壳聚糖的制备方法及其应用。
背景技术:
近年来,随着我国工业化的不断加速,涉及重金属排放的行业越来越多,再加上一些污染企业的违法开采,超标排污等问题突出,使得重金属污染事件出现高发态势,铬的危害尤为突出。铬主要以Cr(VI)和Cr(III)两种价态存在,而Cr(VI)和Cr(III)之间可以相互转化,其中Cr(III)最稳定,在水体中主要以Cr(OH)2+的形式存在;Cr(VI)在水中主要以CrO42+、Cr2O72-和HCrO43-等离子形式存在。铬对人体的毒性大多是由Cr(VI)引起的,一般认为Cr(VI)的毒性比Cr(III)高1000倍。一些Cr(VI)化合物是致癌、致畸性和致突变物,严重危害人类的生命健康。为了防治重金属Cr(VI)污染并使其达标排放,有效的处理方法就显得尤为重要。
目前,Cr(VI)废水的常见处理方法主要有化学沉淀法、氧化还原处理法、吸附法、离子交换法和生物处理法等。其中,吸附法具有操作简单、成本低廉和去除率高等优点而受到关注,在为数众多的吸附剂中,壳聚糖基天然聚合物吸附剂近年来尤为关注。
壳聚糖分子中含有大量带孤对电子的活性羟基(-OH)和氨基(-NH2)侧基,可作为配体与金属离子形成鳌合物,有效地吸附溶液中的Cr(VI)。CN101973618A公开了一种壳聚糖-铁配合物吸附剂的制备方法,即将壳聚糖单体溶解在氯化铁水溶液中,待其混合均匀后再加入乙醇析出固体,经过滤、洗涤后与戊二醛水溶液进行交联反应,所制得吸附剂对Cr(VI)浓度小于50mg/L溶液的去除率可达100%,但其吸附Cr(VI)后分离较困难。然而往往Fe3O4的引入会降低壳聚糖的吸附能力,甚至抵消改性带来的效果。例如,张思锐等人(张思锐,刘春元,梁燕萍,等.磁性壳聚糖微球对Cr6+的吸附性能研究[C].颗粒学最新进展研讨会——暨全国颗粒制备与处理研讨会.2011.)用反相悬浮交联法将壳聚糖包埋Fe3O4粒子,合成了磁性壳聚糖微球,其对Cr(VI)的最大吸附量为12.339mg·mg-1。又如,Hu等人(Hu X J,Wang J S,Liu Y G,et al.Adsorption of chromium(VI)by ethylenediamine-modified cross-linked magnetic chitosan resin:Isotherms,kinetics and thermodynamics[J].Journal of Hazardous Materials,2011,185(1):306-14.)制备的乙二胺改性磁性壳聚糖在313K下对Cr(VI)的最大吸附量仅为45.872mg·mg-1。
综上,开发制备方法简便温和、无需改性、在不牺牲壳聚糖吸附性能的前提下引入磁性,对剧毒污染物Cr(VI)具有优良吸附性能磁性壳聚糖的研制具有重要意义。
技术实现要素:
本发明所要解决的关键技术问题是:在简单、温和的条件下,以氨水/乙醇为沉淀剂,使Fe3O4/壳聚糖同步生成,制备再生循环吸附性能优异的磁性壳聚糖。
本发明解决其技术问题采用以下的技术方案:
本发明提供的Fe3O4/壳聚糖共沉淀制备磁性壳聚糖吸附剂的方法,具体是:首先将壳聚糖充分溶解在FeCl3·6H2O溶液中,再加入一定量的FeCl2·4H2O粉末,待其溶解完全后再滴加乙醇和氨水的混合溶液进行沉淀,然后经过磁性分离、干燥,将得到的产品研磨后,分散到乙醇和戊二醛的混合溶液中进行交联,再经过磁性分离、干燥,制得磁性壳聚糖吸附剂粉末。
该方法包括以下制备步骤:
(1)在室温下将FeCl3·6H2O溶解在50ml去离子水中制备Fe(III)盐溶液后,加入一定量壳聚糖,并搅拌2h,再加入一定量FeCl2·4H2O粉末,继续搅拌2h得到均匀的混合溶液;
(2)将乙醇/氨水混合溶液滴加到步骤(1)所得溶液中,直至沉淀完全,然后经过磁性分离、用乙醇洗去多余的离子,重复上述过程三次,将产物在60℃的真空条件下干燥12h;
(3)将步骤(2)所得产物研磨后,全部加入到乙醇/戊二醛混合溶液中进行交联,在室温下搅拌充分后用磁铁分离并且用乙醇洗涤,重复上述过程三次,将产物在60℃的真空条件下干燥12h,即得到磁性壳聚糖吸附剂。
所述FeCl3·6H2O和FeCl2·4H2O加入量的摩尔比为:n(Fe(III)):n(Fe(II))=1~4。
所述壳聚糖的加入量为1~2g。
所用乙醇/氨水混合溶液的制备方法为:将10~40mL、质量分数为25%的氨水逐滴加入到100mL乙醇中。
所用乙醇/戊二醛混合溶液的体积为50mL,控制戊二醛的体积分数在20~40%,交联反应时间为1~3h。
上述方法制备的磁性壳聚糖吸附剂,其在对剧毒污染物Cr(VI)中的应用。
该吸附剂用于吸附pH为2,浓度为0.5-200mg/L的Cr(VI)溶液,该吸附剂使用量为1g/L。
该吸附剂吸附Cr(VI)后的磁性壳聚糖-铁用0.05mol/L的NaOH溶液脱附,脱附Cr(VI)后的磁性壳聚糖吸附剂循环使用。
该吸附剂对Cr(VI)/Mg(II)/Zn(II)/Ni(II)/Cd(II)/Cu(II)混合溶液中的Cr(VI)具有较好的竞争吸附选择性。
本发明的技术方案所依据的原理是:溶解于FeCl3溶液的壳聚糖通过配位作用,与Fe3+均匀紧密结合,为后续的沉淀提供了反应位点。随着氨水/乙醇混合溶液的逐滴引入,一方面乙醇有效降低了壳聚糖的溶解度使其大量析出,另一方面,氨水促使Fe3O4同步产生。正是基于这一同步过程,不仅制备出了磁性壳聚糖,还使壳聚糖与Fe3O4结合更紧密均匀,从而充分发挥Fe3O4的磁性和充分暴露壳聚糖的-OH和-NH2侧基,使材料表现出较强的磁性和较好的吸附能力;并且Fe3O4能起到支撑壳聚糖的作用,增加了材料的比表面积,进一步增加了吸附位点数量。所以在酸性条件下,更多的-NH2被质子化成带有正电荷的-NH3+,通过静电作用吸附更多的带负电的HCrO4-,并且通过外磁场就能实现吸附剂分离。
与其它壳聚糖吸附剂相比,本发明所制备的磁性壳聚糖具有以下主要优点:
(1)室温下氨水/乙醇混合溶液的引入促使Fe3O4和壳聚糖一步生成,制备过程简单,反应条件温和,并且对设备的要求较低;
(2)通过调节Fe(III)与Fe(II)的引入量,制备出一系列性能较好的磁性壳聚糖吸附剂;
(3)吸附Cr(VI)后的磁性壳聚糖易于从水体中分离,不会产生二次污染;
(4)无需改性就能制备出吸附能力强的壳聚糖吸附剂;
(5)化学性质稳定,具有较好的循环再生吸附性能。
附图说明
图1为实施例1-6中样品吸附200mg/L Cr(VI)溶液时的吸附动力学曲线;
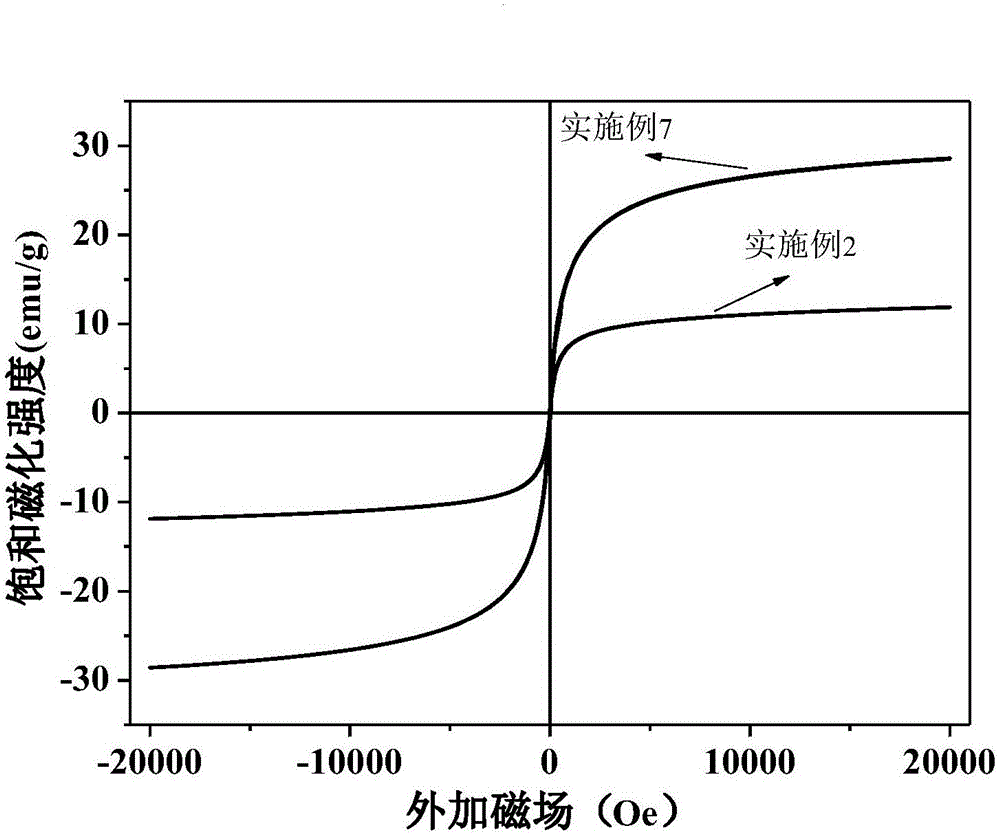
图2为实施例2和实施例7中样品的磁性能测试;
图3为实施例2和实施例7中样品吸附100mg/L Cr(VI)溶液时再生循环5次所对应的吸附量;
图4为实施例8中样品对Cr(VI)及其与Mg(II)/Zn(II)/Ni(II)/Cd(II)/Cu(II)混合阳离子溶液中重金属阳离子的去除率和选择性吸附系数。
具体实施方式
下面结合附图和实施例对本发明作进一步的说明,这些实施例仅是对本发明较佳实施方式的描述,但并不限定以下所述的内容。
实施例1:
将1mmol FeCl3·6H2O溶解在50ml去离子水中后,加入1g壳聚糖,室温下搅拌2h;然后加入1mmol FeCl2·4H2O,继续搅拌2h;之后缓慢加入100ml、质量分数为99.5%的无水乙醇与10ml、质量分数为25%的氨水的混合溶液进行沉淀;得到的沉淀经磁性分离后用质量分数为99.5%的无水乙醇洗涤,重复三次后,产物在60℃的真空条件下干燥12h;将得到的产品研磨后,分散到10ml、体积分数为25%的戊二醛和40ml、质量分数为99.5%的无水乙醇的混合溶液中进行交联,在室温下搅拌2h;再经过磁性分离并且用质量分数为99.5%的无水乙醇洗涤,重复三次,然后将得到的产品在60℃的真空条件下干燥12h,即得到磁性壳聚糖。
吸附100ml、200mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节其pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附动力学曲线见图1,其对Cr(VI)的吸附去除率为54.0%,吸附量为108.00mg/g。
吸附100ml、100mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附去除率为92.4%,吸附量为92.43mg/g。
实施例2:
将1mmol FeCl3·6H2O溶解在50ml去离子水中后,加入1g壳聚糖,室温下搅拌2h;然后加入0.5mmol FeCl2·4H2O,继续搅拌2h;之后缓慢加入100ml、质量分数为99.5%的无水乙醇与10ml、质量分数为25%的氨水的混合溶液进行沉淀;得到的沉淀经磁性分离后用质量分数为99.5%的无水乙醇洗涤,重复三次,产物在60℃的真空条件下干燥12h;将得到的产品研磨后,分散到10ml、体积分数为25%的戊二醛和40ml、质量分数为99.5%的无水乙醇的混合溶液中进行交联,室温下搅拌2h;再经过磁性分离并且用质量分数为99.5%的无水乙醇洗涤,重复三次,然后将得到的产品在60℃的真空条件下干燥12h,即得到磁性壳聚糖。
吸附100ml、200mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附动力学曲线见图1,其对Cr(VI)的吸附去除率为75.3%,吸附量为150.6mg/g。该材料的磁性能测试见图2。
吸附100ml、100mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附去除率为93.0%,吸附量为93.00mg/g。
实施例3:
将2mmol FeCl3·6H2O溶解在50ml去离子水中后,加入1g壳聚糖,室温下搅拌2h;然后加入0.5mmol FeCl2·4H2O,继续搅拌2h;之后缓慢加入100ml、质量分数为99.5%的无水乙醇与10ml、质量分数为25%的氨水的混合溶液进行沉淀;得到的沉淀经磁性分离后用浓度质量分数为99.5%的无水乙醇洗涤,重复三次,然后将得到的产品在60℃的真空条件下干燥12h;将得到的产品研磨后,分散到10ml、体积分数为25%的戊二醛和40ml、质量分数为99.5%的无水乙醇的混合溶液中进行交联,室温下搅拌2h;再经过磁性分离并且用质量分数为99.5%的无水乙醇洗涤,重复三次,然后将得到的产品60℃真空干燥12h,即得到磁性壳聚糖。
吸附100ml、100mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附动力学曲线见图1,其对Cr(VI)的吸附去除率为62.9%,吸附量为125.80mg/g。
吸附100ml、100mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附去除率为90.2%,吸附量为90.21mg/g。
实施例4:
室温下将1mmol FeCl3·6H2O溶解在50ml去离子水中后,加入1g壳聚糖,搅拌2h;然后加入1mmol FeCl2·4H2O,继续搅拌2h;之后缓慢加入100ml、质量分数为99.5%的无水乙醇与20ml、质量分数为25%的氨水的混合溶液进行沉淀;得到的沉淀经磁性分离后用质量分数为99.5%的无水乙醇洗涤,重复三次,产物在60℃的真空条件下干燥12h;将得到的产品研磨后,分散到20ml、体积分数为25%的戊二醛和30ml、质量分数为99.5%的无水乙醇的混合溶液中进行交联,室温下搅拌1h;再经过磁性分离并且用质量分数为99.5%的无水乙醇洗涤,重复三次,然后将得到的产物在60℃的真空条件下干燥12h,即得到磁性壳聚糖。
吸附100ml、200mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附动力学曲线见图1,其对Cr(VI)的吸附去除率为53.8%,吸附量为107.71mg/g。
吸附100ml、150mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附去除率为67.4%,吸附量为101.20mg/g。
实施例5:
室温下将1mmol FeCl3·6H2O溶解在50ml去离子水中后,加入1g壳聚糖,搅拌2h;然后加入1mmol FeCl2·4H2O,继续搅拌2h;之后缓慢加入100ml、质量分数为99.5%的无水乙醇与40ml、质量分数为25%的氨水的混合溶液进行沉淀;得到的沉淀经磁性分离后用质量分数为99.5%的无水乙醇洗涤,重复三次,然后将得到的产物在60℃的真空条件下干燥12h;将干燥产物研磨后,分散到15ml、体积分数为25%的戊二醛和35ml、质量分数为99.5%的无水乙醇的混合溶液中进行交联,室温下搅拌3h;再经过磁性分离并且用质量分数为99.5%的无水乙醇洗涤,重复三次,然后将得到的产物在60℃的真空条件下干燥12h,即得到磁性壳聚糖。
吸附100ml、200mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附动力学曲线见图1,其对Cr(VI)的吸附去除率为56.8%,吸附量为113.60mg/g。
吸附100ml、80mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附去除率为90.0%,吸附量为71.90mg/g。
实施例6:
室温下将2mmol的FeCl3·6H2O溶解在50ml去离子水中后,加入2g壳聚糖,搅拌2h;然后加入0.5mmol FeCl2·4H2O,继续搅拌2h;之后缓慢加入100ml、质量分数为99.5%的无水乙醇与20ml、质量分数为25%的氨水的混合溶液进行沉淀;得到的沉淀经磁性分离后用质量分数为99.5%的无水乙醇洗涤,重复三次,然后将得到的产物在60℃的真空条件下干燥12h;将干燥产物研磨后,分散到10ml、体积分数为25%的戊二醛和40ml、质量分数为99.5%的无水乙醇的混合溶液中进行交联,室温下搅拌2h;再经过磁性分离并且用质量分数为99.5%的无水乙醇洗涤,重复三次,然后将得到的产物在60℃的真空条件下干燥12h,即得到磁性壳聚糖。
吸附100ml、200mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附动力学曲线见图1,其对Cr(VI)的吸附去除率为64.1%,吸附量为128.10mg/g。
吸附100ml、50mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附去除率为96.0%,吸附量为48.01mg/g。
实施例7:
将1mmol FeCl3·6H2O溶解在50ml去离子水中,搅拌均匀后,加入0.5mmol FeCl2·4H2O,待其溶解完全再加入1g壳聚糖,室温下搅拌4h;之后缓慢加入10ml、质量分数为25%的氨水溶液进行沉淀;得到的沉淀经磁性分离后用质量分数为99.5%的无水乙醇洗涤,重复三次,然后将得到的产物在60℃的真空条件下干燥12h;将干燥产物研磨后,分散到10ml、体积分数为25%的戊二醛和40ml、质量分数为99.5%的无水乙醇的混合溶液中进行交联,室温下搅拌2h;再经过磁性分离并且用质量分数为99.5%的无水乙醇洗涤,重复三次,然后将得到的产品在60℃的真空条件下干燥12h,即得到磁性壳聚糖。该材料的磁性能测试如图2。
吸附100ml、100mg/L的Cr(VI)溶液时用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。磁性壳聚糖对Cr(VI)的吸附去除率为82.5%,吸附量为82.50mg/g。
为了比较实施例2和实施例7所制备的磁性壳聚糖的再生循环吸附性能,将0.05g吸附剂加入到50ml、100mg/L的Cr(VI)溶液中,用0.1mol/L的HCl溶液将其起始pH值调至2,在25℃、150r/min下恒温振荡吸附4h,然后取样测定Cr(VI)的残余浓度。使用永久磁铁吸附分离磁性吸附剂,并将其加入到100mL的0.05mol/L NaOH溶液中解吸8h,分离洗涤磁性吸附剂后,将其投入到下一轮吸附试验中,直到样品对Cr(VI)的吸附量出现明显下降。该样品循环5次吸附结果见图3。实施例2所制备的磁性壳聚糖样品初次吸附量为93.00mg/g,循环5次吸附试验之后,吸附量仍能达到初次吸附量的81.0%,为75.33mg/g;实施例7所制备的磁性壳聚糖样品初次吸附量为82.50mg/g,循环5次吸附试验之后,吸附量下降了31.2%,为56.80mg/g。显然,实施例2所制备的磁性壳聚糖循环稳定性要好。
实施例8:
为了测试混合阳离子对Cr(VI)吸附性能的影响,配制成分别含有100mg/L的Cr(VI)/Mg(II)/Zn(II)/Ni(II)/Cd(II)/Cu(II)的混合重金属阳离子溶液来模拟真实工业废水。取100mL该混合阳离子溶液,用浓度为0.1mol/L的盐酸溶液调节pH至2,随后加入0.1g实施例2所制备的磁性壳聚糖样品,设置恒温振荡箱的参数为25℃、150r/min。该样品对Cr(VI)的选择性吸附结果见图4,在混合阳离子溶液中,所制备的磁性壳聚糖对Cr(VI)的吸附率为78.6%,且对Mg(II)、Zn(II)、Ni(II)、Cd(II)和Cu(II)的选择性系数分别为28.0、63.2、86.8、123.5和153.1,表现出较好的选择性。
上述实施例中,采用研钵对在真空条件下干燥后得到的产品进行研磨。
- 还没有人留言评论。精彩留言会获得点赞!