流式细胞术快速检测大肠杆菌O157:H7的方法与流程
本发明属于食品快速检测领域,涉及食源性致病菌大肠杆菌O157:H7(Escherichia coli O157:H7)的快速检测,尤其是一种基于流式细胞术的荧光定量检测食品中的食源性致病菌的检测方法。
背景技术:
食源性疾病长期损伤我们的脏器并有致命性。主要的食源性致病菌包括Salmonella enteric subspecies I serovar Typhimurium,Escherichia coli O157:H7,Listeria monocytogenes,Staphylococcus aureus,Campylobacter jejuni,Clostridium perfringens,和Yersinia enterocolitica,它们对食品工业和消费者产生了巨大影响。2010年5月传染病研究与政策中心(CIDRAP)宣布:美国农业部(USDA)最新估计每年E.coli和Salmonella花费近31.3亿美元。在北美、英国和日本,E.coli O157:H7是EHEC致病菌中最重要的,属于主要食源性致病菌的前五位之一,曾报道在菠菜、生菜、苹果酒、哈密瓜、萝卜芽以及碎牛肉中有污染,感染剂量小于100个菌体细胞。E.coli O157:H7的传染主要是经过粪口途径,但是也可以通过接触被污染的水源、感染动物或人类进行感染,主要导致肠道疾病。在美国1990年至2010年期间,由E.coli爆发引起的食品安全事件有361起,其中由E.coli O157:H7引起的有303起,在美国平均每年导致9,6000人感染,31人死亡。
一个有效的途径来阻止污染的商业食品被引入人类食物链就是在最初的控制点进行监测。因此在食品安全中对于食品中微生物致病菌的识别和检测预防有重要意义。在根据Arnandis-Chover等最近的报道,在2011年欧洲就有进行了27.5千万次的食品中微生物检测试验,预计到2016年会有35千万次的食品微生物检测试验。
传统检测致病微生物的方法主要依赖于特异性的微生物和生化鉴定。如图1所示,传统方法有:培养和菌落计数法,基于免疫学的方法以及PCR(polymerase chain reaction)方法[5]。这些方法很灵敏、费用低廉并且可以定性和定量判定被检微生物,但是它们很大程度上被检测时间所限制,并且如果要检出食品样品中低浓度的致病菌就需要进行样品的前富集。
综上可知传统方法通常费时,这就需要一个新的技术能快速、简便、特异、灵敏、可靠地检测食源性致病菌。而且这种新技术应该可以较低的成本在原地实时监测。生物传感器是对生物物质敏感并将其响应转换为可识别的信号进行检测的分析仪器。主要由两部分组成:可以识别靶标分析物的生物识别元件和能把识别信号转换为可测量的电信号的换能器。生物识别元件可以是组织、微生物、细胞器、细胞、酶、抗体、核酸和仿生材料等。近年来随着细胞生物学的飞速发展,细胞作为生物传感器的识别元件被用于致病菌的检测中已经日益突显了其无可比拟的优越性。一些基于哺乳动物细胞的CBBs的检测系统已经达成了商业化,诸如(a)电细胞基质的阻抗传感器(electric cell-substrate impedance sensing,ECIS)可以检测细胞培养物中的阻抗改变,该方法检测时间较长;(b)CANARY系统,在B细胞(B淋巴细胞)表面构建了致病菌特异性的抗体,在B细胞质内表达生物发光钙离子响应蛋白,当抗原与B细胞表面的抗体结合后启动信号通路从而导致胞内的钙离子激流可使B细胞发光,可以用光度计进行检测,该方法虽然检测时间较短,但是样品需要通过离心的方法进行前富集;(c)生物电识别系统(BERA)使用了电穿孔的方法构建了抗体或其他分子到哺乳动物细胞膜,当结合了诸如病毒粒子的分析物后,抗体就开启了膜电位的改变,这可以用微电极检测到,该方法的工作电极不可重复利用。
这类哺乳动物细胞的CBBs被用于食品、农业和生物安全方面的致病性微生物和毒素的检测,在生物传感器领域的增长率达到了11.2%,这说明了在该领域需要发展新型的功能化的CBBs。
SYBR Green I是一种结合于所有dsDNA双螺旋小沟区域的具有绿色激发波长的染料。在游离状态下,SYBR Green I发出微弱的荧光,但一旦与双链DNA结合后,荧光大大增强。因此,SYBR Green I的荧光信号强度与双链DNA的数量相关,可以根据荧光信号检测出染色后的细菌数量。
备注说明:流式细胞术(Flow Cytometry,FCM)是一种在功能水平上对单细胞或其他生物粒子进行定量分析和分选的检测手段,它可以高速分析上万个细胞,并能同时从一个细胞中测得多个参数,与传统的荧光镜检查相比,具有速度快、精度高、准确性好等优点,成为当代最先进的细胞定量分析技术。
技术实现要素:
本发明要解决的技术问题是提供一种可定量检测食源性致病菌E.coli O157:H7定量的检测方法,该方法操作简单、检测时间短,无需样品的前富集。
为了解决上述技术问题,本发明提供一种流式细胞术快速检测大肠杆菌O157:H7的方法,包括以下内容:SYBR Green I对E.coli O157:H7进行染色;流式细胞术检测E.coli O157:H7;通过B细胞捕获不同浓度E.coli O157:H7所呈现的荧光强度,最终获得待测样品(液态)中细菌浓度(包括检测线性范围,确定检测限)。
作为本发明的流式细胞术快速检测大肠杆菌O157:H7的方法的改进,该方法依次包括以下步骤:
1)、在1mL的待检样品(液态,含有E.coli 157:H7)中,加入2μL SybrGreen I原液(10,000×),在室温条件下避光孵育20±2min;
2)、对步骤1)所得样品进行离心洗涤;
3)、取50μL步骤2)的所得物,加入至450μL 3.8×105cells/mL的B细胞无酚红培养液中;
4)、将步骤3)所得物混匀后(约5min),以1400±100rpm的速度离心5±0.5min,弃掉上清,用400μL HBSS重悬沉淀后,用流式细胞仪进行检测;
流式细胞仪例如为FACSCaliburTM(BD Biosciences,San Jose,CA,USA);
5)、将步骤4)检测所得的SybrGreen荧光强度(百分比)作为Y值,代入回归方程Y=26.74+74.36/(1+10^(6.011-X)*0.9185)中,所得的X为液态待测样品中大肠杆菌的细菌浓度。
作为本发明的流式细胞术快速检测大肠杆菌O157:H7的方法的改进:回归方程的检测限范围为4.9×104CFU/mL至4.9×108CFU/mL。
作为本发明的流式细胞术快速检测大肠杆菌O157:H7的方法的改进,所述步骤2)中:以8000±100rpm的速度离心5±0.5min,弃掉上清后,用1mL的HBSS缓冲液重悬沉淀后进行重复洗涤,重复洗涤的次数为2~4次。
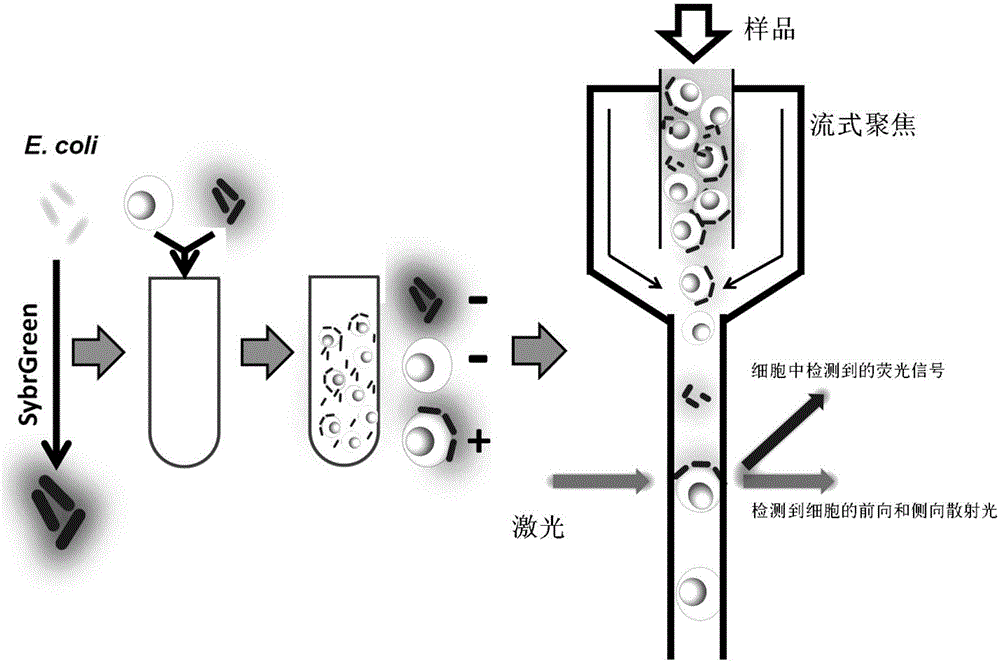
本发明根据B细胞对E.coli O157:H7的特异性和SYBR Green I对细菌染色的特性,设计本发明的检测方法。将B细胞与SYBR Green I染色后的不同浓度E.coli O157:H7菌体细胞混合后,B细胞就会捕获细菌细胞,通过流式细胞仪对荧光信号的分析,从而确定细菌的浓度。研究发现,细菌浓度与荧光强度的百分比成正相关。
因为该B细胞表面的IgM是对E.coli O157:H7具有特异性,因此它可以特异性捕获E.coli O157:H7,其他细菌存在的情况下会有少量物理性吸附,可以通过HBSS洗脱,但是与B细胞IgM特异性吸附的E.coli O157:H7较难被洗脱。从而可以通过洗脱的方法来消除非特异性吸附的影响。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
图1是用于致病菌检测的不同传统方法的示意图;
图2是基于B细胞的流式快速检测食源性致病菌E.coli O157:H7的原理示意图;
图3是E.coli O157:H7经SybrGreen染色后结合到B细胞表面的流式直方图;
图3中,abcdefghi分别代表E.coli O157:H7浓度为0CFU/mL,4.9×101-4.9×108CFU/mL时的流式直方图;
图4是基于B细胞的流式快速检测E.coli O157:H7的标准曲线图。
具体实施方式
实施例1、一种基于B细胞的流式快速检测食源性致病菌Escherichia coli O157:H7的方法,依次进行以下步骤:
1)、在1mL含有E.coli 157:H7的样品中,加入2μL SybrGreen I原液(10,000×),在室温条件下避光孵育20min。
2)、然后对样品进行离心洗涤,即以8000rpm的速度离心5min,弃掉上清,用1mL的HBSS缓冲液重悬沉淀;洗涤三次(即,再依次重复上述离心洗涤2次)。
3)、将样品进行梯度稀释(采用HBSS缓冲液作为稀释剂,10倍的梯度),细菌浓度分别为4.9×101CFU/mL至4.9×108CFU/mL;取各浓度梯度的细菌纯培养物50μL,分别加入450μL 3.8×105cells/mL的B细胞(采用HBSS进行悬浮)中;对照组用50μL HBSS替代细菌加入450μL B细胞培养液中。
4)、将步骤3)所得的各个组别分别进行如下处理:
轻柔混匀并在室温静置5min后,以1400rpm的速度离心5min,弃掉上清,用400μL HBSS重悬沉淀后,直接用流式细胞仪FACSCaliburTM(BD Biosciences,San Jose,CA,USA)进行检测。
5)、绘制荧光强度与E.coli 157:H7浓度的响应曲线,得回归方程为Y=26.74+74.36/(1+10^(6.011-X)*0.9185),R2=0.99,其中Y为SybrGreen荧光强度(百分比),X为细菌浓度。
检测限范围为4.9×104CFU/mL至4.9×108CFU/mL。
实验1、将液态待测样品按照实施例1所述方法进行检测,具体如下:
1)、在1mL液态待测样品中,加入2μL SybrGreen I原液(10,000×),在室温条件下避光孵育20min。
2)、然后对样品进行离心洗涤,即以8000rpm的速度离心5min,弃掉上清,用1mL的HBSS缓冲液重悬沉淀后进行重复洗涤;共洗涤三次(即,再重复洗涤2次)。
3)、取50μL步骤2)的所得物,加入450μL 3.8×105cells/mL的B细胞无酚红培养液中;
4)、将步骤3)所得物混匀5min后,以1400rpm的速度离心5min,弃掉上清,用400μL HBSS重悬沉淀后,直接用流式细胞仪FACSCaliburTM(BD Biosciences,San Jose,CA,USA)进行检测。
5)、将步骤4)检测所得的SybrGreen荧光强度(百分比)作为Y值,代入Y=26.74+74.36/(1+10^(6.011-X)*0.9185)中,所得的X为液态待测样品中细菌浓度。
待测样品为如下表1中的3种待测样品,所得结果如表1所述。
表1、实验1检测结果
将上述3种样品按照目前公认的平板菌落计数法检测,所得的浓度数据如表1所述。
实验2、2个待测样品中O157:H7浓度高于检测限的上限
当待测物细菌浓度高于检测上限时,检测到的荧光强度百分比和当E.coli O157:H7浓度为4.9×108CFU/mL是一致的(99%),因为此时B细胞表面结合的E.coli O157:H7数量已经达到了饱和。因此,需要对待测样品用HBSS进行梯度稀释,然后用此方法进行检测,才能获得所需的X值。
对比实验1,待测样品D和E分别为稀释了10倍和100倍后的样品,其余操作与实验1相同,得出X值后再分别乘以10和100从而得到细菌浓度。所得结果如下:
表2、实验2检测结果
实验3、除了含有O157:H7、还含有别的细菌的待测样品
1)、在1mL的样品中,加入2μL SybrGreen I原液(10,000×),在室温条件下避光孵育20min。
2)、然后对样品进行离心洗涤,即以8000rpm的速度离心5min,弃掉上清,用1mL的HBSS缓冲液重悬沉淀后进行重复洗涤;共洗涤三次。
3)、取50μL步骤2)的所得物,加入至450μL 3.8×105cells/mL的B细胞无酚红培养液中;
4)、将步骤3)所得物混匀5min后,以1400rpm的速度离心5min,弃掉上清,用400μL HBSS重悬沉淀后,直接用流式细胞仪FACSCaliburTM(BD Biosciences,San Jose,CA,USA)进行检测。
当我们使用与B细胞非特异性吸附的细菌E.coli BL21和Listeria.innocua ATCC33090代替E.coli O157:H7时,检测得到的荧光信号明显减弱。结果如下表3所示。
表3
对比试验1、将实验1中的步骤(3)省去,其余等同于实验1,即如果不加入B细胞时,用流式细胞仪则不能检测出E.coli O157:H7。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!