一种紫外光谱法高通量检测对香豆酸的方法与流程
本发明涉及一种紫外光谱法高通量检测对香豆酸的方法,属于生物化学领域。
背景技术:
对香豆酸属于苯丙素类化合物,其具有抗细菌和降血脂等众多生理功效和生物活性,已经被广泛的作为食品和药品的有效成分。由于苯丙素类化合物是由苯环和3个碳原子相连而构成的一类化合物的总称,而对香豆酸是苯丙素类化合物中较为简单的化合物。因此,对香豆酸作为合成更多其他结构更为复杂的苯丙素类化合物,如黄酮类化合物等的重要前体或中间产物,在代谢工程和合成生物学中的地位十分重要。
对香豆酸作为众多具有药用价值的苯丙素类化合物的中间代谢产物,在代谢工程中其在胞内的积累水平直接影响到目标苯丙素类化合物的生产水平。因此在分子生物学改造生产苯丙素类化合物时,常常以发酵体系中积累的对香豆酸水平作为从葡萄糖到目标化合物的代谢流平衡与否的重要标志。对菌体代谢流带改造需要随时检测中间产物对香豆酸的含量,而目前普遍应用的高效液相色谱(HPLC)检测方法虽然非常准确,但是检测效率偏低,无法满足高通量的快速检测需求。
已有研究表明,由L-酪氨酸作为底物合成对香豆酸等苯丙素类化合物的过程中,酪氨酸解氨酶(TAL)活性较低是限制苯丙素类化合物的大量合成的关键因素。而由于检测方法的限制,对已有高活性TAL进行随机突变改造困难重重。虽然早在1987年Abell报道了在315nm处可检测对香豆酸含量,然而其所应用的反应体系为纯净的缓冲液体系,无法应用于发酵工程领域。因此为了加速对香豆酸合成限速酶TAL的进化,建立一套可快速检测发酵液中对香豆酸含量的检测方法对于推进苯丙素类植物天然产物的大规模合成具有重要意义。
技术实现要素:
为了解决上述问题,本发明提供了一种通过添加NaBH4作为助色基团的检测对香豆酸的方法。
所述检测对香豆酸的方法,是向待测样品中,添加NaBH4,于300~400nm处检测紫外光吸收强度,对照标准曲线,确定待测样品中对香豆酸的含量。
所述检测对香豆酸的方法,是于339nm处检测紫外光吸收强度。
所述待测样品,是生物法合成对香豆酸得到的样品。包括以微生物发酵制备对香豆酸时,得到的发酵上清液。
所述待测样品的pH呈碱性,例如pH10~12。
所述以微生物发酵制备对香豆酸,包括以大肠杆菌作为对香豆酸生产菌株,以葡萄糖、或L-酪氨酸为底物发酵制备对香豆酸。
所述以微生物发酵制备对香豆酸,包括以大肠杆菌作为对香豆酸生产菌株,以MOPS培养基为发酵培养基。
所述NaBH4,在待测样品中的浓度为0.5%~3%。
所述NaBH4,在待测样品中的浓度为0.5%~1%。
所述NaBH4,可首先溶解于水、甲醇、乙醇或二甲基亚砜等不干扰检测的溶剂中,再添加到待测样品中。
所述检测对香豆酸的方法,还包括前处理,以去除菌体、细胞碎片和固体代谢产物等杂质。
所述检测对香豆酸的方法,其中,紫外光吸收强度可利用多功能酶标仪和分光光度计等可检测紫外吸收信号的仪器检测。
针对发酵工业中苯丙素类化合物的中间代谢产物对香豆酸检测困难的问题,本发明建立了一种简单快捷的发酵产品对香豆酸的高通量检测方法,首次实现了通过添加NaBH4助色基团可使对香豆酸(红移47nm)和L-酪氨酸的最大吸收峰分离,并在在339nm处形成一个新的最大吸收峰,且紫外吸收强度与对香豆酸含量呈正比。本发明方法特别适合微生物发酵体系中对香豆酸的高通量检测,为苯丙素类化合物的微生物法生产的中间代谢产物检测提供了方法。对香豆酸合成相关的酶学性质检测同样可采用此方法。与传统的HPLC检测方法相比较,本方法最大的优势是检测效率高,无需复杂的样品前处理过程,可实现在多孔板中的高通量检测。基于此检测方法,未来诱变技术和随机突变方法以及其他的高通量改造策略均可应用于对对香豆酸等苯丙素类化合物微生物法生产。
附图说明
图1对香豆酸和L-酪氨酸全波长扫描光谱。
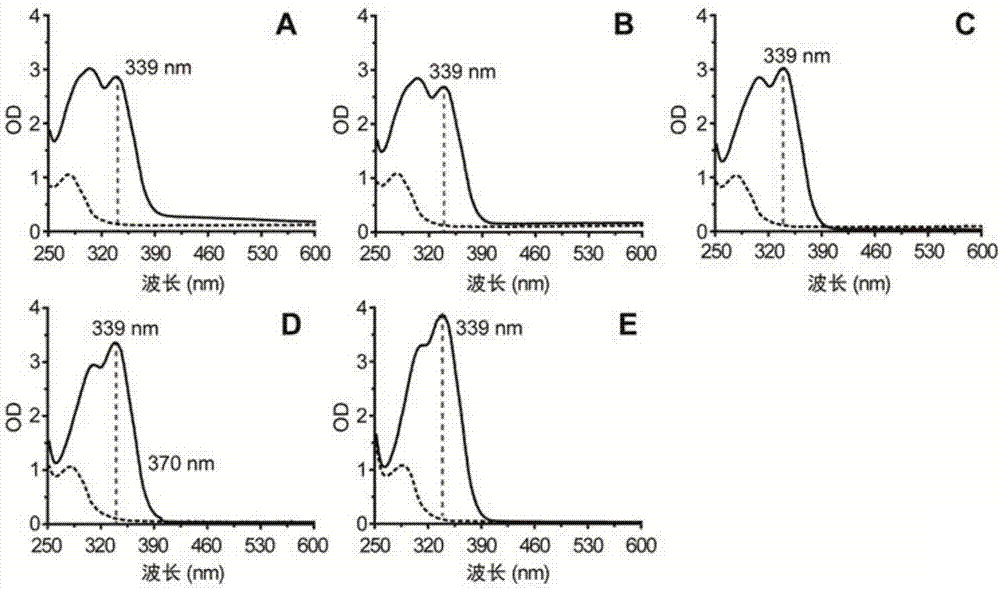
图2不同pH环境下对香豆酸和L-酪氨酸全波长扫描光谱,A:自然pH≈4.5,B:pH=7,C:pH=8,D:pH=10,E:pH=12。对香豆酸(实线),L-酪氨酸(虚线)。
图3混合交叉实验测定结果,实线代表HPLC测定结果,虚线代表紫外光检测结果。
具体实施方式
材料与方法
野生型E.coli BL21(DE3),NaBH4,对香豆酸,L-酪氨酸,N-[三(羟甲基)甲基]甘氨酸,丙二酸钠,二甲基亚砜,MOPS均购自上海生工。紫外可透的96潜孔板购自康宁公司。多功能酶标仪Cytation 3 plate reader(BioTek)用于检测样品荧光强度。
实施例1光谱学性质分析
首先以二甲基亚砜(DMSO)为溶剂配制200mg/L的对香豆酸、50mg/L的L-酪氨酸。由于L-酪氨酸是对香豆酸的直接前体,为了验证L-酪氨酸与对香豆酸的紫外吸收是否会相互干扰,将配制好的样品置于多功能酶标仪Cytation 3 plate reader(BioTek)进行230~999nm全波长扫描。结果显示两种物质均在290nm处具有最大吸收峰(图1)。即在不添加助色基团时是无法分离L-酪氨酸和对香豆酸的最大吸收峰的,因此无法针对对香豆酸定量分析。
实施例2检测波长对检测结果的影响
发酵产品产量检测的一个重要挑战之一是,发酵液中存在的复杂成分可能会干扰目标化合物的检测。我们利用MOPS培养基培养野生型的大肠杆菌BL21(DE3)48h。随后将发酵液12000rpm离心5min,取上清液作为溶剂(自然pH≈4.5),配制质量分数为2%的NaBH4溶液作为助色基团,再分别添加10mg/L对香豆酸、50mg/L L-酪氨酸。随后,利用多功能酶标仪进行230~999nm的全波长扫描,扫描结果显示,当以MOPS作为发酵培养基培养大肠杆菌BL21(DE3)得到的发酵液中,NaBH4作为助色基团时,对香豆酸在339nm处可形成一个新的吸收峰,且与L-酪氨酸在290nm处形成的吸收峰重叠区域较少(图2A)。由此可知,以MOPS作为发酵培养基培养大肠杆菌BL21(DE3)时,在339nm处以NaBH4作为助色基团可定量检测发酵液中对香豆酸的含量。
利用M9培养基培养野生型的大肠杆菌BL21(DE3)得到的发酵液与NaBH4溶液、对香豆酸混合时会形成沉淀,无法检测对香豆酸。
实施例3 NBH4溶液浓度与发酵液pH对检测结果的影响
(1)利用MOPS培养基培养野生型的大肠杆菌BL21(DE3)48h,随后将发酵液12000rpm离心5min,取上清液作为溶剂(自然pH≈4.5),分别配制质量分数为1%、2%、4%和6%的NaBH4溶液作为溶剂用于检测对香豆酸。
(2)分别以DMSO为溶剂配制浓度为4、8、12、16和20mg/L的对香豆酸标准溶液。将对香豆酸标准溶液分别与步骤(1)得到的浓度为1%、2%、4%和6%的NaBH4溶液等体积混合,随后于多功能酶标仪检测紫外吸收强度,制作标准曲线。以标准曲线R2为评定标准,结果显示如表1:
表1 NaBH4浓度优化
测定结果显示,以MOPS为发酵培养基时,以发酵上清配制0.5%的NaBH4溶液用于检测对香豆酸时,能获得很好的标准曲线(R2=0.9998)。
由于NaBH4是一种强还原剂,在酸性条件下不稳定会生成大量气泡,在碱性条件下却可以稳定存在,而大肠杆菌发酵液显酸性,从而影响了检测准确性。因此,需要对发酵液pH进行调整。利用KOH溶液调节以MOPS培养基、大肠杆菌BL21(DE3)发酵得到的发酵上清的pH分别为4.5(自然pH)、7、8、10和12。应用调节过pH后的发酵上清配制0.5%的NaBH4溶液,随后分别与10mg/L的对香豆酸和50mg/L的L-酪氨酸等体积混合。全波长扫描结果显示在pH=12时具有最大的紫外吸收信号(图2)。由于在高碱性条件下NaBH4可以更稳定的存在,因此可知,pH=12时是对香豆酸检测的最佳检测pH。
实施例4 HPLC与紫外检测方法比较
由于在真实的发酵体系中,需检测的目标化合物往往与中间代谢产物和培养基混合在一起,混合的检测体系可能会对检测的准确性造成干扰。为验证混合体系对对香豆酸的紫外光谱检测方法造成的干扰程度,实验将对香豆酸和其直接前体L-酪氨酸以及以MOPS培养基、大肠杆菌BL21(DE3)发酵得到的发酵上清按照不同的比例混合,从而配制出不同的混合体系,分别利用本发明和常用的HPLC检测方法进行检测。混合体系中的各成分含量见表2。
表2 0.5%NaBH4混合体系各成分比例
当混合体系中L-酪氨酸含量逐渐增加时,以发酵上清配制的0.5%的NaBH4溶液作为助色基团,在339nm处检测时,对香豆酸含量检测结果总体与HPLC检测结果相吻合(误差±10%)(图3)。从而可知此紫外光谱法检测发酵体系中对香豆酸含量具有一定的准确性。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种构建Hi‑C高通量测序文库的方法与制造工艺
- 桑葚病原菌高通量鉴定及种属分类方法及其应用与制造工艺
- 基于高通量测序技术检测乳腺癌/卵巢癌易感基因的多重PCR特异性引物、试剂盒及方法与制造工艺
- 基于高通量测序检测人EGFR基因变异的质控方法及试剂盒与制造工艺
- 基于高通量测序技术的小麦病原微生物检测方法及其应用与制造工艺
- 一种基于二代高通量测序技术的地中海贫血症的基因检测试剂盒的制造方法与工艺
- 一种基于集群的高通量数据分析方法与制造工艺
- 高通量双折射干涉成像光谱仪装置及其成像方法与制造工艺
- 高通量测序检测人循环肿瘤DNA EGFR基因的捕获探针及试剂盒的制造方法与工艺
- 一种高通量测序检测无创亲子鉴定的方法与制造工艺