衍生化HPLC-DAD法测定药物中小分子脂肪胺的方法与流程
本发明属于药品分析检测领域,涉及衍生化hplc-dad法测定小分子脂肪胺的方法,尤其涉及衍生化hplc-dad法测定药物中小分子脂肪胺的方法。
背景技术:
小分子有机胺是指有机类物质与氨发生化学反应生成的小分子有机化合物。除了工业生产外,蛋白质、氨基酸和其它含氮化合物通过微生物发酵降解也会产生相应的小分子有机胺。小分子有机胺因具有较强的碱性和反应活性,在化工和制药领域应用广泛,经常作为药物合成中的有机溶剂、原料和中间体。胺类物质往往具有鱼腥气味或氨的刺激气味,对皮肤、呼吸道、黏膜及眼睛具有强烈刺激作用;而且大部分都有毒性,有的甚至是“三致”物质:文献表明,仲胺(二甲胺、二乙胺等)可与体内存在的亚硝酸根离子反应形成致癌的亚硝胺,从而对人体健康造成威胁。另外,临床上将检测二甲胺的含量作为诊断遗传性代谢性紊乱疾病的重要指标。为了保证药品的安全性,应严格对药品合成过程中可能引入的相关杂质进行质量控制。因此建立高效、简便而灵敏的分析方法对药品中的这类物质进行监控显得尤为重要。
药物中小分子脂肪胺的分析方法的建立存在着诸多的挑战。首先,小分子脂肪胺极性大,挥发性强,结构上缺少紫外发色团或荧光基团,采用一般的分析方法难以对其进行检测;其次,大量药物基质的存在势必产生较强的干扰,因此要求分析方法应具有极高的专属性和灵敏度;再者,由于基质成分的复杂性,药物分析时无法经历复杂的浓缩富集过程以防止药物析出结晶;最后,药品检验是常规工作,不能使用昂贵的试剂或繁琐的前处理操作,且最好使用常规的分析仪器以增加方法的普适性。
目前已报道的测定微量脂肪胺的分析方法很多,包括分光光度法、气相色谱法、离子色谱法、衍生化法等,主要针对于环境样本。夏涛将水样中的二甲胺与氯化铜及二硫化碳反应生成黄棕色二甲氨基二硫代甲酸铜,在430nm处测量溶液的吸光度,比色定量。分光光度法操作简便,但是只能测定总胺的含量,专属性差。气相色谱法结合不同的前处理技术(固相微萃取技术、顶空进样技术和溶剂棒微萃取技术)被报道用于水环境中脂肪胺的测定,这些方法经浓缩富集之后直接分析,无须衍生化,灵敏度高;然而胺分子极性大,容易吸附在硅烷和硅氧烷等极性固定相上,造成峰拖尾,重复性差。ferreira等建立了蒸馏提取-离子色谱法测定海水中残留的铵根离子、甲胺和乙胺,方法的检测限低,回收率良好。然而,考虑到药物合成中存在大量的反簇离子会对实验结果造成干扰,且离子色谱法在药物分析中普适性差,因此并非测定胺类物质的最佳方案。
衍生化法也是测定微量有机胺最常用的分析方法,目前有关胺类物质衍生化法的报道较多,包括衍生化气质联用法、衍生化高效液相色谱法、衍生化毛细管电泳法以及衍生化液质联用法等,这促使了很多衍生化试剂的诞生和发展。氯甲酸-9-芴甲酯、丹磺酰氯、叔丁基溴乙酸乙酯、五氟苯甲醛、1,3,5,7-四甲基-8-(n-羟基琥珀酰亚胺基丁酸酯)-二氟硼酸基-s-吲丹烯等均被用于胺类物质的衍生化分析中。这些衍生化试剂虽然在一定程度上缓解了微量胺类物质难以测定的问题,却存在着不同程度的缺陷,包括基质效应大、衍生化试剂干扰、灵敏度低、选择性差、反应条件苛刻、衍生化试剂难以商品化等。其中过量未反应衍生化试剂的干扰已成为困扰分析学者的主要矛盾之一。衍生化试剂与产物往往具有相似的结构,为了去除过量的衍生化试剂,经常需要结合繁琐的前处理步骤,或者摸索复杂的色谱条件。
技术实现要素:
本发明的目的是针对现有技术的上述不足,提供衍生化hplc-dad法测定小分子脂肪胺的方法。
本发明的另一目的是提供衍生化hplc-dad法测定药品中小分子脂肪胺的方法。
本发明的目的可通过如下技术方案实现:
衍生化hplc-dad法测定小分子脂肪胺的方法,包含以下步骤:
(1)在20~60℃下,以非质子极性溶剂为反应溶剂,在弱碱催化剂的催化作用下,使用卤代硝基苯类衍生化试剂对小分子脂肪胺衍生化反应生成在紫外可见光区(350~450nm)有较强的吸收的产物;
(2)以步骤(1)中衍生化反应结束后的反应液作为进样样品,利用hplc-dad法,基于反相分配色谱法原理在紫外可见光区(350~450nm)测定其中脂肪胺的衍生化产物,从而实现对小分子脂肪胺的定性或定量检测。
所述的小分子脂肪胺选自如式r1nh2所示的伯胺、如式r2r3nh所示的仲胺、含1或2个n的五元或六元饱和或不饱和杂环,其中,r1、r2、r3分别独立的选自c1~c6的烷基;优选的,所述的小分子脂肪胺选自甲胺、二甲胺、乙胺、二乙胺、丙胺、丁胺、吡咯烷或哌啶中的任意一种。
所述的卤代硝基苯类衍生化试剂选自2-硝基氟苯(o-nfb)、4-硝基氟苯(p-nfb)、4-硝基氯苯(p-ncb)、2,4-二硝基氟苯(2,4-dnfb)、2,6-二硝基氯苯(2,6-dncb)、2-硝基-4-三氟甲基氟苯(fnbt)中的任意一种;优选的,所述的卤代硝基苯类衍生化试剂选自2-硝基-4-三氟甲基氟苯。
所述的弱碱催化剂选自碳酸钠、碳酸氢钠、乙酸钠、三乙胺、n,n-二异丙基乙胺中的任意一种;优选的,所述的弱碱催化剂选自n,n-二异丙基乙胺。
所述的非质子极性溶剂选自二甲亚砜、丙酮、乙腈、二甲基甲酰胺、二甲基乙酰胺中的任意一种;优选的,所述的非质子极性溶剂选自二甲亚砜。
优选的,所述的衍生化反应的条件为:在常温(20~30℃)下,以二甲亚砜为反应溶剂,2-硝基-4-三氟甲基氟苯浓度为0.10~0.20mg/ml,1.5%n,n-二异丙基乙胺60~240μl,反应时间为0.5~2h;进一步优选的,衍生化反应的条件为:在常温下,以二甲亚砜为反应溶剂,2-硝基-4-三氟甲基氟苯浓度为0.15mg/ml,1.5%n,n-二异丙基乙胺150μl,反应时间为1.5h。
优选的,所述的hplc-dad法:采用hplc色谱仪;采用反相分配色谱法;以非极性键合相为固定相,采用极性流动相,检测波长位于350~450nm之间,进一步优选位于350~440nm之间,最优选为400~440nm。
更进一步优选的,所述的hplc-dad法使用的仪器为shimadzulc20at液相色谱仪,该色谱仪配制有在线真空脱气机、二元梯度泵,自动进样器、柱温箱、dad检测器和lc-solution色谱工作站;色谱柱采用250mm×4.6mm,5μm的汉邦megresc18;进样量:20μl;流动相流速:1.2ml/min;流动相梯度:a相为甲醇-乙腈(1∶4,v∶v),b相为0.05%甲酸,0min35%b相,8min20%b相,12min20%b相,14min15%b相,16min10%b相,20min35%b相;柱温:40℃;检测波长:416nm。
本发明所述的方法可用于多种样品中小分子脂肪胺的定性与定量检测,优选在测定药物中小分子脂肪胺中的应用。
衍生化hplc-dad法测定药物中小分子脂肪胺的方法,包含以下步骤:
(1)20~60℃下,以二甲亚砜为反应溶剂,在n,n-二异丙基乙胺的催化作用下,使用2-硝基-4-三氟甲基氟苯对待测药物衍生化反应0.5~2h;
(2)以步骤(1)中衍生化反应结束后的反应液作为进样样品,利用hplc-dad法在350~450nm测定其中小分子脂肪胺的衍生化产物,从而实现对药物中小分子脂肪胺的定性或定量检测。
步骤(1)中,优选的,所述的衍生化反应的条件:在常温(20~30℃)下,以二甲亚砜为反应溶剂,2-硝基-4-三氟甲基氟苯浓度为0.10~0.20mg/ml,1.5%n,n-二异丙基乙胺60~240μl,反应时间为0.5~2h;进一步优选的,所述的衍生化反应的条件:在常温下,2-硝基-4-三氟甲基氟苯浓度为0.15mg/ml,1.5%n,n-二异丙基乙胺150μl,反应时间为1.5h。
步骤(2)中,优选的,所述的hplc-dad法采用hplc色谱仪;采用反相分配色谱法;以非极性键合相为固定相,采用极性流动相,检测波长位于350~450nm之间,进一步优选位于350~440nm之间,最优选为400~440nm。
进一步优选的,所述的hplc-dad法使用的仪器为shimadzulc20at液相色谱仪,该色谱仪配制有在线真空脱气机、二元梯度泵,自动进样器、柱温箱、dad检测器和lc-solution色谱工作站;色谱柱采用250mm×4.6mm,5μm的汉邦megresc18;进样量:20μl;流动相流速:1.2ml/min;流动相梯度:a相为甲醇-乙腈(1∶4,v∶v),b相为0.05%甲酸,0min35%b相,8min20%b相,12min20%b相,14min15%b相,16min10%b相,20min35%b相;柱温:40℃;检测波长:416nm。
本发明所述的常温是指常规的分析实验进行的温度,通常为20~30℃之间均可。
和现有技术相比,本发明的有益效果:
本发明基于卤代硝基苯类衍生化试剂的胺类衍生化产物由于硝基苯环上邻位或对位存在烷氨基助色团,紫外吸收带出现明显的红移效应,而大多数药物及其杂质在紫外可见光区(400nm左右)紫外吸收很弱,建立了一种简单、通用的柱前衍生化hplc-dad测定小分子脂肪胺的方法。方法学验证的结果显示药物及其他杂质均不会对分析造成干扰,表明该方法专属性良好。此外,方法的检测限为0.08-0.33nmol/ml,定量限为0.24-0.80nmol/ml,线性关系良好(r>0.999);日内和日间精密度分别小于0.93%和4.82%;平均回收率在81.8%~124.4之间(rsd<2.04%),无明显的基质干扰;且衍生化产物在24h内稳定性良好。
附图说明
图1:分别以2-硝基氟苯(a)、4-硝基氟苯(b)、4-硝基氯苯(c)、2,4-二硝基氟苯(d)、2,6-二硝基氯苯(e)和2-硝基-4-三氟甲基氟苯(f)作为衍生化试剂与甲胺反应前后的紫外吸收光谱图。虚线代表衍生化试剂;实线代表衍生化产物。甲胺浓度为1nmol/ml。
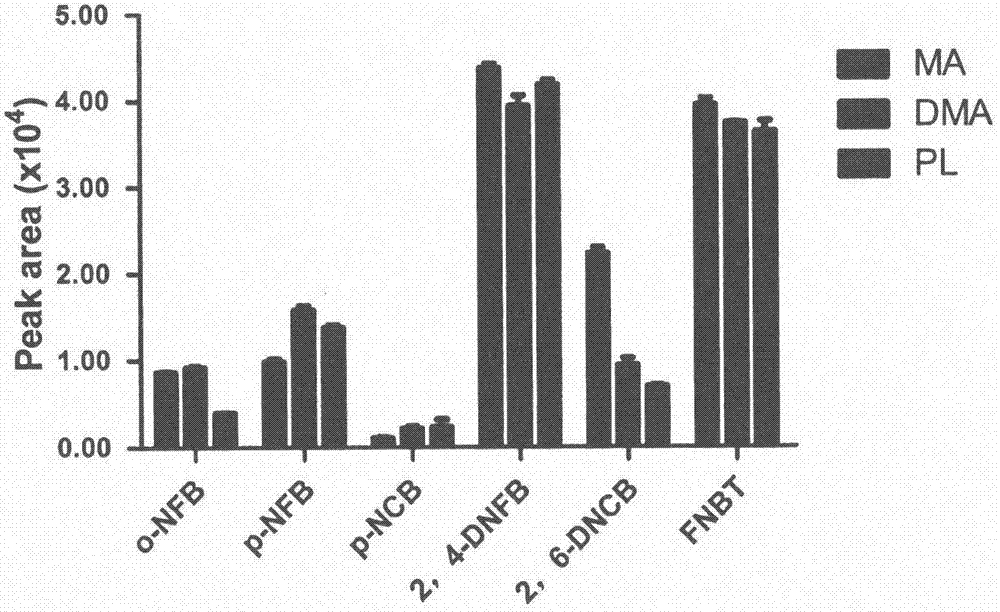
图2:相同浓度下卤代硝基苯类衍生化试剂与代表性胺类反应的产物的在长波长处色谱响应值的比较。所有胺类待测物浓度均为1nmol/ml。
图3:反应条件对脂肪胺衍生化的影响:(a)衍生化试剂用量对衍生化效率的影响;(b)催化剂用量对衍生化效率的影响;(c)反应时间对衍生化效率的影响;(d)反应温度对衍生化效率的影响。所有胺类待测物的浓度均为1nmol/ml。
图4:相同条件下空白溶液(a)、维生素b6(b)、缬沙坦(c)、利伐沙班(d)、塞来昔布(e)、甲磺酸伊马替尼(f)、阿莫西林钠(g)、盐酸二甲双胍(h)、盐酸洛哌丁胺(i)以及8种混合小分子脂肪胺(j)衍生化产物的色谱图:(1)甲胺衍生物;(2)二甲胺衍生物;(3)乙胺衍生物;(4)吡咯烷衍生物;(5)二乙胺衍生物;(6)丙胺衍生物;(7)哌啶衍生物;(8)丁胺衍生物。小分子脂肪胺的浓度均为loq水平。
图5:用2-硝基-4-三氟甲基氟苯分别对空白或加样后的缬沙坦原料药(0.1mg/ml)进行衍生化时得到的色谱图:a.空白缬沙坦原料药(240nm),b.加样后的缬沙坦原料药(240nm),c.空白缬沙坦原料药(416nm),d.加样后的缬沙坦原料药(416nm)。所有胺类待测物的浓度均为2倍loq水平(峰1-8代表8种待测的脂肪胺衍生物,峰9代表缬沙坦原料药中所含的其他内源性杂质)。
具体实施方式
1.1.仪器
shimadzulc20at液相色谱仪(含在线真空脱气机、二元梯度泵,自动进样器、柱温箱、dad检测器和lc-solution色谱工作站);aglient6520lc-tof液相色谱串联质谱仪(含在线真空脱气机、高压二元梯度泵、自动进样器、柱温箱、dad检测器、电喷雾(esi)接口和agilentmasshunteracquisitionsoftwarever.a.01.00工作站);mettlertoledoab135-s分析天平(梅特勒瑞典公司);sartoriousbs110分析天平(北京赛多利斯有限公司)。
1.2.试剂
甲胺盐酸盐(98.0%)、二甲胺盐酸盐(99.0%)、乙胺盐酸盐(98.0%)、正丙胺(99.0%)、正丁胺(99.5%)和吡咯烷(99.0%)均购于阿拉丁试剂公司。二乙胺(99.0%)购于上海凌峰化学试剂有限公司。哌啶(99.9%)购于国药集团化学试剂有限公司。4-硝基氯苯(99.5%)和2,4-二硝基氟苯(99%)购于麦克林试剂公司;2-硝基氟苯(98%)、4-硝基氟苯(98%)、2,6-二硝基氯苯(97%)和2-硝基-4-三氟甲基氟苯(99%)购于阿拉丁试剂公司。
水为娃哈哈纯净水,甲醇(色谱纯)和乙腈(色谱纯)均购于tedia公司,乙醇(分析纯)、丙酮(分析纯)、甲酸(分析纯)和碳酸氢钠(分析纯)等其他试剂均购于南京化学试剂有限公司。
1.3.溶液的制备
甲胺(ma)、二甲胺(dma)和乙胺(ea)储备液:取适量甲胺盐酸盐(二甲胺盐酸盐或乙胺盐酸盐),精密称定,置于10ml量瓶中,用40%乙腈溶解稀释至刻度线,摇匀,制得浓度为0.2mmol/ml的储备液。
正丙胺(pa)、正丁胺(ba)、吡咯烷(pl)和哌啶(pd)储备液:精密移取正丙胺(正丁胺、吡咯烷或哌啶)适量,置于10ml量瓶中,用纯乙腈溶解稀释至刻度线,摇匀,制得浓度为0.2mmol/ml的储备液。
二乙胺(dea)储备液:精密移取二乙胺适量,置于10ml量瓶中,用纯乙腈溶解稀释至刻度线,摇匀,制得浓度为0.1mmol/ml的储备液。
衍生化试剂的配制:分别取上述6种卤代硝基苯类衍生化试剂约200mg,精密称定,置于10ml量瓶中,加乙腈溶解稀释至刻度,摇匀,即得。需新鲜配制。
1.4.衍生化实验条件
样品溶液:精密称定适量药品,置于5ml离心管中,分别加入150μl衍生化试剂和150μl催化剂溶液,用二甲亚砜稀释定容至2ml刻度线,涡旋30s,摇匀。室温下静置反应1.5h后,用二甲亚砜稀释定容终止反应。摇匀,12000r/min高速离心5min,取上清液20μl直接进样。
对照品溶液:精密移取一定体积的脂肪胺储备液,置于5ml离心管中,分别加入150μl衍生化试剂和150μl催化剂溶液,用二甲亚砜稀释定容至2ml刻度线,涡旋30s,摇匀。室温下静置反应1.5h后,用二甲亚砜稀释定容终止反应。摇匀,12000r/min高速离心5min,取上清液20μl直接进样。
1.5色谱分离条件
shimadzulc20at液相色谱仪(含在线真空脱气机、二元梯度泵,自动进样器、柱温箱、dad检测器和lc-solution色谱工作站);色谱柱:汉邦megresc18(250mm×4.6mm,5μm);流动相:甲醇-乙腈(1∶4,v/v)(a相)-0.05%甲酸(b相),梯度洗脱见表1,流速:1.2ml/min;进样量:20μl;柱温:40℃;检测波长:416nm。
表1梯度洗脱程序
实施例1
分别选择甲胺、二甲胺和吡咯烷代表一级胺、二级胺和含氮杂环化合物,用相同浓度的6种卤代硝基苯类衍生化试剂对其进行衍生化。衍生化实验条件见1.4。在相同的色谱条件下,用dad扫描各衍生化产物,记录产物的光谱图和色谱图,以产物的最大吸收波长和吸收强度来评价衍生化试剂的优劣。
图1显示,六种衍生化试剂与甲胺反应生成的产物紫外吸收带均呈现一定的红移,最大吸收波长分别为434nm(2-硝基氟苯)、433nm(2,6-二硝基氯苯)、416nm(2-硝基-4-三氟甲基氟苯)、409nm(4-硝基氟苯)、406nm(4-硝基氯苯)、356nm(2,4-二硝基氟苯)。本实验理想的情况是在紫外可见光区(400nm左右)进行测定,可以使背景干扰降到最低,简化色谱分离条件,提高方法专属性。从图1来看,2,4-二硝基氟苯产物的吸收波长最短,红移效应最不明显,其他代表性脂肪胺衍生物也表现出类似的吸收特性,因此可先将其剔除。
进一步比较各衍生化产物的紫外吸收强度(见图2)。发现2-硝基氟苯、4-硝基氟苯或4-硝基氯苯产物的吸收强度均较弱;2,4-二硝基氟苯和2-硝基-4-三氟甲基氟苯的产物的吸收强度最强;2,6-二硝基氯苯与一级胺的反应产物吸收强度较强,与其他胺类反应产物的吸收强度较弱。这可能与苯环上吸电子取代基对反应中心的活化作用有关。一般来说,如果苯环上有两个吸电子基团,对卤素原子的活化程度更高,有利于亲核试剂进攻形成带负电的中间体,因此单硝基取代的卤代芳烃反应活性明显弱于多硝基取代的卤代芳烃。值得一提的是,当两个硝基基团同时处在卤原子的邻位时,由于空间位阻的影响,亲核试剂不容易进攻卤原子,也会抑制亲核取代,尤其当碳链增长的时候受空间位阻影响明显加深,这就能解释为什么2,6-二硝基氯苯反应活性弱,特别是针对二级胺等大体积胺。
综上,结合表2分析,选择2-硝基-4-三氟甲基氟苯作为合适的衍生化试剂,因为它与胺类反应的产物在416nm处有很强的紫外吸收。既能够产生明显的红移效应,同时提供较高的反应活性,保证方法的专属性和灵敏度。
表2衍生化反应总结
实施例2
为了使衍生化效率达到最高,本实验以生成的衍生化产物的峰面积为指标,单因素考察了不同体积的衍生化试剂(25、50、100、150、200μl)、不同体积的催化剂(15、30、60、120、180、240μl)、反应时间(0、0.5、1.0、1.5、2.0h)和反应温度(20、30、40、50、60℃)对衍生化反应的影响。具体结果见图3a-d。
由图3a可知,在其他条件相同的情况下,加入150μl的2-硝基-4-三氟甲基氟苯(20mg/ml)足以使衍生化反应完全,因此,我们确定衍生化试剂的体积为150μl。由图3b可知,随着加入的催化剂1.5%dipea体积的增加,衍生化产物的响应明显增强,说明一定的碱性条件是有利于芳香亲核取代反应进行的,特别是针对二乙胺以及带有盐酸盐的胺而言。然而,当催化剂体积超过180μl时,丙胺和丁胺衍生化产物的峰面积略有下降,推测是由于碱浓度过高导致的衍生化试剂水解。所以,为了保证衍生化反应快速进行同时防止衍生化试剂水解,我们选择加入150μl的催化剂。同样地,由图3c得出,当反应时间大于1.5h后,衍生化产物的峰面积几乎保持不变,为此确定反应时间为1.5h。由图3d可知,当反应温度高于40℃时,多个衍生化产物的峰面积略有下降,说明高温不利于该反应的进行;由于本实验的目的是建立一种温和的反应条件以避免药物的降解,干扰测定,所以本实验设置的反应温度为室温(25℃)。
最终确定的反应条件:在150μl的1.5%dipea的催化作用下,加入150μl的2-硝基-4-三氟甲基氟苯(20mg/ml),室温下反应1.5h,即得。
实施例3
考察空白溶液(衍生化试剂、催化剂等)对目标衍生物的影响。
由图4a和j可知,在上述色谱条件下,8种脂肪胺衍生化产物与衍生化试剂、催化剂之间分离度较好。考虑到药物基质(维生素b6、利伐沙班、缬沙坦、塞来昔布、甲磺酸伊马替尼、盐酸二甲双胍、阿莫西林钠和盐酸洛哌丁胺)的复杂性,所以本实验在相同的条件下对这8种空白药物进行衍生化,研究其是否干扰目标物的测定。结果如图4b-i,药物基质在待测物的峰处没有干扰,说明该方法的专属性良好。
为了进一步说明红移效应的优势,本研究用2-硝基-4-三氟甲基氟苯分别对空白或加样后的缬沙坦原料药进行衍生化,记录比较了240nm和416nm两种波长检测下的色谱图。发现当检测波长为240nm时,无论是空白(图5a)或加样后的色谱图(图5b),药物基质在待测物的峰处均可能产生干扰。值得一提的是,杂质9与待测物8(丁胺衍生物)的保留时间几乎一致,而杂质9在240nm波长下能够被检测到(图5a),在416nm波长下由于无明显紫外吸收检测不到(图5c),二者的紫外吸收光谱图进一步证明了杂质9非待测物8(丁胺衍生物)。若采用240nm作为检测波长,在实际的杂质检测中可能造成假阳性的结果。相比于低波长,416nm波长下的色谱图尽管在灵敏度上有一定的损失,但是能够提供较为平衡的基线和最少的干扰来保证方法的专属性。
实施例4方法学验证与应用
4.1.专属性
专属性试验主要考察了空白溶液(衍生化试剂、催化剂等)、空白药物基质(维生素b6、利伐沙班、缬沙坦、塞来昔布、甲磺酸伊马替尼、盐酸二甲双胍、阿莫西林钠和盐酸洛哌丁胺)对目标衍生物的干扰。结果如图4,衍生化试剂、催化剂和空白药物基质在待测物的峰处没有干扰,说明该方法的专属性良好。
4.2.线性与范围
分别精密移取各对照品储备液适量置于同一只5ml量瓶中,加二甲亚砜稀释至刻度,制成混合对照品系列浓度溶液。按1.4.项下方法进行衍生化,取20μl注入液相色谱仪,测定各衍生化产物的峰面积。以小分子脂肪胺浓度c(nmol/ml)为横坐标,衍生化产物峰面积(a)为纵坐标,采用最小二乘法进行线性回归分析,计算线性回归方程及相关系数。结果显示,甲胺、乙胺、丙胺、吡咯烷和丁胺线性范围为0.24~2.4nmol/ml;二甲胺线性范围为0.36~3.6nmol/ml;哌啶在0.48~4.8nmol/ml范围内线性关系良好;二乙胺在0.8~8.0nmol/ml范围内线性关系良好。且各待测物线性关系良好(r>0.999)。结果见表3-1。
4.3.检测限与定量限
以信噪比3∶1为方法的检测限,以信噪比10∶1为方法的定量限。结果显示,8种小分子脂肪胺的检测限在0.08~0.33nmol/ml(2.48~23.6ng/ml)之间,定量限在0.24~0.80nmol/ml(7.44~57.1ng/ml)之间。具体见表3-2。
4.4.精密度试验(日内精密度和日间精密度)
按4.2.项下方法配制100%限度水平(0.40~1.65nmol/ml)混合对照品溶液,取100μl上述溶液,置于5ml量瓶中,按照1.4.项下方法加入衍生化试剂及催化剂进行前处理后,日内精密度重复进样6次,日间精密度连续3天每天重复进样6次,以衍生化生成物峰面积计算rsd值。由表3-2可知,此方法的日内精密度和日间精密度良好,rsd分别小于1.0%和5.0%。
4.5.衍生物稳定性
按4.2.项下方法配制100%限度水平(0.40~1.65nmol/ml)混合对照品溶液,取100μl上述溶液,置于5ml量瓶中,按照1.4.项下方法进行衍生化后,分别于室温下放置0、1、2、4、8、12、24h时进行测定,以待测物峰面积的变化考察衍生物的稳定性。由表3-2可知,衍生化产物室温放置时,在24h内峰面积的rsd小于2.0%,即稳定性良好。
表3-1方法学试验结果(一)
x-待测物的浓度(μg/ml),y-峰面积,r-回归方程的相关系数.
表3-2方法学试验结果(二)
4.5.加样回收率
为了评价该方法的准确性,我们分别计算了各小分子脂肪胺的加样回收率。涉及的药物本底包括维生素b6(0.5mg/ml)、利伐沙班(0.3mg/ml)、缬沙坦(0.1mg/ml)、塞来昔布(0.1mg/ml)、甲磺酸伊马替尼(0.4mg/ml)、盐酸二甲双胍(0.2mg/ml)、阿莫西林钠(0.1mg/ml)和盐酸洛哌丁胺(0.2mg/ml)。
回收率样品溶液:精密称取药物适量,置于10ml量瓶中,分为两组,加入混合对照品溶液适量,配制成25%和100%两种限度水平的回收率样品溶液,按1.4项下方法进行衍生化,每个浓度水平6份。取20μl注入液相色谱仪,测定各衍生化产物的峰面积。
回收率对照品溶液:按1.4项下方法分别配制25%和100%两种限度水平的对照溶液,不加药物,按1.4项下方法进行衍生化,每个浓度水平6份。作为回收率的对照溶液。取20μl注入液相色谱仪,测定各衍生化产物的峰面积。
加样回收率=(样品峰面积-本底峰面积)/对照品峰面积×100%。
并计算各个浓度水平加样回收率的平均值和rsd。
由表4-1~表4-3可知,各小分子脂肪胺的加样回收率均在81.8%~124.4%,且rsd均小于12.0%。说明方法的准确度良好,可应用于测定药物中小分子脂肪胺。
表4-18种小分子脂肪胺的回收率试验结果(一)
表4-28种小分子脂肪胺的回收率试验结果(二)
表4-38种小分子脂肪胺的回收率试验结果(三)
a表示药物本底中能检测相应的小分子脂肪胺.
实施例5
根据药物的最大服用剂量以及各杂质ttc值,制备一定浓度药物的供试品溶液。按1.4.项方法进行衍生化,过滤后按照实施例2方法取20μl进样,记录衍生化产物的峰面积,计算待测物在药物中的含量(μg/g)。
结果表明,维生素b6、利伐沙班、缬沙坦、塞来昔布和盐酸洛哌丁胺等5种原料药均未能检测出相应的小分子脂肪胺。甲磺酸伊马替尼原料药中检测出二甲胺,阿莫西林钠原料药中检测出二乙胺,含量均低于定量限水平。5批不同来源的盐酸二甲双胍原料药中均检测出残留有二甲胺,含量在92.0~784.8μg/g,且rsd均小于3%(表5)。上述结果表明二级胺在药物合成中应用更加广泛,这一结论与二级胺可能产物形成潜质的致癌物是相符的。
表55批不同来源的盐酸二甲双胍原料药的检测结果
- 还没有人留言评论。精彩留言会获得点赞!