渗透胁迫泛素化修饰蛋白筛选方法与流程
本发明属于分子遗传育种领域,提供了马铃薯渗透胁迫下泛素化修饰蛋白筛选方法。
背景技术:
马铃薯(solanumtuberosuml.)属于茄科块茎作物,发源于安第斯山脉,具有很高的经济价值。人类驯化并种植马铃薯已有8000多年的历史。2016年世界粮农组织(fao)的统计资料显示,马铃薯全球种植面积达到19,246,462公顷,年产量376,826,967吨(http://www.fao.org/home/en/),仅次于玉米、小麦和水稻,属于第四大粮食作物。截止2018年5月全球共有163个国家种植马铃薯(http://www.fao.org/faostat/en/#data/qc),且种植面积近年来持续增加,许多贫困地区居民的粮食和营养主要来源于马铃薯。马铃薯也是一种理想的食品,含有丰富的淀粉、蛋白质、维生素c、b族维生素、矿物质、β-胡萝卜素、有机酸等营养物质,马铃薯还广泛用作工业原料和燃料生产。
泛素-蛋白酶体系统是最重要的、有高度选择性的蛋白质降解途径,也是重要的蛋白质翻译后修饰方式,研究表明泛素化系统参与调控非生物胁迫等众多生理过程。泛素化系统在植物的胁迫应答中的广泛作用表明泛素化修饰的靶蛋白可能是响应各种胁迫信号通路中的关键蛋白,因此,系统的筛选马铃薯泛素化修饰蛋白,特别是干旱胁迫下泛素化修饰差异蛋白,这对揭示泛素化修饰参与马铃薯干旱胁迫中的生理作用具有重要意义。
现有技术存在的问题:现有技术中未见渗透胁迫下泛素化修饰蛋白筛选方法。
技术实现要素:
鉴于现有技术的不足,本发明提供了马铃薯渗透胁迫下泛素化修饰蛋白筛选方法。
为了达到上述目的,本发明采用了如下的技术方案:马铃薯渗透胁迫下泛素化修饰蛋白筛选方法,包括以下步骤:(1)茎尖脱毒组培苗繁育及分组与胁迫处理;(2)泛素(ub)和26s蛋白酶体(26s)表达量测定并确定取样时间;(3)蛋白质样品制备;(4)蛋白样品胰酶酶解;(5)泛素化肽段富集;(6)lc-ms/ms分析;(7)质谱数据分析。
附图说明
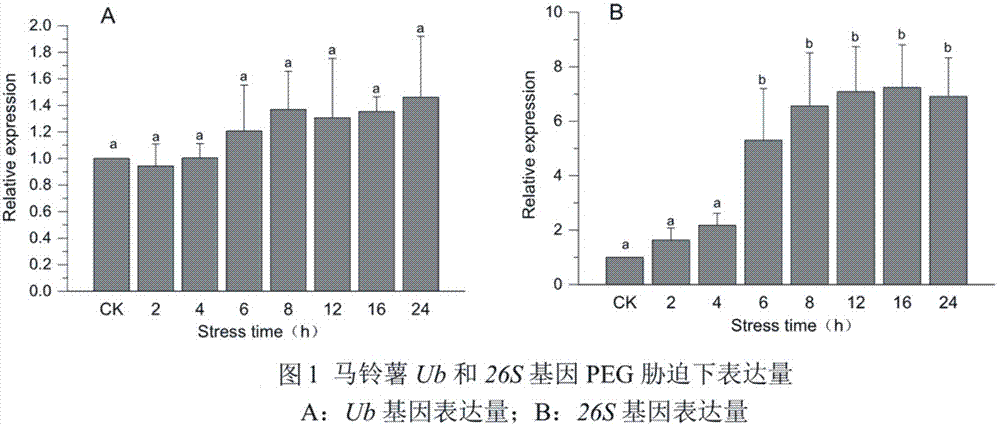
图1为马铃薯泛素(ub)和26s蛋白酶体(26s)表达量随时间变化趋势。
图2-图3为25个马铃薯渗透胁迫下差异泛素化修饰位点。
图4-图12为340个马铃薯渗透胁迫下泛素化修饰位点。
具体实施方式
为使发明的目的、技术方案和优点更加清楚,下面结合附图对本发明的具体实施方式进行详细说明。这些优选实施方式的示例在附图中进行了例示。附图中所示和根据附图描述的本发明的实施方式仅仅是示例性的,并且本发明并不限于这些实施方式。
在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明的技术方案,在附图中仅仅示出了与根据本发明的方案密切相关的结构和/或处理步骤,而省略了关系不大的其他细节。
实施例1
马铃薯渗透胁迫下泛素化修饰蛋白筛选方法,具体包括如下步骤:
1.茎尖脱毒组培苗繁育及分组与胁迫处理
马铃薯栽培品种“atlantic”块茎自冷库中取出,室温下避光放置30d使其发芽。待马铃薯芽长至2cm时,取其芽无菌水冲洗10min,转移至无菌锥形瓶中,采用0.1%hgcl2灭菌1min,转移至新的无菌锥形瓶中,75%乙醇灭菌5min,再转移至新的无菌锥形瓶中,0.05%naclo灭菌15min,无菌水冲洗3遍,最后用灭菌的剪刀剪去芽的底部,转移到固体ms培养基上,20℃光照(2000lx,16h/d)培养20d。待芽初次分化出幼苗时剪取茎段转接到新的ms培养基上,光照培养待用。
取马铃薯组培苗含有两叶片的茎段转接到无菌液体ms培养基中培养,待植株长至6cm高时随机分成8组,每组6瓶,其中7组更换含有20%peg6000的ms培养液,并于0、2、4、6、8、12、16和24h后收集每组中3瓶试管苗鲜叶,液氮速冻后置于-80℃冰箱保存用于rna提取,另外3瓶试管苗植株用蒸馏水冲洗5遍,液氮速冻后置于-80℃冰箱保存用于蛋白质提取。
2.泛素(ub)和26s蛋白酶体(26s)表达量测定并确定取样时间
(1)取马铃薯叶片100mg,采用实施例2所述的方法提取马铃薯总rna,并用微量紫外分光光度计测定rna浓度和纯度,取od260/280位于1.9-2.1之间的rna样品用于后续实验。
(2)上述rna样品置于碎冰中缓慢解冻,tiangenfastquantrt试剂盒室温下解冻后涡旋混匀,再置于碎冰中。
(3)取上述经depc处理的微量离心管加入rna2μg(根据浓度计算得到相应体积)、5×gdnabuffer2μl、rnasefreeddh2o补足至20μl。置于pcr仪上42℃反应3min,使样品中的dna充分水解。
(4)取出上述离心管加入10×fastrtbuffer2μl、rtenzymemix1μl、fq-rtprimermix2μl、rnasefreeddh2o补足至20μl。置于pcr仪上42℃反应15min,95℃变性3min。取出逆转录得到的cdna稀释10倍用于后续qrt-pcr。
(5)从马铃薯基因组数据库(http://solanaceae.plantbiology.msu.edu/index.shtml)中获取ub转录本序列(pgsc0003dmt400089149)、26s蛋白酶体rpt4a亚基转录本序列(pgsc0003dmt400079514)和内参基因ef1α转录本序列(pgsc0003dmt400059830);利用ncbiprimer-blast(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)在线工具在cds区设计引物,并由上海生工合成。ub-f:ttacccttgaggtcgaaagc,ub-r:ttccaactgtttccctgcaa;26s-f:aggtatgtggttggctgtcg,26s-r:ggatcaacttcacgggggagef1α-f:gatggtcagacccgtgaaca,ef1α-r:ccttggagtacttcggggtg。
(6)qrt-pcr反应之前先进行pcr反应,以验证引物特异性。在微量离心管中加入2×mastermix10μl、引物各0.6μl(10μmol/μl)、模板cdna1.0μl、ddh2o7.8μl。pcr反应条件:94℃预变性40s;94℃变性10s,60℃退火30s,72℃延伸20s,38个循环;最后72℃延伸10min;产物经1%琼脂糖电泳检测。
(7)tiangensuperrealpremixplus试剂盒在碎冰中解冻。在96孔板中加入2 ×superrealpremix10μl、50 ×roxreferencedye0.4μl、引物各0.6μl(10μmol/μl)、模板cdna1.0μl,ddh2o补足至20μl。qrt-pcr反应在stratagenemx3005荧光pcr仪上进行,反应条件为:94℃预变性40s;94℃变性10s,60℃退火30s,72℃延伸20s,38个循环;最后72℃延伸10min。每个cdna样品设置3个技术重复,收集各反应ct值,ub和26s相对表达量采用2-δδct法进行计算。数据处理和标准差计算采用excel2016,差异显著性分析采用spss17.0统计软件duncan's新复极差法,作图采用origin9.0。
采用2-δδct法计算渗透胁迫下马铃薯ub和26s基因表达量,结果如附图1所示,马铃薯ub基因表达量在24h的渗透胁迫处理下整体呈上升趋势,但上升幅度未达到显著水平,26s基因表达量也呈上升趋势,并于处理后6h达到显著水平。说明渗透胁迫下马铃薯泛素化修饰水平被加强,并且泛素化修饰水平并不取决于ub在细胞内的浓度,而更可能与26s蛋白酶体的数量有关。
蛋白质翻译的速度取决于编码区的长度和密码子的偏好性,核糖体平均每分钟翻译10-20aa,结合26s蛋白酶体mrna含量在6h达到显著水平,26s蛋白酶体多肽链的翻译大约需要1h,加之多肽链的折叠和多亚基的组装,预计渗透胁迫8h后细胞内26s蛋白酶体含量达到显著水平。因此,本研究采用渗透胁迫处理8h后采样用于泛素化修饰蛋白质分析,将最大限度的检测到泛素化修饰的蛋白。
3.蛋白质样品制备
(1)取对照组和peg胁迫处理8h组马铃薯试管苗各3株在液氮中用研钵磨碎成细粉状,将细粉加入离心管并加入5倍体积1:9混合的三氯乙酸(tca)/丙酮,震荡混匀,置于-20℃冰箱中沉淀4h。
(2)4℃6000r/min离心40min,弃去上清,加入碎冰中预冷的丙酮重悬,再离心洗涤3次,超净工作台中干燥。
(3)称取20-30mg干燥后的粉末,加入30倍体积(m/v)的ua裂解液(8mol/l尿素,150mmol/ltris-hcl,ph8.0),涡旋混匀并重新沉淀。
(4)冰浴中超声破碎,采用工作10s,间歇15s,循环10次,避免产生局部高温,14000r/min离心40min,取上清采用0.22µm滤膜过滤,收集滤液-80℃保存。
(5)采用bradford法进行蛋白质定量,具体操作按说明书进行。
(6)取各组样品蛋白质20µg分别加入5×loadingbuffer,沸水浴5min,然后采用12.5%sds-page14ma电泳90min(经考马斯亮蓝染色)。
4.蛋白样品胰酶酶解
(1)取各组蛋白质样品分别加入二硫苏糖醇(dtt)至终浓度为10mmol/l,置于37℃摇床中600r/min,1.5h,取出冷却至室温,加入碘乙酰胺(iaa)至终浓度50mmol/l,室温避光反应40min。
(2)加入4倍体积50mmol/ltris-hcl(ph8.0)。采用25mmol/lnh4hco3缓冲液稀释4倍使尿素浓度低于2mol/l底物,白酶(trypsin)质量比50:1加入胰蛋白酶,37℃酶切15-18h。加入三氟乙酸(tfa)至终浓度为0.1%,终止酶解反应。
(3)将酶解的肽段采用c18specartridge进行脱盐,真空离心浓缩并冻干,取冻干粉采用40µl0.1%甲酸重悬并测定od280,计算多肽含量。
5.泛素化肽段富集
k-ε-gg肽段富集采用cellsignalingtechnology公司ptmscan®ubiquitinremnantmotif(k-ε-gg)试剂盒按说明书操作进行,具体方法如下:
将多肽冻干粉溶于iapbuffer(50mmol/lmops,10mmol/lna3po4,50mmol/lnacl,ph7.2),12000r/min离心5min。取上清液与含有k-ε-gg抗体的小珠混合,4℃下抗原与抗体结合2h。结合有泛素化肽段的小珠用1mliapbuffer冲洗两次,再用1ml色谱纯水洗三次。最后采用0.15%tfa从小珠上将泛素化肽段洗脱,洗脱液真空干燥。
6.lc-ms/ms分析
将洗脱的泛素化肽段加载到缓冲液a(0.1%甲酸)中,采用c18-反相分析柱,通过流速为300nl/min的缓冲液b(84%乙腈和0.1%甲酸)的进行梯度hplc分离。浓度梯度和时间设为0-55%缓冲液b110min,55-100%缓冲液b5min,100%缓冲液b5min。
样品经hplc液相系统分离后,采用qexactive质谱仪进行lc-ms/ms分析。分析时长为120min,检测方式为正离子,从hcd碎片中扫描(300-1800m/z)最丰富的前体离子(top10),agc目标设置为3e6,最大注入时间为10ms,最大填充时间可能达到的目标值的最小百分比设为0.1%,质谱仪运行肽识别模式。
7.质谱数据分析
质谱结果采用maxquant软件(version1.3.0.5)进行数据库筛选鉴定及定量分析。相关参数和说明如下:允许的最大漏切位点数目设为4,一级离子质量容差设为6ppm,二级级离子质量容差设为20ppm,固定修饰为carbamidomethyl,可变修饰为glygly(k),数据库选择uniprot(http://www.uniprot.org/),计算fdr的数据库模式为reverse,可信肽段fdr≤0.01,可信蛋白质fdr≤0.01,可信修饰位点fdr≤0.01,色谱对齐时间2min。
经lc-ms/ms分析并在uniprot数据库筛选,最终共鉴定到314个泛素化修饰位点分布在200个蛋白质上(如附图4至附图12所示),其中组内有数值样品数大于等于2的泛素化修饰位点共157个。采用significanceb进行对照组和处理组统计学分析,最终鉴定出差异修饰位点25个(如附图2和附图3所示),包括显著上调7个、显著下调2个、处理组特有的15个、对照组特有的1个。
实施例2
本实施例提供植物总rna提取方法,按tiangen质粒小提试剂盒说明书进行操作(有删改),具体步骤如下:
1、圆底离心管、镊子、剪刀、移液枪吸头、研磨棒等器具使用0.1%depc溶液浸泡24h,取出后置于塑料盒中,用报纸包好于高压灭菌锅120℃30min灭菌两次,于超净台中通风干燥,备用。
2、取植物组织约200mg置于圆底离心管,圆底离心管外壁浸入液氮中冷冻(避免液氮进入离心管带来污染),采用研磨棒不断研磨直至样品呈粉末状,期间圆底离心管不断伸入液氮中冷冻。
3、向样品中加入l.0ml裂解液rz,上下颠倒混匀,室温下放置5min,4℃条件下12000rmp离心8min,缓慢吸取上清液至新的离心管中。
4、再加入200μlch3cl,涡旋混匀器震荡混匀,室温下放置3min后在4℃条件下12000r/min离心8min,缓慢吸取上清液(三层中的最上层)至新的离心管中。
5、根据上述液体体积加入约0.5倍体积的无水乙醇,上下颠倒混匀,将溶液连同白色沉淀一起转移到rna吸附柱cr3中,4℃条件下12000rmp离心30s,弃废液。
6、向rna吸附柱cr3中加入去蛋白液rd500μl,4℃条件下12000rmp离心30s,弃废液。
7、向rna吸附柱cr3中加入漂洗液rw500μl,4℃条件下12000r/min离心30s,弃废液,再向吸附柱cr3加入漂洗液rw500μl,4℃条件下12000r/min离心30s,弃废液。
8、将rna吸附柱cr3置于超净台中风干5min,加入0.1%depc水溶液50μl进行洗脱,4℃条件下12000r/min离心3min,回收洗脱液。
9、取1μlrna样品以0.1%depc水溶液为对照采用微量紫外分光光度计测定浓度和纯度,取od260/280位于1.9-2.1之间的rna样品用于后续实验。
有益效果:综上所述通过该方法能够准确并最大限度的筛选出马铃薯渗透胁迫下泛素化修饰蛋白,共得到泛素化修饰位点达到314个,其中渗透胁迫下差异泛素化修饰位点25个,包括3个显著下调和22个显著上调,这些显著变化的泛素化修饰蛋白与渗透胁迫响应有关,因此本申请所述筛选泛素化修饰蛋白的方法对发现响应渗透胁迫的基因和阐明泛素化修饰参与渗透胁迫的机制具有重要意义和显著进步。
以上所述仅是本申请的具体实施方式,仅作为本发明可实施的技术方案提出;应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以对实验步骤做出若干改进和润饰,这些改进和润饰也应视为本申请的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!