具有锂金属或含锂金属的合金作为阳极材料的原电池的制作方法
本申请是专利申请号为201080008412.x,申请日为2010年2月17日,同题的中国专利申请的分案申请。
本发明涉及一种具有锂金属或含锂金属的合金作为阳极材料的原电池。
背景技术:
移动式电子设备总需要较高效率的可充电电池用于独立供电。除镍/镉-蓄电池和镍/金属氢化物-蓄电池外,特别是一种与上述体系相比具有明显更高的能量密度的锂电池也适于此目的。未来,大型的锂蓄电池例如也应适于固定应用(后备电源)以及在汽车领域用于牵引目的(混合驱动或纯电驱动)。当前,为此目的研制和应用含石墨材料作为阳极的锂离子电池。石墨阳极在充电状态通常以不超过每6个碳原子1个锂即相应于极限化学计算量lic6的形式引入(嵌入)。由此得到最大为8.8重量%的锂密度。因此该阳极材料导致这类电池体系所不希望的能量密度限制。
原则上也可使用锂金属或含锂金属的合金(如锂与铝、硅、锡、钛或锑的合金)作为阳极材料来代替锂-嵌入阳极如石墨。与通常的石墨嵌入阴极相比,该原则可实现明显较高的比锂负载量,并由此达到明显较高的能量密度。但遗憾的是,这类含锂金属体系具有不利的安全特性。在不利的运行条件(如高温)下会发生分解反应,其导致危险的失控-状态。然后,该电池步入自热途径,由此可导致爆炸性的气体形成并破坏电池壳。由于由有机溶剂或其混合物如碳酸酯例如碳酸乙烯酯(ec)、碳酸丙烯酯(pc)、乙基甲基碳酸酯(emc)、内酯如γ-丁内酯(γ-bl)或醚如二甲氧基乙烷(dme)组成的常用的电解质溶液的可燃性,其可导致燃烧。因为当前的锂电池含有不稳定的含氟导电盐(lipf6或libf4),则在此事件下还会形成危险的有腐蚀性的和毒性的分解产物(氟化氢和挥发性的含氟有机产物)。由于此种原因,至今仅以微型结构形式如钮扣电池生产含锂金属的可充电电池。
技术实现要素:
本发明的目的在于克服现有技术的上述缺点,并提供一种具有超过锂离子-技术的能量密度的更安全的可充电电池体系。
本发明的目的是通过一种具有锂金属或含锂金属的合金作为阳极材料的原电池实现的,该电池含电解质,该电解质含有在非质子溶剂或溶剂混合物中的锂-双(草酸基)硼酸盐以及至少一种其它的式i和/或式ii的锂络合盐,
其中化合物(i)和/或(ii)在导电盐中的含量为0.01-20mol%,和式(i,ii)中x,y和z是与连到硼原子或磷原子上的两个氧原子相连接的桥,其选自
其中
z=n,n=c;
s,s=c;
o,o=c;
c=c
y1和y2一起表示=o,m=1,n=0和y3和y4各自独立为h或具有1-5个碳原子的烷基,或
y1,y2,y3,y4各自独立为or(其中r=1-5个碳原子的烷基)、h或1-5个碳原子的烷基r1,r2,且其中m,n=0或1。
令人意外地发现,在具有上述络合添加剂之一的混合物中的libob在锂金属表面或锂金属合金表面明显形成薄的极其热稳定的层,该层可非常有效地防止含锂金属阳极材料和电解质成分之间的分解反应。此外,可明显减少在可导致电池破裂的较高温度下不希望有的气体形成。在使用仅含libob作为导电盐或含有含氟导电盐的电解质时观测不到这种效果。
在该原电池中仅含式i和/或ii的化合物之一且用量为0.1-10重量%是有利的。
或者,在该原电池中仅含式i和/或ii的化合物之一且用量为0.2-5重量%。
电解质中仅含无氟材料的原电池是特别优选的。
含锂三(草酸基)-磷酸盐或锂丙二酸基-草酸基硼酸盐作为锂络合盐的原电池是更特别优选的。
此外,电介质呈液态-电解质或凝胶态-电解质存在的原电池是优选的。
在原电池的电解质中的溶剂是碳酸丙烯酯或是碳酸乙烯酯和乙基甲基碳酸酯的混合物是优选的。
本发明的原电池用于制备适用于电牵引或固定式应用的大型电池。
下面以5个实施例、3个对比实施例和5张附图详述本发明。
为论证上述含人意外的观测结果,下面描述使用锂金属/电解质混合物的实验。对这些实验,由锂金属(电池规格的,即na-含量低于200ppm)、锂导电盐(lipf6或libob)和任选的其它锂络合盐如锂三(草酸基)-磷酸盐(litop)或锂丙二酸基-草酸基硼酸盐(limob)制备在常用的溶剂(pc或ec-emc)中的无水混合物,并在充有氩气的手套箱中将约2.5g的该混合物充填入约3ml的啮合型钢质高压容器中。在radex-装置中加热该容器,并测定产生的热效应(dsc)。在另一些实验中,该钢质高压容器与压力测量传感器相连,使得也可观测气体形成。
附图说明
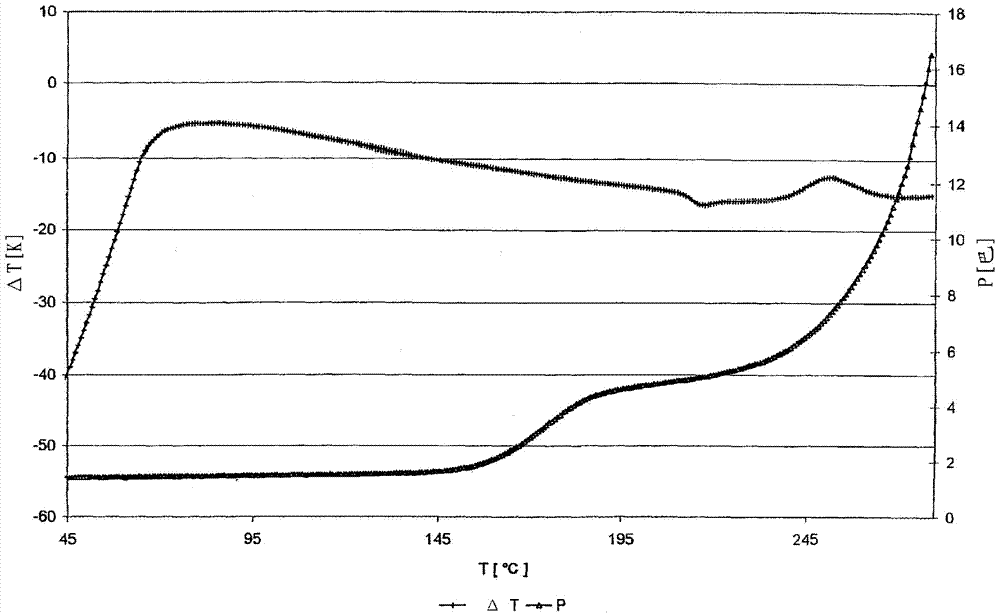
图1表示出在li-金属存在下无氟的基于libob的电解质溶液的特性;
图2表示出在li-金属颗粒存在下含14%libob和1%litop的pc-溶液的同时有压力跟踪的dsc-实验;
图3表示出在li-金属颗粒存在下15%lipf6在pc中的溶液的同时有压力跟踪的dsc-实验;
图4表示出在li-金属颗粒存在下含14%lipf6和1%litop的pc-溶液的同时有压力跟踪的dsc-实验;
图5表示出在li-金属颗粒存在下含libob的无氟的ec-emc(50∶50)溶液的dsc-实验。
具体实施方式
图1中表示出实施例1-3和对比实施例1的在li-金属存在下无氟的基于libob电解质溶液的特性。
在约190-200℃的炉温下的所有实验中,可看出有弱的吸热,这可归因于所含锂金属的熔化。
在非本发明的对比实施例1中,仅使用含15重量%libob的电解质作为导电盐。可看出(红色曲线)峰温约205℃的强的放热事件。相反,如果按实施例1使用含14重量%libob和1重量%limob的pc-溶液(淡蓝色曲线),则观测到明显低的热释放出。在实施例2中用0.3%litop部分取代libob(绿色曲线)和实施例3中用1%litop部分取代libob(深蓝色曲线)的情况下,这种效应明显降低。
在本发明的实施例3中,借助于同时的压力测量表明,几乎没有libob-litop-电解质的放热分解反应(峰温约250℃),仅伴随非常小的气体释放出。
接下来的的对比实施例2表示出基于纯lipf6的电解质溶液的压力特性/温度特性。在炉温超过约210℃时,出现强的放热分解反应,其伴随爆炸性的气体形成。该压力(蓝色曲线)在几秒钟内就从<10巴迅速上升到>250巴。
接下来的实施例4和5(libob/litop电解质溶液)与非本发明的实施例(仅含libob的电解质溶液)相比表明,在溶剂混合物ec-emc中也发生所期望的锂金属稳定化。通过加入litop可将分解的峰温推移约30℃至更高的温度,极明显降低了热释放出,即在本发明的实施例中,在成分锂金属和有机的电解质溶液之间所不希望的分解反应在较小程度上发生。
- 还没有人留言评论。精彩留言会获得点赞!
- 具有金属脊的大功率微波器件的制作方法与工艺
- 金属组件以及具有其的车辆的制作方法与工艺
- 一种具有可冲压性的金属涂料的制作方法与工艺
- 具有接合结构的金属件、制作方法及金属料带与流程
- 具有合金线的护具的制作方法与工艺
- 具有金属壳体的电子通讯设备及其制作方法与流程
- 一种具有抗菌效果的PET/PTT合金的制备方法与流程
- 常压下具有金属特性的Mx′相VO2纳米材料的制备方法与流程
- 具有在不同金属层上的第一和第二读字线及写字线以及跨每个SRAM位单元的边界边缘拆分的相关联着陆焊盘的三端口SRAM位单元的制造方法与工艺
- 具有在不同金属层上的第一和第二读字线及写字线以及跨每个SRAM位单元的边界边缘拆分的相关联着陆焊盘的三端口SRAM位单元的制造方法与工艺