一种快速高效的大蒜组织培养方法与流程
本发明涉及植物组织培养技术,具体设计一种快速高效的大蒜组织培养方法。
背景技术:
大蒜(alliumsativuml.)又名蒜,葫蒜,是百合科葱属二年生草本植物,有“植物黄金”之称,是世界范围内广受欢迎且具有重要食用和药用价值的蔬菜、药物和调味品,也是中国在国际市场上有较强竞争力的重要出口蔬菜,其精深加工产品走俏欧洲和北美。由于大蒜开花结实困难,采用鳞茎进行无性繁殖,不仅用种量大、繁殖系数低,且作为常年无性繁殖的作物,还极易出现细菌、真菌和病毒积累,导致种性退化、产量和品质下降,进而影响我国大蒜产量的发展和大蒜产品的国际市场竞争优势。
组织培养技术能在短时间内获得大量无菌无毒的试管苗,可在一定程度可以克服大蒜用种、用地、用工大,达到恢复种性,增强长势和增加产量的目的。虽然我国大蒜脱毒快繁研究也持续了近30年,但现有的组织培养体系普遍存在着繁殖系数不高、体外繁殖时间长和玻璃化的严重的问题,这都限制了大蒜组织培养技术的规模化应用,给科研和生产造成巨大的损失。
玻璃化,是组织培养中常见的一种形态、解剖和生理紊乱,其影响因素复杂,发生机理仍不清楚。迄今为止,超过200种植物中发现了玻璃化的发生。大蒜玻璃化试管苗呈现半透明水浸状,其组织结构和生理功能异常,分化能力低下,难以恢复、增殖成芽和生根成苗,移栽后成活率低,后期生长差,成为植物组培脱毒快繁、基因遗传转化、种质资源创新和次生代谢产物形成的严重障碍之一。尤其是对于规模化试管苗生产,玻璃化苗数量往往高达几十万甚至上百万株,造成人力、物力、财力等资源的极大浪费。
玻璃化影响因素十分复杂,受到外植体、培养基成分和培养条件的诸多影响,直接导致了玻璃化防控技术的困难。使用一个或者几个控制措施常常并不能理想的预防玻璃化的发生。已报道的对其他物种有效的方法对大蒜玻璃化的防控效果并不好。除此之外,防控玻璃化的方法常常会影响试管苗的繁殖系数。例如,降低细胞分裂素的浓度可以显著降低玻璃化率,但是严重影响了繁殖系数。平衡试管苗再生和玻璃化的发生成为了一个难题。
即使严格控制条件,一旦某个条件控制不当,试管苗玻璃化还时有发生,因此玻璃化的恢复显得尤为重要,但是目前还没有特别有效的玻璃化恢复手段,特别是低成本的玻璃化恢复手段。
为解决现有的大蒜再生体系中存在的玻璃化严重、繁殖系数低、离体培养时间长和快繁成本高的问题,我们建立了一个快速又高效的大蒜试管苗再生体系。
技术实现要素:
本发明的目的是提供一种快速高效的大蒜组织培养方法,解决现有技术中存在的玻璃化严重、繁殖系数低、离体培养时间长和快繁成本高等问题。
本发明的目的可以通过以下措施达到:
一种快速高效的大蒜组织培养方法,包括以下步骤:
步骤(1):取田间自然生长,抽薹后5~10天的大蒜,花茎发育相对高度即花茎高度/假茎高度为0.5~1的大蒜花序轴作外植体;
步骤(2):将步骤(1)中的外植体完全浸没在饱和洗衣粉溶液中表面灭菌25~35分钟,用流水冲洗25~35分钟,将充分洗净的材料置于超净工作台,以70%~75%酒精表面消毒60~90秒,用无菌水冲洗1~3次,接着用1~2%次氯酸钠溶液处理10~15分钟,用无菌水冲洗2~3次;
步骤(3):剥离花序轴外层苞叶,去除所有花序轴表面退化的花原基残留物和膜质苞片,去除花茎0.1~0.3mm以下部分,将无菌的花序轴纵切为2~4块,即花序轴表面体积约为0.25~0.5mm3;
步骤(4):将切割好的外植体接种于不定芽诱导培养基,置于光照强度为50~100μmolm-2s-1,光照时间为12~14h·d-1,22~28℃条件下培养12~25天后获得大蒜不定芽;
步骤(5):待花序轴分化出不定芽,一旦观察到发生玻璃化的不定芽后,尽快将玻璃化试管芽接种到不定芽恢复培养基中,晴天的白天将带有不定芽的培养瓶置于自然光下处理3h~10h,夜晚置于光照强度为100~200μmolm-2s-1,22~28℃的培养间,连续处理1~5天;所述不定芽恢复培养基配比为30~35g·l-1蔗糖,7.0~8.0g·l-1琼脂,ph5.8~6.0;
步骤(6):将步骤(4)或步骤(5)中获得的正常不定芽接种到继代生根培养基中,置于光照强度为100~200μmolm-2s-1,光照时间为12~14h·d-1,22~28℃条件下培养15~25天后,即可获得大量正常大蒜试管苗;
步骤(7):步骤(6)中培养的试管苗,一旦发生玻璃化,尽快将玻璃化试管苗接种到试管苗恢复培养基中,晴天的白天将带有不定芽的培养瓶置于自然光下处理3h~10h,夜晚置于光照强度为100~200μmolm-2s-1,22~28℃的培养间,连续处理1~5天;所述试管苗恢复培养基的配比为30~35g·l-1蔗糖,7.0~8.0g·l-1琼脂,0.5~1g·l-1活性炭,ph5.8~6.0。
本发明步骤(1)中取田间自然生长、抽薹后5~10天,即花茎发育相对高度(花茎高度/假茎高度)为0.5~1的大蒜花序轴作为外植体,这样可以预防花序轴的二次发育,提高再生系数,同时避免花序轴过于幼嫩,防控玻璃化的发生,优选抽薹后5天的花序轴。
步骤(1)采收好的大蒜花序轴当天若没有处理完,可以留3~5cm花茎,在保证花序轴干燥的情况下用保鲜膜密封好,存于2~6℃冰箱冷藏保存。其中:在花序轴抽薹时间期采收花序轴,留3~5cm的花茎,可以避免花序轴顶部退化的花器官吸收花茎营养、二次发育,影响再生系数;保证花序轴的完全干燥,可以避免细菌和真菌滋生;利用保鲜膜密封花序轴,置于2~6℃冰箱或冷库中冷藏保存,减少花序轴的生命活动,最大程度的保证外植体的新鲜。
本发明步骤(2)过程中优选地要保证外植体完整,以免灭菌剂伤害花序轴内部。
本发明步骤(2)花序轴的灭菌处理时,70~75%酒精表面消毒时间为60~90秒,1~2%次氯酸钠溶液处理时间为10~15分钟,以确保灭菌彻底,且不伤害花序轴;用0.1~0.2%的过氧化处理4~6分钟,一方面可以降低污染率,还可以缓解玻璃化的发生。优选75%酒精处理60~90秒,2%次氯酸钠处理15分钟。
作为本发明一种优选方案,步骤(2)处理后的材料用0.1~0.2%的h2o2过氧化处理4~6分钟,用无菌水冲洗3~4次,最后置于无菌滤纸上吸干表面水分,再进行下一步步骤(3)的处理。用0.1~0.2%的h2o2预处理,可以降低玻璃化。
本发明步骤(3)中灭菌后,剥离花序轴外层苞叶,小心去除所有花序轴表面退化的花原基残留物和膜质苞片,防止退化花序轴再发育,影响不定芽再生;合理控制外植体和培养基的接触面积,去除花序轴花茎0.1~0.3mm以下部分,将干净的花序轴纵切为2~4块(花序轴表面体积约为0.25~0.50mm3),可在保证较高繁殖系数的同时,预防玻璃化的发生。优选留外植体下部0.1mm花轴,切割为2块或带0.3mm花轴,切分为4块的外植体。
本发明步骤(4)中的不定芽诱导培养基优选采用1/2~1倍b5培养基,在保证试管苗的营养需要的同时还可以缓解玻璃化的发生;使用1倍浓度以下1/2浓度以上的b5培养基浓度,不会影响不定芽的再生,工厂化生产中还可以用来降低成本。
作为一种优选方案,本发明步骤(4)中所采用的不定芽诱导培养基的配比为0.1mg·l-1萘乙酸,1~2mg·l-16-苄基氨基嘌呤,15~30g·l-1蔗糖,6.0~7.5g·l-1琼脂,ph5.8~6.0;其中:蔗糖浓度为1.5~3.0%,在保证玻璃化率和再生系数不受影响的情况下,使用15~30g·l-1浓度的蔗糖可以降低成本;6-苄氨基嘌呤浓度为1~2mg·l-1,花序轴在此浓度范围下有较高的繁殖系数和较低的玻璃化率;琼脂浓度为6.0~7.5g·l-1,花序轴在此浓度范围内可获得最多的正常不定芽。更优选的,配比为0.1mg·l-1萘乙酸,2mg·l-16-苄基氨基嘌呤,30g·l-1蔗糖,6.5g·l-1琼脂,ph5.8。
本发明步骤(4)中不定芽诱导的光照强度选择为50~100μmolm-2s-1,可以避免光照过弱导致的玻璃化和光照过强导致的不定芽失绿和白化。
本发明步骤(5)发现玻璃化不定芽恢复的过程,通过白天自然光下处理,夜间置于光照强度为100~200μmolm-2s-1的强光下处理,可以加速玻璃化不定芽内水分代谢,促进玻璃化的恢复,恢复率达82.5%以上。
本发明步骤(6)中的继代生根培养基优选为1倍的b5培养基。
作为一种优选方案,本发明步骤(6)中的继代生根培养基的配比为30~45g·l-1蔗糖,7.0~7.5g·l-1琼脂,0.5~1mg·l-16-苄基氨基嘌呤,0.1mg·l-1萘乙酸,0.5~1g·l-1活性炭,ph5.8~6.0;其中:活性炭浓度为0.5~1g·l-1,可以创造黑暗环境,促进试管苗生根。更优选的,配比为30g·l-1蔗糖,7.0g·l-1琼脂,1mg·l-16-苄基氨基嘌呤,0.1mg·l-1萘乙酸,1g·l-1活性炭,ph5.8~6.0。
本发明步骤(6)中光照强度为100~200μmolm-2s-1,可以保证试管苗的能力充足,预防弱光下玻璃化的发生和强光照下的白化情况。
本发明步骤(7)中玻璃化试管苗恢复的过程,通过白天自然光下处理,夜间置于光照强度为100~200μmolm-2s-1的强光下处理,可以加速玻璃化试管苗内水分代谢,促进玻璃化的恢复,恢复率达100%。
本发明的有益效果:
1、繁殖系数高:本发明通过花序轴器官发生途径,通过控制玻璃化的发生和对玻璃化的恢复处理等方式,使得每花序轴的繁殖系数从以前的25.05以下增加到现在的52.0以上,最高可达73.0。
2、玻璃化率低:本发明通过调控外植体、培养基成分和培养条件等因素,以及对玻璃化的恢复处理等,有效的防控了玻璃化的发生,大蒜不定芽的玻璃化率达5%以下,大蒜试管苗的玻璃化率为0%。
3、污染率低:本发明通过控制两种灭菌剂的灭菌时间,在保证较高繁殖系数的同时,大大降低了大蒜试管苗的污染率。
4、操作简单:本方法对花序轴进行处理,和茎尖剥离等其他大蒜试管苗方法相比,操作简单。
5、再生时间短:本发明利用不定芽诱导培养和继代生根培养,两次培养,约在35~50天内获得大量的再生试管苗,试管苗的再生时间缩短为愈伤组织诱导试管苗的1/5~1/3。
6、变异低:利用器官直接再生途径,克服了愈伤组织途径变异率高的问题。
7、节约成本:本发明在保证较高繁殖系数和较低玻璃化率的基础上,合理调节基本培养基和蔗糖等浓度,缩短了培养时间,此外,我们还提供了玻璃化的恢复处理方案,控制了玻璃化的发生,大大降低生产成本。
附图说明
图1大蒜花序轴的预处理;
其中:a.抽薹后5天的花序轴,b.花序轴保鲜预处理,c.花序轴的灭菌处理,d.灭菌后干燥的花序轴,e.剥离花序轴外层苞片、切掉花序轴表面退化的花器官、花序轴纵切2块,f.接种于不定芽诱导培养基,g.诱导的大蒜不定芽,h.诱导的大蒜试管苗;
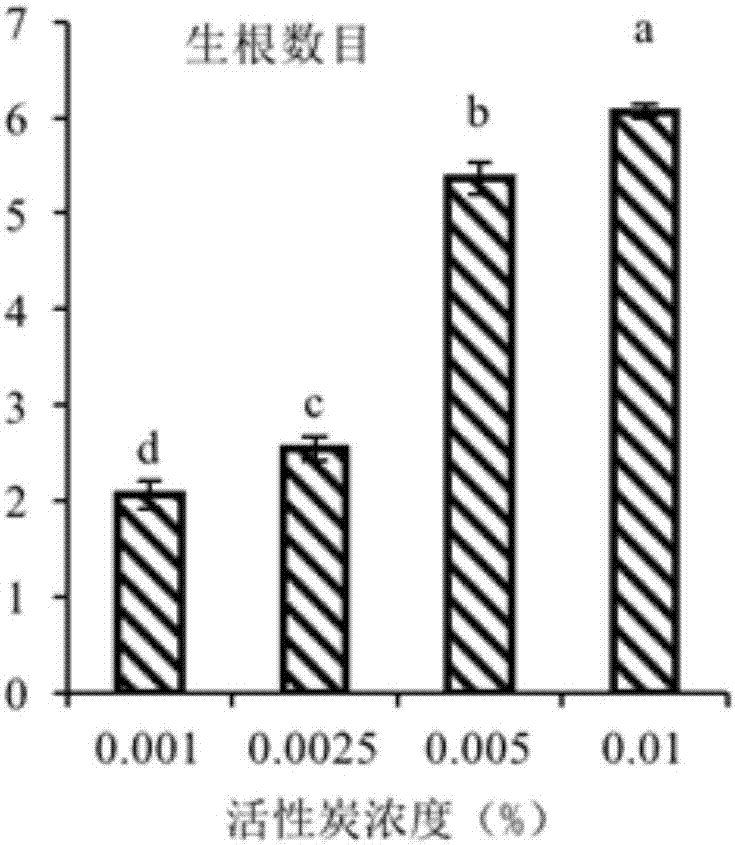
图2活性炭对大蒜试管苗生根的影响;
图3不同保存时间对大蒜花序轴再生的影响。
具体实施方式
通过以下实施例对本发明作进一步的详细说明,但本发明的内容并不局限于此。
实施例1:
供试材料为田间自然生长,自然抽薹后1天、5天、10天和15天的“二水早”花序轴,测量花序轴相对长度后选取花茎直径一致的花序轴,剪下总苞带1cm左右薹段,完全浸没在饱和洗衣粉溶液中约30分钟,用流水冲洗约30分钟表面灭菌,将充分洗净的材料置于超净工作台,以75%酒精表面消毒60秒,用无菌水冲洗1次,接着用2%次氯酸钠溶液处理12分钟,用无菌水冲洗4~5次,最后置于无菌滤纸上吸干表面水分。
剥离花序轴外层苞叶,去除所有花序轴表面退化的花原基残留物和膜质苞片,去除花茎0.3mm以下部分,将无菌的花序轴纵切为4块;
将切割好的外植体接种于诱导培养基(b5培养基,0.1mg·l-1萘乙酸,2mg·l-16-苄基氨基嘌,30g·l-1蔗糖,6.5g·l-1琼脂,ph5.8),置于光照强度为50μmolm-2s-1,光照时间为12h·d-1,25±1℃条件下培养20天后获得大蒜不定芽。
统计每花序轴繁殖系数,玻璃化率和正常不定芽数,相关指标的计算公式如下:
繁殖系数=每花序轴切分数×每外植体再生不定芽数目
玻璃化率=玻璃化试管苗/所有外植体数目×100%
每花序轴正常不定芽数=繁殖系数×(1-玻璃化率)
表1不同生理年龄花序轴对大蒜不定芽繁殖系数和玻璃化率的影响
表注:表中小写字母表示差异显著(p<0.05)
结果表明:本发明所选用的抽薹5~10天的花序轴,可同时具有较高的繁殖系数和较低的玻璃化率,特别是选用抽薹5天的花序轴;低于此范围,则难以产生正常不定芽,致使繁殖系数过低,而高于此范围,则容易导致玻璃化率升高。
实施例2:
参照实施例1所述方法,供试材料为田间自然生长,自然抽薹后5天“二水早”花序轴,剪下总苞带1cm左右薹段,完全浸没在饱和洗衣粉溶液中约30分钟,用流水冲洗约30分钟表面灭菌,将充分洗净的材料置于超净工作台,设9个处理:
t1:75%酒精处理30秒,2%次氯酸钠溶液处理10分钟;
t2:75%酒精处理30秒,2%次氯酸钠溶液处理15分钟;
t3:75%酒精处理30秒,2%次氯酸钠溶液处理20分钟;
t4:75%酒精处理60秒,2%次氯酸钠溶液处理10分钟;
t5:75%酒精处理60秒,2%次氯酸钠溶液处理15分钟;
t6:75%酒精处理60秒,2%次氯酸钠溶液处理20分钟;
t7:75%酒精处理90秒,2%次氯酸钠溶液处理10分钟;
t8:75%酒精处理90秒,2%次氯酸钠溶液处理15分钟;
t9:75%酒精处理90秒,2%次氯酸钠溶液处理20分钟。
用无菌水冲洗5次,最后置于无菌滤纸上吸干表面水分。
其他处理同实验案例1。统计污染率、繁殖系数和玻璃化率,公式同上。
其中,污染率=污染的外植体数目/外植体总数×100%,其他指标计算方法同上。
表2不同灭菌组合对大蒜不定芽污染率、繁殖系数和玻璃化率的影响
表注:表中小写字母表示差异显著(p<0.05)
结果表明:采用本发明所述方案:75%酒精处理60到90秒,2%次氯酸钠处理10到15分钟时,可以在降低污染率和玻璃化率的同时,提高繁殖系数,特别优选75%酒精处理60或者90秒,2%次氯酸钠处理15分钟;若酒精处理时间过短,则容易导致玻璃化率提高,若次氯酸钠处理时间过长,则容易导致玻璃化率,且降低繁殖系数。
实施例3:
参照实施例1所述方法,供试材料为田间自然生长,自然抽薹后5天“二水早”花序轴,75%酒精处理60秒,2%次氯酸钠处理15分钟后,设置0.05%,0.10%,0.20,0.40%的过氧化氢处理5分钟,其他处理和数据统计方法同实验案例1:
表3不同浓度过氧化氢对大蒜不定芽污染率、繁殖系数和玻璃化率的影响
结果表明:采用本发明所述方案,采用0.1~0.2%浓度的过氧化氢可以更进一步预防污染,并明显降低玻璃化率提高繁殖系数,当低于此浓度时不仅污染率会急剧升高,且玻璃化率会显著增加,若高于此浓度,则不仅玻璃化率升高、繁殖系数也会降低。
实施例4:
参照实施例1所述方法,供试材料为田间自然生长,自然抽薹后5天“二水早”花序轴。剥离花序轴外层苞叶,去除所有花序轴表面退化的花原基残留物和膜质苞片,花序轴的切割方式,设9个处理:
t1:去除花序轴0.1mm以下部分,不切割;
t2:去除花序轴0.1mm以下部分,纵切为2块;
t3:去除花序轴0.1mm以下部分,纵切为4块;
t4:去除花序轴0.3mm以下部分,不切割;
t5:去除花序轴0.3mm以下部分,纵切为2块;
t6:去除花序轴0.3mm以下部分,纵切为4块;
t7:去除花序轴0.5mm以下部分,不切割;
t8:去除花序轴0.5mm以下部分,纵切为2块;
t9:去除花序轴0.5mm以下部分,纵切为4块。
将切割好的外植体接种于诱导培养基,其他处理同实施案例1。统计繁殖系数和玻璃化率,公式同上。
表4外植体切割方式对大蒜不定芽繁殖系数和玻璃化率的影响
表注:表中小写字母表示差异显著(p<0.05)
结果表明:本发明所述方案:去除花茎0.1~0.3mm以下部分,将无菌的花序轴纵切为2~4块,可同时具有较高的繁殖系数和较低的玻璃化率,特别是留外植体下部0.1mm,切割为2块和带0.3mm花轴,切分为4块的外植体;当外植体下部所带花茎长度常于此范围,则会导致玻璃化率增加。当外植体不进行切割,会导致较低的繁殖系数;此外,发明人另外发现切分数增加,会导致玻璃化率增加。
实施例5:
参照实施例1所述方法,供试材料为田间自然生长,自然抽薹后5天“二水早”花序轴,将无菌的花序轴纵切为2块,设4个处理:
t1:1/2倍b5培养基;
t2:1倍b5培养基;
t3:1/2倍ms培养基;
t4:1倍ms培养基;
培养基成分及其他处理同实施案例1。
表5基本培养基种类和浓度对大蒜不定芽繁殖系数和玻璃化率的影响
表注:表中小写字母表示差异显著(p<0.05)
结果表明:本发明所采用的b5培养基上试管苗的繁殖系数显著高于ms培养基,玻璃化率显著低于ms培养基,说明本发明所采用的b5培养基更适合大蒜不定芽的诱导。且1/2倍b5培养基和1倍培养基之间的繁殖系数和玻璃化率差异不显著,即适当降低b5培养基的浓度不影响可获得的正常试管苗数目,还可降低成本。
实施例6:
参照实施例1所述方法,供试材料为田间自然生长,自然抽薹后5天“二水早”花序轴,不定芽诱导培养基的配比为:0.1mg·l-1萘乙酸,6-苄基氨基嘌呤,30g·l-1蔗糖,6.5g·l-1琼脂,ph5.8;其中培养基中6-苄基氨基嘌呤的浓度设置4个处理:0.5,1,2,4mg/l。其他处理同案例1,培养20天后统计繁殖系数和玻璃化发生情况。
表6细胞分裂素浓度对大蒜不定芽繁殖系数和玻璃化率的影响
表注:表中小写字母表示差异显著(p<0.05)
结果表明:本发明所选用的6-苄基氨基嘌呤浓度1~2mg/l可同时具有较高的繁殖系数和较低的玻璃化率,当低于此范围时,繁殖系数会降低,当高于此范围时,玻璃化率会急剧增加。
实施例7:
参照实施例1所述方法,供试材料为田间自然生长,自然抽薹后5天“二水早”花序轴,灭菌和切割处理听案例1,不定芽诱导培养基的配比为0.1mg·l-1萘乙酸,1~2mg·l-16-苄基氨基嘌呤,15~30g·l-1蔗糖,琼脂,ph5.8~6.0,其中培养基中琼脂的浓度设置4个处理:0.3,0.45,0.65,0.75mg/l。培养20天后统计繁殖系数和玻璃化发生情况。其他处理同案例1
表7琼脂浓度对大蒜不定芽繁殖系数和玻璃化率的影响
表注:表中小写字母表示差异显著(p<0.05)
结果表明:选用本发明所述的6.0~7.5g·l-1琼脂,可以显著降低玻璃化率,提高正常试管苗的数量,低于此范围则会显著提高玻璃化率。
实施例8:
参照实施例1所述方法,供试材料为田间自然生长,自然抽薹后5天“二水早”花序轴,不定芽诱导培养基的配比为0.1mg·l-1萘乙酸,1~2mg·l-16-苄基氨基嘌呤,15~30g·l-1蔗糖,6.0~7.5g·l-1琼脂,所述的不定芽诱导培养基中,ph设置5个处理:5.4,5.8,6.2,6.4,6.8。培养20天后统计繁殖系数和玻璃化发生情况。其他处理同案例1。
表8ph对大蒜不定芽繁殖系数和玻璃化率的影响
表注:表中小写字母表示差异显著(p<0.05)
结果表明:本发明所选用的ph为5.8和6.0时,可可大大降低玻璃化率,提高繁殖系数和正常试管苗的数量;低于或高于此范围时,玻璃化率会提高,且繁殖系数和正常试管苗数量均会下降。
实施例9:
参照实施例1所述方法,取正常不定芽,接种到继代生根培养基的配比为30~45g·l-1蔗糖,7.0~7.5g·l-1琼脂,0.5~1mg·l-16-苄基氨基嘌呤,0.1mg·l-1萘乙酸,活性炭,ph5.8~6.0,其中活性炭浓度分别设置4个处理:0.001%、0.0025%、0.005%和0.01%,统计试管苗生根情况。其他条件同实施案例1。
结果见图2,本发明所采用的活性炭浓度可以显著增加试管苗的生根率,特别是采用本发明所述的0.5~1g·l-1活性炭,可以显著提高生根率。
实施例10:
参照实施例1所述方法,供试材料为田间自然生长,自然抽薹后5天“二水早”、“徐州白”、“正月早”和“葡萄牙”花序轴,剪下总苞带1cm左右薹段,完全浸没在饱和洗衣粉溶液中约30分钟,用流水冲洗约30分钟表面灭菌,将充分洗净的材料置于超净工作台,以75%酒精表面消毒60秒,用无菌水冲洗1次,接着用2%次氯酸钠溶液处理10分钟,用无菌水冲洗5次,0.1%过氧化氢处理5分钟后,用无菌水冲洗3次,最后置于无菌滤纸上吸干表面水分;剥离花序轴外层苞叶,去除所有花序轴表面退化的花原基残留物和膜质苞片,去除花茎0.2mm以下部分,将无菌的花序轴纵切为2块;将切割好的外植体接种于诱导培养基(1/2倍b5培养基,0.1mg·l-1萘乙酸,1mg·l-16-苄基氨基嘌,15g·l-1蔗糖,6.5g·l-1琼脂,ph5.8),置于光照强度为100μmolm-2s-1,光照时间为12h·d-1,25℃,条件下培养20天后统计获得繁殖系数和玻璃化率。
表9不同品种在优化条件下的不定芽和试管苗再生情况
结果表明,本实施例所述的方法四个品种的繁殖系数较高,玻璃化率都低于5%,在保证较高繁殖系数的同时,大大降低了大蒜试管苗玻璃化率;说明本发明所述方法可适用于不同品种的大蒜,即适用范围更广。
将获得的正常不定芽接种到继代生根培养基(1倍b5培养基,30g·l-1蔗糖,6.5g·l-1琼脂,1mg·l-16-1苄基氨基嘌,0.1mg·l-1萘乙酸,ph5.8)中,置于光照强度为100μmolm-2s-1,光照时间为12h·d-1,25℃条件下培养20天后没有发现玻璃化的试管苗;说明所述方法所获得的不定芽品质稳定,后期不易发生玻璃化。
实施例11:
按实施案例1所述的方法,待花序轴分化出不定芽,一旦观察到发生玻璃化的不定芽后,尽快将玻璃化试管芽接种到不定芽恢复培养基中,晴天的白天将带有不定芽的培养瓶置于自然光下处理3h~10h,夜晚置于光照强度为100~200μmolm-2s-1,22~28℃的培养间,连续处理1~5天;所述不定芽恢复培养基配比为30~35g·l-1蔗糖,7.0~8.0g·l-1琼脂,ph5.8~6.0,通过恢复处理,恢复率达82.5%以上。
同样的,培养的试管苗,一旦发生玻璃化,尽快将玻璃化试管苗接种到试管苗恢复培养基中,晴天的白天将带有不定芽的培养瓶置于自然光下处理3h~10h,夜晚置于光照强度为100~200μmolm-2s-1,22~28℃的培养间,连续处理1~5天;所述试管苗恢复培养基的配比为30~35g·l-1蔗糖,7.0~8.0g·l-1琼脂,0.5~1g·l-1活性炭,ph5.8~6.0,通过恢复处理,恢复率可达100%。
通过两步恢复处理,可以使整个大蒜组织培养方法的玻璃化率总体上降低至5%以下,繁殖系可达73.0。
实施例12:
供试材料为田间自然生长,采收自然抽薹后5天的“二水早”花序轴,花序轴用保鲜膜密封保存,分别以冷藏0、10、20、40天的花序轴为外植体用于实验,其他处理同实施案例1,如图1所示。统计花序轴再生系数。
结果见图3(表注:表中小写字母表示差异显著(p<0.05)),结果表明:本实施例所述的冷藏保存方法对大蒜组培的再生能力具有很好的保护作用,保藏10天以内对大蒜组织培养的再生能力没有影响,随着冷藏保存的时间延长,大蒜的繁殖系数降低,处理40天后的每花序轴再生系数依然较高,为32。
- 还没有人留言评论。精彩留言会获得点赞!