PirB基因敲入的小鼠动物模型及其构建方法与流程
技术领域:
本发明属于遗传学和生物技术领域,具体涉及pirb基因敲入的小鼠动物模型,还涉及上述小鼠动物模型的构建方法。
背景技术:
鼠源成对免疫球蛋白样受体b(pairedimmunoglobulin-likereceptorb,pirb),是人类免疫球蛋白样受体b2(humanleukocyteimmunoglobulin(ig)-likereceptorb2,lilrb2)的同源基因,pirb基因(ncbireferencesequence:nm_011095.2)位于小鼠的7号染色体近端,总大小为8.97kb,编码841个氨基酸,目前鉴定出15个外显子,外显子1起始密码为atg,外显子15的终止密码子是tga(转录本:pirb-201ensmust00000078451.6)。pirb蛋白属于i型跨膜糖蛋白,包含由六个免疫球蛋白样结构域(domain,d)组成(d1-d6)的胞外段,一个疏水的跨膜段,三个免疫受体酪氨酸依赖的抑制序列(immunoreceptortyrosinebasedinhibitorymotifs,itims)和一个itims样序列组成的胞内段。理论上讲,pirb的分子量约为92kd,但是western-blot分析中,pirb经常位于105kd处,因为pirb是糖蛋白。以往研究发现,pirb在免疫系统和中枢调节中均发挥重要作用。
在免疫系统中,pirb在许多造血细胞都有表达,包括b细胞、肥大细胞、巨噬细胞、粒细胞和树突细胞,但是在胸腺细胞、成熟的t细胞和自然杀伤细胞不表达,另外pirb在髓细胞和b细胞的表达随细胞分化和激活增加。在免疫系统,pirb作为主要组织相容性复合物1(classimajorhistocompatibilitycomplex,mhc1)的受体,广泛参与免疫调节,包括中性粒细胞和巨噬细胞整合素通路、细胞毒性t淋巴细胞激活、b淋巴细胞激活和体液—细胞免疫应答等。pirb的前两个细胞外免疫球蛋白结构域(d1-d2)介导mhci和pirb的结合。
在中枢神经系统(centralnervoussystem,cns),pirb在许多脑区包括皮层、海马、小脑和嗅球都有表达,但在成年脊髓不表达。在细胞层面,pirb不仅表达于神经元,也表达于星形胶质细胞。在许多病理条件下,如脑外伤、中风和cns感染,pirb的mrna和蛋白表达水平显著增加。在cns,pirb是髓鞘抑制因子nogo-a、mag、omgp的受体,参与神经元突起芽发和生长锥塌陷,抑制神经元轴突再生和突触可塑性。pirb的细胞外免疫球蛋白结构域(d3-d6)介导了pirb与nogoa的结合。近年来关于阿尔茨海默病(alzheimer’sdisease,ad)研究还发现,pirb是aβ42寡聚体的高亲和力受体,亲和力达到纳摩尔水平。pirb的前两个细胞外免疫球蛋白结构域(d1-d2)介导了aβ42寡聚体和pirb的相互作用,导致丝切蛋白(cofilin)信号通路增强。免疫组织化学染色结果发现,pirb在轴突生长锥表达,位于富含肌动蛋白的前缘和synapsin免疫阳性的囊泡中,在神经元突起的表达呈点状分布。文献表明,pirb表达随年龄增加,特别是在老龄认知损伤的小鼠海马中,pirb能够抑制轴突再生和突触可塑性。研究表明小鼠aβ寡聚体对海马长时程增强的破坏作用需要pirb的参与,在ad转基因模型中,pirb不仅参与成年小鼠记忆缺失,而且介导幼年小鼠视皮层突触可塑性的丢失。这些研究提示我们,pirb参与突触可塑性,抑制pirb可能对ad起到治疗效应。但是在cns,pirb的功能和下游抑制性信号通路仍然未被阐明,因此迫切需要pirb的细胞和动物模型。
目前对于pirb基因功能的研究,多采用可溶性的pirb的胞外段(pirbextracellularpeptide,pep)和抑制剂,或者采用慢病毒转染。前者受到是否能够透过血脑屏障和抑制剂效率的影响,后者慢病毒转染在原代细胞和在体的转染效率比较低,使研究pirb的功能受到极大的限制。为解决这些问题,我们通过crispr/cas9技术建立了pirb基因敲入小鼠,将pirb基因敲入c57bl/6j的rosa26位点,为研究pirb在免疫系统或者神经系统的作用和机制提供了很好的工具。
技术实现要素:
本发明的目的在于提供pirb基因敲入的小鼠动物模型,该模型能够帮助我们研究pirb基因在免疫系统和神经系统的功能以及下游的调节机制。
本发明的另一目的在于提供上述小鼠动物模型的构建方法。
本发明所采用的第一种技术方案是:pirb基因敲入的小鼠动物模型,包括确定pirb基因的待敲入的特异性靶位点grna1和grna2,将pirb基因敲入c57bl/6j小鼠的rosa26基因的内含子1内,所述grna1的基因序列如seqidno.1所示,grna2的基因序列如seqidno.2所示。
本发明所采用的第二种技术方案为:pirb基因敲入的小鼠动物模型的构建方法,具体按照以下步骤实施:
步骤1、基于crispr/cas9技术构建针对c57bl/6j小鼠rosa26基因的特异性grna1和grna2,grna1的基因序列如seqidno.1所示,grna2的基因序列如seqidno.2所示;
步骤2、构建“cagpromoter-loxp-stop-loxp-kozak-mousepirbcds-polya”基因盒打靶载体,将打靶载体进行线性化处理;
步骤3、步骤2中将含有loxp位点打靶载体、步骤1中有活性的grna1和grna2与cas9蛋白共同注射进入代孕小鼠受精卵中,获得f0代小鼠;
步骤4、将步骤3中性成熟的阳性f0小鼠分别与野生型鼠交配繁一代,获得f1代杂合子小鼠,通过pcr、测序和southern杂交确定动物基因型;
步骤5、将步骤4获得的f1代杂合子小鼠近交获得f2代纯合子小鼠,即为本发明构建的一种pirb基因敲入的小鼠动物模型。
本发明所采用第二种技术方案的特点还在于,
步骤1中得到grna1和grna2后分别与trancrrna在25℃孵育10min形成二级结构。
步骤3中grna1、grna2的浓度均为2~10pmol/ul,cas9蛋白的注射浓度为30~100ng/μl。
步骤4中southern杂交采用bamhi和avrii核酸内切酶切割f1代杂合子小鼠的dna。
本发明的有益效果是:本发明提供了pirb基因敲入的小鼠动物模型及其构建方法,本发明的小鼠动物模型对于pirb基因功能的研究和在体验证提供了良好的基础。分离自pirb基因敲入小鼠的细胞还可以用于研究pirb发挥调节作用的下游机制。通过pirb敲入动物模型与不同类型cre小鼠的杂交,可以用于研究ad不同器官或不同细胞类型pirb的调节作用。
附图说明
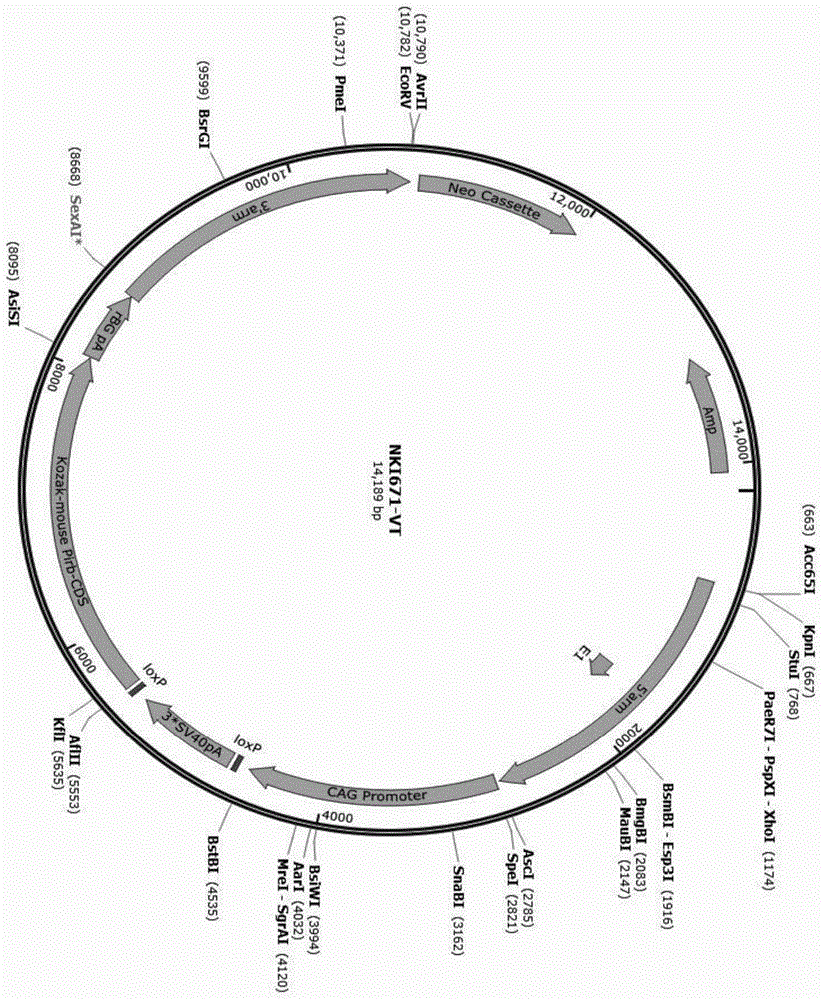
图1为本发明pirb基因敲入的小鼠插入pirb基因cds和loxp位点的打靶质粒载体的构建图;
图2为本发明pirb基因敲入的小鼠模型的构建方法的流程图;
图3为本发明f1代pirb敲入的小鼠的基因型pcr结果鉴定电泳图;
图4为本发明f1代pirb敲入的小鼠验证pirb基因敲入效果的测序峰图;
图5为本发明f1代pirb基因敲入的小鼠进行southern鉴定的方法示意图;
图6为本发明f1代pirb基因敲入的小鼠进行southern鉴定的结果图。
具体实施方式
下面结合附图和具体实施方式对发明作进一步阐述。
本发明构建了pirb基因敲入的小鼠动物模型,将pirb基因敲入c57bl/6j小鼠的rosa26基因的内含子1内。具体来说,构建一个cagpromoter-loxp-stop-loxp-kozak-mousepirbcds-polya的基因盒,将其克隆进入rosa26基因的内含子1中。
rosa26基因(ncbireferencesequence:nr_011095.2)位于小鼠的七号染色体。
本发明pirb基因敲入的小鼠动物模型的构建方法,具体按照以下步骤具体实施:
步骤1、根据小鼠rosa26基因(genebank:nr_027008.1))序列,利用cas-desigher软件在1号内含子设计grna靶序列,并搜索小鼠dbm-db基因组数据库基因,采用crispr脱靶效应软件cas-offinder检测潜在的脱靶位点:最终选取两个grna,grna1的基因序列如seqidno.1所示,grna2的基因序列如seqidno.2所示:
seqidno.1:ggcaggcttaaaggctaacctgg
seqidno.2:ctccagtctttctagaagatggg
将grna1和grna2分别与trancrrna在25℃孵育10min形成二级结构;
步骤2、利用c57bl/6小鼠文库bac克隆,通过pcr扩增获得pirb基因cds的同源臂,采用in-fusion方法构建含有cagpromoter-loxp-stop-loxp-kozak-mousepirbcds-polya的基因盒的质粒打靶载体,通过酶切、pcr及测序对打靶质粒载体进行验证,图1为构建好的pirb基因打靶载体的示意图。
步骤3、pmsg处理c57bl/6雌性小鼠(6周龄,平均体重20g),46h后注射hcg,与雄性小鼠合笼交配,次日取受精卵进行显微注射,将步骤1的grna1、grna2、cas9蛋白以及线性化后的打靶载体一起注射到受精卵中,取注射后存活的受精卵移植到假孕母鼠体内,产出小鼠,即f0代小鼠。
上述步骤中grna1、grna2的浓度均为2~10pmol/ul,cas9蛋白的注射浓度为30~100ng/μl,cas9蛋白购自newenglandbiolabs,货号为m0386m。
步骤4、提取f0代小鼠尾部dna,pcr扩增产物测序,鉴定是否为嵌合体。
本发明用于f0代小鼠pirb基因pcr鉴定的特异性引物如下:
pcrprimers1(annealingtemperature60.0℃):
5’armforwardprimer(f1):
5’-tacgccacagggagtccaagaatg-3’
5’kireverseprimer(r1):
5’-gatggggagagtgaagcagaacg-3’
pcrprimers2(annealingtemperature60.0℃):
3’kiforwardprimer(f2):
5’-ctgctgtccattccttattccatag-3’
3’armreverseprimer(r2):
5’-ctggaaatcaggctgcaaatctc-3’。
primers1对应的扩增产物大小为2.7kb,primers2对应的扩增产物为2.5kb。
用于f0代小鼠测序的引物如下:
sequencingprimerforpcrproduct1:
5’sequenceprimer(f3):
5’-cacttgctctcccaaagtcgctc-3’
sequencingprimerforpcrproduct2:
3’sequenceprimer(r3):5’-atactccgaggcggatcacaa-3’
步骤4、鉴定为pirb基因敲入的f0代雄性小鼠7周龄、雌性小鼠6周龄分别与野生型异性小鼠交配获得f1代杂合子小鼠,图2为本发明f1代杂合子小鼠pirb基因敲除小鼠的流程图,小鼠出生后20天进行pcr鉴定,若有阳性小鼠出生,则表示转基因已经整合到生殖细胞。
(1)通过pcr方法对获得的f1代小鼠进行基因型的鉴定:
(a)dna的提取:
方法1:采用takaraminibestuniversalgenomicdnaextractionkit(ver.5.0_codeno.9765)来获得高纯度的基因组dna。
步骤a.每只小鼠剪下一段尾巴(2~5mm),放入离心管中,加入180μlbuffergl,20μl蛋白激酶k和10μlrnasea。
步骤b.将步骤a离心管内于56℃孵育过夜。
步骤c.过夜后12000rpm离心2min去除杂质。
步骤d.加入200μlbuffergb和200μl无水乙醇,充分混匀。
步骤e.将吸附柱放在收集管上,将步骤d得到的样品加到吸附柱里,12000rpm离心2min,弃掉收集管中液体。
步骤f.弃去液体后在吸附柱中加入500μlbufferwa,12000rpm离心1min,弃掉收集管中液体。
步骤g.在收集管中加入700μlbufferwb,12000rpm离心1min。弃掉收集管中液体。
注意:bufferwb需要与100%乙醇预混,沿管壁加入bufferwb冲走残余的盐。
步骤h.重复步骤g一次。
步骤i.将步骤h的吸附柱放入收集管,12000rpm离心2min。
步骤j.吸附柱放到一个新的1.5ml的离心管,在吸附柱膜中央加入50~200μl灭菌水或者洗脱液,停留5min。(将无菌水或者洗脱液加热到65℃能够增加洗脱的得率)。
步骤i.基因组dna定量,洗脱的基因组dna可以通过电泳鉴定。
方法2:一种低成本基因组dna的粗提方法:
步骤a.每只小鼠剪下一段尾巴(2-5mm),放入离心管中,加入100μl尾部消化缓冲液,注意不要剪尾太长;
步骤b.将离心管及其内容物于56℃孵育过夜;
步骤c.过夜后将离心管于98℃孵育13min,使蛋白酶k失活;
步骤d.在微型离心机以最大转速旋转15min,上清直接用于pcr体系(每50μlpcr体系加入上清2μl)。
尾消化缓冲液成分:
50mmkcl
10mmtris-hcl(ph9.0)
0.1%tritonx-100
0.4mg/mlproteinasek
(b)长链pcr反应:
长链引物:
pcrprimers1(annealingtemperature60.0℃):扩增片段:2.7kb
5’armforwardprimer(f1):
5’-tacgccacagggagtccaagaatg-3’
5’kireverseprimer(r1):
5’-gatggggagagtgaagcagaacg-3’
pcrprimers2(annealingtemperature60.0℃):扩增片段:2.5kb
3’kiforwardprimer(f2):
5’-ctgctgtccattccttattccatag-3’
3’armreverseprimer(r2):
5’-ctggaaatcaggctgcaaatctc-3’
pirb基因敲除型有上述两条扩增片段,野生型等位基因没有扩增产物。
pcrmix:
反应条件:
pcr扩增产物的电泳鉴定结果如图3所示,从图3中可以看出,6、8、9号为pirb基因敲入小鼠在2.7kb、2.5kb有特异性扩增产物,wt小鼠pcr产物没有这两个扩增产物。
(c)短链pcr反应,引物如下:
primers(annealingtemperature60.0℃):
forwardprimer(f4):5’-aacaatcaggctgccgaatctg-3’
reverseprimer(r4):5’-ctttattagccagaagtcagatgc-3’
expectedpcrproduct:
targetedallele:344bp
pirb基因敲入型小鼠能够扩增出344bp的产物,而野生型没有。
pcr体系:
反应条件:
(2)f1代小鼠测序:
通过pcr扩增后测序鉴定小鼠基因型,如图4所示,为6号pirb基因敲入小鼠测序峰图,pcr所用引物如下:
sequencingprimerforpcrproduct1:
5’sequenceprimer(f3):
5’-cacttgctctcccaaagtcgctc-3’
sequencingprimerforpcrproduct2:
3’sequenceprimer(r3):
5’-atactccgaggcggatcacaa-3’
(3)southern杂交检测f1代小鼠基因型:
采用bamhi和avrii核酸内切酶切割dna分子,切割示意图如图5。具体的southern杂交检测过程如下:
步骤a、提取f1代小鼠尾部dna;
步骤b、制备探针,通过pcr方法将dig-dutp渗入到步骤a的dna分子中;
f1代小鼠southern印记的5’探针引物如下:
primersfor5’probe:
5’probeforwardprimer:
5’-aaacgtggagtaggcaatacccagg-3’
5’probereverseprimer:
5’-aaagaagggtcacctcagtctccct-3’
primersfor3’probe:
3’probeforwardprimer:
5’-ttctgggcaggcttaaaggctaac-3’
3’probereverseprimer:
5’-aggagcgggagaaatggatatgaag-3’
southern印记的目标片段大小如下:
5’probe-bamhi:5.83kb-wt,4.80kb-mt
3’probe-avrii:5.27kb-wt,11.12kb-mt。
步骤c、采用限制性内切酶bamhi和avrii对dna进行切割;琼脂糖凝胶电泳分离dna;
步骤d、将dna转到尼龙膜上;
步骤e、探针变性后,与dna分子进行杂交,nbt/bcip化学显色法显色,拍照观察。southern杂交结果如图6所示,可以看到:6、8、9号pirb基因敲除小鼠如果被bamhi切割,在5.83kb和3.56kb有两个片段,wt小鼠只在5.83kb处有一个切割片段,如果被avrii切割,pirb基因敲除小鼠在11.12kb和5.27kb有两个片段,wt小鼠只在5.27kb处有一个切割片段。
步骤6、将f1代杂合子小鼠近交获得f2代纯合子pirb基因敲入小鼠,即为本发明所述小鼠pirb基因敲入的动物模型。
将本发明获得的动物模型f2代纯合子小鼠与同品系小鼠组织/细胞特异性cre表达的小鼠杂交,获得f3代小鼠,可以实现在不同组织或者细胞类型中敲入pirb基因。
对f3代小鼠进行基因型的鉴定:含有无(pirb-cwt)、一个(pirb-chet)或者两个(pirb-cki)pirb基因敲入的小鼠,pirb基因敲入到特异性组织或细胞中。其中pirb-cwt小鼠表达cre,但不含有loxp-pirb等位基因,pirb-chetandpirb-cki小鼠表达cre并分别含有一个或者两个loxp-pirb等位基因。
其中f3代杂交小鼠纯合子/杂合子鉴定所用的pcr引物如下:
f3:5’-cacttgctctcccaaagtcgctc-3’
r3:5’-atactccgaggcggatcacaa-3’
f5:5’-gcatctgacttctggctaataaag-3’
homozygotes:644bp
heterozygotes:644bp/453bp
wildtypeallele:453bp
组织特异性的基因敲入也可以通过加入另一对引物,用pcr来验证:
pcrforconstitutivekiallele:
f6:5’-ggcaacgtgctggttattgtg-3’
r6:5’-ggctgtactctgaggataggcttag-3’
f7:5’-agatctgcaagctaattcctgc-3’
withcki:1180bp/215bp
constitutivekiallele:303bp
注意:如果dna的样本不够纯,或者pcr的延伸时间不够长,可能扩增不出来1180bp的产物。
cre阳性pcr鉴定所需的引物如下:
forward:5’-gaacgcactgatttcgacca-3’
reverse:5’-gctaaccagcgttttcgttc-3’
creamplicon:204bp。
序列表
<110>西安医学院
<120>pirb基因敲入的小鼠动物模型及其构建方法
<130>2019
<160>2
<170>siposequencelisting1.0
<210>1
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>1
ggcaggcttaaaggctaacctgg23
<210>2
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>2
ctccagtctttctagaagatggg23
- 还没有人留言评论。精彩留言会获得点赞!