沙棘黄酮及其应用的制作方法
本发明涉及生物医药
技术领域:
,特别是涉及一种沙棘黄酮及其应用。
背景技术:
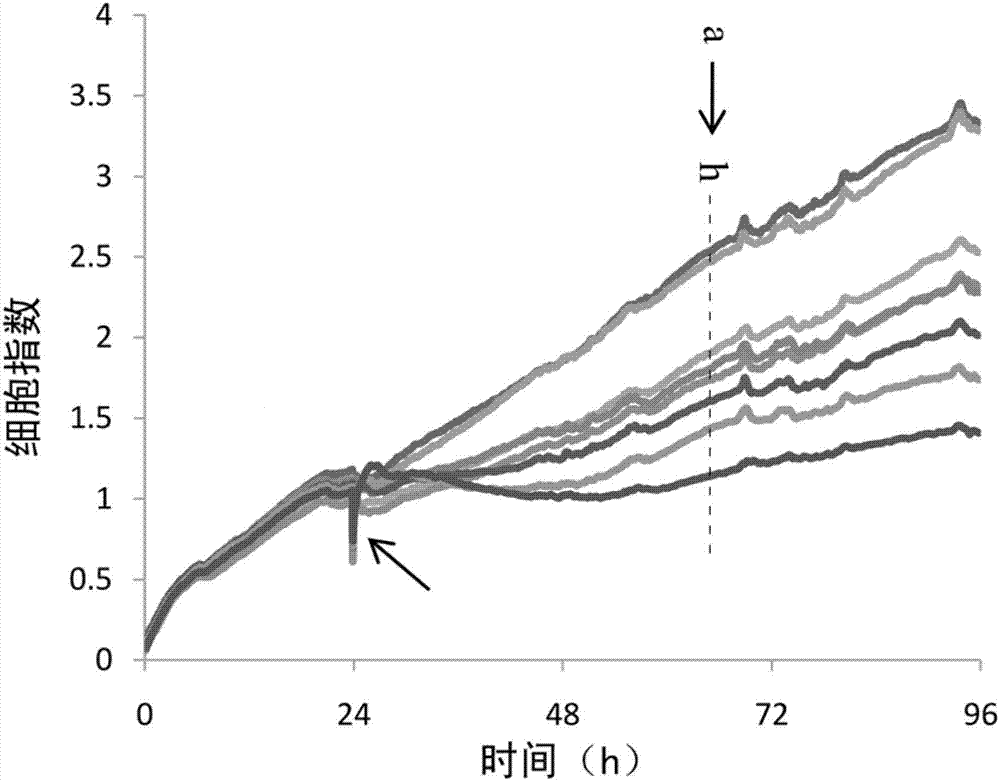
:前列腺癌是指发生在前列腺的上皮性恶性肿瘤。2004年who《泌尿系统及男性生殖器官肿瘤病理学和遗传学》中前列腺癌病理类型上包括腺癌(腺泡腺癌)、导管腺癌、尿路上皮癌、鳞状细胞癌、腺鳞癌。其中前列腺腺癌占95%以上,因此,通常所说的前列腺癌就是指前列腺腺癌。前列腺癌是西方国家男性发病率居于第一位、致死率居于第二位的恶性肿瘤。近几年,我国男性的前列腺癌发病率也逐年升高,尤其是我国正步入老龄化社会,未来数十年很有可能出现前列腺癌发病高峰。2012年我国肿瘤登记地区前列腺癌发病率为9.92/10万,列男性恶性肿瘤发病率的第6位。发病年龄在55岁前处于较低水平,55岁后逐渐升高,发病率随着年龄的增长而增长,高峰年龄是70~80岁。家族遗传型前列腺癌患者发病年龄稍早,年龄≤55岁的患者占43%。前列腺癌由于其生理位置的隐蔽性,且早期常无症状,往往容易被忽视,诊断发现后大多处在中晚期,从而失去了治疗的最佳时间。化学药物疗法在治疗前列腺癌中占有重要地位。然而,近几年新生产的化疗药物在药物靶向性和全身毒性方面效果一直不好,这使得从天然植物中寻找药物活性成分成为开发抗前列腺癌药物的重要手段。沙棘(hippophaerhamnoidesl.)又名醋柳、黑刺,属胡颓子科沙棘属植物,广泛分布于我国西北部地区,是我国藏医传统习用药材。目前,沙棘作为药食两用作物被允许使用在食品、药品等行业,具有广泛的应用前景。沙棘黄酮是沙棘果实和沙棘叶中黄酮的总称,不同产地来源和不同活性部位其黄酮成分和含量有较大差异,但主要都以槲皮素苷元、异鼠李素苷元、山奈酚及其苷类为主。黄酮类物质是沙棘最主要的活性成分之一,现代医学证明,沙棘黄酮在降血脂、降血糖、提高心肌耐缺氧能力、抗氧化、抗肿瘤等方面具有较好的生理功效。公开号为cn105982928a的中国发明专利公开了沙棘果抗肿瘤提取物及其组合物的医药用途和制备方法。一种维吾尔药沙棘果提取物,维吾尔药沙棘果经溶剂超声提取,提取液浓缩后,用硅胶柱分离,上样后的硅胶柱,先用体积比为100∶0-100∶10的二氯甲烷:甲醇混合溶剂洗脱,继用体积比100∶12-100∶17的二氯甲烷:甲醇混合溶剂洗脱,用体积比为100∶12-100∶17的二氯甲烷:甲醇混合溶剂洗脱的洗脱液经回收溶剂,干燥即为该提取物。还公开了所述维吾尔药沙棘果提取物在制备预防及治疗乳腺癌、肺癌、胃癌、结肠癌、胰腺癌、宫颈癌、脑胶质瘤或肝癌中的应用。目前尚无沙棘黄酮用于抗前列腺癌的相关文献报道。技术实现要素:本发明提供了一种沙棘黄酮及其应用,该沙棘黄酮为利用本发明方法从沙棘中提取,对前列腺癌具有一定的疗效。沙棘黄酮,由沙棘果提取获得,所述提取方法包括以下步骤:(1)沙棘果经有机溶剂超声提取获得提取液;(2)提取液浓缩并去除有机溶剂获得粗提物;(3)粗提物经柱层析分离纯化获得洗脱液;(4)洗脱液经酸水解获得所述沙棘黄酮。步骤(1)用于初步提取沙棘果的有效成分,可以多次抽提后合并提取液。所述的沙棘黄酮,步骤(1)中有机溶剂为60%~80%的乙醇溶液。所述的沙棘黄酮,超声时的温度为50℃~60℃。超声辅助提取,超声时,适当的提高温度有利于有效成分溶解到有机溶剂中。步骤(2)中去除步骤(1)中的有机溶剂,可以通过多种方法,比如说减压蒸馏,或者浓缩后冷冻干燥得到粉末状的粗提物,下一步分离纯化时再用水复溶。步骤(3)中,柱层析分离主要去除的是糖类、蛋白质、鞣制等物质。所述柱层析使用ab-8大孔树脂作为填料。ab-8型大孔吸附树脂是苯乙烯型弱极性共聚体,比表面积在480-520m2/g左右,适合黄酮类化合物的纯化;其他类似的填料还有d-101,hp-20等。所述的沙棘黄酮,大孔吸附树脂分离时使用50%乙醇作为洗脱溶剂。使用ab-8大孔树脂作为填料时,上样后,先用水洗,再用10%乙醇、30%乙醇梯度洗,洗去杂质后,最后再用50%乙醇洗脱,以50%乙醇洗脱下来的组分用于下一步的酸水解。当然,洗杂时的乙醇浓度可以适当变动,以洗净杂质为准,而洗脱时乙醇的浓度也可以适当变动,以能够将目标物洗脱下来为宜。所述的沙棘黄酮,步骤(4)中酸水解所使用的水解液为盐酸-甲醇溶液,由质量浓度为2%~6.5%的盐酸与甲醇按体积比1∶3~5混合获得。酸水解,也可以使用硫酸或醋酸等其他酸。甲醇是作为溶剂使用,其他醇也是可以使用具有相同作用,比如乙醇。酸水解是将糖苷水解成为苷元和糖基。所述的沙棘黄酮,酸水解前,将洗脱液浓缩、冷冻干燥去除溶剂。所述的沙棘黄酮,酸水解温度为60~80℃,水解时间为3~5h。所述的沙棘黄酮,以质量比计,槲皮素苷元含量不低于4.20%、异鼠李素苷元含量不低于17.50%。本发明还提供了所述的沙棘黄酮在制备预防或治疗前列腺癌的药物或保健食品中的应用。本发明沙棘黄酮由沙棘果经有机溶剂粗提,再经柱层析分离纯化,然后酸水解获得。不同的提取方法对沙棘黄酮中各有效成分的含量具有较大的影响。本发明沙棘黄酮经研究发现对前列腺癌具有一定的治疗和预防效果,能够被用于制备预防或治疗前列腺癌的药物或保健食品。附图说明图1为实施例5中mtt法检测细胞活性结果图,其中,*表示与对照组相比,p<0.01,具有显著性。图2为rtca实时监测沙棘黄酮对细胞影响的结果图,其中,曲线a~h分别代表沙棘黄酮浓度0、0.78、1.56、3.13、6.25、12.5、25、50μg/ml。图3为细胞迁移实验24h时的结果图,其中,图a为对照组,图b沙棘黄酮浓度为100μg/ml,图c沙棘黄酮浓度为200μg/ml。图4为实施例8中细胞凋亡实验结果图,其中,图a为对照组,图b为沙棘黄酮浓度为50μg/ml。图5为实施例8中细胞凋亡实验的统计结果图,其中,“*”表示与对照组相比具有显著性差异。图6为实施例9中细胞周期实验结果图,其中,图a为对照组,图b为沙棘黄酮浓度为50μg/ml。图7为实施例9中细胞周期实验的统计结果图,其中,“*”表示与对照组相比具有显著性差异。图8为对比例1中mtt法检测细胞活性结果图。具体实施方式实验材料和仪器:雄激素非依赖性前列腺癌pc-3细胞(来源:中国科学院上海生命科学研究院细胞库);bio-rad680酶标仪(美国bio-rad公司);rtcas16实时无标记细胞功能分析仪(艾森生物(杭州)有限公司);噻唑蓝(mtt)(北京雷根生物技术有限公司);6ht流式细胞计(美国bd公司);annexinv/pi细胞凋亡检测试剂盒(索莱宝生物科技有限公司);dna含量(细胞周期)检测试剂盒(索莱宝生物科技有限公司)培养基:含有10%胎牛血清和1%链霉素、赤霉素的dmem/f12培养基(hyclone公司)。实施例1取干燥沙棘果100g,加入10倍体积(1.0l)70%乙醇溶液,55℃超声辅助提取1h,重复3次,过滤,合并滤液,减压蒸馏,除去乙醇,浓缩样品,经冷冻干燥后得到沙棘果粗提物粉末23.6g;取上述沙棘果粗提物粉末10.0g,加水100ml复溶,取上清液过ab-8大孔树脂,其中,上样速率为0.2bv/h,吸附一晚。依次用10%、30%、50%乙醇梯度洗脱,洗脱流速为40ml/min,共洗脱1.5bv,保留50%乙醇洗脱组分,浓缩,冷冻干燥;取冷冻干燥所得粉末1.0g,加入600ml水解液,水解液由质量浓度为4%的盐酸与甲醇按体积比1∶4混合,其余为水,70℃水解4h,减压蒸馏,除去甲醇,冷冻干燥即得到沙棘黄酮样品。取样进行检测,以槲皮素苷元、异鼠李素苷元标准品对对照品,通过高效液相色谱(hplc)法进行检测,其中,槲皮素苷元含量5.20%,异鼠李素苷元含量19.02%。实施例2取干燥沙棘果150g,加入10倍体积(1.5l)60%乙醇溶液,60℃超声辅助提取1h,重复3次,过滤,合并滤液,减压蒸馏,除去乙醇,浓缩样品,经冷冻干燥后得到沙棘果粗提物粉末40.18g;取上述沙棘果粗提物粉末20.2g,加水200ml复溶,取上清液过ab-8大孔树脂,其中,上样速率为0.2bv/h,吸附一晚。依次用10%、30%、50%乙醇梯度洗脱,洗脱流速为40ml/min,共洗脱1.5bv,保留50%乙醇洗脱组分,浓缩,冷冻干燥;取冷冻干燥所得粉末1.2g,加入650ml水解液,水解液由质量浓度为6.5%的盐酸与甲醇按体积比1∶3混合制得,其余为水,60℃水解3h,除去甲醇,冷冻干燥即得到沙棘黄酮样品。取样进行检测,以槲皮素苷元、异鼠李素苷元标准品对对照品,通过高效液相色谱(hplc)法进行检测,其中,槲皮素苷元含量4.98%,异鼠李素苷元含量20.87%。实施例3取干燥沙棘果250g,加入10倍体积(2.5l)80%乙醇溶液,50℃超声辅助提取1h,重复3次,过滤,合并滤液,减压蒸馏,除去乙醇,浓缩样品,经冷冻干燥后得到沙棘果粗提物粉末60.2g;取上述沙棘果粗提物粉末30.0g,加入300ml蒸馏水复溶,取上清液过ab-8大孔树脂,其中,上样速率为0.2bv/h,吸附一晚。依次用10%、30%、50%乙醇梯度洗脱,洗脱流速为40ml/min,共洗脱1.5bv,保留50%乙醇洗脱组分,浓缩,冷冻干燥;取冷冻干燥获得的粉末2.0g,加入1200ml水解液,水解液由质量浓度为2%的盐酸与甲醇按体积比1∶5混合制得,其余为水,80℃水解5h,除去甲醇,冷冻干燥即得到沙棘黄酮样品。取样进行检测,以槲皮素苷元、异鼠李素苷元标准品对对照品,通过高效液相色谱(hplc)法进行检测,其中,槲皮素苷元含量5.21%,异鼠李素苷元含量19.47%。实施例4取干燥沙棘果200g,加入2.0l70%乙醇溶液,60℃超声辅助提取1h,重复3次,过滤,合并滤液,减压蒸馏除去乙醇,浓缩样品,经冷冻干燥后得到沙棘果渣粗提物粉末45.8g;取上述沙棘果渣粗提物粉末15.0g,加入150ml蒸馏水复溶,取上清液过ab-8大孔树脂,其中,上样速率为0.2bv/h,吸附一晚。依次用0、10%、30%、50%乙醇梯度洗脱,洗脱流速为40ml/min,共洗脱1.5bv,保留50%乙醇洗脱组分,浓缩,冷冻干燥;取上述干燥粉末2.0g,加入1.2l水解液,水解液由质量浓度为6.5%的盐酸与甲醇按体积比1∶4混合,其余为水,60℃水解3h,除去甲醇,冷冻干燥即得到沙棘黄酮样品。以槲皮素苷元、异鼠李素苷元标准品为对照品,通过高效液相色谱(hplc)进行检测,其中槲皮素苷元含量4.20%,异鼠李素苷元含量17.50%。实施例5取新复苏的pc-3细胞于37℃,5%co2培养箱中培养,待细胞稳定传代2次后,用于后续实验。取对数生长期的pc-3细胞,用0.25%胰酶消化后,计数,调整细胞浓度为2×104个/ml,接种200μl细胞悬浮液于96孔培养板,在37℃、5%co2培养箱培养24h使细胞贴壁。更换培养液,每孔加入沙棘黄酮样品(实施例1制备)的培养液200μl(样品用0.5%dmso溶解)。设置空白组和样品组,每组6个复孔,浓度分别为50、100、150、200μg/ml,继续培养24h,48h,72h。终止反应前4h,每孔加入5g/lmtt20μl继续培养4h。吸弃孔内培养液,每孔加入dmso150μl,振荡10min使紫色结晶完全溶解后,在570nm测定吸光度。相对细胞活力=(加药组od值-本底od值)/(空白对照组od值-本底od值)其中,空白对照组为0.5%dmso的培养基组;本底组为未加细胞组。实验数据以mean±sd表示,采用spss软件分析,统计检验用t检验和单因素f检验,检验水平p=0.01。结果如图1所示,相比于对照组,一定剂量的沙棘黄酮可以明显抑制pc-3细胞的活力,且呈剂量和时间依赖性。各样品处理时间段的ic50值见表1。表1时间24h48h72hic50(μg/ml)91.07549.74227.921实施例6rtca(realtimecellularanalysis)实时无标记细胞分析技术是将微电子细胞传感器芯片整合到表面适于细胞贴附与生长的细胞检测板的底部或细胞浸润迁移板的微孔膜,用以构建实时、动态、定量跟踪细胞形态和增殖分化等改变的细胞阻抗检测传感系统。本实验中的细胞培养板e-plate16的底部整合有微金电子传感器芯片,贴壁生长在微电极表面的细胞状态改变会引起电极阻抗的变化,这种改变与细胞的实时状态改变成相关性,因此可基于电阻抗的测定用细胞指数(cellindex,ci)来表示细胞状态,实现实时监测。取对数生长期的pc-3细胞,以5000/孔的密度接种于rtca16孔板中,培养24h,加入不同浓度的样品溶液50μl,继续培养72h,实时监测电极阻抗变化,每个浓度设置3个重复。结果如图2所示,相比于对照组,一定剂量的沙棘黄酮可以明显抑制pc-3细胞的增殖,且呈剂量和时间依赖性,通过rtca实时监测沙棘黄酮对细胞的影响,发现低剂量的沙棘黄酮样品(6.25μg/ml)即可明显改变细胞的状态,造成细胞指数的下降。实施例7对数生长期的pc-3细胞经胰酶消化后,调节细胞浓度,加入适量(1×105个)细胞至6孔板中,待一段时间的培养后细胞贴壁。当细胞长至基本铺满6孔板时,用10μl的枪头在6孔板上进行划痕,划痕后用pbs清洗3次去除脱落的细胞。分别向6孔板中加入不同浓度的沙棘黄酮样品(实施例1制备),同时设置空白组,放入培养箱继续培养。别在12h、24h、36h进行拍照观察细胞在划线区域的迁移情况。结果如图3所示,相比于对照组,100μg/ml的沙棘黄酮即可明显抑制pc-3细胞的横向迁移,当浓度达到200μg/ml时,pc-3细胞基本失去迁移的能力。实施例8annexinv是一种磷脂结合蛋白,能与细胞凋亡过程中翻转到膜外的磷酯酰丝氨酸高亲和力特异结合,在蓝色光的激发下,发出绿色荧光,从而区分出凋亡细胞和正常细胞;碘化丙啶(pi)是一种核酸染料,它不能穿透完整细胞膜,但对凋亡晚期细胞和死细胞的破损细胞膜能够穿透,并使细胞核红染。将annexinv与pi匹配使用,可以将凋亡早期、凋亡晚期的细胞区分开来。取对数生长期的pc-3细胞,调节细胞浓度,以20000/孔的密度接种于6孔板中,培养24h,弃去原培养基,加入含有不同浓度(25、50、100μg/ml)沙棘黄酮样品(实施例1制备)的培养基,继续培养48h。按照annexinv/pi细胞凋亡检测试剂盒说明书上的操作收集细胞染色后,流式细胞计检测细胞凋亡情况。结果如图4所示,其中图4a为不加药的对照组,图4b为加入了50μg/ml沙棘黄酮的实验组。左下象限代表正常细胞,左上象限代表机械损伤细胞,右下象限代表早期凋亡细胞,右上象限代表晚期凋亡细胞或坏死细胞。统计结果如图5所示,处理48h后,与正常对照组比较,各实验组中细胞早期凋亡率虽然没有明显变化,但晚期凋亡(坏死)率和总凋亡率都显著升高(p<0.01),且呈一定的剂量依赖性,说明实施例1制备的沙棘黄酮具有诱导pc-3细胞凋亡的作用。实施例9细胞周期是指连续分裂细胞从一次有丝分裂结束到下一次有丝分裂结束所经历的整个过程,包括g0/g1期、s期、g2/m期。荧光染料碘化丙啶pi可以与细胞内dna结合,细胞各个时期其dna含量不同从而导致结合的荧光染料不同,流式细胞仪可以根据荧光强度的不同来检测dna含量,从而判断细胞周期分布。取对数生长期的pc-3细胞,调节细胞浓度,以20000/孔的密度接种于6孔板中,培养24h,弃去原培养基,加入含有不同浓度(25、50、100μg/ml)沙棘黄酮样品(实施例1制备)的培养基,继续培养48h。按照dna含量(细胞周期)检测试剂盒说明书上的操作收集细胞染色后,流式细胞计检测细胞周期情况。结果如图6所示,其中图6a为不加药的对照组,图6b为加入了50μg/ml沙棘黄酮的实验组,各个峰代表不同的细胞周期阶段。统计结果如图7所示,沙棘黄酮样品作用pc-3细胞48h后,与正常对照组比较,样品组中细胞g2/m期比例显著升高(p<0.01),且呈一定剂量依赖性。因此样品主要通过将细胞周期阻滞在g2/m期,延缓细胞完成有丝分裂过程,并进一步延迟进入下一个细胞周期的时间,影响物质合成和dna复制,从而抑制pc-3细胞增殖。影响dna合成并延缓细胞周期的进行,从而抑制pc-3细胞增殖。对比例1沙棘黄酮未水解样的制备,沙棘黄酮的制备工艺:取干燥沙棘果,加入10倍体积70%乙醇溶液,55℃超声辅助提取1h,重复3次,过滤,合并滤液,浓缩,经冷冻干燥后得到沙棘果粗提物粉末;取上述沙棘果粗提物粉末,加水复溶,取上清液过ab-8大孔树脂。其中,上样速率为0.2bv/h,吸附一晚。依次用10%、30%、50%乙醇梯度洗脱,洗脱流速为40ml/min,共洗脱1.5bv,保留50%乙醇洗脱组分,浓缩,冷冻干燥,得到沙棘黄酮未水解样品。其中测得槲皮素苷元含量0.1%,异鼠李素苷元含量0.08%。mtt法检测细胞活力的方法同实施例5。沙棘黄酮未水解样品对pc-3细胞活力的影响见图8,相比于对照组,250μg/ml的沙棘样品仍能促进pc-3细胞的生长,不存在抑制细胞增殖作用,由此分析可知,本发明中的沙棘黄酮必须经过水解才能发挥抑制前列腺增殖的作用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1