瓣叶中具有平面区的假体心脏瓣膜的制作方法与工艺
瓣叶中具有平面区的假体心脏瓣膜相关申请本申请要求保护在2012年12月19日提交的临时申请序列号第61/739,721号的优先权,该申请以全文引用的方式并入到本文中。技术领域本公开大体而言涉及假体瓣膜并且更具体而言涉及合成柔性瓣叶型假体瓣膜装置、系统和植入方法。
背景技术:
已经发展了生物假体瓣膜,其试图模仿自体瓣膜的功能和性能。从诸如牛心包等生物组织来制造柔性瓣叶。在某些瓣膜设计中,生物组织被缝合到相对刚性框架上,相对刚性框架支承瓣叶并且在植入时提供尺寸稳定性。尽管生物假体瓣膜能在短期内提供优良的血液动力学性能和生物力学性能,它们倾向于造成钙化和尖瓣撕裂,以及其它损毁模式,因此需要重做手术和置换。曾经尝试使用合成材料,诸如聚氨酯等作为生物组织的替代品,以提供更耐用的柔性瓣叶假体瓣膜,在本文中被称作合成瓣叶瓣膜(SLV)。然而,因为次优的设计和缺乏耐用的合成材料等导致合成瓣叶瓣膜经受过早损毁,所以合成瓣叶瓣膜尚未变成有效的瓣膜置换选项。瓣叶在流体压力的影响下运动。在操作中,当上游流体压力超过下游流体压力时瓣叶打开,并且当下游流体压力超过上游流体压力时瓣叶闭合。瓣叶的自由边缘在下游流体压力的影响下合紧,闭合瓣膜以防止下游血液逆行流过瓣膜。合成心脏瓣膜瓣叶的优选形状已经展开多次讨论,但每一个都与其它不同。各种三维形状的范围从球形或圆柱形到与球和“非球面(alpharabola)”的截头圆锥相交。
技术实现要素:
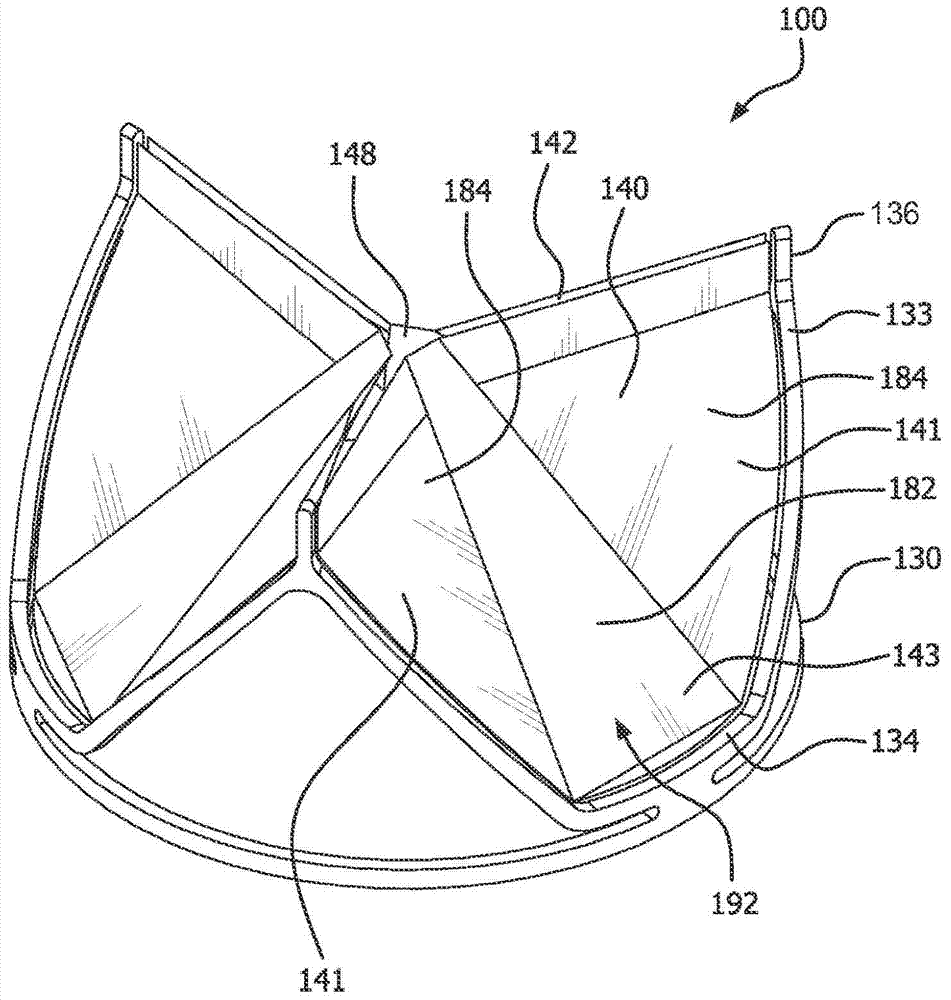
所描述的实施例针对于一种用于瓣膜置换,诸如心脏瓣膜置换的一种设备、系统和方法。更具体而言,所描述的实施例针对于柔性瓣叶瓣膜装置,其中,瓣叶具有平面中央区。仅当瓣膜不在压力下时能确定该平面区的存在。根据一实施例,一种假体瓣膜,包括:瓣叶框架,联接到瓣叶框架上的多个瓣叶,其中每个瓣叶有自由边缘和基部。每个瓣叶在中央部分中具有平面区,其中平面区基本上是平面的。平面区限定具有如下面积的形状,其中该面积在基部附近比在自由边缘附近更大。根据一实施例,一种假体瓣膜,包括:框架,其具有大体上管状形状,并附连有膜。框架限定多个瓣叶窗口。膜限定从瓣叶窗口中的每一个延伸的至少一个瓣叶。每个瓣叶两个瓣叶侧部、一平面中央区、一瓣叶基部和与瓣叶基部相对的一自由边缘。两个瓣叶侧部从瓣叶基部叉开。附图说明包括附图以提供对本公开的进一步理解并且附图合并于本说明书中并且构成本说明书的部分,示出本文所描述的实施例,并且与描述一起用于解释在本公开中所讨论的原理。图1A是根据一实施例的假体瓣膜的侧视图;图1B为图1A的瓣膜的实施例的立体图;图1C为假体瓣膜处于打开配置的实施例的轴向视图;图1D为图2A的瓣膜的实施例处于闭合配置的轴向视图;图2是展开为平坦取向的瓣叶框架的实施例的视图;图3A是在解剖机构内经导管递送系统的实施例的侧视图;图3B是在解剖结构内的外科瓣膜的实施例的侧视图;图4是展开为平坦取向的瓣叶框架的实施例的视图;图5为假体瓣膜的另一实施例处于闭合配置的轴向视图;图6为假体瓣膜的另一实施例处于闭合配置的轴向视图;图7是根据一实施例在组装心轴上的瓣叶框架的侧视图;图8A是根据一实施例在切割心轴上的瓣叶框架的侧视图;以及图8B是在图8A的组装心轴上的瓣叶框架的立体图。具体实施方式本领域技术人员将易于认识到本公开的各个方面可以由被配置成执行预期功能的多种方法和设备来实现。换言之,其它方法和设备可以合并于本发明中以执行预期的功能。还应当指出的是本文中参考的附图未必按照比例绘制,而是可能夸大以示出本公开的各种方面,并且就此而言,附图不应认为具有限制意义。尽管本文的实施例可以结合各种原理和益处展开描述,所描述的实施例不应认为受特定理论限制。例如,关于假体瓣膜,更具体而言心假体瓣膜来描述实施例。然而,在本公开的范围内的实施例可以适用于具有类似结构和/或功能的任何瓣膜或机构。而且,在本公开的范围内的实施例可以应用于非心脏应用中。如在本文中在假体瓣膜的上下文中使用的术语瓣叶是单向瓣膜的部件,其中,瓣叶可操作成在压差的影响下在打开位置与闭合位置之间运动。在打开位置,瓣叶允许血液通过假体瓣膜流动。在闭合位置,瓣叶基本上阻挡通过瓣膜的逆向流动。在包括多个瓣叶的实施例中,每个瓣叶与至少一个相邻瓣叶协作,以阻挡血液逆向流动。例如,由于心室或心房收缩造成血液中的压差,这种压差通常是由于瓣叶闭合时在瓣叶一侧上流体压力积聚造成。在瓣膜流入侧上的压力升高到高于在瓣膜流出侧上的压力时,瓣叶打开并且血液穿过瓣叶流动。在血液通过瓣膜流入到相邻腔室或血管中时,在流入侧上的压力与流出侧上的压力均衡。在瓣膜流出侧上的压力升高到高于瓣膜流入侧上的血压时,瓣叶返回到闭合位置,闭合位置通常防止血液通过瓣膜逆向流动。如本文所用的术语隔膜指包括单组分的材料片,诸如(但不限于)膨胀型含氟聚合物。如本文所用的术语复合材料指隔膜诸如(但不限于)膨胀型含氟聚合物和弹性体诸如(但不限于)含氟弹性体的组合。弹性体可以吸入到隔膜的多孔性结构中,涂布到隔膜的一侧或两侧上,或者涂布到隔膜上和吸入到隔膜内的组合。如本文所用的术语层合件指隔膜、复合材料或其它材料诸如弹性体和其组合的多个层。如本文所用的术语膜通常指隔膜、复合材料或层合件中的一种或多种。如本文所用的生物相容性材料通常指膜或生物材料,诸如(但不限于)牛心包。术语瓣叶窗口被定义为框架限定的空间,瓣叶从框架延伸。瓣叶可以从框架元件延伸或者邻近框架元件并且与框架元件间隔开。术语自体瓣膜口和组织口指其内可放置有假体瓣膜的解剖结构。这种解剖结构包括(但不限于)心瓣膜可以或可以不通过外科手术移除的部位。应了解能接纳假体瓣膜的其它解剖结构包括(但不限于)静脉、动脉、管和分路。但在本文中参考利用假体瓣膜置换自体瓣膜,还应了解瓣膜口或植入位点也可以指在可能接纳瓣膜用于特定目的的合成或生物管道中的部位,并且因此本文所提供的实施例的范围并不限于瓣膜置换。如本文所用的术语“联接”表示连结、联接、连接、附连、粘附、固结或结合,无论是直接的还是间接的,无论是永久的还是暂时的。本文的实施例包括用于适合于外科手术和经导管放置的假体瓣膜的各种设备、系统和方法,诸如(但不限于)心瓣膜置换。瓣膜可用作单向瓣膜,其中,瓣膜限定瓣膜口,响应于流体差压,瓣叶打开以允许流入瓣膜口和闭合以阻塞瓣膜口并且防止流动。本文提供的实施例将合成材料放置于比基于自体瓣膜的复制件的那些最小化的应力条件下。这特别地通过瓣叶材料中减小的折曲而实现。本文所提供的实施例解决了受控制的瓣叶开口。瓣膜瓣叶的耐用性主要受到打开-闭合循环期间瓣叶表现出的弯曲特性控制。小半径弯曲、褶皱和特别是相交褶皱可能在瓣叶中产生高应力区。这些高应力区可能在重复负荷下造成孔和撕裂的形成。本文所提供的实施例提供瓣叶形状特征以将褶皱形成减到最少,这在薄高模量瓣叶中是特别重要的,因为在这些材料中的弯曲倾向于类似于赛璐酚(cellophane,玻璃纸)那样。如果不对瓣叶弯曲特性进行控制,不仅形成褶皱,而且褶皱相交导致形成较大三维结构,其抵抗弯曲并且减缓瓣叶打开和闭合时的运动。本文提供的实施例控制瓣叶打开,并且提供对在瓣叶中包括平面区而造成的褶皱形成的最小化。瓣膜图1A是根据一实施例的瓣膜100的侧视图。图1B是图1A的瓣膜100的立体图。图1C和图1D是分别处于打开配置和闭合配置的图1A的瓣膜100的轴向视图。瓣膜100包括瓣叶框架130和限定瓣叶140的膜160。图2是图1A的瓣膜100的瓣叶框架130的侧视图,其中,瓣叶框架130沿纵向被切割并且摊开以更好地示出大体上管状瓣膜100的元件。在图1A、图1B和图1D以及图5和图6中,瓣叶140被示出略微打开,以更好地示出特征,但应了解完全闭合的瓣膜100使瓣叶140的自由边缘142靠拢在一起以在下游流体压力下合紧,这导致瓣膜闭合以防止下游流体通过瓣膜逆向流动。框架参考图1A至图1D,根据一实施例,瓣叶框架130大体上为管状构件,限定孔口122的大体上敞开图案。根据经导管的实施例,瓣叶框架130可操作成允许它在不同直径之间压缩和扩张。瓣叶框架130包括框架第一端121a和与框架第一端121a相对的框架第二端121b。瓣叶框架130包括瓣叶框架外表面126a和与瓣叶框架外表面126a相对的瓣叶框架内表面126b,如图1A所示。瓣叶框架130限定连合柱136,连合柱136联接到瓣叶自由边缘142。图4是根据一实施例的瓣膜100的瓣叶框架130a的侧视图,其中瓣叶框架130a被纵向切割并且摊开以更好地示出大体上管形框架130a的元件。瓣叶框架130a包括成角度的框架元件,其适合于影响压缩和扩张,如血管内放置所需要的那样,瓣叶140以虚线示出以表示瓣叶140位于瓣叶窗口137内,瓣叶窗口137由瓣叶窗口侧部133和瓣叶窗口基部134限定。瓣叶框架130可以包括本领域中被称作支架的结构。支架是管状构件,其可以具有适合于经皮经导管递送到解剖结构内的较小直径,并且当部署于解剖结构内时可以扩张到较大直径。具有各种设计和材料性质的支架是本领域中熟知的。瓣叶框架130可以限定多个特征,可重复的或其它特征,诸如几何形状和/或线性或曲折的正弦曲线系列。几何形状可以包括便于基本上均匀周向压缩和扩张的任何形状。瓣叶框架130可以包括切割管或适合于特定目的的任何其它元件。瓣叶框架120可以被蚀刻、切割、激光切割或冲压成管或材料片,然后材料片被形成为基本上圆柱形结构。替代地,细长材料、诸如线、可弯曲的条带或其系列可以弯曲或编结和形成为基本上圆柱形结构,其中圆柱壁包括敞开构架,敞开构架能以大体上均匀和周向方式压缩成更小直径并且可扩张到较大直径。瓣叶框架130可包括任何金属或聚合生物相容性材料。例如,瓣叶框架130可包括诸如(但不限于)下列材料:镍钛诺、钴-镍合金、不锈钢或聚丙烯、乙酰均聚物、乙酰共聚物、ePTFE、其它合金或聚合物,或者具有充分物理和机械性质以如本文所描述起作用的任何其它生物相容性材料。根据各种实施例,瓣叶框架130可以被配置成提供与植入位点的形状配合地接合(positiveengagement),以将瓣膜100牢固地锚固到位点,如图3A所示,表示瓣膜100的经导管部署。根据一实施例,瓣叶框架130可以包括足够刚硬的框架,其具有小弹性反冲以便维持抵靠于组织口150的充分并置以维持位置。根据另一实施例,瓣叶框架130可以被配置成扩张到大于组织口150的直径,以使得当瓣膜100扩张到组织口150内时,其能牢固地安放于其中。根据另一实施例,瓣叶框架130可以包括一个或多个锚固件(未图示),锚固件被配置成接合植入位点,诸如组织口150,以将瓣膜100固定到植入位点。应理解到预计将瓣膜100联接到植入位点的其它元件或手段。举例而言,但并无限制意义,其它手段,诸如机械和粘合性手段可以用于将瓣膜100联接到合成或生物管道上。如在下文中所讨论,外科瓣膜100的实施例可以或可以不具有之字形配置,因为外科瓣膜100可以具有固定直径,并且无需操作成压缩和再扩张。参考图2,瓣叶框架包括由基部元件138互连的多个间隔开的瓣叶框架元件,瓣叶框架元件限定基本上等腰三角形,瓣叶框架限定瓣叶窗口137,瓣叶窗口137限定等腰梯形。每个瓣叶窗口侧部133由一个三角形的一个侧边和相邻三角形的一个侧边限定,并且其中每个瓣叶窗口基部134由所述基部元件138限定。再次参考图1A和图2,瓣叶框架第一端121a还包括柱136,这些柱从限定基本上等腰三角形的各瓣叶框架元件的顶点延伸。柱136可以影响瓣叶自由边缘142,以在相邻瓣叶自由边缘142之间形成较大或较宽的合紧区域146。根据一实施例,框架130包括框架,框架具有至少部分地通过将二维等腰梯形图案缠绕到框架130的管状形状上而确定的形状,等腰梯形图案具有一个基部134和从基部134叉开的两个侧部133,并且来自相邻等腰梯形的侧部133在框架第一端121a处会合,如图2所示。瓣叶140以虚线示出以表示瓣叶143在瓣叶窗口137内,瓣叶窗口137由瓣叶窗口侧部133和瓣叶窗口基部134限定。缝套根据外科瓣膜100实施例,瓣膜100还包括根据一实施例绕瓣叶框架130的缝套10,如在图3B中所示。缝套170可操作成提供接纳缝合线以联接到植入位点的结构。缝套170可以包括任何合适材料,诸如(但不限于)双丝绒聚酯。缝套170可以围绕瓣叶框架130的基部的周界沿周向定位。缝套是本领域中已知的。根据假体瓣膜的一实施例,每个瓣叶140具有基本上等腰梯形的形状,该等腰梯形具有两个瓣叶侧部141、一瓣叶基部143和与瓣叶基部143相对的一瓣叶自由边缘142,其中两个瓣叶侧部141从瓣叶基部143叉开,其中瓣叶基部143基本上是平坦的,如在图2中以虚线示出。根据一实施例,瓣叶框架130包括框架第一端和与框架第一端相对的框架第二端,瓣叶窗口具有至少部分地通过将二维等腰梯形图案缠绕到瓣叶框架的管状形状上而确定的形状,等腰梯形图案具有一基部和从基部叉开的两个侧部,并且来自相邻等腰梯形的侧部在框架第二端处会合。在经导管瓣膜100实施例中,瓣叶框架130可以弹性地、或塑性地,或者既弹性又塑性地压缩,以获得相对较小直径从而适应经皮经导管安装和递送。根据一实施例,瓣叶框架130包括形状记忆材料,其能操作成在负荷下挠曲,并且当移除负荷时保持其原始形状,因此允许瓣叶框架130从压缩形状自行扩张到预定形状。根据一实施例,瓣叶框架130能塑性变形以由囊体扩张。在另一实施例中,瓣叶框架130可弹性变形以自扩张。膜根据实施例,膜160大体上呈现任何薄片状材料,其是生物相容的并且被配置成将瓣叶联接到瓣叶框架。应了解术语“膜”通用于适合于特定目的的一种或多种生物相容性材料。瓣叶140也包括膜160。根据一实施例,生物相容性材料是并非生物源并且对于特定目的的膜160,其充分柔性和牢固,诸如生物相容性聚合物。在一实施例中,膜160包括生物相容性聚合物,其与弹性体组合,被称作复合物。在下文中讨论各种类型膜160的细节。在一实施例中,膜160可以由大体上管状材料形成,以至少部分地覆盖瓣叶框架130。膜160可以包括隔膜、复合材料或层合件中的一种或多种。在下文中讨论各种类型膜160的细节。瓣叶每个瓣叶窗口137设有生物相容性材料,诸如膜160,其联接到瓣叶窗口侧部133的一部分,其中膜160限定瓣叶140,如在图1A和图2所示。根据一实施例,每个瓣叶140限定瓣叶自由边缘142和瓣叶基部143。如下文所描述,预期可以提供瓣叶基部143配置的多个实施例。根据一实施例,膜160联接到瓣叶窗口侧部133的一部分和瓣叶窗口基部134(其中瓣叶140由瓣叶窗口侧部133的部分限定)和瓣叶窗口基部134。根据另一实施例,膜160联接到瓣叶窗口侧部的一部分。当瓣叶140处于完全打开位置时,瓣膜100呈现基本上圆形瓣膜口102,如在图1C中所示。当瓣叶140处于打开位置时,允许流体流动通过瓣膜口102。当瓣叶140在打开位置与闭合位置之间循环时,瓣叶140通常绕瓣叶所联接的瓣叶窗口侧部133的部分和瓣叶基部143挠曲。当瓣膜100闭合时,每个瓣叶自由边缘142的通常大约一半抵接相邻瓣叶140的瓣叶自由边缘142的相邻一半,如在图1D中所示。图1D的实施例的三个瓣叶140在三重点148会合。当瓣叶140处于阻挡流体流动的闭合位置时,瓣膜口102被闭塞。参看图1D,根据一实施例,每个瓣叶140包括中央区域182和在中央区域182相对两侧上的两个侧部区域184。中央区域182基本上由两个中央区域侧部183、瓣叶基部143和自由边缘142限定的等腰三角形的形状限定。两个中央区域侧部183从瓣叶基部143向瓣叶自由边缘142会聚。根据一实施例,当瓣膜100处于闭合位置并且不在流体压力下时,中央区域182基本上是平面的,从而限定平面区192。平面区192具有基本上等腰三角形的形状,其顶点向瓣叶框架130延伸。参考图1D,顶点线La被指示连接瓣叶140的各顶点142。顶点线La将瓣叶140分成邻近瓣叶框架130的第一区域149a和邻近瓣叶自由边缘的第二区域149b。第一区域149a包含比第二区域149b更大的平面区192的比例。在其它实施例中,每个瓣叶140的大部分平面区192位于连结两个相邻连合柱136的顶点的顶点线La的下方和外部。发现与平面区192的面积在第二区域149b中的分布大于在第一区域149a中的情况相比,在第一区域149a和第二区域149b中分布的平面区192的上述面积比得到更好的瓣叶打开动力学。瓣叶140可以被配置成由血液中的压差促动,例如由于心室或心房收缩而造成血液中的压差,这种压差通常是由于在瓣膜100闭合时在瓣膜100一侧上的流体压力积聚造成。在瓣膜100流入侧上的压力升高到高于在瓣膜100流出侧上的压力时,瓣叶140打开并且血液穿过瓣叶流动。在血液通过瓣膜100流入到相邻的腔室或血管内时,压力均衡。在瓣膜100流出侧上的压力升高到高于瓣膜100流入侧上的血压时,瓣叶140返回到闭合位置,以通常防止血液逆行流过瓣膜100的流入侧。应了解到根据实施例,瓣叶框架130可以包括适合于特定目的的任何数量瓣叶窗口137和因此瓣叶140。设想到包括一个、两个、三个或更多个瓣叶窗口137和对应的瓣叶140的瓣叶框架130。图5是根据一实施例处于打开配置的另一瓣膜10的轴向视图。当瓣膜100处于闭合位置并且不在流体压力下时,中央区域182基本上是平面的,从而限定平面区192。平面区192基本上具有圆的截断楔状物的形状。图6是根据一实施例处于打开配置的又一瓣膜100的轴向视图。当瓣膜100处于闭合位置并且不在流体压力下时,中央区域182基本上是平面的,从而限定平面区192。平面区192具有不与瓣叶框架130接触的基本上等腰梯形的形状。应意识到可以存在适于特定目的的、平面区192可限定的许多形状。根据适合于经导管放置的瓣膜100的一实施例,瓣膜100可以被压缩到具有较小直径的收拢配置并且扩张到扩张配置,以使得瓣膜100能经由导管以收拢配置递送并且在部署于组织口150内时扩张,如在图3A中所示。瓣膜框架130可以操作成在从收拢配置转变到扩张配置时恢复周向均匀性。瓣膜100可以安装到适合于特定目的的递送导管内。处于收拢配置的瓣膜100的直径部分地由瓣叶框架的厚度和瓣叶厚度来决定。瓣叶膜构成瓣叶140的生物相容性材料可以包括具有充分柔顺和柔性的任何生物组织或合成的生物相容性材料。在一实施例中,瓣叶140包括与弹性体组合的生物相容性聚合物,被称作复合物。根据一实施例的材料包括复合材料,复合材料包括膨胀型含氟聚合物隔膜(其在原纤维基质内包括多个空间)和弹性体材料。应意识到多种类型的含氟聚合物隔膜和多种类型的弹性体材料可以组合以形成层合件,同时仍在本公开的范围内。还应认识到弹性体材料可以包括多种弹性体、多种类型的非弹性体组分,诸如无机填料、治疗剂、不透辐射的标记和类似物,仍在本公开的范围内。根据一实施例,复合材料包括由多孔性ePTFE隔膜制成的膨胀型含氟聚合物材料,例如,如在授予Bacino的美国专利第7,306,729号中总体上描述。用于形成所描述的膨胀型含氟聚合物材料的可膨胀的含氟聚合物可以包括PTFE均聚物。在替代实施例中,可以使用PTFE、可膨胀的改性PTFE和/或膨胀的PTFE共聚物的掺混物。合适含氟聚合物材料的非限制性示例描述于例如授予Branca的美国专利5,708,044、授予Baillie的美国专利6,541,589,授予Sabol等人的美国专利7,531,611,授予Ford的美国专利申请11/906,877以及授予Xu等人的美国专利申请12/410,050中。膨胀型含氟聚合物隔膜可以包括用于实现所希望的瓣叶性能的任何合适微结构。根据一实施例,膨胀型含氟聚合物包括由原纤维互连的节点的微结构节点,诸如授予Gore的美国专利3,953,566所描述。原纤维从节点在多个方向上延伸,并且隔膜具有大体上同质结构。具有这种微结构的隔膜通常在两个正交方向上表现出小于2并且可能小于1.5的基质抗拉强度比。在另一实施例中,膨胀型含氟聚合物隔膜具有基本上仅原纤维的微结构,诸如由授予Bacino的美国专利7,306,729大体上教导。具有基本上仅原纤维的膨胀型含氟聚合物隔膜可以具有高表面积,诸如大于20m2/g,或者大于25m2/g,并且在某些实施例中,可以提供高度平衡的强度材料,在两个正交方向上具有至少1.5×105MPa2的基质抗拉强度乘积,和/或在两个正交方向上具有小于4并且可能小于1.5的基质抗拉强度比。膨胀型含氟聚合物隔膜可以被定制成具有适合于实现所希望的瓣叶性能的任何合适厚度和质量。举例而言,但并无限制意义,瓣叶140包括具有约0.1μm厚度的膨胀型含氟聚合物隔膜。膨胀型含氟聚合物隔膜能具有大约1.15g/m2的单位面积质量。根据本发明的一实施例的隔膜可以在纵向方向上具有约411MPa的基质抗拉强度并且在横向方向上具有约315MPa的基质抗拉强度。额外材料可以并入到隔膜的孔隙内或者隔膜材料内或者各层隔膜之间以增强所希望的瓣叶性质。本文所描述的复合材料可以被定制成具有适合于实现所希望的瓣叶性能的任何厚度和质量。根据实施例的复合材料可以包括含氟聚合物隔膜并且具有约1.9μm的厚度和约4.1g/m2的单位面积质量。膨胀型含氟聚合物隔膜与弹性体组合以形成复合材料,其以各种方式向本公开的元件提供用于高循环挠曲植入物应用诸如心瓣膜瓣叶所需的性能属性。例如,添加弹性体能通过排除或减小观察到的仅ePTFE材料的刚硬度而改进了瓣叶140的疲劳性质。此外,其能减小材料将经历永久定型变形、诸如起皱或皱折的可能性,这类永久定型变形可能导致受损的性能。在一实施例中,弹性体占据膨胀型含氟聚合物隔膜的多孔性结构内的基本上所有孔隙体积或空间。在另一实施例中,弹性体存在于至少一个含氟聚合物层的基本上所有孔隙内。利用弹性体来填充孔隙体积或者使弹性体存在于基本上所有孔隙中减小了异物可能不合需要地包含到复合材料内的空间。这种异物的示例可以是钙,能通过与血液接触将钙抽吸到隔膜内。如果钙变得包含于如在心瓣膜瓣叶中所用的复合材料内,例如,在循环打开和闭合期间可能发生机械损坏,因此导致瓣叶中形成孔和血液动力学降级。在一实施例中,与ePTFE组合的弹性体是四氟乙烯(TFE)和全氟甲基乙烯基醚(PMVE)的热塑性共聚物,诸如在授予Chang等人的美国专利7,462,675中所描述。如上文所讨论,弹性体与膨胀型含氟聚合物隔膜组合使得弹性体基本上占据膨胀型含氟聚合物隔膜内的基本上所有空隙空间或孔隙以形成复合材料。这种利用弹性体对膨胀型含氟聚合物隔膜的孔隙进行填充可以以多种方式执行。在一实施例中,填充膨胀型含氟聚合物隔膜的孔隙的方法包括以下步骤:将弹性体溶解在如下溶剂中,即该溶剂适合于形成具有一种粘度和表面张力的溶液,这种溶液适于部分地或完全流入到膨胀型含氟聚合物隔膜的孔隙内并且允许溶剂蒸发,从而留下填料。在一实施例中,复合材料包括三层:两个ePTFE外层和安置在它们之间的含氟弹性体内层。额外含氟弹性体可能是合适的并且描述于授予Chang等人的美国公告2004/0024448中,该公告以全文引用的方式并入到本文中。在另一实施例中,填充膨胀型含氟聚合物隔膜的方法包括以下步骤:经由分散体递送填料以部分地或完全地填充膨胀型含氟聚合物隔膜的孔隙。在另一实施例中,填充膨胀型含氟聚合物隔膜的孔隙的方法包括以下步骤:在允许弹性体流入到膨胀型含氟聚合物隔膜的孔隙内的热和/或压力条件下使多孔性膨胀型含氟聚合物隔膜与弹性体片接触。在另一实施例中,填充膨胀型含氟聚合物隔膜的孔隙的方法包括以下步骤:通过首先向孔隙填充弹性体的预聚物并且然后使弹性体至少部分地固化来在膨胀型含氟聚合物隔膜的孔隙内使弹性体聚合。在到达弹性体的最低重量百分比后,由含氟聚合物材料或ePTFE构成的瓣叶一般随着弹性体百分比增加而更好地表现,导致显著延长的循环寿命。在一实施例中,与ePTFE组合的弹性体是四氟乙烯与全氟甲基乙烯基醚的热塑性共聚物,诸如描述于授予Chang等人的美国专利7,462,675和本领域技术人员已知的其它参考。适合用于瓣叶140的其它生物相容性聚合物包括(但不限于)聚氨酯、硅酮(有机聚硅氧烷)、硅-聚氨酯的共聚物、苯乙烯/异丁烯共聚物、聚异丁烯、聚乙烯共聚物(乙酸乙烯酯)、聚酯共聚物、尼龙共聚物、氟化烃聚合物和前述每一个的共聚物或混合物。其它考虑根据一实施例,瓣膜100可以被配置成当植入时通过不覆盖左心室中的束支而防止干涉心脏传导系统,诸如主动脉瓣置换手术中遇到的情况。例如,瓣膜100可以包括小于约25mm或小于约18mm的长度。瓣膜100还可包括小于一的长径比,其中该长径比描述了瓣膜100的长度与扩张的作用直径之间的关系。然而,瓣膜100可以被构造成任何长度并且更通常地,任何所希望的尺寸。在经导管实施例中,在收拢状态,瓣膜100可以具有小于约35%扩张轮廓的收拢轮廓。例如,包括26mm扩张直径的瓣膜100可以具有小于约8mm或小于约6mm的收拢直径。直径的百分比差异取决于瓣膜100的尺寸和材料和其各种应用,并且因此,实际百分比差异并不受本公开限制。瓣膜100还可包括生物活性试剂。生物活性试剂可以被涂布到膜160的一部分上或整个膜160上以一旦植入瓣膜100时就控制试剂释放。生物活性试剂可包括(但不限于)血管舒张药、阻凝剂、抗血小板剂、抗血栓形成剂,诸如(但不限于)肝素。其它生物活性剂还可包括(但不限于)抗增生/抗有丝分裂试剂,其包括天然产物例如长春花属生物碱(即长春花碱、长春新碱、和长春瑞滨)、紫杉醇、表鬼臼毒素(即足叶乙甙、替尼泊甙)、抗生素(更生霉素(放线菌素D)红比霉素、阿霉素和黄胆素)、对氨茴环霉素、米托蒽醌、博来霉素、普卡霉素(光神霉素)和丝裂霉素、酶类(左旋天门冬酰胺酶,其通过内吸收使左旋天门冬素新陈代谢,并夺去不具备合成其自身天门冬素能力的细胞);抗血小板剂例如G(GP)IIb/IIIa抑制剂和外连素受体拮抗剂;抗增生/抗有丝分裂烷化剂例如氮芥(二氯甲二乙胺、环磷酰胺和类似物、美法仑、瘤可宁)、乙撑亚胺和甲基蜜胺类(六甲蜜胺和硫替派)、烷基磺酸盐白消安、亚硝基脲(卡氮芥(BCNU)和类似物、链脲霉素)、氮烯咪胺(DTIC);抗增生/抗有丝分裂抗代谢物例如叶酸类似物(甲氨蝶呤)、嘧啶类似物(氟脲嘧啶、氟尿苷和阿糖胞苷)、嘌呤类似物和相关的抑制剂(巯基嘌呤、硫鸟嘌呤、喷司他丁和2-氯脱氧腺苷{克拉屈滨});铂配位络合物(顺氯氨铂、卡波铂)、甲基下肼、羟基脲、米托坦、氨鲁米特;激素(即雌激素);抗凝血剂(肝磷脂、合成肝磷脂盐和其它凝血酶抑制剂);纤维蛋白溶解剂(例如组织血纤维蛋白酶原激活药、链激酶和尿激酶)、阿斯匹林、潘生丁、噻氯匹定、氯吡格需、阿昔单抗;抗迁移剂;抗分泌激素(布雷非德);抗炎药:例如肾上腺皮质类固醇类(皮质酮、可的松、氟氢可的松、泼尼松、泼尼龙、6α-甲泼尼龙、曲安西龙、倍他米松、和甲氟烯索)、非类固醇试剂(水杨酸盐衍生物即阿斯匹林;帕拉胶-氨基苯酚衍生物即醋胺酚;吲哚和茚醋酸(消炎痛、舒林酸和依托度酸)、杂芳基乙酸(托美汀、双氯芬酸、和酮洛来克)、芳基丙酸(布洛芬和衍生物)、邻氨基苯酸(甲灭酸和甲氯灭酸)、烯醇酸(吡罗昔康、替诺昔康、苯基丁氮酮和羟基保泰松)、萘丁美酮、金化合物(金诺芬、金硫葡萄糖、硫代苹果酸金钠);免疫抑制剂:(环孢霉素、血流谱(FK-506)、西罗莫司(雷帕霉素)、硫唑嘌呤、霉酚酸酯);抗血管新生药物:血管内皮生成因子(VEGF);成纤细胞生长因子(FGF);血管紧张素受体拮抗剂;一氧化氮供体;反义寡核苷酸和其组合;细胞周期抑制剂,mTOR抑制剂,以及生长因子受体信号转导激酶抑制剂;类视黄醇;细胞周期蛋白/CDK抑制剂;HMG辅酶还原酶抑制剂(他汀类药物);以及蛋白酶抑制剂。经导管递送系统在一实施例中,现参看图3A,瓣膜递送系统500包括:瓣膜100,脏瓣膜100具有如先前所描述的收拢配置和扩张配置;以及,细长柔性导管480,诸如囊体导管,其被配置成经由导管来部署瓣膜100。导管480可以包括囊体以使瓣膜100扩张,和/或若需要,以触摸瓣膜100以确保适当安放。瓣膜100可以安装到导管480的远端部段以通过脉管系统递送。为了保持瓣膜处于在导管480上的收拢配置,瓣膜递送系统还可以包括可移除的护套(未图示)以紧密地装配于经导管瓣膜100上。递送方法可包括以下步骤:将瓣膜在径向压缩到其收拢配置并径向压缩到细长柔性导管的远端上,细长柔性导管具有近端和远端;经由经股或经心尖途径,将瓣膜递送到组织口内,诸如自体大动脉瓣膜口,并且将瓣膜扩张到组织口。可通过使囊体充胀来使瓣膜扩张。递送方法可包括以下步骤:将瓣膜径向压缩到其收拢配置,并径向压缩到细长柔性导管的远侧部段上,细长柔性导管具有近端和远端。约束件装配于瓣膜的柱周围,约束件能连接到栓系件,栓系件穿过瓣膜口和导管管腔。瓣膜然后经由递送路线而递送到自体瓣膜口,诸如自体大动脉瓣膜口,并且扩张到自体瓣口。递送路线可以包括经股或经心尖路线。可通过使囊体充胀来使瓣膜扩张。外科手术实施例可理解到预期瓣膜100的实施例可以通过外科手术植入,而不是使用经导管技术。根据一实施例,外科手术植入的瓣膜100的实施例可以与上文所描述的那些基本上相同,并加上邻近瓣叶框架外表面126a的缝套190,在图3B中示出。本领域中熟知的缝套可操作成提供接纳缝合线的结构,其将瓣膜100联接到植入位点,诸如组织口。缝合带190可包括任何合适材料,诸如(但不限于)双丝绒聚酯。缝套190可以沿周向位于瓣叶框架130周围或从瓣叶框架130悬置的血管周围。制造方法本文所描述的实施例涉及如本文所描述的制造瓣膜100实施例的方法。为了做出各种实施例,可以使用圆柱形心轴710。参考图5,心轴710包括可操作成在其上接纳瓣叶框架130的结构形式。本文所描述的实施例涉及制造如本文所描述的瓣膜100实施例的方法。为了做出各种实施例,可以使用圆柱形心轴710。参考图7,心轴710包括可操作成在其上接纳瓣叶框架130的结构形式。制造瓣膜100的方法的实施例包括以下步骤:将第一层膜160、例如本文所描述的复合物绕心轴710缠绕成管状形式;将瓣叶框架120放置于第一层膜160上,如在图7中所示;在瓣叶框架130上形成第二层膜160;使组件热定型;将该组件接纳于切割心轴172上,如图8A和图8B所示;跨瓣叶窗口137内的瓣叶窗口顶部切割膜160。示例示例1在示例性实施例中,根据以下过程来构造心脏瓣膜,心脏瓣膜具有复合材料形成的聚合瓣叶,其具有膨胀型含氟聚合物隔膜和弹性体材料并且连结到半刚性、不可收拢的金属框架上,并且还具有应变消除:从一段MP35N钴镍管机械加工瓣叶框架,MP35N钴镍管的形状被硬调制为26.0mm的外径和0.6mm的壁厚。对瓣叶框架进行电抛光,导致从每个表面移除0.0127mm材料并且使边缘倒圆。框架经历表面粗糙化步骤,以改进瓣叶到框架的粘附。框架通过浸没于丙酮超声浴中持续大约五分钟而清洁。然后使用本领域普通技术人员通常已知的器械(例如,加利福尼亚州的科洛纳PVATePLa美国公司的等离子体笔)和方法使整个金属瓣叶框架表面经受等离子体处理。这种处理也用于改进氟化乙丙烯(FEP)粘合剂的湿润。FEP粉末(纽约州奥兰治堡大金美国公司(DaikinAmerica))然后被施加到框架上。更具体而言,FEP粉末被搅拌以在封闭的掺混设备、诸如标准厨房型掺混器中形成气载“浮云状团”,而框架悬浮于浮云状团中。框架暴露于FEP浮云状团,直到一层粉末粘附到框架的整个表面上。然后通过将框架放置于强制通风炉(设置为320℃)中持续大约三分钟来使框架经受热处理。这造成粉末熔化并且粘附为整个框架上的薄涂层。从烤箱移除框架,并且将框架冷却到大约室温。聚合物应变消除层以如下方式附连到框架上。通过在锥形心轴上沿径向拉伸,带薄(122μm)壁的烧结15mm直径的ePTFE管安置于24.5nn通风金属心轴上。带有连续的FEP涂层的两层基本上非多孔性ePTFE隔膜沿周向缠绕到心轴上,其中FEP侧朝向心轴。缠绕的心轴放置在设置为320℃的对流炉中并且加热持续20分钟,并且空气冷却到室温。ePTFE和基本上非多孔性ePTFE隔膜组合,以用作内部释放内衬,并且使用解剖刀片穿孔,以在心轴中的通风孔之间使压力连通。这整个释放内衬在随后的步骤中移除。5cm长度的带厚(990μ)壁部分地烧结22mm内径ePTFE管(密度=0.3g/cm3)安置到带有释放内衬的24.5通风金属心轴上。通过在锥形心轴上拉伸ePTFE管内径而使之内径扩大从而适应较大心轴直径。使用熔体挤压和拉伸来构造1型FEP薄(4μm)膜(ASTMD3368)。一层FEP缠绕到5cm长的ePTFE管上。涂布了FEP粉末的框架安置于通风金属心轴上、大体上在ePTFE管和FEP膜的5cm跨距的中间。一层FEP缠绕于瓣叶框架上和5cm长度的ePTFE管上。通过在锥形心轴上拉伸ePTFE管的半径以适应较大构造直径,将第二5cm长度的990μm厚/22mm内径ePTFE管安置于组件上,组件在24.5mm通风金属心轴上分层。基本上非多孔性ePTFE隔膜被配置为直径大于该构造的圆筒,并且放置于组件上,被称作牺牲管。烧结ePTFE纤维(例如,缝合线,零件号#S024T2,特拉华州纽瓦克(NewarkDE))用于抵靠心轴来密封牺牲管的两端。包括心轴在内的组件在对流炉中加热(温度设置点390℃),其能在上文所描述的牺牲管外部施加100磅/平方英寸(psi)的气动压力,同时维持心轴内部的真空。组件被热加工40分钟,以使得心轴温度到达大约360℃(如通过与心轴内径直接接触的热电偶所测量那样)。从炉移除该组件并且允许冷却到大约室温,同时仍在100磅/平方英寸(psi)压力和真空下。然后移除纤维和牺牲管。大约30磅/平方英寸(psi)的压力被施加到心轴的内径上以辅助移除组件。通过使内衬倒置并且沿轴向拉开它而使内释放内衬从组件内径剥离。利用解剖刀来修剪过量聚合材料并且从瓣叶窗口移除并且瓣叶框架底部留有大约0.5至1.0mm的材料垂悬。然后制备瓣叶材料。根据在美国专利7,306,729中描述的一般教导内容来制造ePTFE的隔膜。EPTFE隔膜具有0.452g/m2的单位面积质量,约508nm的厚度,在纵向方向上705MPa的基质拉伸强度和在横向方向上385MPa的基质拉伸强度。这个隔膜吸入了含氟弹性体。共聚物基本上包括在约65重量%与70重量%之间的全氟甲基乙烯基醚和互补地约35重量%与30重量%的四氟乙烯。这些含氟弹性体以2.5%浓度溶解于NovecHFE7500(明尼苏达州圣保罗的3M公司)中。使用麦勒棒(mayerbar)将溶液涂布到ePTFE隔膜(同时由聚丙烯释放膜支承)上并且在设置为145℃的对流炉中干燥持续30秒。在两次涂布步骤之后,最终ePTFE/含氟弹性体或复合物具有1.75g/m2的单位面积质量,29.3重量%的含氟聚合物、大约8.6KPa的穹顶爆裂强度和0.81μm的厚度。然后以如下方式将框架附连到呈圆柱形或管状形状的瓣叶材料上,框架封装有聚合材料,聚合材料限定应变消除。释放内衬安置于24.5mm通风心轴上,并且使用解剖刀片穿孔以连通在心轴中的各通风孔之间的压力。带有聚合应变消除的框架安置于释放内衬上,释放内衬在心轴的10cm跨距的大致中间覆盖通风金属心轴。六十二层瓣叶材料缠绕于框架和100cm长度的心轴上。利用解剖刀邻近通风孔从心轴修剪过量的瓣叶材料。牺牲管放置于组件上并且纤维用来抵靠心轴密封牺牲管的两端。包括心轴在内的组件在对流炉中加热(温度设置点390℃),其能在上文所描述的牺牲管外部施加100磅/平方英寸(psi)的气动压力,同时维持心轴内部的真空。组件被热加工23分钟,以使得心轴温度到达大约285℃(如通过与心轴内径直接接触的热电偶所测量)。从炉移除该组件并且允许冷却到大约室温,同时仍在100磅/平方英寸(psi)压力和真空下。然后移除纤维和牺牲管。大约30磅/平方英寸(psi)的压力被施加到心轴内部,以辅助移除组件。通过使释放内衬倒置并且沿轴向拉开它而使内释放内衬从组件内径剥离。然后,将框架和瓣叶组件的圆柱形状以如下方式模制成最终闭合瓣叶几何形状。将组件放置于24.5毫米的通风心轴上,通风心轴具有限定瓣叶闭合几何形状的腔。纤维用于抵靠心轴中的周向凹槽来密封瓣叶的两端。包括心轴在内的组件在对流炉中加热(温度设置点390℃),其能在上文所描述的牺牲管外部施加100磅/平方英寸(psi)的气动压力,同时维持心轴内部的真空。组件被热加工23分钟,以使得心轴温度到达大约285℃(如通过与心轴内径直接接触的热电偶而测量)。从炉移除该组件并且允许冷却到大约室温同时仍在100磅/平方英寸压力和真空下。然后移除纤维,并且向心轴的内径施加大约10磅/平方英寸压力,以辅助移除该组件。通常沿着图6A和图6B中示出的切割心轴712的腔模714中描绘的自由边缘线来修剪过量瓣叶材料。最终瓣叶材料包括28.22重量%的含氟聚合物,厚度为50.3μm。每个瓣叶具有62层复合物和0.81微米的厚度/层数比。所得到的瓣膜组件包括由复合材料形成的瓣叶,其具有多于一个带多个孔隙的含氟聚合物层和基本上存在于多于一个含氟聚合物层的所有孔隙内的弹性体。每个瓣叶能在图1D所示的闭合位置与图1C所示的打开位置之间运动,在闭合位置,基本上防止血液通过瓣膜组件,在打开位置,允许血液通过瓣膜组件。因此,瓣膜组件的瓣叶在闭合位置与打开位置之间循环,以通常调节人患者中的血流方向。在加速磨损测试之前测量流体动力学性能。性能值为EOA=2.4cm2,并且反流分数为=11.94%。利用解剖刀来修剪聚合材料并且从瓣叶窗口移除并且瓣叶框架底部留有大约0.5至1.0mm的材料垂悬。然后制备瓣叶材料。根据在美国专利7,306,729中描述的一般教导内容来制造ePTFE的隔膜。EPTFE隔膜具有0.452g/m2的单位面积质量,约508nm的厚度,在纵向方向上705MPa的基质拉伸强度和在横向方向上385MPa的基质拉伸强度。这个隔膜吸入了含氟弹性体。共聚物基本上包括在约65重量%与70重量%之间的全氟甲基乙烯基醚和互补地约35重量%与30重量%的四氟乙烯。含氟共聚物以2.5%浓度溶解于NovecHFE7500(明尼苏达州圣保罗的3M公司)中。使用麦勒棒(Mayerbar)将溶液涂布到ePTFE隔膜(同时由聚丙烯释放膜支承)上,并且在设置为145℃的对流炉中干燥持续30秒。在两次涂布步骤之后,最终ePTFE/含氟弹性体或复合物具有1.75g/m2的单位面积质量,29.3重量%的含氟聚合物、大约8.6KPa的圆顶爆裂强度和0.81μm的厚度。最终瓣叶包括28.22重量%的含氟聚合物,其厚度为50.3μm。每个瓣叶具有26层复合物和1.93μm的厚度/层数比。所得到的瓣膜组件包括由复合材料形成的瓣叶,复合材料具有多于一个带多个孔隙的含氟聚合物层和基本上存在于多于一个含氟聚合物层的所有孔隙内的弹性体。每个瓣叶能在图2D所示的闭合位置与图2C所示的打开位置之间运动,在闭合位置,基本上防止血液通过瓣膜组件,在打开位置,允许血液通过瓣膜组件。因此,瓣膜组件的瓣叶在闭合位置与打开位置之间循环,以通常调节人患者中的血流方向。瓣膜瓣叶的性能利用实时脉冲复制机来表征,实时脉冲复制机测量典型的解剖结构压力和跨瓣膜的流量。流动性能由以下过程来表征:瓣膜组件被封装到硅酮环形圈(支承结构)内,以允许随后在实时脉冲复制机中评估瓣膜组件。根据脉冲复制机制造商(加拿大维多利亚市(VictoriaBC,Canada)的维维托实验室公司(ViVitroLaboratoriesInc.))的建议来执行封装过程。封装的瓣膜组件然后放置于实时左心流动脉冲复制机系统中。流动脉冲复制机系统包括由加拿大维多利亚市的VSI维维托系统公司(VSIVivitroSystemsInc.,VictoriaBC,Canada)供应的以下部件:超级泵,伺服功率放大器零件编号SPA3891;超级泵头,零件编号SPH5891B,38.320cm2缸面积;瓣膜工位/固定件;波形生成器,TriPack零件编号TP2001;传感器接口,零件编号VB2004;传感器放大器部件,零件编号AM9991;以及,方波电磁流量计(美国北卡罗来纳伊斯特本的卡罗来纳医疗电子公司(CarolinaMedicalElectronicsInc.,EastBend,NC,USA))。一般而言,流动脉冲复制机系统使用固定排量活塞泵来产生流过被测试的瓣膜的所希望的流体流动。心脏流动脉冲复制机系统被调整为产生所希望的流量(5L/分钟)、平均压力(15毫米汞柱)和模拟脉冲速率(70bpm(拍/分钟))。被测试的瓣膜然后循环大约5至20分钟。在测试期间测量并且收集压力和流量数据,包括右心室压、肺动脉压、流率和泵活塞位置。用来表征瓣膜的参数为有效瓣口面积和反流分数。有效瓣口面积(EOA)可以如下计算:EOA(cm2)=Qrms/(51.6*(ΔP)1/2),其中Qrms是收缩/舒张流率(cm3/s)的均方根,而ΔP是平均收缩/舒张压降(毫米汞柱)。瓣膜的流体动力学性能的另一量度是反流分数,其是通过瓣膜反流的流体或血液量除以心搏量。在加速的磨损试验之前,流体动力学性能测量为EOA=2.4cm2,并且反流分数为=11.94%。如本文所使用,单位质量的表面积(以m2/g为单位表达)是在购自美国加利福尼亚州富勒顿贝克曼库尔特公司的库尔特SA3100气体吸附分析仪(CoulterSA3IOOGasAdsorptionAnalyzer,BeckmanCoulterInc)上通过布鲁诺一埃梅特-特勒(BET,Brunauer-Emmett-Te11er)方法测量的。为了进行该测试,从膨胀型含氟聚合物隔膜的中心切下一块样品,然后放入小样品管中。样品的质量为约0.1至0.2克。将管放入购自美国加利福尼亚州富勒顿贝克曼库尔特公司(BeckmanCoulter)的库尔特SA-Prep表面积脱气仪(型号为SA-Prep、零件号为5102014),然后在约110℃下鼓入约两小时的氦气。将样品管从SA-Prep脱气仪取出并称重。然后,将样品管放入SA3100气体吸附分析仪,根据仪器说明书进行BET表面积分析,利用氦气计算自由体积以及氮气作为吸附气体。使用购自纽约伊萨卡的多孔材料公司(PorousMaterialsInc.,Ithaca,NY)的型号CFP1500AEXL的毛细管流动气孔计,根据ASTMF316-03所述的一般技术测试泡点和平均流量孔径。将样品隔膜放置于样品室,用表面张力为约20.1达因(dynes)/厘米的SilWick聚硅氧烷流体(可从多孔材料公司购买(PorousMaterialsInc.))润湿。样品室的底部夹具有直径为约2.54厘米的孔。异丙醇用作测试流体。使用7.73.012版的Capwin软件,按下表所示设定以下参数。如本文所用的平均流动孔隙大小和孔隙尺寸可互换地使用。参数设置点最大流量(Maxflow)(cm3/m)200000气泡流量(Bublflow)(cm3/m)100F/PT(oldbubltime)(旧气泡时间)50最小气泡压力(Minbpress)(PSI)0零时间(Zerotime)(秒)1V2增加(V2incr)(厘斯(cts))10浸渍增加(Preginc)(厘斯(cts))1脉冲延迟(秒)2最大压力(Maxpre)(PSI)500脉冲宽度(秒)0.2最小等效时间(Mineqtime)(秒)30压力转换(Presslew)(厘斯(cts))10流动转换(Flowslew)(厘斯(cts))50等效重复(Eqiter)3平均重复(Aveiter)20最大压力扩散(Maxpdif)(PSI)0.1最大流动扩散(Maxfdif)(磅/平方英寸(PSI))50初始压力(Sartp)(磅/平方英寸(PSI))1初始流量(Sartf)(cm3/m)500将隔膜放置于购自德国菲林根-施文宁根的甲壳虫钟表有限公司(KSferMessuhrenfabrikGmbH)的FZ1000/30卡规的两块平板之间对隔膜厚度进行测量。取三次测量的平均值。本领域所属技术人员可用多种已知方法确定弹性体存在于孔中,如表面和/或截面观察,或其它分析。这些分析可在把弹性体从瓣叶除去之前或之后进行。将隔膜样品冲切形成约2.54厘米×约15.24厘米的矩形部分,以测量其质量(使用梅特勒-托伦脱分析天平(Mettler-Toledoanalyticalbalance),型号AG204)和厚度(使用FZ1000/30卡规)。使用这些数据,按照下式计算密度:ρ=m/w*l*t,其中:ρ=密度(克/立方厘米)、m=质量(克)、w=宽度(厘米)、1=长度(厘米)、以及t=厚度(厘米)。取三次测量的平均值。使用组装有平面夹具(flat-facedgrip)和0.445千牛的测力计的INSTR0N122拉伸测试仪测量拉伸断裂负荷。量规长度为约5.08厘米,十字头速度为约50.8厘米/分钟。样品尺寸为约2.54厘米乘约15.24厘米。纵向测试时,样品中更长的维度沿最高强度方向取向。正交MTS测试时,样品中更长的维度与最高强度方向垂直取向。使用梅特勒-托伦脱AG204型号天平(MettlerToledoScaleModelAG204)对各样品称重,再使用卡规测量样品的厚度。然后将样品在抗张测试仪上分别进行测试。分别测量每个样品的三个不同部分。取测得的三次最大负荷(即,峰值力)的平均值。采用下式计算纵向和横向的基质抗张强度MTS:MTS=(最大负荷/横截面积)*(PTFE的体密度)/(多孔隔膜的密度),其中PTFE的体密度为约2.2克/立方厘米。根据美国材料与测试协会标准D790(ASTMD790)所列的一般步骤测量抗弯刚度。除非有可用的大测试样品,否则测试样品必须缩小。测试条件如下所述。瓣叶样品是在三点弯曲测试仪上测试的,该测试仪使用了尖端杆,尖端杆水平方向相互间距为约5.08毫米。用一根直径约为1.34毫米、重约80毫克的钢棒产生y(向下)方向的变形,但样品的X方向没有任何约束。将钢棒缓慢的置于隔膜样品的中心点上。等待约5分钟后,测量y偏移量。按上述支撑的弹性梁的偏移量可用下式表示:d=F*L3/48*EI,式中F(N)为施加在梁长度中心处的负荷、长度L(m),因此L=l/2悬挂杆之间的距离,以及EI为弯曲硬度(Nm)。可根据这个关系计算EI的值。当截面为长方形时:I=t3*w/12,式中I=截面转动惯量、t=样品厚度(m)、w=样品宽度(米)。根据这个关系,可以计算所测弯曲偏移量范围内的平均弹性模量。上对于本领域技术人员显而易见,它不偏离本实施例的精神或范围的情况下可做出各种修改和变型。因此,预期本公开涵盖属于所附权利要求书和其等效物内的这些修改和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1