一种含有喹啉衍生物或其盐的药物组合物的制作方法
本发明属于药物制剂领域,具体涉及一种含有喹啉衍生物4-[3-氯-4-(环丙基氨基羰基)氨基苯氧基]-7-甲氧基-6-喹啉甲酰胺或其盐的药物组合物,该组合物具有溶出迅速、稳定性良好的特点。
背景技术:
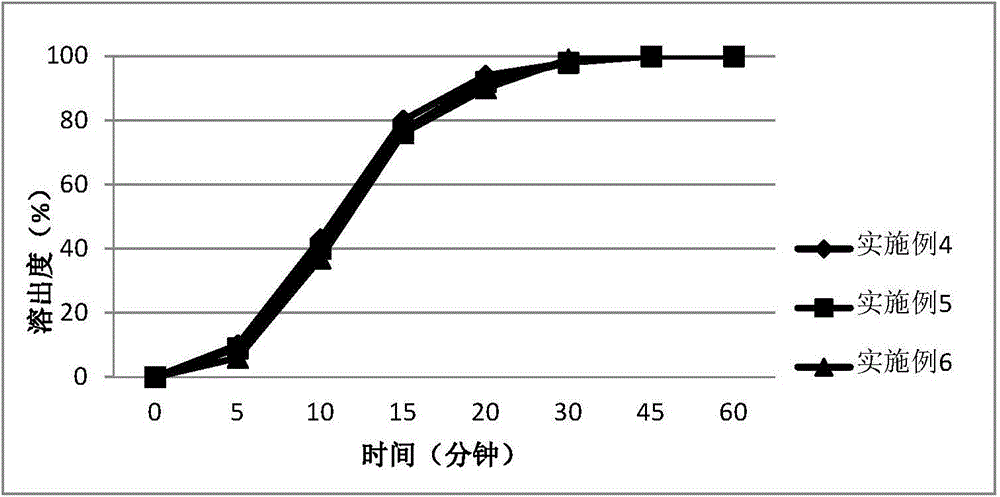
:WO2002032872公开了一种喹啉衍生物4-[3-氯-4-(环丙基氨基羰基)氨基苯氧基]-7-甲氧基-6-喹啉甲酰胺,已知其具有抑制参与肿瘤增殖的其他促血管生成和致癌信号通路相关RTK,还能够选择性抑制血管内皮生长因子(VEGF)受体的激酶活性,临床上可用于甲状腺癌、肺癌、黑色素瘤等多种肿瘤的治疗。但是,在将4-[3-氯-4-(环丙基氨基羰基)氨基苯氧基]-7-甲氧基-6-喹啉甲酰胺或其药学上可接受的盐制备成药物组合物时,在湿、热存在的条件下,药物发生分解,同时药物组合物吸湿,造成药物溶出度下降。专利CN101001629A公开了含有4-[3-氯-4-(环丙基氨基羰基)氨基苯氧基]-7-甲氧基-6-喹啉甲酰胺或其药学上可接受的盐的组合物,采用氧化镁等碱性无机化合物来解决药物的降解问题,同时采用硅酸类化合物来解决药物的溶出度下降问题。但是硅酸类化合物用量较大,硅酸类化合物密度极小,在生产中极易飘扬,造成对操作人员呼吸系统的伤害。同时在混合过程中,由于其密度与其他辅料相差较大,可能会造成物料混合不均匀的风险,给制剂工业化大生产造成困难。技术实现要素:本发明的目的在于提供一种稳定性良好同时溶出迅速的药物组合物,并且该药物组合物制备工艺简单,更适合工艺化大生产。本发明提供的药物组合物包括活性药物成分和碱性物质。活性药物成分为4-[3-氯-4-(环丙基氨基羰基)氨基苯氧基]-7-甲氧基-6-喹啉甲酰胺或其药理学上可接受的盐。碱性物质包括下述物质的一种或几种:(1)碱性氨基酸,(2)葡甲胺,(3)碳酸钾或碳酸氢钾中的至少一种化合物;其中,碱性氨基酸优选选自赖氨酸、精氨酸和组氨酸中的一种或几种。在本发明优选的实施方案中,所述碱性物质为精氨酸或葡甲胺中的至少一种 化合物与碳酸钾或碳酸氢钾中的至少一种化合物的混合物。在本发明特别优选的实施方案中,所述碱性物质为精氨酸或葡甲胺中的至少一种化合物与碳酸氢钾的混合物。在本发明的另一个优选的实施方案中,所述碱性物质为精氨酸与葡甲胺的混合物。当本发明的碱性物质是两种物质的混合物时,所述两种混合物的比例没有特别限制,在优选的实施方案中,它们的重量比例可以在1:0.1至1:10之间,优选1:0.5至1:2之间,最优选1:1。所述碱性物质的含量不受限制,只要含少量的上述碱性物质,即可起到提高溶出,增加稳定性的效果。为了制剂的方便,在本发明优选的实施方案中,所述碱性物质的含量范围可以是基于组合物总重量计0.5%-90%;优选1%-50%;更优选1-35%;最优选5-20%。本发明的药物组合物中,所述活性成分的药理学上可接受的盐可以选自盐酸盐、氢溴酸盐、对甲苯磺酸盐、甲磺酸盐、硫酸盐或乙磺酸盐。基于组合物的总重量,所述活性成分的含量范围可以是基于组合物总重量计0.5%-30%;优选1%-25%;最优选1-15%。本发明提供的药物组合物可以含有填充剂,例如微晶纤维素、磷酸氢钙、甘露醇、预胶化淀粉、乳糖等一种或多种。基于组合物的总重量,所述填充剂含量为约5%~80%。本发明提供的药物组合物可以含有崩解剂,其中崩解剂为交联羧甲基纤维素钠、羧甲基淀粉钠、低取代羟丙基纤维素及交联聚维酮中的一种或多种。基于组合物的总重量,所述崩解剂含量为约1%~30%。本发明提供药物组合物可以含有粘合剂,所述粘合剂可选自羟丙甲纤维素、羟丙基纤维素、羧甲基纤维素钠、聚乙烯吡咯烷酮、甲基纤维素等一种或多种,基于组合物的总重量,所述粘合剂含量为约0.5~15%。本发明提供的药物组合物还可包含一种或多种润滑剂,有助于灌装胶囊或压片。润滑剂可选自滑石粉、硬脂酸镁、硬脂酸锌、山嵛酸甘油酯、月桂基硫酸钠、氢化植物油、胶体二氧化硅等。基于组合物的总重量,所述润滑剂的含量为约0.5%~5%本发明的药物组合物可以采用本领域常见的方法制备,例如高剪切湿法制粒、干法制粒、一步制粒等方法制备药物组合物颗粒,然后灌装胶囊,制备硬胶囊剂。附图说明图1显示实施例1至3的胶囊在0.1mol/L盐酸溶液中的溶出曲线。图2显示实施例4至6的胶囊在0.1mol/L盐酸溶液中的溶出曲线。图3显示实施例7至11以及比较例1的胶囊在0.1mol/L盐酸溶液中的溶出曲 线。图4显示实施例12至16以及比较例2的胶囊在0.1mol/L盐酸溶液中的溶出曲线。图5显示比较例3与比较例4的胶囊在0.1mol/L盐酸溶液中的溶出曲线。图6显示实施例3的胶囊以及其放置7天后在0.1mol/L盐酸溶液中的溶出曲线。图7显示实施例6的胶囊以及其放置7天后在0.1mol/L盐酸溶液中的溶出曲线。图8显示实施例12的胶囊以及其放置7天后在0.1mol/L盐酸溶液中的溶出曲线。图9显示实施例13的胶囊以及其放置7天后在0.1mol/L盐酸溶液中的溶出曲线。图10显示实施例14的胶囊以及其放置7天后在0.1mol/L盐酸溶液中的溶出曲线。图11显示实施例15的胶囊以及其放置7天后在0.1mol/L盐酸溶液中的溶出曲线。图12显示实施例16的胶囊以及其放置7天后在0.1mol/L盐酸溶液中的溶出曲线。图13显示比较例2的胶囊以及其放置7天后在0.1mol/L盐酸溶液中的溶出曲线。图14显示比较例3的胶囊以及其放置7天后在0.1mol/L盐酸溶液中的溶出曲线。图15显示比较例4的胶囊以及其放置7天后在0.1mol/L盐酸溶液中的溶出曲线。具体实施方式通过以下实施例和实验例进一步详细说明本发明。这些实施例和实验例仅用于说明性目的,而并不用于限制本发明的范围。实施例1~3将4-[3-氯-4-(环丙基氨基羰基)氨基苯氧基]-7-甲氧基-6-喹啉甲酰胺的甲磺酸盐(以下简称为化合物A)、精氨酸、D-甘露醇、微晶纤维素、羟丙基纤维素、低取代羟丙基纤维素,按表1中的比例,采用高速剪切制粒机进行湿法制粒,以纯化水为润湿剂,对湿软材进行湿整粒及干燥处理,然后将干颗粒(水分小于2%)进行干整粒,加入处方量的滑石粉,采用旋转总混机进行混合。将得到的总混颗粒灌装胶囊,制备胶囊剂。表1成分实施例1实施例2实施例3化合物A2.54.914.7精氨酸10.010.010.0D-甘露醇23.521.111.3羟丙基纤维素3.03.03.0微晶纤维素33.033.033.0低取代羟丙基纤维素25.025.025.0滑石粉3.03.03.0总计100100100单位:质量%实施例4~6将4-[3-氯-4-(环丙基氨基羰基)氨基苯氧基]-7-甲氧基-6-喹啉甲酰胺的甲磺酸盐(以下简称为化合物A)、葡甲胺、D-甘露醇、微晶纤维素、羟丙基纤维素、低取代羟丙基纤维素,按表1中的比例,采用高速剪切制粒机进行湿法制粒,以纯化水为润湿剂,对湿软材进行湿整粒及干燥处理,然后将干颗粒(水分小于2%)进行干整粒,加入处方量的滑石粉,采用旋转总混机进行混合。将得到的总混颗粒灌装胶囊,制备胶囊剂。表2成分实施例4实施例5实施例6化合物A2.54.914.7葡甲胺10.010.010.0D-甘露醇23.521.111.3羟丙基纤维素3.03.03.0微晶纤维素33.033.033.0低取代羟丙基纤维素25.025.025.0滑石粉3.03.03.0总计100100100单位:质量%实施例7~16,比较例1~2将4-[3-氯-4-(环丙基氨基羰基)氨基苯氧基]-7-甲氧基-6-喹啉甲酰胺的甲磺酸 盐(以下简称为化合物A)、精氨酸或葡甲胺、碳酸氢钾或碳酸钾、D-甘露醇、微晶纤维素、羟丙基纤维素、低取代羟丙基纤维素,按表1中的比例,采用高速剪切制粒机进行湿法制粒,以纯化水为润湿剂,对湿软材进行湿整粒及干燥处理,然后将干颗粒(水分小于2%)进行干整粒,加入处方量的滑石粉,采用旋转总混机进行混合。将得到的总混颗粒灌装胶囊,制备胶囊剂。并且采用同样的方法制备不含精氨酸、葡甲胺、碳酸钾和碳酸氢钾的比较例1~2的胶囊剂。表3成分比较例1实施例7实施例8实施例9实施例10实施例11化合物A4.94.94.94.94.94.9精氨酸010.010.010.000葡甲胺010.00010.010.0碳酸钾0010.0010.00碳酸氢钾00010.0010.0D-甘露醇31.111.111.111.111.111.1羟丙基纤维素3.03.03.03.03.03.0微晶纤维素33.033.033.033.033.033.0低取代羟丙基纤维素25.025.025.025.025.025.0滑石粉3.03.03.03.03.03.0总计100100100100100100单位:质量%表4成分比较例2实施例12实施例13实施例14实施例15实施例16化合物A14.714.714.714.714.714.7精氨酸010.010.010.000葡甲胺010.00010.010.0碳酸钾0010.0010.00碳酸氢钾00010.0010.0D-甘露醇31.111.111.111.111.111.1羟丙基纤维素3.03.03.03.03.03.0微晶纤维素23.223.223.223.223.223.2低取代羟丙基纤维素25.025.025.025.025.025.0滑石粉3.03.03.03.03.03.0总计100100100100100100单位:质量%实验例1:溶出实验根据中国药典2010版二部附录溶出度测定第二法(桨法),对实施例1~16和比较例1~2的胶囊剂进行溶出度测定。使用900ml的0.1mol/L盐酸溶液作为溶出介质,并在37±0.5℃下以50rpm的桨速进行溶出试验。结果表明,处方中含精氨酸与碳酸钾或碳酸氢钾的实施例8、9、13、14的胶囊剂中,化合物A溶出迅速完全;处方中含葡甲胺与碳酸钾或碳酸氢钾的实施例10、11、15、16的胶囊剂中,化合物A溶出迅速完全;处方中只含精氨酸或葡甲胺的实施例1~6以及处方中含精氨酸与葡甲胺的实施例7、12的胶囊剂中,化合物A溶出缓慢一些,但溶出完全;不含精氨酸、葡甲胺、碳酸钾及碳酸氢钾的比较例1~2的胶囊剂中,化合物A溶出缓慢且不完全。溶出曲线图见图1、图2、图3和图4。比较例3~4以表5的处方比例,将化合物A、碳酸钾或碳酸氢钾、D-甘露醇、微晶纤维素、羟丙基纤维素、低取代羟丙基纤维素,采用高速剪切制粒机进行湿法制粒及干燥处理,然后将干颗粒(水分小于2%)进行干整粒,加入处方量的滑石粉,混合,将得到的总混颗粒灌装胶囊,制备比较例3~4的胶囊剂。表5成分比较例3比较例4化合物A14.714.7碳酸钾20.00碳酸氢钾020.0D-甘露醇11.311.3羟丙基纤维素3.03.0微晶纤维素23.023.0低取代羟丙基纤维素25.025.0滑石粉3.03.0总计100100单位:质量%实验例2:溶出实验根据中国药典2010版二部附录溶出度测定第二法(桨法),对比较例3~4的胶囊剂进行溶出度测定。使用900ml的0.1mol/L盐酸溶液作为溶出介质,并在37±0.5℃下以50rpm的桨速进行溶出试验。结果表明,处方中含有碳酸钾或碳酸氢钾的比较例3~4的胶囊剂中,化合物A溶出迅速完全。溶出曲线图见图5。实验例3:稳定性研究将实施例3、6和实施例12~16的胶囊剂和比较例2~4的胶囊剂,置于温度60℃、相对湿度75%的环境下,在开放条件中放置7天,然后采用HPLC法测定降解物的生成,采用中国药典2010版二部附录溶出度测定第二法(桨法),对放置7天后的样品测定溶出度。降解物测定结果表明,实施例3(含精氨酸)、实施例6(含葡甲胺)、实施例12(含精氨酸与葡甲胺)、实施例13(含精氨酸与碳酸钾)、实施例14(含精氨酸碳酸氢钾)、实施例15(含葡甲胺与碳酸钾)、实施例16(含葡甲胺与碳酸钾)的胶囊剂中,降解物没有增加,比较例3(含碳酸钾)、比较例4(含碳酸氢钾)的胶囊剂中,降解物也没有增加,而未含有碱性辅料的比较例2的胶囊剂中,降解物明显增加。(见表6)溶出度结果表明,实施例3(含精氨酸)、实施例6(含葡甲胺)、实施例12(含精氨酸与葡甲胺)、实施例13(含精氨酸与碳酸钾)、实施例14(含精氨酸碳酸氢钾)、实施例15(含葡甲胺与碳酸钾)、实施例16(含葡甲胺与碳酸钾)的胶囊剂中,化合物A的溶出度在放置7天后与初期相比仍没有明显下降,溶出完全。比较例2(无碱性辅料)的胶囊剂中,化合物A初期与放置7天后的溶出均不完全,比较例3(含碳酸钾)、比较例4(含碳酸氢钾)的胶囊剂中,化合物A的溶出度在放置7天后与初期相比明显下降,放置7天后溶出不完全。(见图6至15)。表6当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1