一种制作难溶药物固体剂型的方法与流程
本发明涉及医药领域,特别是涉及一种制作难溶药物固体剂型的方法。
背景技术:
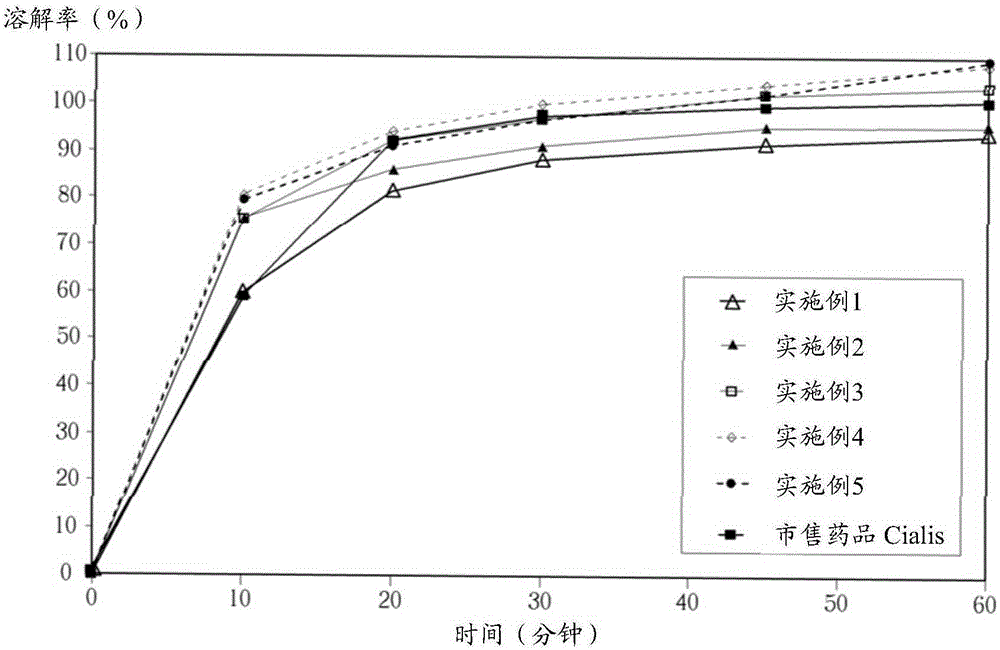
:由于β-咔啉(β-Carboline)或氨基三唑(Triazole)类化合物所具有的水难溶性促进了提升溶离速率方法的发展,如在PCT公报WO96/38131和Butler美国专利第5,985,326号中所揭示的共沉淀技术。此技术是制备β-咔啉化合物与例如聚合物型羟丙基甲基纤维素苯二甲酸酯的共沉淀物,经研磨后与赋形剂混合并打锭成口服锭剂。但此方法的缺点是放大批量制造困难且制程复杂,使得该技术在实际的应用上受限。此外,使用共沉淀技术所制造的锭剂,进行的临床研究结果显示,β-咔啉化合物的最大血液浓度是在3至4小时达到,而对于治疗效用起始的平均时间则尚未明确地被测定出。但在性功能障碍的应用,例如男性勃起障碍或女性性欲激起病的治疗中,最大的血液浓度的更快到达,以更快达到疗效是主要希望的目的。因此,增加β-咔啉化合物的医药组合物的溶离速率以缩短其于人体最大血液浓度达到的时间和增加生体可用率,在本制造技艺领域中仍有其继续进步的需要。另外,台湾第I235658号发明专利中所揭示的自由药物形式的粒状制剂技术,提出一种具有特定且明确的粒度特性的β-咔啉化合物自由药物形式的粒状制剂。美国专利第8,288,394号也揭露了一种微粒化(micronized)氨基三唑化合物药物的粒状形式其具有特定且明确的粒度特性。更特别者,当氨基三唑化合物药物的粒状形式有90%小于150微米的粒度,尤其具有0.5~2m2/g的特定表面积及约4~20μm沙得平均直径(Sauterdiameter)时,可以有效克服许多药品上难溶的问题。明确的粒 度虽可促成稳定医药组合物的均匀调配和提升溶离速率,但要求特定且明确粒度特性的原料来源和质量管控原本即不容易,因此在备料和制造上会耗费许多的时间和成本,也因此限制了此技术在实际应用上的范围。因此,以改良的方法制造β-咔啉或氨基三唑化合物的医药组合物,并同时增加溶离速率和人体生体可用率仍有其需要。技术实现要素:本发明主要解决的技术问题是提供一种制作难溶药物固体剂型的方法,特别针对β-咔啉或氨基三唑化合物的医药组合物。根据本发明的其中一个实施方式,本发明制作难溶药物固体剂型的方法包括:(1)将难溶药物加入有机溶液以及聚山梨醇酯中,形成溶液一;(2)将所述溶液一加入溶液二与至少一种医药上可接受的赋形剂中,其中所述溶液二包含水及/或月桂基硫酸钠,且所述溶液二与所述溶液一的体积比率为8:1~1:1;以及(3)将所述步骤(2)的产物干燥压缩,以形成难溶药物的固体剂型。本发明的有益效果是:区别于现有技术的情况,本发明所提供的制作难溶药物的固态剂型的方法,使用的溶液一与溶液二的特殊配方,可以增加药物的溶出速率,且制作的方法不受药物的粒度大小所限制。在本发明所提供的特殊比例的剂型下,比市售药物有更突出的离溶效果,对于药物在生物体内的吸收有显著的提升。附图说明图1是本发明实施例提供的一种制作难溶药物固体剂型的方法的流程图;图2是本发明实施例提供的包含主成分(他达拉非)锭剂的溶出率对时间的示意图;图3是本发明实施例提供的另一包含主成分(他达拉非)锭剂的溶出率对时间的示意图;图4是本发明实施例提供的还有一(伏立康唑)锭剂的溶出率对时间的示意图。具体实施方式以下结合具体实施方式和附图对本发明的方法和实现功效进行进一步的阐述,但是,这些只是本发明的具体实现方式,并不用以限制本发明的保护范围。本发明主要目的在于提供一种制作难溶药物的固体剂型的方法。本发明所制造的口服锭剂较佳是使用湿式造粒法。一般造粒主要分成湿式与干式造粒,而所谓湿式造粒就是在造粒过程中需加水或溶剂以有效地结合有效成份及非有效成份(赋型剂)成特定形状。而干式造粒,则省略了加水或溶剂的步骤,因此不需再干燥而可以直接进行打锭压缩,但干式造粒制程中通常仍可添加黏合剂及润滑剂。一些密度较松散但比重相对较轻且流动性差的原料,经过干式造粒可获得改善,成为假比重大、密度高、且流动性良好的原料或成品。请参阅图1,图1是本发明实施例提供的一种制作难溶药物的固体剂型的方法的流程图。如图所述,本实施例的制作难溶药物的固体剂型的的方法包括:S300:将难溶药物加入有机溶液以及聚山梨醇酯(polysorbate)中,形成溶液一;S302:提供溶液二,包含水或月桂基硫酸钠(sodiumlaurylsulfate,SLS)溶液;S304:混合溶液一与溶液二,并加上至少一种医药上可接受的赋形剂,溶液二与溶液一的体积比率为8:1~1:1;S306:将S304的产物干燥压缩,以形成难溶药物的固体剂型。以下将针对以上各步骤进一步详细说明。在S300中,是将难溶药物加入有机溶液以及聚山梨醇酯(polysorbate)中,完全溶解后形成溶液一。本发明所称的药物,是指各种原料药及制剂,包括各种使用于诊断、治疗、减轻或预防人类疾病的药品,或是其他足以影响人类身体结构及生理机能的药品,或用以配制前述药品的化学成分。本发明所称难溶药物(veryslightlysoluble),是指依照美国药典 (UnitedStatesPharmacopeia,USP)的标准,药物与溶剂的比例为1000以上才可完全溶解的药物。在一实施例中,难溶药物包含β-咔啉(β-Carboline)化合物或氨基三唑(Triazole)化合物。举例而言,β-咔啉化合物例如是他达拉非(Tadalafil),其水溶解度为2g/1,000,000ml;而氨基三唑化合物例如是伏立康唑(Voriconazole),其水溶解度为1g/10,000ml,或伊曲康唑(Itraconazole),其水溶解度为1g/1,000ml。值得注意的是,由于本发明制作方法可以轻易制作难溶药物的固态药剂,故难溶药物的粒子粒度并无特别限制。一般小于150微米的难溶药物在常规技术中不易被制作,但可在本发明中轻易完成。因此在一实施例中,难溶药物的粒度至少有90%的粒子大于150微米;另一实施例中,难溶药物的粒度至少有90%的粒子在150微米与40微米之间;另一实施例中,难溶药物的粒度至少有90%的粒子大于40微米。本发明的有机溶剂是任何具有极性(polarity)的溶剂。在一实施例中,有机溶液是指极性指数(polarityindex)为5.0~7.0之间的有机溶剂,较佳是5.8-6.7,更佳的有机溶剂极性范围约为6.5,以在后续造粒中增加粉体的流动性和结合性,以提升打锭效率。请参考下列表1,表1所示为一般常用溶剂的极性指数。表1:以上述表1所示,极性指数为5.0-7.0间的有机溶剂包含丙酮 (Acetone)、甲醇(Methanol)、乙醇(Ethanol)、吡啶(Pyridine)、2-甲氧基乙醇(2-Methoxyethanol)、乙腈(Acetonitrile)、碳酸丙烯酯(PropyleneCarbonate)、乙酸(Aceticacid)、N,N-二甲基甲酰胺(N,N-Dimethylformamide)、N,N-二甲基乙酰胺(N,N-DimethylAcetamide)、N-甲基吡咯烷酮(N-Methylpyrrolidone)。其中优选的有机溶剂极性范围约为5.8-6.7者,包含乙腈、碳酸丙烯酯、乙酸、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲基吡咯烷酮,最优选的有机溶剂极性范围约为6.5者,包含N,N-二甲基乙酰氨(N,N-DimethylAcetamide,简称为DMA)。上述列举极性指数范围的有机溶剂仅为示例,本领域技术人员应了解极性指数的溶剂应不限于上述所列的溶剂。此外,在S300的聚山梨醇酯(polysorbate)可以是各种不同聚合度的聚山梨醇酯,包含聚山梨醇酯20、聚山梨醇21、酯聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯61、聚山梨醇酯65、聚山梨醇酯80、聚山梨醇酯81、聚山梨醇酯85或是聚山梨醇酯120等。在本发明优选实施例中,是使用聚山梨醇酯80(又称Tween80)。需注意的是,S300中有机溶剂、聚山梨醇酯、难溶药物之间加入的顺序可以任意配置,较优选是先将难溶药物加入有机溶剂搅拌使之完全溶解后再加入聚山梨醇酯,但并不以此为限。在一实施例中,可使用磁石搅拌并加热至一适当温度(例如是摄氏60度)使其中成分完全溶解,而形成溶液一。在S302中,所述溶液二包含水及/或月桂基硫酸钠(sodiumlaurylsulfate,SLS)溶液。在一实施例中,溶液二为二次水(DIwater);而在另一实施例中,溶液二为月桂基硫酸钠的水溶液。在S304中,是将溶液一与溶液二混合,并可选择性地加入任何医药上可接受的赋型剂或载体。在一实施例中,是将造粒用的赋形剂以筛网30目筛过筛以去除结块后置入高速造粒机中,并将上述溶液一和溶液二以约8:1~1:1的比例逐步地加入高速造粒机中混合并造粒,此较优选的混合比例约为4:1~1.5:1,最优选的混合比例约为2:1。本发明所述的赋型剂或载体,包含各种用于制药上除有效活性成分的其他物质,例如各种稀释剂、崩解剂、黏合剂、湿润剂或润滑剂等。在一实施例中, 稀释剂例如是乳糖水合物和微晶纤维素等;崩解剂,例如是交联羧甲基纤维素钠和羧甲基淀粉钠等;黏合剂,例如是羟丙基纤维素和聚乙烯吡咯烷酮;润滑剂,例如硬脂酸镁和硬脂酸等。上述赋型剂的使用方法和用量可参考药用辅料手册,第6版(HandbookofPharmaceuticalExcipients,6thEdition,Amer.Pharm.Assoc.(2009))。在一实施例中,各种赋型剂一般的使用量如下表2所示。表2:赋型剂名称(功能别)重量百分比(%)乳糖水合物(稀释剂)15~75%微晶纤维素(稀释剂)20~90%羟丙基纤维素(黏合剂)1~5%交联羧甲基纤维素钠(崩解剂)0.5~5%硬脂酸镁(润滑剂)0.25~5%最后,如S306所示,将溶液一与溶液二混合后的产物干燥压缩,以形成固体剂型。固体剂型例如是锭剂、口含锭、舌下锭、糖衣锭、肠衣锭、膜衣锭、咀嚼锭、发泡锭、胶囊剂、长效缓释锭等,且不以上述为限。在一实施例中,在经过前述步骤的造粒完成后,将湿团块以筛网目筛过筛以去除结块并增加干燥效率。干燥时可使用流动床干燥机或烘箱,温度可设定在50~90℃,烘干至含水率0.1~2%wt。在一实施例中,若有机溶剂是使用DMA,干燥完成后会管控其残留量小于1,090ppm以符合药品法规要求。干燥达标准后,将干燥的颗粒以筛网30目筛过筛以去除结块以形成混合物一。接着将外加的赋形剂,例如微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁以筛网30目筛过筛以去除结块后,再将其加入上述已干燥完成的颗粒(即上述混合物一)并混合均匀以形成混合物二。混合后的混合物二颗粒以适当的打锭模具和打锭机进行打锭, 以形成固体剂型。在本发明其中一实施例中,最终的固体剂型中(包含造粒后的外加成分)聚山梨醇酯的重量百分比为0.1-0.6%wt,例如是0.3%wt;而月桂基硫酸钠的重量百分比小于等于1.0%wt。此外,本方法中所用的纯水和N,N-二甲基乙酰氨,会在锭剂制造过程中去除,并订定残留限量标准以确保产品质量,因此较优选的,最终的固体剂型中没有N,N-二甲基乙酰氨,或是其含量至少小于1,090ppm。以下提供几个实施例以及比较例,并提供相关实验以证实本发明的功效。实施例1以下为制备1,000颗含20毫克Tadalafil为主成分的锭剂配方。*注:总重内不含50g纯水。本实施例制程:(本例以湿式造粒法制造锭剂)1.首先将Tadalafil溶于40克纯水中并以磁石搅拌直至完全混合,以此作为造粒用的溶液一。2.接着将月桂基硫酸钠(SLS)溶于10克纯水并以磁石搅拌直至完全溶解,以此作为造粒用的溶液二。3.再将要造粒的赋形剂(即乳糖水合物、羟丙基纤维素、交联羧甲基纤维素钠)以筛网过筛以去除结块后置入高速造粒机中。4.将上述溶液一和溶液二以2:1的比例逐步地加入高速造粒机中造粒。5.造粒完成后将湿团块以筛网过筛以去除结块增加干燥效率。干燥湿粒使用流动床干燥机。6.干燥达标准后,将干燥的颗粒以筛网过筛以去除结块,形成混合物一。7.接着将外加的赋形剂(即微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁)以筛网过筛以去除结块后,加入上述的干燥后的颗粒(混合物一)并混合均匀,形成混合物二。8.混合均匀后的颗粒(混合物二)以适当的打锭模具和打锭机打锭。9.打锭完成后进行膜衣包覆制程。本制造方法中所用的纯水和药典级N,N-二甲基乙酰氨,已在制造过程中去除至标准限定值以下。实施例2以下为制备1,000颗含20毫克tadalafil为主成分的锭剂配方。*注:总重内不含10g纯水及40gDMA。本实施例制程:(本例以湿式造粒法制造锭剂)1.首先将Tadalafil溶于药典级N,N-二甲基乙酰氨(DMA)中并以磁石搅拌同时加热至60℃直至完全溶解,以此作为造粒用的溶液一。2.接着将月桂基硫酸钠(SLS)溶于10克纯水并以磁石搅拌直至完全溶解,以此作为造粒用的溶液二。3.再将要造粒的赋形剂(即乳糖水合物、羟丙基纤维素、交联羧甲基纤维素钠)以筛网过筛以去除结块后置入高速造粒机中。4.将上述溶液一和溶液二以2:1的比例逐步地加入高速造粒机中造粒。5.造粒完成后将湿团块以筛网过筛以去除结块增加干燥效率。干燥湿粒时使用流动床干燥机,并管控DMA残留量小于标准限定值。6.干燥达标准后,将干燥的颗粒以筛网过筛以去除结块,形成混合物一。7.接着将外加的赋形剂(即微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁)以筛网过筛以去除结块后,加入上述的干燥后的颗粒(混合物一)并混合均匀,形成混合物二。8.混合均匀后的颗粒(混合物二)以适当的打锭模具和打锭机打锭。9.打锭完成后进行膜衣包覆制程。本制造方法中所用的纯水和药典级N,N-二甲基乙酰氨,已在制造过程中去除至标准限定值以下。实施例3以下为制备1,000颗含20毫克tadalafil为主成分的锭剂配方。*注:总重内不含10g纯水及40gDMA。本实施例制程:(本例以湿式造粒法制造锭剂)1.首先将Tadalafil和Tween80溶于药典级N,N-二甲基乙酰氨(DMA)中并以磁石搅拌同时加热至60℃直至完全溶解,以此作为造粒用的溶液一。2.接着将月桂基硫酸钠(SLS)溶于纯水并以磁石搅拌直至完全溶解,以此作为造粒用的溶液二。3.再将要造粒的赋形剂(即乳糖水合物、羟丙基纤维素、交联羧甲基纤维素钠)以筛网过筛以去除结块后置入高速造粒机中。4.将上述溶液一和溶液二以2:1的比例逐步地加入高速造粒机中造粒。5.造粒完成后将湿团块以筛网过筛以去除结块增加干燥效率。干燥湿粒时使用流动床干燥机,并管控DMA残留量小于标准限定值。6.干燥达标准后,将干燥的颗粒以筛网过筛以去除结块,形成混合物一。7.接着将外加的赋形剂(即微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁)以筛网过筛以去除结块后,加入上述的干燥后的颗粒(混合物一)并混合均匀,形成混合物二。8.混合均匀后的颗粒(混合物二)以适当的打锭模具和打锭机打锭。9.打锭完成后进行膜衣包覆制程。本制造方法中所用的纯水和药典 级N,N-二甲基乙酰氨,已在制造过程中去除至标准限定值以下。实施例4以下为制备1,000颗含20毫克tadalafil为主成分的锭剂配方。*注:总重内不含10g纯水及40gDMA。本实施例制程:(本例以湿式造粒法制造锭剂)1.首先将Tadalafil和Tween80溶于药典级N,N-二甲基乙酰氨(DMA)中并以磁石搅拌同时加热至60℃直至完全溶解,以此作为造粒用的溶液一。2.接着将月桂基硫酸钠(SLS)溶于纯水并以磁石搅拌直至完全溶解,以此作为造粒用的溶液二。3.再将要造粒的赋形剂(即乳糖水合物、羟丙基纤维素、交联羧甲基纤维素钠)以筛网过筛以去除结块后置入高速造粒机中。4.将上述溶液一和溶液二以2:1的比例逐步地加入高速造粒机中造粒。5.造粒完成后将湿团块以筛网过筛以去除结块增加干燥效率。干燥 湿粒时使用流动床干燥机,并管控DMA残留量小于标准限定值。6.干燥达标准后,将干燥的颗粒以筛网过筛以去除结块,形成混合物一。7.接着将外加的赋形剂(即微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁)以筛网过筛以去除结块后,加入上述的干燥后的颗粒(混合物一)并混合均匀,形成混合物二。8.混合均匀后的颗粒(混合物二)以适当的打锭模具和打锭机打锭。9.打锭完成后进行膜衣包覆制程。本制造方法中所用的纯水和药典级N,N-二甲基乙酰氨,已在制造过程中去除至标准限定值以下。实施例5以下为制备1,000颗含20毫克tadalafil为主成分的锭剂配方。*注:总重内不含10g纯水及40gDMA。本实施例制程:(本例以湿式造粒法制造锭剂)1.首先将Tadalafil和Tween80溶于药典级N,N-二甲基乙酰氨(DMA)中并以磁石搅拌同时加热至60℃直至完全溶解,以此作为造粒用的溶 液一。2.接着将月桂基硫酸钠(SLS)溶于纯水并以磁石搅拌直至完全溶解,以此作为造粒用的溶液二。3.再将要造粒的赋形剂(即乳糖水合物、羟丙基纤维素、交联羧甲基纤维素钠)以筛网过筛以去除结块后置入高速造粒机中。4.将上述溶液一和溶液二以2:1的比例逐步地加入高速造粒机中造粒。5.造粒完成后将湿团块以筛网过筛以去除结块增加干燥效率。干燥湿粒时使用流动床干燥机,并管控DMA残留量小于标准限定值。6.干燥达标准后,将干燥的颗粒以筛网过筛以去除结块,形成混合物一。7.接着将外加的赋形剂(即微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁)以筛网过筛以去除结块后,加入上述的干燥后的颗粒(混合物一)并混合均匀,形成混合物二。8.混合均匀后的颗粒(混合物二)以适当的打锭模具和打锭机打锭。9.打锭完成后进行膜衣包覆制程。本制造方法中所用的纯水和药典级N,N-二甲基乙酰氨,已在制造过程中去除至标准限定值以下。实施例6以下为制备1,000颗含20毫克tadalafil为主成分的锭剂配方。*注:总重内不含10g纯水及40gDMA。本实施例制程:(本例以湿式造粒法制造锭剂)1.首先将Tadalafil溶于药典级N,N-二甲基乙酰氨(DMA)中并以磁石搅拌同时加热至60℃直至完全溶解,以此作为造粒用的溶液一。2.接着将称取10克纯水,以此作为造粒用的溶液二。3.再将要造粒的赋形剂(即乳糖水合物、羟丙基纤维素、交联羧甲基纤维素钠)以筛网过筛以去除结块后置入高速造粒机中。4.将上述溶液一和溶液二以2:1的比例逐步地加入高速造粒机中造粒。5.造粒完成后将湿团块以筛网过筛以去除结块增加干燥效率。干燥湿粒时使用流动床干燥机,并管控DMA残留量小于标准限定值。6.干燥达标准后,将干燥的颗粒以筛网过筛以去除结块,形成混合物一。7.接着将外加的赋形剂(即微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁)以筛网过筛以去除结块后,加入上述的干燥后的颗粒(混合物一)并混合均匀,形成混合物二。8.混合均匀后的颗粒(混合物二)以适当的打锭模具和打锭机打锭。9.打锭完成后进行膜衣包覆制程。本制造方法中所用的纯水和药典级N,N-二甲基乙酰氨,已在制造过程中去除至标准限定值以下。实施例7以下为制备1,000颗含20毫克tadalafil为主成分的锭剂配方。*注:总重内不含10g纯水及40gDMA。本实施例制程:(本例以湿式造粒法制造锭剂)1.首先将Tadalafil溶于药典级N,N-二甲基乙酰氨(DMA)中并以磁石搅拌同时加热至60℃直至完全溶解,以此作为造粒用的溶液一。2.接着将月桂基硫酸钠(SLS)溶于纯水并以磁石搅拌直至完全溶解,以此作为造粒用的溶液二。3.再将要造粒的赋形剂(即乳糖水合物、羟丙基纤维素、交联羧甲基纤维素钠)以筛网过筛以去除结块后置入高速造粒机中。4.将上述溶液一和溶液二以2:1的比例逐步地加入高速造粒机中造粒。5.造粒完成后将湿团块以筛网过筛以去除结块增加干燥效率。干燥湿粒时使用流动床干燥机,并管控DMA残留量小于标准限定值。6.干燥达标准后,将干燥的颗粒以筛网过筛以去除结块,形成混合物一。7.接着将外加的赋形剂(即微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁)以筛网过筛以去除结块后,加入上述的干燥后的颗粒(混合物一)并混合均匀,形成混合物二。8.混合均匀后的颗粒(混合物二)以适当的打锭模具和打锭机打锭。9.打锭完成后进行膜衣包覆制程。本制造方法中所用的纯水和药典级N,N-二甲基乙酰氨,已在制造过程中去除至标准限定值以下。实施例8以下为制备1,000颗含20毫克tadalafil为主成分的锭剂配方。*注:总重内不含10g纯水及40gDMA。本实施例制程:(本例以湿式造粒法制造锭剂)1.首先将Tadalafil溶于药典级N,N-二甲基乙酰氨(DMA)中并以磁石搅拌同时加热至60℃直至完全溶解,以此作为造粒用的溶液一。2.接着将月桂基硫酸钠(SLS)溶于纯水并以磁石搅拌直至完全溶解,以此作为造粒用的溶液二。3.再将要造粒的赋形剂(即乳糖水合物、羟丙基纤维素、交联羧甲基纤维素钠)以筛网过筛以去除结块后置入高速造粒机中。4.将上述溶液一和溶液二以2:1的比例逐步地加入高速造粒机中造粒。5.造粒完成后将湿团块以筛网过筛以去除结块增加干燥效率。干燥湿粒时使用流动床干燥机,并管控DMA残留量小于标准限定值。6.干燥达标准后,将干燥的颗粒以筛网过筛以去除结块,形成混合物一。7.接着将外加的赋形剂(即微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁)以筛网过筛以去除结块后,加入上述的干燥后的颗粒(混合物一)并 混合均匀,形成混合物二。8.混合均匀后的颗粒(混合物二)以适当的打锭模具和打锭机打锭。9.打锭完成后进行膜衣包覆制程。本制造方法中所用的纯水和药典级N,N-二甲基乙酰氨,已在制造过程中去除至标准限定值以下。实施例9以下为制备1,000颗含200毫克voriconazole为主成分的锭剂配方。*注:总重内不含100g纯水。本实施例制程:(本例以湿式造粒法制造锭剂)1.首先将Voriconazole和Tween80溶于80克纯水中并以磁石搅拌直至混合完全,以此作为造粒用的溶液一。2.接着将月桂基硫酸钠(SLS)溶于20克纯水并以磁石搅拌直至完全溶解,以此作为造粒用的溶液二。3.再将要造粒的赋形剂(即乳糖水合物、羟丙基纤维素、交联羧甲基纤维素钠)以筛网过筛以去除结块后置入高速造粒机中。4.将上述溶液一和溶液二以2:1的比例逐步地加入高速造粒机中造粒。5.造粒完成后将湿团块以筛网过筛以去除结块增加干燥效率。干燥湿粒时使用流动床干燥机,并管控DMA残留量小于标准限定值。6.干燥达标准后,将干燥的颗粒以筛网过筛以去除结块,形成混合物一。7.接着将外加的赋形剂(即微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁)以筛网过筛以去除结块后,加入上述的干燥后的颗粒(混合物一)并混合均匀,形成混合物二。8.混合均匀后的颗粒(混合物二)以适当的打锭模具和打锭机打锭。9.打锭完成后进行膜衣包覆制程。本制造方法中所用的纯水,已在制造过程中去除至标准限定值以下。实施例10以下为制备1,000颗含200毫克voriconazole为主成分的锭剂配方。*注:总重内不含20g纯水及80gDMA。本实施例制程:(本例以湿式造粒法制造锭剂)1.首先将Voriconazole和Tween80溶于药典级N,N-二甲基乙酰氨 (DMA)中并以磁石搅拌同时加热至60℃直至完全溶解,以此作为造粒用的溶液一。2.接着将称取10克纯水,以此为造粒用的溶液二。3.再将要造粒的赋形剂(即乳糖水合物、羟丙基纤维素、交联羧甲基纤维素钠)以筛网过筛以去除结块后置入高速造粒机中。4.将上述溶液一和溶液二以2:1的比例逐步地加入高速造粒机中造粒。5.造粒完成后将湿团块以筛网过筛以去除结块增加干燥效率。干燥湿粒时使用流动床干燥机,并管控DMA残留量小于标准限定值。6.干燥达标准后,将干燥的颗粒以筛网过筛以去除结块,形成混合物一。7.接着将外加的赋形剂(即微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁)以筛网过筛以去除结块后,加入上述的干燥后的颗粒(混合物一)并混合均匀,形成混合物二。8.混合均匀后的颗粒(混合物二)以适当的打锭模具和打锭机打锭。9.打锭完成后进行膜衣包覆制程。本制造方法中所用的纯水和药典级N,N-二甲基乙酰氨,已在制造过程中去除至标准限定值以下。比较实验1为证明本发明所制成的医药组合物在生体可用率上的改良,故在人体活体内进行试验研究。本研究是对年龄22至32岁健康男性为对象所进行的随机跨接研究。下表列出在包含20毫克主成份为tadalafil的口服锭剂的人体活体各种药动学参数,且阐示出具不同制程条件下所制得的药品的药效表现,并和原厂药品比较。结果显示本发明所提出制造方法制得的医药组合物,即实施例4,确实比一般的制造方法制得的医药组合物,即实施例1,可明显的提升人体的生体可用率(Cmax&AUC0-24)并缩短到达β-咔啉化合物(Tadalafil)的最大血液浓度的时间(Tmax),并能与原厂药品达成生体相等性(Bioequivalence)。比较实验2为证实本发明所提供的制药方法所形成的药物确实能有溶出功效,针对市售的药品与本发明前述实施例进行比较。如前述的说明,实施例1至实施例5是针对主成分tadalafil的制备方式,其中实施例1没有加入DMA也没有加入Tween80,而实施例2至实施例5则加入DMA,且其Tween80浓度分别为0%、0.1%、0.28%、0.57%。另外,也和市售药品进行比较。请参考图2,显示包含主成份(tadalafil)锭剂的溶出率(dissolved%)对时间的示意图,从图2展示了本发明不同制程和配方条件下所得的药物组合物溶出特性和市售药品的比较。本实验的溶离试验条件是以美国药典提供的方法(USP法)测试,条件装置为桨式(paddle)药物溶离试验系统,设定转速50rpm,溶煤为1000ml水+0.5%(w/w)SLS,取样点为10分钟、20分钟、30分钟、45分钟、60分钟。如图2所示,本发明实施例2至5所制造的β-咔啉化合物(Tadalafil)和实施例1相比,药物的溶离速率得到明显提升,这说明加入Tween80与DMA能增加药物的溶解速率,且随着Tween80的浓度增加,其溶出率也随的增加。实施例1至实施例5和市售药物相比,其溶出率相当,甚至实施例3至实施例5的溶离速度更胜一筹,其中配方中含Tween800.1%以上者较佳,最优选为配方中含Tween800.28%(实施例4)。比较实验3如前述的说明,实施例6至实施例8是针对主成分tadalafil的制备方式,其中实施例6、实施例7与实施例8中都具有DMA以及SLS, 且其SLS浓度分别为0%、0.5%、1.0%。请参考图3,图3所示为包含主成份(tadalafil)锭剂的溶出率(dissolved%)对时间的示意图,展示出本发明不同制程和配方条件下所得的溶出特性和市售药品的比较,其中实验参数与比较实验二中所列相同。如图3所示,本发明的实施例6至实施例8,确实可明显提升β-咔啉化合物(Tadalafil)的溶离速率,尤其是配方中含SLS0.5%以上者较好,最优选为配方中含SLS1.0%(实施例8)。和市售药品比较,实施例6至实施例8中加入的SLS,可以增加药品在短时间内的溶离速率,例如在10分钟时比CialisR的溶解度更大,对于治疗男性勃起障碍的实用性更大。比较实验4如前述的说明,实施例9与实施例10是针对主成分voriconazole的制备方式,其中实施例9与实施例10相比,实施例9没有加入DMA。请参考图4,图4为包含主成份(voriconazole)锭剂的溶出率(dissolved%)对时间的示意图,图4展示出具不同制程条件下所得的溶出特性和原厂药品VfendR的比较。本实验的溶离试验条件是以美国药典提供的方法(USP法)测试,条件装置为桨式(paddle)药物溶离试验系统,设定转速50rpm,溶煤为900ml0.1NHCl溶液,取样点为10分钟、20分钟、30分钟、45分钟、60分钟。如图4所示,本发明所提出制作方法制得的医药组合物,例如实施例10,确实可明显提升氨基三唑化合物(Voriconazole)的溶离速率。综上所述,本发明主要是提供了一种制作难溶药物的固态剂型的方法,使用的溶液一与溶液二的特殊配方,可以增加药物的溶出速率,且制作的方法不受药物的粒度大小所限制。在本发明所提供的特殊比例的剂型下,比市售药物有更突出的离溶效果,对于药物在生物体内的吸收有显著的提升。以上所述仅为本发明的实施方式,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的
技术领域:
,均同理包括在本发明的专利保护范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1