利用神经干细胞与IL12p40增强神经再生的方法与流程
相关申请的交叉引用本申请要求提交与2014年8月15日的美国临时专利申请号62/037,612的优先权,其公开的内容通过引用全文并入本文。本申请涉及利用神经干细胞及il12p40增强神经再生之组合物及方法。
背景技术:
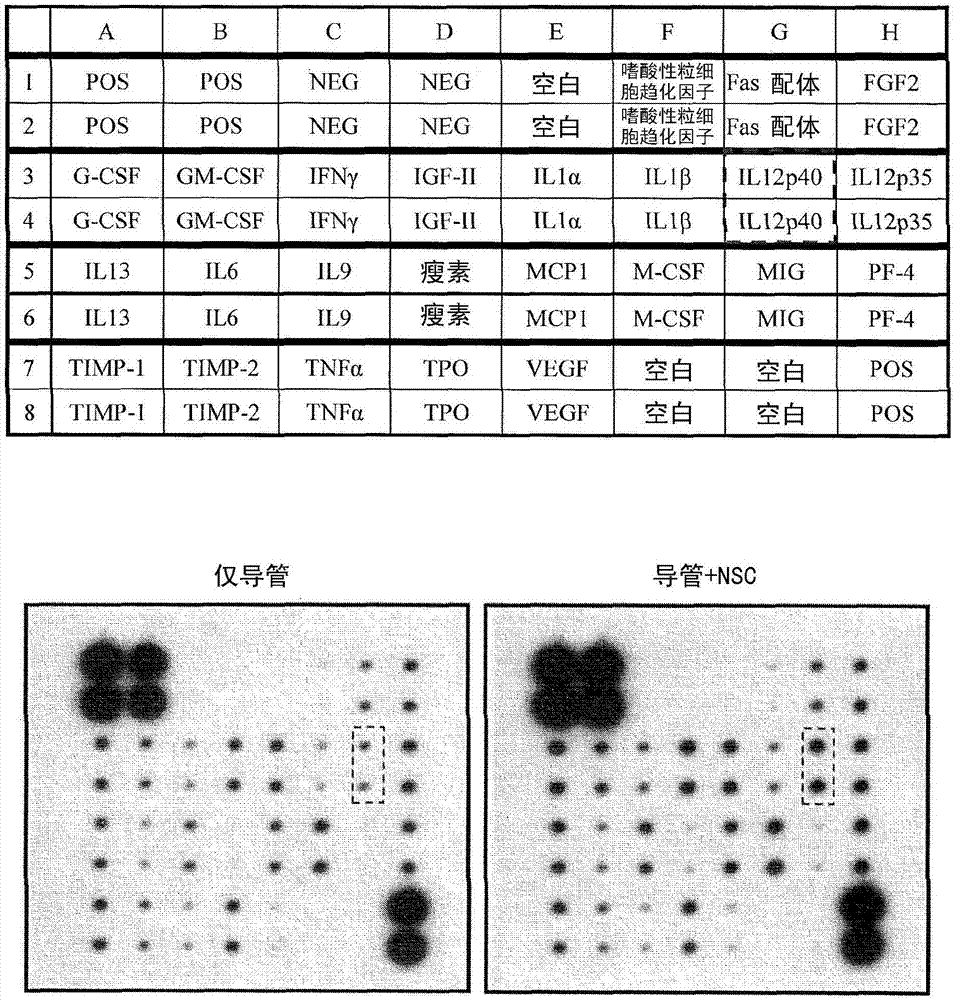
:严重的外周神经损伤会造成运动及感觉神经元活性减少,以及神经纤维及周围组织退化。受损之外周神经再生是复杂的过程,以瓦勒氏变性(walleriandegeneration,wd)为最基本反应,而许旺细胞(schwanncell)则扮演一重要角色(renz.etal.,reviewsintheneurosciences2012,23:135-143)。wd创造存活的神经元再生的微环境,且对功能恢复有利(navarrox.etal.,progressinneurobiology2007,82:163-201.)。调控wd涉及有许旺细胞之存在、神经营养因子之分泌、以及作为神经细胞之支架之特定胞外基质之分泌(gaudeta.d.etal.,journalofneuroinflammation2011,8:110;kehoes.etal.,injury2012,43:553-572.)。神经导管提供机械性支撑及引导该受损神经残余处之间的轴突萌芽。导管可用以保留由该受损细胞分泌或补充之神经营养因子(kehoes.etal,injury2012,43:553-572.)并避免受伤处之纤维组织向内生长。最近的研究显示,植入含有神经干细胞(nsc)之导管可促进受损之外周神经再生(zhangh.etal.,journaloftranslationalmedicine2008,6:67;shiy.etal.,actaoto-laryngologica2009,129:906-914.)。可依赖植入的神经干细胞分化成许旺细胞,或本身分泌神经营养因子,或建立微环境以从周围富集神经营养因子,及帮助髓鞘形成之能力促进神经再生(renz.etal.,reviewsintheneurosciences2012,23:135-143)。然而,尚不清楚涉及此过程之细胞激素或生长因子之特性。该植入之神经干细胞分化成许旺细胞并参与新轴突再生之分子机转亦未良好地建立。于本研究中,目标是鉴定出参与nsc介导之神经再生及功能恢复之因子。发明人利用蛋白质抗体阵列,检索在小鼠坐骨神经损伤模型中使用含有或不含有nsc之导管蛋白质水平之差异。il12p80(为il12p40的具生物活性的同源二聚体形式)(heinzelf.p.etal.,journalofimmunology1997,158:4381-4388)的浓度,在含有nsc导管为不含神经干细胞导管之将近两倍高。于小鼠坐骨神经损伤模型中,植入含有nsc及il12p80之神经导管可改善运动功能。提供il12p80可以进一步促进神经再生,可由该再生神经直径增加而获得证实。与仅有导管组相较,该再生神经中段之粗度增加达4.5倍,并可改善神经传导。这显示il12p80可通过信号转换子和转录活化子3(stat3)之磷酸化体外诱导小鼠nsc之神经胶质分化。如kettenmann及verkhratsky所报告,该神经胶质包括星形神经胶质、寡树突细胞及许旺细胞(kettenmannh,verkhratskya,fortschrittederneurologie-psychiatrie2011,79:588-597.)。技术实现要素:本申请提供一种神经再生组合物,包含神经干细胞及神经营养因子,其由il12p40作为至少一个亚基所构成。本申请提供一种神经再生组合物,包含神经干细胞、神经营养因子(其由il12p40作为至少一个亚基所构成)及神经再生增强成分。本申请进一步提供一种神经再生之组合物,包含神经干细胞、神经营养因子(其由il12p40作为至少一个亚基所构成)及神经导管,其运载该神经干细胞及该神经营养因子之至少一者。本申请提供一种再生神经之方法,包括给对象提供一种神经再生组合物,该神经再生组合物包含含有il12p40作为至少一个亚基之神经营养因子。本申请进一步提供一种再生神经之方法,包括给对象提供一种神经再生组合物,该神经再生组合物包含神经干细胞及含有il12p40作为至少一个亚基之神经营养因子。图式简单说明图1的示意图显示在小鼠中植入nsc以及神经导管可改善小鼠之坐骨神经损伤之功能恢复,且比仅有导管组更好。(a)sfi用于评估自第一周至第八周每周之功能恢复。统计分析显示,导管+nsc组较仅导管组具有明显更好之恢复。(b)转棒试验(rotarodtest)于手术后第四及第八周进行。与对照组和导管+nsc组相比,仅导管组在转棒上具有明显更差之平衡与步行。导管+nsc组具有更好的行动恢复且与对照组无差别。所有数据均以平均值±与平均值之标准差(sem)(假手术对照组中n=3、仅导管组中n=8、导管+nsc组中n=8及对照组中第四周n=8且第八周n=8)。统计显著性显示为*p<0.05及**p<0.01。图2是显示来自植入之含有或不含nsc之导管之细胞提取物之抗体阵列之表及照片。从导管+nsc获得的组存在于细胞提取物之il12p40之信号(以红色虚线框指示)为仅导管组之1.89倍高(仅导管组与导管+nsc组均为n=4)。这些实验重复三次,且导管+nsc组之il12p40浓度大幅高于仅导管组。图3的示意图显示,于含有或不含il12p80(mil12)之nsc移植中,利用sfi及转棒试验进行之功能评估之比较性分析。(a)于手术后第八周,导管+nsc组及导管+nsc+mil12组之小鼠显示明显比仅导管组更高的sfi分数。(b)于转棒试验中,导管+nsc组及导管+nsc+mil12组之小鼠展现比仅导管组更好的平衡与步行之能力。这些数据说明,在sfi及转棒分析之功能评估上,与不含il-12p80之组相比(*p<0.05),该导管+nsc+mil12组显示了统计学上更显著之结果(**p<0.01)。数据以平均值±sem表示(在sfi中,仅导管组中n=3、导管+nsc组中n=3及导管+nsc+mil12组中n=4。在转棒试验中,仅导管组中n=7、导管+nsc组中n=5及导管+nsc+mil12组中n=8)。图4显示再生之坐骨神经区段之h&e染色及免疫组织化学。(a-c)再生之新轴突之区段以苏木精及伊红染色,而“p”与“d”意指该残余神经两端(“p”距导管近侧端1.0mm,而“d”为距“p”之远侧3.0mm)。与导管+nsc组(b)及导管+nsc+mil12组(c)相较,仅导管组(a)显示更低之新生轴突之接合。此外,发明人以抗-神经丝200抗体(nf200,神经纤维之标记)及抗蛋白质零之抗体(pzo,髓鞘化之许旺细胞之标记)之免疫组织化学染色验证再生神经之特征。染色结果显示,仅导管组之轴突再生失败(d)。发明人可观察到,在导管+nsc(e)中,髓鞘化之许旺细胞(pzo阳性细胞)伴随神经纤维(nf200阳性细胞)存在于导管之中间区域,且于导管+nsc+mil12组(f)存在更多。d、e及f之相对位置以虚线方框分别表示于a、b及c中。不同位置之再生神经直径之定量结果显示于(g),其中,所指的近侧位置离该导管之近侧端1.0mm,所指的远侧位置离该近侧位置3.0mm,而所指的中间位置在该近侧位置与该远侧位置之间之中央(仅导管组为n=3、导管+nsc组为n=4、导管+nsc+mil12组为n=3)。(h)显示不同处理之组别之再生作用示意图。(a)、(b)及(c)图之比例尺为1mm,(d)、(e)及(f)图之比例尺为100μm。统计显著性显示为*p<0.05及**p<0.01。图5的示意图显示以复合肌肉动作电位测量之坐骨神经损伤恢复。测量伤腿与对侧之正常腿之cmap。cmap之恢复以伤腿除以正常腿进行计算。不同组之cmap之恢复显示于图中(仅导管组中n=4、导管+nsc组中n=4、导管+nsc+mil12组中n=6及假手术对照组中n=3)。图6显示免疫细胞化学法之结果,显示il12p80可取代cntf+t3以诱导小鼠nsc之寡树突细胞分化作用。(a)以cntf+t3或il12p80将小鼠nsc诱导分化为寡树突细胞(y轴所列)。将分化的细胞以下列进行染色,寡树突细胞标记:抗-galc抗体及抗-osp抗体,或髓鞘化之许旺细胞标记:抗-pzo抗体(x轴所列)。标记阳性之细胞之倍数经定量及总结于(b)。各图之比例尺为100μm。统计显著性显示为*p<0.05及**p<0.01。图7显示蛋白质印记之结果,显示il12p80可将小鼠nsc分化为寡树突细胞及许旺细胞。以cntf+t3或il12p80将小鼠nsc诱导分化为寡树突细胞。以不同细胞激素处理条件命名分化组别。(a)细胞分化作用以蛋白质印记及种系特异性抗体拮抗星形神经胶质标记gfap、寡树突细胞标记osp及髓鞘化之许旺细胞标记pzo进行鉴定。(b)显示定量结果。统计显著性显示为*p<0.05及**p<0.01。图8显示,il12p80诱导nsc中的stat3磷酸化。以蛋白质印记分析测定于对照培养基(对照)或于包含人类il12p80(hil12)或小鼠il12p70(mil12)之分化培养基中,于不同时间点(球体、0min、15min、30min、1h、2h、4h及8h),stat3于y705及s727位置之磷酸化程度(pstat3)。结果显示,当与il12p80培养时,pstat3之浓度于15分钟达到高峰。以stat3总量及α-微管蛋白作为对照。发明详述在本申请中,神经再生之组合物包含nsc及神经营养因子,其由il12p40作为至少一个亚基构成。在一些实施方式中,il12p40具有如ncbi登录号nm_008352(小鼠)或1f42_a(人类)所示之蛋白质序列。神经营养因子可为il12p40之单体或同源二聚体或异源二聚体,其中至少一个亚基为il12p40。在实施方式中,该神经营养因子可为il12p40之异源二聚体、il12p40之同源二聚体、il12p40之三聚体、il12p40之四聚体、或其任意之组合。在一实施方式中,该同源二聚体可为il12p80。于实施例中,该异源二聚体可为il12p70。在本申请中,该用于神经再生之组合物之nsc之特征在于,为cd133及gfap为阳性表达之脑细胞或为f1b-gfp+细胞。本申请提供组合物,其进一步包含神经再生增强成分。该神经再生增强成分包括细胞、生长因子及其组合。在实施方式中,该神经再生增强成分可为许旺细胞、间充质干细胞(msc)、脂肪源干细胞(adsc)、羊水干细胞(afsc)、诱导神经元(in)、诱导神经干细胞(insc)或衍生自诱导多能干细胞(ipsc)之细胞。在一些实施方式中,该神经再生增强成分可为成纤维细胞生长因子1(fgf1)、成纤维细胞生长因子2(fgf2)、血小板衍生生长因子(pdgf)、脑衍生神经营养因子(bdnf)、神经胶质细胞衍生神经营养因子(gdnf)、神经生长因子(ngf)及其任意之组合。在一实施方式中,该组合物可进一步包含神经导管,其运载至少nsc及神经营养因子之一。在一些实施方式中,该神经导管进一步运载神经再生增强成分。本发明亦提供一种再生神经之方法,包括给对象提供神经再生组合物,该神经再生组合物包含神经干细胞及含有il12p40作为至少一个亚基的神经营养因子。在一些实施方式中,该神经再生组合物可进一步包含nsc。在实施方式中,该神经再生组合物被包含于神经导管中。在实施方式中,该神经导管植入于靶神经或该靶神经周围之组织中。该神经营养因子可为il12p40之单体、il12p40之异源二聚体、il12p40之同源二聚体、il12p40之三聚体、il12p40之四聚体或其任意之组合。在一些实施方式中,该神经营养因子为il12p80。该对象为哺乳动物。在一实施方式中,该哺乳动物可为小鼠或人类。在本申请中,该组合物通过注射、植入、经皮途径及/或口服提供。实施例材料与方法il12p40之序列il12p40之蛋白质序列如ncbi登录号nm_008352(小鼠)或1f42_a(人类)所示,这些资料可由美国国家生物技术信息中心之网站(http://www.ncbi.nlm.nih.gov/)获得。细胞培养及nsc分离小鼠nsc分离与细胞培养如两篇之前的出版物(hsuy.c.etal.,developmentaldynamics2009,238:302-314;leed.c.etal.,molecularandcellularneurosciences2009,41:348-363;此两篇出版物通过引用全文并入)所述进行。将kt98/f1b-gfp细胞培养于含有10%胎牛血清(fbs)、1%青霉素/链霉素及500μg/mlg418(merck,usa)之经杜贝卡氏修饰的依格氏培养基(dmem)/f12(1:1)。对于nsc分离,将gfp-阳性之kt98/f1b-gfp(kt98/f1b-gfp+)细胞以facsaria细胞分选仪(bdbioscience)进行区分,并于神经球形成培养基(dmem/f12,包含1xb27(gibco)、20ng/mlegf(peprotechinc.)、20ng/mlfgf2(peprotechinc.)、2μg/ml肝素(sigma)及500μg/mlg418)中培养7天,其诱导kt98/f1b-gfp+神经球形成。接着,将kt98/f1b-gfp+神经球衍生之单一细胞用于后续动物实验及细胞分化试验中。所有细胞培养于37℃及5%co2下。动物外科手术:坐骨神经损伤及导管植入于本申请中,所有动物实验流程均遵照伦理准则,并经由卫生研究院之实验动物照护及使用委员会(iacuc)(计划编号nhri-iacuc-101067a)核准。fvb小鼠(8-10周大)用于动物实验,饲养于卫生研究院(nhri)动物中心。手术前,将小鼠以5%异氟烷(卤碳)以空气吸入麻醉,于手术期间以2%异氟烷空气吸入维持麻醉。在坐骨神经损伤手术中,以显微手术剪切断3mm之小鼠坐骨神经段。对于手术植入神经导管,使用聚(l-乳酸)(pla)导管,如先前所述(hsus.h.etal.,artiforgans2009,33:26-35,出版物通过引用全文并入)。将该5mm导管(包含或不包含nsc及/或小鼠il12p80)植入该坐骨神经损伤处。使用6-0尼龙显微缝线将该坐骨神经损伤处之近侧及末端神经以1mm余留神经锚接至该导管中。未进行坐骨神经损伤之小鼠则定义为假手术对照组(n=3)。外科手术植入组包含仅导管组(n=8)、导管+nsc组(n=8)及导管+nsc+mil12组(n=8)。于仅导管组中,导管以5μl基质胶(matrigel)(bdbioscience)/磷酸缓冲盐水(pbs)之混合物(1:1)填充。于导管+nsc组(n=8)中,导管以5μl基质胶/pbs之混合物(1:1)及1×106nsc填充。于导管+nsc+mil12组(n=8)中,导管以5μl基质胶/pbs之混合物(1:1)及1×106nsc及100ng之小鼠il12p80(biolegend)填充。功能性评估:步行分析与转棒试验利用treadmill/treadscan系统(cleversys)进行步行分析,并以手术后每周之坐骨功能指数(sfi)表示。sfi公式如下所示:sfi计算依据正常足(n)与实验足(e),其中pl意指足印长度(最长的脚趾尖端至脚跟之纵向长度)、ts意指总脚趾延展度(第一与第五脚趾之间的横向距离)及it意指中间脚趾延展度(第二与第四脚趾之间的横向距离)。利用fvb成鼠获得该正常步行录像(一只小鼠之完整步行期间总共收集1500个画面)且这些影像数据用以校准该treadscan软件(每踏步10–12个轮廓图才足以训练该软件识别脚掌位置)。校准后,将很好地建立之程序用以于坐骨神经损伤之小鼠之完整步行期间排除异常步行及不规则之脚趾延展度。手术后第四周及第八周,以rt系列rotarodtreadmill(singa)执行该转棒试验。于对照组中,小鼠定义为无神经切开及肌肉损伤(第四周时n=8,且第八周时n=8)。于正式收集数据前,每只小鼠先跑过旋转的棒三次,分别为10rpm、12rpm及15,作为测试前训练。针对数据收集,小鼠以20rpm跑旋转的棒6次。记录时间最大值为120秒。蛋白质分析以含有1x蛋白酶抑制剂混合物的1xripa缓冲液[50mmhepes,ph7.3,150mmnacl,2mmedta,20mmβ-甘油磷酸盐,0.1mmna3vo4,1mmnaf,0.5mmdtt,and0.5%np-40](roche),由该植入之导管提取蛋白质样品。依据制造商之方案,将100μg蛋白质样品用于小鼠血管生成蛋白质抗体阵列(raybiotech)分析。以化学荧光法检测蛋白质含量。神经分化分析以1xhyqtase(hyclone)由该神经球分离出单一细胞。将2×103细胞植于聚-d-赖氨酸(bdbioscience)-涂覆之室玻片(chamberslide)上,以神经分化培养基(含有2%fbs之dmem/f12)培养(补充或不补充诱导因子)。对于cntf+t3组,神经分化培养基含有50ng/mlcntf与10ng/mlt3。对于hil12及mil12组,神经分化培养基分别含有100ng/ml之人类il12p80与小鼠il12p80。对于cntf+t3+hil12组,神经分化培养基含有50ng/mlcntf、10ng/mlt3及100ng/ml人类il12p80。对于cntf+t3+mil12组,神经分化培养基含有50ng/mlcntf、10ng/mlt3及100ng/ml小鼠il12p80。cntf、t3及人类il12p80购自peprotech。每三天更换培养基。免疫荧光染色将细胞培养于室玻片(nunc,naperville,il,usa)上,于37℃及5%co2下。对于免疫荧光染色,以pbs洗涤细胞并于室温下以含4%(v/v)三聚甲醛(pfa;electronmicroscopysciences)之pbs固定15分钟。接着于室温下将细胞0.1%(v/v)tritonx-100之pbs渗透15分钟。接着于室温下将细胞以封闭溶液(含1%bsa之1xpbs)封闭1小时,接着于室温下与特异性一抗温育1小时。在本申请中,利用免疫荧光染色,以针对半乳糖脑苷脂之小鼠单克隆抗体(galc,1:1000,millipore)、针对寡树突细胞特异性蛋白质之兔多克隆抗体(osp,1:1000,abcam)及针对髓磷脂蛋白质零之鸡多克隆抗体(pzo,1:1000,genetex),验证分化能力。随后将该细胞于室温下与若丹明缀合之二抗(millipore,billerica,ma,usa)温育1小时。所有区段均以2-(4-脒基苯基)-6-吲哚胍二盐酸盐(dapi)(molecularprobes)将核染色,并于荧光显微镜(olympus,tokyo,japan)下观察。计数galc/dapi、osp/dapi及pzo/dapi双阳性细胞并以对照组进行标准化。蛋白质印记针对胶质原纤维酸性蛋白之兔多克隆抗体(gfap,1:1000;abcam)、针对寡树突细胞特异性蛋白质之兔多克隆抗体(osp,1:4000;abcam)、针对髓磷脂蛋白质零之鸡多克隆抗体(pzo,1:4000;genetex)及针对α-微管蛋白之兔多克隆抗体(α-tubulin,1:8000稀释;genetex)用于以免疫印渍法检测已分化细胞中之该对应蛋白质浓度,这些已分化细胞由神经球分离,并以包含或不包含诱导因子之神经分化培养基(表1)培养7天。来自已分化细胞之蛋白质样品以补充有1x蛋白酶抑制剂混合物(roche)之1xripa分解缓冲液(millipore,billerica,ma,usa)获得。针对stat3之小鼠单克隆抗体(1:1000;cellsignaling)、针对pstat3-y705位点之兔多克隆抗体(1:1000;cellsignaling)、针对pstat3-s727位点之兔多克隆抗体(1:1000;cellsignaling)及针对α-微管蛋白之兔多克隆抗体(α-tubulin,1:8000稀释;genetex)用于分析经il12p80处理之小鼠nsc之stat3磷酸化状态。由神经球分离出单一细胞,将细胞离心3分钟以获得实验信号细胞,于不同时间点提取细胞溶解产物(球体,0min、15min、30min、1h、2h、4h及8h)。因此,于时间点"0min",细胞于离心期间处于il12p80存在下达3分钟。以蛋白质印记分析细胞溶解产物。以蛋白质分析染色试剂(bio-radlaboratories)检测各样品之蛋白质浓度。等量之蛋白质样品以于十二烷基硫酸钠聚丙烯酰胺凝胶(sds-page)进行大小分级,接着转移至聚偏二氟乙烯(pvdf)膜(amersham)上,接着,于室温下,以含5%牛血清白蛋白(biobasic,markhamontario,canada)之封闭缓冲液封闭膜1小时。接着将膜与含5%牛血清白蛋白之封闭缓冲液中的特异性一抗温育,接着与对应之hrp缀合之二抗(1:10000)(millipore)温育。利用ecl试剂(millipore)测定蛋白质浓度,以α-微管蛋白之x-射线膜作为内部对照组。以imagej软件定量三组独立实验之免疫反义性键,并以对照组标准化。复合肌肉动作电位测量复合肌肉动作电位以biopacmp36及biopacbsl4.0软件(biopacsysteminc.)记录及分析。不锈钢电极之直径为0.22mm。将刺激电极置于坐骨切痕,记录电极置于腓肠肌(距离该坐骨切痕约2cm)。刺激电压为6伏特,刺激持续时间为0.1毫秒,且获取长度为200毫秒。以游标卡尺测量距离,在室温维持于恒定温度25℃将皮肤温度维持于36℃。苏木精与伊红(h&e)染色与免疫组织化学染色于手术后第八周收集植入之导管。简言之,该植入之导管以4%pfa于4℃下固定过夜。经固定之样品以含30%蔗糖之1xpbs于4℃下脱水过夜。将样品包埋入tissue-teko.c.t.(sakura,netherlands),并以液氮冷冻后储存于-80℃。对于苏木精与伊红(h&e)与免疫组织化学染色,以冷冻切片机(micromhm550)将冷冻包埋之神经导管切成10μm薄片。免疫组织化学染色利用特异性抗体进行:针对神经丝200之兔多克隆抗体(nf-200,1:500,神经纤维之标记)及针对髓磷脂蛋白质零之鸡多克隆抗体(pzo,1:500,髓鞘化之许旺细胞之标记)。于pbs洗涤后,将样品与各二抗于室温下温育1小时。将所有样品以dapi(1:5000)在室温下进行核染色3分钟,并以fluorsave试剂(merck)固定。以荧光显微镜(olympus)与共聚焦显微镜(leica)观察并收集所有再生组织之影像数据。统计数据以平均值±标准差(sem)表示。以学生t检验(student’st-test)比较两个组别,并以单向anova比较多个组。当p<0.05时,统计显著性为可接受。表1、诱发细胞分化之条件组名诱导因子cntf+t350ng/mlcntf及10ng/mlt3hil12100ng/ml人类il12p80mil12100ng/ml小鼠il12p80cntf+t3+hil1250ng/mlcntf、10ng/mlt3及100ng/ml人类il12p80cntf+t3+mil1250ng/mlcntf、10ng/mlt3及100ng/ml小鼠il12p80结果与仅有导管相比,含有nsc之神经导管之植入更能改善小鼠之坐骨神经损伤之功能性恢复左侧坐骨神经切除(3mm)后,所有小鼠丧失左后肢之运动功能,表现为脚趾蜷缩及拖行。于本实验中,发明人植入含nsc之导管以修复该受伤之坐骨神经。利用非侵入式方法,即步行分析与转棒试验,检测再生期间之功能性恢复。坐骨功能指数(sfi)为来自步行分析之数据经计算之分数,所述步行分析结合步态分析及在步行期间,一足印与其它足印之间在时间与空间上的关系。sfi数值范围为0至-100,其中0表示正常步行功能而-100表示完全丧失功能。于追踪分析中,假手术对照组之小鼠定义为接受相同手术程序但并未实质伤害坐骨神经。与手术前sfi分数相较,此种小鼠显示在手术后第一周至第八周之sfi分数并无明显差异(图1a,假手术对照组)。对于植入含nsc之导管(图1a,导管+nsc组)或仅有导管(图1a,仅导管组),于手术后第一周,该两组之间之sfi分数并无显著差别(-73.2±2.5vs.-77.0±3.9)。自手术后第二周起,导管+nsc组显示比仅导管组高的sfi分数(p<0.01)。与仅导管组相较,导管+nsc组持续至第八周均呈现更好的功能(第1a图)。转棒试验亦用于评估坐骨神经受伤之小鼠之运动功能与平衡能力之恢复。于转棒试验中,对照组小鼠定义为未接受神经切开及肌肉伤害者。对照组、导管+nsc组及仅导管组于第四周之转棒试验之结果分别为55±8、40±7及16±1秒,而第八周则分别为62±14、53±9及25±4秒(图1b)。与对照组、导管+nsc组相较,仅导管组在手术后第四与第八周显示了于转棒上明显较差之平衡与步行能力。有趣的是,对照组与导管+nsc组之间,在手术后第四与第八周之转棒试验并未观察到差异性。这些结果说明,将nsc于导管一起植入可帮助坐骨神经损伤之小鼠之功能恢复。il12p80参与nsc-介导之坐骨神经修复nsc具有分化为全部三种神经外胚层世系(包含许旺细胞)之潜力,且亦可分泌或补充用于神经再生之营养因子(renz.etal.,reviewsintheneurosciences2012,23:135-143)。因此,为鉴定参与nsc-介导之神经再生之因子,以小鼠抗体阵列研究仅导管组与导管+nsc组之间的蛋白质表达量。以由该植入之含有或不含nsc之导管之神经(于手术后第四周)提取所得之蛋白质裂解液用于蛋白质抗体阵列。依据该抗体阵列之定量数据,于导管+nsc组所得之细胞提取液中之il12p40之表达为仅导管组之1.89倍高,导管+nsc组之il12p35表达则与仅导管组类似(1.04倍)(参照图2,il12p40与il12p35)。il12p40为il12p70之亚基之一,而il12p40亚基整体之20%至40%会以同源二聚体形式(il12p80)分泌,其在生物功能之诱导上的活性为il12p40单体的25-50倍(heinzelf.p.etal.,journalofimmunology1997,158:4381-4388;gillessens.etal.,europeanjournalofimmunology1995,25:200-206;jacobsonn.g.etal.,journalofexperimentalmedicine1995,181:1755-1762.)。在该抗体阵列数据中,导管+nsc组增加了il12p40之表达量而非il12p35,说明il12p80(il12p40生物活性形式)可能为涉及神经再生之因子。il12p40结合il12受体β1,并造成stat3磷酸化及活化stat3下游信号传导(heinzelf.p.etal.,journalofimmunology1997,158:4381-4388;gillessens.etal.,europeanjournalofimmunology1995,25:200-206;jacobsonn.g.etal.,journalofexperimentalmedicine1995,181:1755-1762.)。先前的研究说明,stat3活化诱导神经祖细胞分化成星形神经胶质世系(wangb.etal.,plosone2008,3:e1856.)。这些结果暗示了il12p80在活化stat3下游信号传导及参与神经再生中的角色。nsc与导管一起移植及il12p80促进功能恢复及神经再生为测试il12p80对神经再生之功能,比较以下列条件处理之经坐骨神经损伤之小鼠:仅导管组、含nsc之导管组(导管+nsc组)及含nsc及小鼠il12p80之导管组(导管+nsc+mil12组)。于移植后第八周,以步行足迹分析及转棒试验进行功能评估。导管+nsc及导管+nsc+mil12组之小鼠显示了明显高于仅导管组之sfi分数(图3a)。于转棒试验中,导管+nsc及导管+nsc+mil12组之小鼠显示了比仅导管组更好之步行及平衡能力(图3b)。此外,这些数据证实,在步行分析及转棒试验之功能评估上,与不含il12p80之组别相较(p<0.05),导管+nsc+mil12组都展现了更为显著的结果(p<0.01)(图3a及3b)。然而,额外施用il12p80(导管+nsc+mil12组)之效果太微弱,以致于在功能评估上无法与未提供il12p80(导管+nsc组)组区分该神经修复之辅助能力。因此,il12p80之神经修复效果藉由组织切片评估(图4)及神经传导研究(图5)进行判定。于神经再生研究中,植入5mm之神经导管以连接该3mm之坐骨神经损伤间隙。将该导管缝合至该受伤之坐骨神经之近端与远程,并于两端各保留1mm之残留神经。因此,存在于该导管中央区域之轴突可被视为新生之再生神经。藉由苏木精与伊红(h&e)染色及利用识别特定神经细胞特异性标记之抗体之免疫组织化学可观察到轴突再生。于图4a、4b及4c中,“p”与“d”指示残余神经端点(“p”为距离该植入导管之近端之1.0mm,“d”为距离“p”之远程之3.0mm)。在h&e染色中,与仅导管组(图4a)相较,导管+nsc组(图4b)与导管+nsc+mil12组(图4c)显示新生轴突之整合之明显促进效果。藉由免疫组织化学染色,利用抗-神经丝200抗体(nf200,神经纤维之标记)及抗蛋白质零抗体(pzo,髓鞘化之许旺细胞之标记)进一步证实神经再生之状况。免疫组织化学染色结果证实,于导管+nsc组(图4e)与导管+nsc+mil12组(图4f)发生导管中之再生神经产生髓鞘化之许旺细胞(pzo阳性细胞)伴随神经纤维(nf200阳性细胞)但仅导管组(图4d)则未发生。更进一步而言,藉由重建以h&e染色于植入之神经导管之近侧、中间及远侧位置染色之系列样品切片测量再生神经之直径:近侧位置(距导管之近端之1.0mm)、远侧位置(距该近侧处3.0mm)及中间位置(该近侧位置与该远侧位置之间之中央)。于近侧位置及远侧位置,三组的再生神经直径并无显著区别(近侧位置分别为262±44μm、284±42μm及302±97μm,而远侧位置分别为279±56μm、298±75μm及322±123μm)。反之,于中间位置之直径则为:与仅导管组(65±21μm)相较,导管+nsc组(189±18μm)与导管+nsc+mil12组(295±47μm)分别为2.9倍及4.5倍粗。很明显地,于再生坐骨神经之中间位置,与未添加il12p80之组别相较,添加il12p80者之神经直径增加1.6倍(图4g)。于该三组之再生之示意图显示于图4h。藉由电刺激坐骨神经并记录该复合肌肉动作电位(cmap)以测量神经传导,cmap为来自个别肌肉纤维动作电位之总和电压反应(mallika.etal.,jneurolneurosurgpsychiatry2005,76suppl2:ii23-31.)。于本申请中,测量伤腿与对侧正常腿之cmap。以伤腿之cmap除以对侧正常腿之cmap,以计算恢复百分比(图5)。导管+nsc+mil12组显示更好的恢复状态,无论是与导管+nsc组或仅导管组相较(分别为17.7±4.3%、8.5±2.1%及6.6±0.2%)。此外,导管+nsc+mil12组显示较仅导管组少的腓肠肌肌肉萎缩(伤腿/正常腿分别为0.39±0.02及0.26±0.07,p<0.01)。这些数据证实,植入含有nsc之导管可帮助功能恢复及神经再生。重要的是,额外施用il12p80,在sfi及转棒分析之功能评估、神经传导改善、新生再生神经之直径增加,均具有统计显著性之结果。il12p80刺激小鼠nsc分化为寡树突细胞系及许旺细胞世系本申请接着研究于小鼠nsc中,il12p80对于分化为寡树突细胞及许旺细胞之诱导潜力。将自神经球分离之细胞分别培养于作为分化对照培养基之含有2%fbs之dmem/f12(对照组)及寡树突细胞分化培养基(cntf+t3组)中(hsuy.c.etal.,developmentaldynamics2009,238:302-314;leed.c.etal,molecularandcellularneurosciences2009,41:348-363.)。为测试il12p80于启动寡树突细胞及许旺细胞分化之潜力,将100ng/ml之人类il12p80(hil12p80)或小鼠il12p80(mil12p80)添加至对照组或cntf+t3组中,并命名为hil12、mil12、cntf+t3+hil12及cntf+t3+mil12组。以一抗(识别特异性细胞标记:半乳糖脑苷脂(galc;寡树突细胞)、寡树突细胞特异性蛋白质(osp;寡树突细胞)及髓磷脂蛋白质零(pzo;髓鞘化之许旺细胞))及荧光染剂缀合之二抗进行免疫荧光染色以证实该经分化之细胞(图6a)。标记阳性细胞之百分比定量并总结于图6b。细胞表型与免疫荧光染色结果显示,于小鼠nsc中,il12p80可取代cntf+t3以诱导分化为寡树突细胞或髓鞘化之许旺细胞。以蛋白质印记,分别利用针对胶质原纤维酸性蛋白(gfap,星形神经胶质标记)、osp及pzo之世系特异性抗体,验证细胞分化与成熟状态(图7a)。定量结果显示,于包含il12p80之分化条件中,gfap、osp及pzo之蛋白质含量上调(图7b)。这些结果证实,il12p80可诱导nsc分化为寡树突细胞及髓鞘化之许旺细胞。il12p80于nsc中诱导stat3之磷酸化于nsc中,已显示stat3磷酸化作用会参与寡树突细胞分化过程(wangb.etal.,plosone2008,3:e1856.)。于t细胞中,il12p40亚基可结合il12受体β1,接着诱导stat3磷酸化及下游信号传导途径(jacobsonn.g.etal.,journalofexperimentalmedicine1995,181:1755-1762.)。因此,il12p80可于nsc中经由stat3活化而启动寡树突细胞分化作用。以蛋白质印记分析经hil12p80或mil12p80处理之nsc之stat3磷酸化状态。于本研究中,y705及s727(stat3磷酸化位点)两者之磷酸化状态,于神经球中为轻微表达(图8,神经球列)。人类及小鼠il12p80都诱导y705之stat3磷酸化,其强度峰出现在15分钟,且于30分钟开始减弱。类似地,s727之stat3磷酸化会藉由il12p80而增加,并维持达8小时(图8,hil12组、mil12组)。这些结果显示,stat3磷酸化对于nsc之il12p80-诱导之寡树突细胞分化至关重要。结论于本研究中,证实植入含有il12p80及nsc之神经导管能增进运动功能恢复、促进神经再生、增进神经传导及增加新生再生神经之直径。实验证实导管+nsc+il12可以使该再生神经之中央区段的直径大小较仅导管的实验组粗4.5倍。于体外试验,il12p80可诱导nsc分化为寡树突细胞或髓鞘化之许旺细胞。此外,本发明进一步显示,该分化作用之诱导经由stat3磷酸化而达成。单独施用il12p80可达成一定程度之神经修复。讨论il12p80为il12p40之同源二聚体,而il12p70为il12p40及il12p35之异源二聚体。il12p40结合il12受体β1,而il12p35结合il12受体β2。亦报导il23为il12p40及il23p19之异源二聚体,il23p19结合il23受体。已显示含有il12p80及nsc之神经导管能增进神经损伤修复。单独施用il12p80可达成一定程度之神经修复。已显示,于体外试验,il12p70可增进小鼠交感上颈神经节神经元之轴突向外生长(linh.etal.,neurosci.lett.2000,278:129-132.)。因此,含有il12p40亚基之蛋白质,包括il12p80、il12p70及il23均可作用于神经修复。神经修复可涵盖之范畴,不仅是神经受损(如外周神经损伤、脊髓损伤及中风)之神经发生,更包括神经退行性疾病(如阿兹海默症、帕金森氏症及多发性硬化症)之神经发生(beckervordersandforthr.etal.,stemcellreports2014,2:153-162.)。上述特定实施方式之内容描述了实现利用神经干细胞及il12p40增强神经再生之组合物及方法。这些实施方式意在说明,而非限制。很多变化、修饰、添加和改进是可能的。这些和其它变化、修饰、添加和改进落入下面的权利要求书限定的本发明的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1