一种骨移植用可降解多孔复合支架材料的制作方法
本发明涉及医用材料领域,特别涉及一种骨移植用可降解多孔复合支架材料。
背景技术:
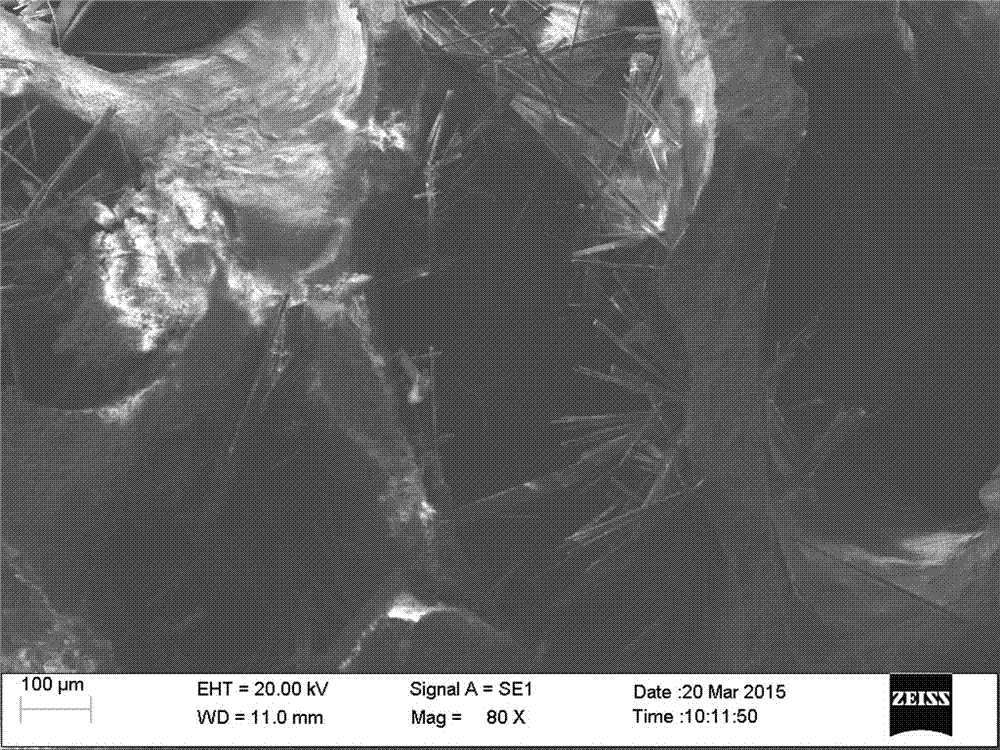
:由于意外事故、骨病、战争或矫形手术所致的骨缺损需要进行骨移植。美国每年需骨移植的病例超过100万人;按人口比例推断国内每年需骨移植的病例逾400万人次、全世界每年需骨移植的病例逾2000万人次。自体骨移植是治疗骨缺损的金标准,但给患者增加了新的创伤且取骨区存在一定的并发症,且自体骨来源有限。骨替代材料的研究、开发是目前医学研究的重点之一,中国十二五国家攻关项目中就有关于骨替代材料与机体作用机理的研究。在骨组织工程支架或人工骨的设计过程中,关键要考虑人骨这种严重矿化组织的复杂组成及结构,人骨不能被单一材料所提供的有限特性所完全替代,更为重要的是,支架还必须为骨组织的再生提供三维多孔微结构以引导细胞的分化增殖,而且要维持足够的力学强度来满足被替代材料的力学要求。理想的骨移植替代材料或骨组织工程支架材料应具有以下条件:1)具有良好的骨传导性;2)具有骨诱导性;3)具有良好的生物相容性以及支持骨细胞生长和功能分化的表面化学性质与微结构;4)具有良好的生物降解性;5)材料中承担骨传导作用的部分必须有足够的力学强度及承载能力;6)易加工等。Johan等2010年在一篇综述中把新西兰临床可得到的骨移植替代材料分为四类:1、单相钙磷材料包括羟基磷灰石生物转化陶瓷三种、合成羟基磷灰石水泥一种,β-磷酸三钙人工陶瓷两种;2、复合材料包括磷酸四钙/磷酸氢钙、62.5%α--磷酸三钙/26.8%无水磷酸氢钙/8.9%碳酸钙/1.8%羟基磷灰石、60%羟基磷灰石/40%b-磷酸三钙、73%b-磷酸三钙/21%磷酸二氢钙/5%磷酸氢镁、磷酸四钙/磷酸氢钙/无定形磷酸钙、α--磷酸三钙/碳酸钙/磷酸二氢钙等配方的合成水泥6种,配方为80%磷酸三钙/20%磷酸氢钙的人工陶瓷一种;3、单相硫酸钙制备的泥膏或颗粒共四种;4、生物玻璃一种。磷灰石、硫酸钙是目前临床上最为常见的骨移植替代材料或构成成分。目前临床缺少理想的骨移植替代材料,主要表现在理想三维互通网孔结构、极大的孔隙率及比表面积、可降解性、骨传导性、骨诱导性及力学强度等特性多不能兼而有之。临床具有较为理想三维互通网孔微结构的人工骨均为动物材料转化而来:其中两个来源于牛松质骨经过高温烧结工序制备的多孔羟基磷灰石陶瓷骨,一个是珊瑚经加磷的水热反应及高温烧结工序制备的珊瑚多孔羟基磷灰石陶瓷骨,特点是保留了牛骨、珊瑚自然骨矿的三维互通网孔微结构且成分接近人骨骨矿成分,具有良好的生物相容性、良好的骨传导性及较好压缩强度,因高温烧结程序而免却异种骨免疫排斥反应及病原体导入之可能,且都易于加工。来自牛骨的多孔羟基磷灰石具有60-90%的良好孔隙率且牛骨资源丰富,其孔径为390-1360μm,稍大于150-400μm的骨移植替代材料及骨组织工程支架的理想孔径,1-20MPa的良好的压缩强度,其巨大的缺点是高温烧结得到的羟基磷灰石太过稳定,在钙磷类植骨材料中溶解度最低,在体内降解过慢,降解速度远远不能与新骨形成速度匹配,亦不能持续释放较高浓度钙等成骨有益离子、不利于骨的修复及改造。来自珊瑚的羟基磷灰石孔径为280-770μm,更接近骨移植替代材料及骨组织工程支架的理想孔径,但其孔隙率较低,且珊瑚为二级保护动物,即使作为医学材料资源也受限。理想的降解速度是人工骨或骨组织工程支架的另一重要要求,理想的人工骨降解速度应该与新骨形成速度相匹配,在引导新骨形成时逐渐降解为新骨替代进一步提供空间,其降解过程中不断释放的钙离子等成骨有益离子为骨矿的重新沉积、改造与代谢提供矿物重组成分;降解速度过快不利于对修复细胞的分化增殖替代提供足够时间的支持与引导,而降解过慢则会阻碍新骨的形成、替代及塑形。钙磷类植骨材料在体内的降解主要通过两个途径:体液介导的溶降和细胞介导的降解过程。溶降过程是在体液的作用下,材料及粘结剂水解,材料逐步离解成颗粒、分子、离子的物理溶降过程。而细胞介导的降解过程主要是巨噬细胞和破骨细胞对材料的吞噬作用的生物降解过程。钙磷类植骨材料在体外的降解过程与其组成成分有关,其降解速度与材料的颗粒大小、孔隙率、比表面积、结晶度和溶解度密切相关,其中溶解度是最重要的影响因素。在临床上最为常见的骨移植替代材料中硫酸钙具有最快的降解速度,钙磷材料中中的羟基磷灰石最慢的降解速度、不能匹配新骨形成速度,其他钙磷成分如磷酸三钙、磷酸氢钙、磷酸二氢钙等的降解率处于两者之间。俗称巴黎水泥的单相硫酸钙泥膏、水泥颗粒是应用于骨缺损填充的最久远的材料,因其生物相容性好、能够完全降解而为骨修复提供空间;硫酸钙在100毫升水中常温下溶解0.2克左右,硫酸钙体内降解时在局部形成高钙环境,为新生骨组织骨矿形成提供钙源,与体液中的磷酸根结合从而促进新骨的矿化,同时还不同程度的促进成骨细胞增殖、分化,其潜在的骨诱导活性与硫酸钙溶解过程中局部高钙、偏酸微环境有关,其中偏酸微环境可能促进人骨骨矿微溶降,造成成骨活性蛋白显露,而有利于新骨形成;但临床目前应用的硫酸钙泥膏或颗粒同样有合成材料的共同缺点即难以具备理想三维互通网孔结构,同时硫酸钙体内完全降解时间为45-72d,比自体骨快两倍多,难以对新骨的形成做持续、稳定的骨传导支持,不能为骨组织的再生提供三维多孔微结构以引导修复细胞的分化增殖即新骨形成的生物活动,不利于新骨的形成;硫酸钙材料溶降后还可使局部微环境偏酸而有可能引起炎症反应。合成复合材料的优点是可通过选择不同降解特性的成分及其成分构成比例,使复合材料的降解速率、pH值等物性达到某种平衡,并且可能吸附更多种人体内活性蛋白,更多地满足骨移植替代材料的理想要求。技术实现要素:本发明的目的在于解决现有骨移植替代材料不能兼具良好三维互通网孔结构及可降解性等问题,提供一种兼具良好三维互通网孔结构及可降解性的骨移植用可降解多孔复合支架材料。本发明解决其技术问题所采用的技术方案是:一种骨移植用可降解多孔复合支架材料,通过将牛煅烧松质骨骨矿多孔支架浸入调节液中,干燥,然后将牛煅烧松质骨骨矿多孔支架浸入硫源-磷源复合溶液中水热反应,清洗,干燥而得。本发明以牛煅烧松质骨骨矿多孔支架作为全部或主要钙源,以硫源-磷源复合溶液作为反应介质,以氯化镁作为晶型调节剂,部分实施例添加辅助钙源。产物为组分质量比变化丰富的硫酸钙-羟基磷灰石或硫酸钙-磷酸氢钙-羟基磷灰石两系列复合材料。产物可保留煅烧牛松质骨羟基磷灰石多孔支架的突出优点-类似人体松质骨骨矿的自然骨骨矿三维互通网孔微结构及其较好的机械强度,同时网孔内生长较大长径比的晶须,可增加材料的比表面积,可相对调适微孔孔径及改善细胞粘附;产物可保留牛煅烧松质骨骨矿多孔支架的突出优点-类似人体松质骨骨矿的自然骨骨矿三维互通网孔微结构及其较好的机械强度,同时网孔内生长较大长径比的晶须,可增加材料的比表面积,可相对调适微孔孔径及改善细胞粘附;产品在模拟体液中能实现梯度降解并形成高钙环境,可见钙磷的重新沉积;产品的降解率依其组分及各组分质量比的不同而变化,因此可通过调节材料组分及各组分的质量比来遴选与新骨形成速度匹配较好的多孔支架;而产品其组分及各组分的质量随原料选择及工艺(溶液浓度、是普通恒温条件下的水热反应还是微波条件下的水热反应、反应温度或微波功率、反应时间等)变化而变化,在移植早期即可见修复细胞在三维多孔微结构有良好的粘附、增殖、分化、分泌骨基质,新骨形成快且骨修复效果良好、新生骨组织与支架有完美的结合,在观察中后期可见材料的渐进降解。支架在动物体内移植时有良好的生物相容性,未发现免疫排斥反应及明显的炎症反应;产物可能更多地满足骨移植替代材料的理想要求。作为优选,所述可降解多孔复合支架材料为硫酸钙-羟基磷灰石系列复合材料或硫酸钙-磷酸氢钙-羟基磷灰石系列复合材料。作为优选,按质量百分比计,所述硫酸钙-羟基磷灰石系列复合材料中硫酸钙含量为10-75%,羟基磷灰石含量为25-90%,硫酸钙与羟基磷灰石含量之和为100%。作为优选,按质量百分比计,所述硫酸钙-磷酸氢钙-羟基磷灰石系列复合材料中磷酸氢钙含量为1-75%,羟基磷灰石含量为24-90%,硫酸钙余量;硫酸钙、磷酸氢钙及羟基磷灰石含量之和为100%。作为优选,所述调节液为浓度0.2-1mol/L的氯化镁溶液;或所述调节液为氯化镁-辅助钙源复合溶液,氯化镁浓度为0.2-1mol/L,辅助钙源浓度为0.5-4mol/L,所述辅助钙源为硝酸钙。作为优选,所述硫源-磷源复合溶液:硫源为硫酸,硫酸浓度0.025-0.25mol/L,磷源为磷酸和可溶性磷酸盐,磷酸浓度0.1-0.3mol/L,可溶性磷酸盐浓度0.03-0.5mol/L;或所述硫源-磷源复合溶液:硫源为硫酸和可溶性硫酸盐,硫酸浓度0.025-0.125mol/L,可溶性硫酸盐浓度≤0.35mol/L,磷源为磷酸和可溶性磷酸盐,磷酸浓度0.1-0.3mol/L,可溶性磷酸盐浓度0.03-0.5mol/L。可溶性硫酸盐为硫酸钠、硫酸钾等,可溶性磷酸盐为磷酸氢钠、磷酸氢钾、磷酸二氢钠、磷酸二氢钾、磷酸三钠、磷酸三钾等。作为优选,所述水热反应采取的方式为恒温水热反应、微波水热反应或两者的组合;所述恒温水热反应控制反应温度60-90℃,反应时间为3-15小时;所述微波水热反应控制微波输出功率200-700w,反应时间6-60min。作为优选,所述牛煅烧松质骨骨矿多孔支架浸入调节液中的时间为10-30min。作为优选,水热反应时,牛煅烧松质骨骨矿多孔支架与硫源-磷源复合溶液的料液比为10g:40-200mL。作为优选,所述牛煅烧松质骨骨矿多孔支架的制备方法为:(1)将牛松质骨切割成厚0.5-2㎝的骨条或骨块得原料骨;(2)原料骨置于蒸馏水内在高压锅内蒸煮35-60min,然后用50-70℃水清洗干净,重复本步骤4-6次;(3)将步骤(2)处理后的原料骨在恒温烘箱内80-120℃干燥12-24小时,然后置于煅烧炉内,900-1200℃煅烧8-12小时,冷却后得牛煅烧松质骨骨矿多孔支架。通过上述方法获得的牛煅烧松质骨骨矿多孔支架(转化生物材料),为组分质量比变化丰富的硫酸钙-羟基磷灰石或硫酸钙-磷酸氢钙-羟基磷灰石两系列复合材料,硫酸钙、磷酸氢钙、羟基磷灰石的质量比为1-75%:0-75%:12-85%。具有自然骨骨矿三维互通网孔微结构及其较好的机械强度,同时网孔内生长较大长径比的晶须,可增加材料的比表面积,可相对调适微孔孔径及改善细胞粘附;本发明的牛煅烧松质骨骨矿多孔支架在模拟体液内可实现梯度降解;在骨缺损区移植时,能引导快且良好的骨修复,可见逐步的降解。观察过程中未发现免疫排斥反应及明显的炎症,材料具备良好的生物相容性。本发明的牛煅烧松质骨骨矿多孔支架更多地满足了骨移植替代材料或骨组织工程支架材料的理想的条件。本发明的有益效果是:材料兼具良好三维互通网孔结构及可降解性,具备较好地力学强度和生物相容性,动物实验时能引导快且良好的骨修复。附图说明图1是本发明产品的一种成分XRD分析图。图2是本发明产品的一种的扫描电镜图图3是本发明产品的一种模拟体液溶降实验后材料的扫描电镜图。图4是本发明产品的一种模拟体液溶降实验后材料的成分XRD分析图。图5是本发明产品的一种移植实验早期组织学图示。图6是本发明产品的另一种移植实验早期组织学图示。图7是本发明产品的一种移植实验后期期组织学图示。具体实施方式下面通过具体实施例,并结合附图,对本发明的技术方案作进一步的具体说明。本发明中,若非特指,所采用的原料和设备等均可从市场购得或是本领域常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。牛煅烧松质骨骨矿多孔支架的制备例1:牛煅烧松质骨骨矿多孔支架的制备:(1)将牛松质骨(牛股骨髁松质骨)切割成厚0.5-1.0cm的骨条得原料骨;(2)原料骨置于蒸馏水内在115℃高压锅内蒸煮35min,然后用50℃水清洗干净,重复本步骤6次;(3)将步骤(2)处理后的原料骨在恒温烘箱内80℃干燥24小时,然后置于煅烧炉内,1100℃(升温速率10℃/分钟)煅烧10小时,随炉冷却后得牛煅烧松质骨骨矿多孔支架。牛煅烧松质骨骨矿多孔支架的制备例2:牛煅烧松质骨骨矿多孔支架的制备:(1)将牛松质骨(牛股骨髁松质骨)切割成厚1-2㎝的骨块得原料骨;(2)原料骨置于蒸馏水内在高压锅内蒸煮60min,然后用70℃水清洗干净,重复本步骤4次;(3)将步骤(2)处理后的原料骨在恒温烘箱内120℃干燥12小时,然后置于煅烧炉内,1200℃(升温速率10℃/分钟)煅烧8小时,随炉冷却后得牛煅烧松质骨骨矿多孔支架。牛煅烧松质骨骨矿多孔支架的制备例3:牛煅烧松质骨骨矿多孔支架的制备:(1)将牛松质骨(牛股骨髁松质骨)切割成厚0.5-1㎝的骨条、骨块得原料骨;(2)原料骨置于蒸馏水内在高压锅内蒸煮50min,然后用pH值水清洗干净,重复本步骤5次;(3)将步骤(2)处理后的原料骨在恒温烘箱内100℃干燥18小时,然后置于煅烧炉内,900℃(升温速率10℃/分钟)煅烧12小时,随炉冷却后得牛煅烧松质骨骨矿多孔支架。实施例总方案1:A:将牛煅烧松质骨骨矿多孔支架浸入调节液(0.2-1mol/L的氯化镁溶液)中保持10-30min,微波干燥:微波输出功率300w,时间8min。B:将A步处理完的牛煅烧松质骨骨矿多孔支架浸入硫源-磷源复合溶液中(牛煅烧松质骨骨矿多孔支架与硫源-磷源复合溶液的料液比为10g:40-200mL)水热反应,水热反应采取恒温水热反应,控制反应温度60-90℃,反应时间为3-15小时。硫源-磷源复合溶液:硫源为硫酸,硫酸浓度0.025-0.25mol/L,磷源为磷酸和可溶性磷酸盐,磷酸浓度0.1-0.3mol/L,可溶性磷酸盐浓度0.03-0.5mol/L。C:产品用蒸馏水和/或模拟体液(医用生理盐水、碳酸氢钠注射液)反复浸洗、甩干;恒温烘箱内60-90℃干燥产品8-24小时。实施例总方案2:A:将牛煅烧松质骨骨矿多孔支架浸入调节液(氯化镁-硝酸钙复合溶液:氯化镁浓度0.2-1mol/L,硝酸钙浓度0.5-4mol/L)中保持10-30min,微波干燥:微波输出功率300w,时间8min。B:将A步处理完的牛煅烧松质骨骨矿多孔支架浸入硫源-磷源复合溶液中(牛煅烧松质骨骨矿多孔支架与硫源-磷源复合溶液的料液比为10g:40-200mL)水热反应,水热反应采用微波水热反应,控制微波功率200-700w,反应时间6-60min。硫源-磷源复合溶液:硫源为硫酸和可溶性硫酸盐,硫酸浓度0.025-0.25mol/L,可溶性硫酸盐浓度≤0.35mol/L,磷源为磷酸和可溶性磷酸盐,磷酸浓度0.1-0.3mol/L,可溶性磷酸盐浓度0.03-0.5mol/L。C:产品用蒸馏水和/或模拟体液(医用生理盐水、碳酸氢钠注射液)反复浸洗、甩干;恒温烘箱内60-90℃干燥产品8-24小时。每一样品进行大体观察进行X射线粉末衍射(X-raydiffraction,XRD)分析;选择部分样品进行用扫描电镜进行显微结构观察;进行模拟体液溶降实验、骨缺损修复的动物实验等。大体观察观察材料的大体形态、强度等,部分样品用INSTRON—5566测试压缩强度。模拟体液溶降实验用医用氯化钠注射作为模拟体液,检测材料与模拟体液的固液质量体积比为1克:100毫升,置入有盖烧杯内,在37℃恒温条件下进行模拟体液溶降实验,溶降实验时间8周,用AU5800全自动生化分析仪检测模拟体液内钙、磷等离子测定,用国产电子天平测定4周、8周时材料的质量并计算降解率;进行溶降实验开始前、结束时材料的XRD分析与扫描电镜观察等。动物骨缺损修复试验选择48只健康新西兰白兔,在兔股骨髁造成直径8mm的骨缺损,随机分为为实验组(多孔复合生物材料)及对照组(进口合成钙磷材料)。分别对实验组和对照组兔做出相同的人为骨缺损,然后实验组兔采用多孔复合生物材料进行骨缺损修复,对照组兔采用进口合成钙磷骨替代材料进行骨缺损修复,术后1、2、4、8、12周处死实验动物,进行骨缺损修复的组织学检查。具体实施例1取牛煅烧松质骨骨矿多孔支架10克,利用其良好的虹吸现象吸附0.25mol/L氯化镁溶液(吸附15min左右);微波干燥:输出功率300瓦,8分钟;磷酸氢二铵0.49克、质量分数83%的磷酸原液0.9ml、1mol/L硫酸溶液2.5ml、加蒸馏水配制100毫升硫源-磷源复合溶液,将牛煅烧松质骨骨矿多孔支架浸入其中;在恒温箱90℃条件下反应198分钟;向硫源-磷源复合溶液中补加0.025mol/L硫酸溶液100毫升;在微波输出功率300瓦条件下反应30分钟;80℃蒸馏水浸洗、甩干,90℃烘箱干燥12小时得产品410302,机械强度良好及微孔结构保持良好。产品410302经XRD检测成分如下:CaSO4·2H2O1%,CaHPO4·2H2O74.4%,Ca10(PO4)6O24.6%。具体实施例2取牛煅烧松质骨骨矿多孔支架10克,利用其良好的虹吸现象饱吸0.25mol/L氯化镁溶液;微波干燥:输出功率300瓦,8分钟;取磷酸氢二铵0.98克、质量分数为83%磷酸原液1.8ml、1mol/L硫酸溶液10ml,加蒸馏水配制110毫升硫源-磷源复合溶液,将牛煅烧松质骨骨矿多孔支架浸入其中;在恒温箱90℃条件下反应5小时,取样品410281A;向硫源-磷源复合溶液中补加0.1mol/L硫酸溶液100毫升;在微波输出功率300瓦条件下反应小时25分钟,取样品410281;80℃蒸馏水清洗,90℃烘箱干燥12小时得样品410281A、410281。产品经XRD检测成分如下:410281ACaSO4·2H2O3.1%CaHPO4(H2O)214.4%Ca5(PO4)3(OH)82.5%。410281CaSO4·2H2O68.1%CaSO4·2H2O31.9%。具体实施例3取牛煅烧松质骨骨矿多孔支架10克,利用其良好的虹吸现象吸饱硝酸钙-氯化镁复合溶液,硝酸钙浓度1.875mol/L,氯化镁浓度0.4mol/L,微波干燥:输出功率300瓦,8分钟;取磷酸氢二铵1.98克、质量分数83%磷酸原液1.5ml、1mol/L硫酸溶液10ml,加蒸馏水配制硫源-磷源复合溶液50毫升,将牛煅烧松质骨骨矿多孔支架浸入其中。在恒温箱90℃条件下反应298分钟,取样品411042A;向硫源-磷源复合溶液补加1mol/L摩尔硫酸溶液5ml、蒸馏水70毫升;在微波输出功率300瓦条件下反应小时30分钟;取样品411042,60-80℃蒸馏水浸洗样品,80℃干燥14小时。产品经XRD检测成分如下:410242A:CaSO4·2H2O8.6%、CaHPO4·2H2O51.0%、Ca5(PO4)3(OH)40.4%。411042:CaSO4·2H2O67.0%、Ca5(PO4)3(OH)33.0%。具体实施例4取煅烧牛骨10克置于2.5mol/L的硝酸钙与0.5mol/L氯化镁的复合溶液溶液中浸泡15分钟;微波干燥:输出功率300瓦,8分钟;取磷酸氢二氨3.125、质量分数83%的磷酸溶液1.8ml、1摩尔硫酸溶液30ml,加蒸馏水配制溶液200ml。将煅烧牛骨浸没于硫-磷源复合溶液,90℃条件下反应9小时;70℃烘箱干燥24小时得终产品4100902,强度较差。产品4100902经XRD检测成分如下:Ca(SO4)(H2O)0.515.8%Ca10.042(PO4)5.952(OH)2.29213.7%CaHPO4·2H2O70.5%。具体实施例5取牛煅烧松质骨骨矿多孔支架10克,利用其良好的虹吸现象饱吸0.6mol/L氯化镁溶液;微波干燥:输出功率200瓦,16分钟;取1mol/L硫酸溶液30ml、硫酸钠4.26克、质量分数83%的磷酸原液3ml、磷酸氢二铵3.96克,加蒸馏水配制200毫升硫源-磷源复合溶液,将牛煅烧松质骨骨矿多孔支架浸入其中。在恒温箱60℃条件下反应10小时,取样品503102;60-80℃蒸馏水浸洗、甩干样品,反复三次,90℃烘箱干燥10小时。产品503102经XRD检测成分如下:Ca5(PO4)3OH69.0%、Ca(SO4)(H2O)230.1%、CaSO4(H2O)0.80.9%。具体实施例6取牛煅烧松质骨骨矿多孔支架30克,利用其良好的虹吸现象饱吸0.4mol/L氯化镁溶液;微波干燥:输出功率500瓦,8分钟;500毫升烧杯内加磷酸氢二氨4.08g、质量分数83%的磷酸原液2.4ml、1mol/L硫酸溶液25ml、硫酸钠3.55克、加蒸馏水配制硫源-磷源复合溶液150毫升,将牛煅烧松质骨骨矿多孔支架浸入其中,80℃条件下反应15小时;得样品50101A;向硫源-磷源复合溶液中补加1mol/L硫酸溶液12.5ml、硫酸钠1.78克,加蒸馏水至200毫升刻度,在微波输出功率200瓦反应共8分钟得样品501011E;加蒸馏水至200毫升刻度,输出功率700瓦档条件下加时反应共6分钟得样品501011。清洗样品,样品强度及保持微孔良好保持良好,90℃干燥5小时样品。产品经XRD检测成分如下:501011A:Ca5(PO4)3OH(71.5%)、Ca(SO4)(H2O)2(28.5%)。501011E:Ca5(PO4)3OH(69.6%)、Ca(SO4)(H2O)2(30.4%)。501011:Ca5(PO4)3OH(56.1%)、Ca(SO4)(H2O)2(43.9%)。具体实施例7取牛煅烧松质骨骨矿多孔支架15克,利用其良好的虹吸现象吸饱0.6mol/L氯化镁溶液,微波输出功率300W干燥10分钟;磷酸氢二铵1.98克、质量分数83%磷酸原液1.5ml、硫酸钠0.36克、1mol/L硫酸溶液10ml、加蒸馏水配制75毫升硫源-磷源复合溶液,将牛煅烧松质骨骨矿多孔支架浸入其中;恒温箱90℃条件下反应240分钟;蒸馏水反复浸泡、甩干三次,医用碳酸氢钠注射液浸泡、甩干一次,80℃箱干燥12小时得505081。产品强度、外观良好、孔隙率较大的块体通气良好、强度亦可。产品505081经XRD检测成分如下:CaSO4·2H2O35.0%,Ca5(PO4)3(OH)65.0%。具体实施例8取牛煅烧松质骨骨矿多孔支架20克,利用其良好的虹吸现象吸饱0.6mol/L氯化镁溶液,微波输出功率300W干燥8分钟;250毫升烧杯内加磷酸氢二铵4.08克质量分数83%磷酸原液2.4ml、加1mol/L硫酸溶液30ml、硫酸钠2.12克、加蒸馏水至200毫升的硫源-磷源复合溶液,将牛煅烧松质骨骨矿多孔支架投入其中。在恒温箱60℃反应7.5小时,取强度良好样品504062A;微波输出功率500瓦微波条件下反应18分钟取样品504062;80℃干燥样品12小时;样品及时强度、放大镜下微孔良好。产品经XRD检测成分如下:504062A:CaSO4·2H2O18.9%,Ca9.74(PO4)6(OH)2.0881.1%。504062:Ca10(PO4)6(OH)253.54%,CaSO4·0.15H2O2.32%,CaSO4·2H2O44.14%。具体实施例9取牛煅烧松质骨骨矿多孔支架30克,利用其良好的虹吸现象吸饱0.6mol/L氯化镁溶液,微波输出功率300W干燥10分钟;取磷酸氢二铵4.08g、质量分数83%磷酸原液2.4ml、1mol/L硫酸溶液30ml、硫酸钠4.26、加蒸馏水至200毫升配制硫源-磷源复合溶液,将牛煅烧松质骨骨矿多孔支架投入其中,微波输出功率700瓦条件下反应共32分钟、40分钟得样品503162A、503162。产品用蒸馏水浸洗、甩干两次,用医用氯化钠浸洗、甩干一次,90℃干燥12小时。产品经XRD检测成分如下:503162A:CaSO4·2H2O34.6%、Ca5(PO4)3OH65.4%。503162:CaSO4·2H2O74.1%、Ca5(PO4)3OH25.9%。本发明可降解多孔复合支架材料为硫酸钙-羟基磷灰石系列复合材料或硫酸钙-磷酸氢钙-羟基磷灰石系列复合材料。按质量百分比计,所述硫酸钙-羟基磷灰石系列复合材料中硫酸钙含量为10-75%,羟基磷灰石含量为25-90%,硫酸钙与羟基磷灰石含量之和为100%。所述按质量百分比计,所述硫酸钙-磷酸氢钙-羟基磷灰石系列复合材料中磷酸氢钙含量为1-75%,羟基磷灰石含量为24-90%,硫酸钙余量;硫酸钙、磷酸氢钙及羟基磷灰石含量之和为100%。检测结果:1、材料大体观察、强度测定、XRD成分分析及扫描电镜观察各种产品完好保持牛松质骨的预制形态,无碎裂、崩塌或粉末化等,具有较好的机械强度;10×10×10mm的1-5号标本用INSTRON—5566松质骨测试压缩强度见表1。X线衍射(XRD)检测证实煅烧牛松骨矿支架与硫源-磷源复合溶液进行水热反应,可形成组分质量比丰富变化的硫酸钙-羟基磷灰石或硫酸钙-磷酸氢钙-羟基磷灰石两系列复合材料,参照图1所示。电镜扫描发现(参照图2),产品保持了牛松质骨自然骨骨矿的三维互通网孔微结构的主体结构,同时网孔内生长较大长径比的晶须,可相对调适微孔孔径、增加材料的比表面积,可能改善细胞粘附。表1压缩强度编号压缩强度(MPa)115.1727.168316.23944.5251.432、材料的体外溶降实验模拟体液溶降实验用医用氯化钠注射作为模拟体液,检测材料与模拟体液的固液质量体积比为1克:100毫升,置入有盖烧杯内,在37℃恒温条件下进行模拟体液溶降实验,溶降实验时间8周,用AU5800全自动生化分析仪检测模拟体液内钙、磷等离子测定,用国产电子天平测定4、8周时材料的质量并计算降解率;进行溶降实验开始前、结束时材料的XRD分析与扫描电镜观察等。实验发现材料有较好的降解率(表2),溶液中有较高的钙离子浓度,实验期间钙浓度维持在2.5-12mol/L之间。模拟体液实验材料的XRD分析发现,材料的成分及质量比以渐进变化亦发生变化,硫酸钙及磷酸氢钙逐渐减少或消失、支架材料渐变为羟基磷灰石(图4)。扫描电镜可发现材料的溶降及钙磷的重新沉积(图3)。表2材料在模拟体液内浸泡8周的降解率(n=3)分组降解率羟基磷灰石1.56%本发明产品A27.18%本发明产品B24.51%本发明产品C49.46%本发明产品D27.11%本发明产品E51.94%本发明产品F43.27%3、动物骨缺损修复试验多孔复合生物材料组的移植早期(1周)即可见细胞、血管进入支架的整个空间,可见修复细胞增殖、分化、分泌骨基质(图5);术后4周可见板层骨形成并可见骨髓组织(图6)。术后8、12周板层骨进一步成熟。新骨形成快且骨修复效果良好,新生骨组织与支架有完美的结合。观察过程中未发现免疫排斥反应及明显的炎症,材料具备良好的生物相容性;观察过程发现新骨小梁逐渐嵌入支架材料壁,提示支架材料可逐渐降解及改造塑形(图7)。以上所述的实施例只是本发明的一种较佳的方案,并非对本发明作任何形式上的限制,在不超出权利要求所记载的技术方案的前提下还有其它的变体及改型。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1