联合用药抗肿瘤药物、制备方法及应用与流程
本发明属于药物合成领域,具体是涉及一种抗血管生成药物和抗肿瘤细胞增殖药物联合用药抗肿瘤药物、制备方法及应用。
背景技术:
7-乙基-10-羟基喜树碱(SN38)是临床抗肿瘤药物伊立替康(CPT-11)的活性产物。SN38以拓扑异构酶为靶向部位,抑制拓扑异构酶I-DNA复合物结合,从而阻止断裂单链的再连接,使DNA双链结构解旋而发挥抗肿瘤作用。SN38在体外显示较高的活性,是CPT-11活性的100~1000倍。因此,直接利用SN38分子,避开对CPT-11进行酶解从而释放SN38的途径,可望有效提高药物的抗肿瘤效果。但是SN38的水溶性很差,且不溶于药剂学上可以接受的溶剂(如吐温或者聚氧乙烯蓖麻油),因此无法直接用于临床注射。
此外,肿瘤治疗临床研究表明,长时间使用单一的抑制肿瘤细胞生长的化疗药物会产生耐药性。随着抗血管治疗肿瘤相关研究方案的不断深入,抗血管生成药物联合应用抗肿瘤细胞增殖药物的抗癌策略,为肿瘤的治疗提供了新的思路和方向。
恶性肿瘤的生长和转移依赖于肿瘤血管,随着肿瘤血管新生机制研究的深入以及以肿瘤血管为靶点的药物在临床治疗肿瘤时取得较好的疗效,证实了通过抑制肿瘤血管新生来抑制肿瘤生长的理念。
康普瑞汀A4(Combretastatin,CA4)是从非洲灌木Combretum Caffrum 的树皮分离的一种顺式二苯乙烯类天然产物,属于秋水仙碱样的微管组装抑制剂,能够特异性地靶向肿瘤血管内皮细胞,破坏内皮细胞骨架引起细胞结构发生变化,从而导致肿瘤血管的减少,引起肿瘤中央区域发生坏死。CA4结构式如下式所示:
但是我们前期的实验显示,SN38由于其独特的化学结构,难以直接与两亲性高分子材料共组装形成纳米粒。而CA4则在高分子材料纳米粒中存在快速释放的问题。
技术实现要素:
本发明的目的在于提供一种抗血管生成药物和抗肿瘤细胞增殖药物联合用药的抗肿瘤药物,实现抗血管生成药物和抗肿瘤细胞增殖药物联合用药的抗癌策略,提高联合用药的疗效。
本发明还提供了一种抗血管生成药物和抗肿瘤细胞增殖药物联合用药的抗肿瘤药物制剂。
本发明同时公开了一种抗血管生成药物和抗肿瘤细胞增殖药物联合用药的抗肿瘤药物制剂的制备方法。
本发明中将采用先进的纳米制备技术,将难溶于水的抗肿瘤药物和抗血管生成药物包载于两亲性高分子材料中,形成载药纳米体系,同时克服了,SN38难以直接与两亲性高分子材料共组装形成纳米粒的问题。
针对现有纳米技术制备抗血管生成药物联合应用抗肿瘤细胞增殖药物存在的问题,本发明将提出一种康普瑞汀前体联合应用喜树碱抗肿瘤药物前体的抗癌方法,并将该联合用药方法与先进纳米技术结合,制备抗肿瘤治疗的联合用药的纳米释放体系,实现抗血管生成药物和抗肿瘤细胞增殖药物联合应用的价值,改善临床抗肿瘤治疗的疗效。
一种联合用药抗肿瘤药物,包括抗血管生成药物、抗肿瘤细胞增殖药物和两亲性高分子材料;所述抗血管生成药物为康普瑞汀A4的药物前体,所述抗肿瘤细胞增殖药物为喜树碱类抗肿瘤药物。
作为优选,所述康普瑞汀A4的药物前体结构如下:
所述R为C1~C10的烷酰基。
作为进一步优选,所述康普瑞汀A4的药物前体为康普瑞汀A4(CA4)与丁酸或庚酸或其对应的酰氯、酸酐酯化得到的药物前体。
作为优选,所述康普瑞汀A4的药物前体结构如下:
上述康普瑞汀A4的药物前体可由康普瑞汀A4(CA4)与丁酸或庚酸酯化得到。
作为优选,所述的抗肿瘤细胞增殖药物为7-乙基-10-羟基喜树碱与不饱和脂肪酸连接形成的药物前体。反应过程中,可根据需要添加催化剂,缩合剂等,比如可采用1-(3-二甲氨基丙基)-3-乙基碳二亚胺的盐酸盐作为缩合剂,4-二甲氨基吡啶作为催化剂,同时可利用N,N-二异丙基乙胺中和1-(3-二甲氨基丙基)-3-乙基碳二亚胺的盐酸盐中的盐酸。作为进一步优选,所述康普瑞汀A4与羧酸、催化剂、缩合剂的摩尔比为1:(1~1.5):(0.5~1.5):(1~1.5)。
作为优选,所述不饱和脂肪酸选自二十二碳六烯酸、全反式维甲酸、亚麻酸、油酸或亚油酸。
作为优选,所述两亲性高分子材料选自聚乙二醇-聚乳酸(PEG-PLA)、聚乙二醇-聚乳酸-羟基乙酸(PEG-PLGA)、甲氧基聚乙二醇-聚乳酸(mPEG-PLA)或甲氧基聚乙二醇-聚乳酸-羟基乙酸(mPEG-PLGA)中的任意一种。其中,PEG或mPEG的分子量为2k~8k,PLA的分子量为2k~16k,PLGA的分子量为2k~16k。优选为mPEG5k-PLA16k。
本发明还提供了一种联合用药抗肿瘤药物制剂,所述抗肿瘤药物为上述任一项所述的抗肿瘤药物。所述制剂可为常见的剂型,比如可为粉剂或片剂、注射剂、丸剂等等。
本发明还提供了一种上述联合用药抗肿瘤药物制剂的制备方法,包括:将抗血管生成药物、抗肿瘤细胞增殖药物和两亲性高分子材料溶于有机溶剂中,然后加入到水中,得到所述抗肿瘤药物制剂。
具体讲,包括:
第一步:对喜树碱衍生物7-乙基-10-羟基喜树碱(SN38)进行分子改性,偶联不饱和脂肪酸,选自二十二碳六烯酸(DHA)、全反式维甲酸(RA)、亚麻酸(LNA)、油酸或亚油酸(LA),赋予药物分子亲脂性。而亲脂性SN38衍生物能够在体内释放具有抗癌活性的SN38分子;对康普瑞汀A4(CA4)进行分子改性,偶联饱和脂肪酸(丁酸或庚酸),减缓药物从纳米粒中的释放速度;
第二步:构建同时负载第一步SN38前药和CA4前药的纳米粒,该纳米粒由CA4前药、SN38前药和两亲性高分子组成。
本发明提供了一种上述任一方案所述联合用药抗肿瘤药物在抗肿瘤中的应用。
本发明的载抗血管生成药物和抗肿瘤细胞增殖药物联合用药纳米粒,在体外能够抑制肿瘤细胞和血管内皮细胞的增殖、抑制血管内皮细胞的迁移和侵袭、抑制血管管腔的形成。本发明的联合用药纳米粒在体内也显示了较好的抑制肿瘤增长的能力,进一步证实本发明中抗血管生成药物和抗肿瘤细胞增殖药物联合用药纳米粒在抗肿瘤治疗中具有广阔的应用价值和应用范围。
而且,细胞毒性实验表明本发明中的纳米粒可以显著抑制肿瘤细胞(HT-29)和人脐静脉血管内皮细胞(HUVEC)的增殖,且有剂量依赖关系;划痕损伤和管腔形成实验也证实本发明中制备的纳米粒能抑制HUVEC的迁移和血管形成。对比单独用药体系,本发明中提供的联合用药纳米粒在体内显示了较好的抑瘤效果,具有良好的临床应用价值和应用前景。
附图说明
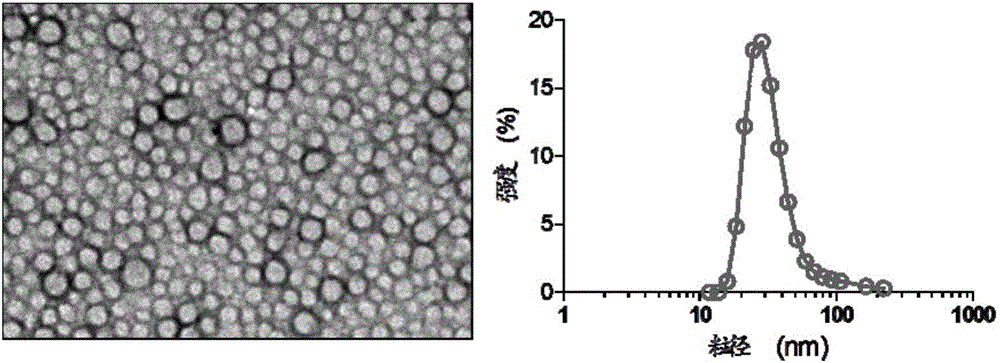
图1为实施例9中纳米粒电镜和粒径图;
图2为实施例10中纳米粒电镜和粒径图;
图3为实施例11中纳米粒电镜和粒径图;
图4为实施例8、9、10、11中不同浓度纳米粒对肿瘤细胞HT-29生存率的影响曲线;
图5为实施例8、9、10、11中不同浓度纳米粒对人脐带血管内皮细胞HUVEC生存率的影响曲线;
图6为实施例9、10、11中纳米粒对人脐带血管内皮细胞HUVEC迁移率的影响;
图7为实施例9、10、11中纳米粒对人脐带血管内皮细胞HUVEC侵袭能力的影响;
图中,SN38表示7-乙基-10-羟基喜树碱,CA4或1表示康普瑞汀A4,丁酸-CA4或2表示丁酸与CA4的偶联物,庚酸-CA4或3表示庚酸与CA4的偶联物,1/4-NP、2/4-NP、3/4-NP分别表示CA4、丁酸-CA4、庚酸-CA4与LNA-SN38与两亲性高分子共组装形成的纳米粒。
具体实施方式
下面结合附图和具体实施方式对本发明作进一步详细说明,但本发明并不受其限制。
实施例1
取丁酸(51.7μL,0.57mmol),CA4(180mg,0.57mmol),EDC·HCl(163mg,0.855mmol),DMAP(76.6mg,0.627mmol),DIEA(188.9μL,1.14mmol)溶于4ml DCM中,室温下搅拌过夜,加入乙酸乙酯,依次利用5%柠檬酸、饱和NaHCO3、饱和食盐水洗涤有机相,有机相用无水硫酸钠干燥,过滤,收集滤液后减压除去溶剂;固体用柱层析色谱分离纯化(乙酸乙酯:正己烷=1:3),得到目标产物丁酸-CA4偶联物化合物2(280mg,收率93%)。
产物丁酸-CA4的1H NMR核磁数据以及质谱数据如下:
1H NMR(400MHz,CDCl3):δ1.00-1.04(t,3H),1.73-1.78(m,2H),2.49-2.53(t,2H),3.71(s,6H),3.80(s,3H),3.83(s,3H),6.45-6.45(d,2H,J=1.2),6.51(s,2H),6.83-6.85(d,1H,J=8.4),7.00-7.01(d,1H,J=1.6),7.10-7.12(q,1H).
HR-ESI Qq-LTMS:计算值:[C22H26O6]+[M+H]+=387.1802;检测值:387.1811。
实施例2
取庚酸(80.8μL,0.57mmol),CA4(180mg,0.57mmol),EDC·HCl(163mg,0.855mmol),DMAP(76.6mg,0.627mmol),DIEA(188.9μL,1.14mmol)溶于4mL DCM中,室温下搅拌过夜,加入乙酸乙酯,依次利用5%柠檬酸、饱和NaHCO3、饱和食盐水洗涤有机相,有机相用无水硫酸钠干燥,过滤,收集滤液后减压除去溶剂;固体用柱层析色谱分离纯化(乙酸乙酯:正己烷=1:3),得到目标产物庚酸-CA4偶联物化合物3(260mg,收率85%)。
产物庚酸-CA4的1H NMR核磁数据以及质谱数据如下:
1H NMR(400MHz,CDCl3):δ0.88-0.91(t,3H),1.26-1.41(m,6H),1.70-1.74(t,2H),2.51-2.54(t,2H),3.71(s,6H),3.80(s,3H),3.84(s,3H),6.45-6.45(d,2H,J=1.6),6.51(s,2H),6.83-6.85(d,1H,J=8.4),7.00-7.00(d,1H,J=1.6),7.10-7.12(q,1H).
HR-ESI Qq-LTMS:计算值[C25H32O6]+[M+H]+=429.2212;检测值:429.2282。
实施例3
LNA-SN38偶联物化合物4合成方法参考专利文献“7-乙基-10-羟基喜树碱药物前体及其制备方法和应用”中SN38前体药物7的合成,专利申请号为201410295432.X。
实施例4
LA-SN38合成方法参考专利文献“7-乙基-10-羟基喜树碱药物前体及其制备方法和应用”中SN38前体药物6的合成,专利申请号为201410295432.X。
实施例5
OA-SN38合成方法参考专利文献“7-乙基-10-羟基喜树碱药物前体及其制备方法和应用”中SN38前体药物5的合成,专利申请号为201410295432.X。
实施例6
RA-SN38合成方法参考专利文献“一种全反式维甲酸-喜树碱类抗癌药物偶联物及其制备方法和应用”中ATRA-SN38偶联物(C10羟基)的制备,专利申请号或专利号为201410692682.7。
实施例7
DHA-SN38合成方法,具体方法如下:
SN38(119.3mg,0.304mmol)、DMAP(40.8mg,0.334mmol)、DHA(100mg,0.304mmol)、EDC·HCl(64mg,3.334mmol)溶于4mL DMF,加入DIEA(43.1mg,0.334mmol),反应过夜,除去反应溶剂后,固体溶于二氯甲烷,水洗7次,依次用饱和碳酸氢钠水溶液、5%柠檬酸及饱和食盐水各洗1次,无水硫酸钠干燥,过滤,收集滤液后减压除去溶剂;固体用柱层析色谱分离纯化(乙酸乙酯:正己烷=1:1),得到产物DHA-SN38偶联物,产率57.5%。
DHA-SN38偶联物核磁和质谱数据如下:
1H NMR(400MHz,CDCl3):δ0.88-0.91(t,3H),0.91-0.99(t,3H),1.31-1.35(t,3H),1.77-1.88(m,2H),1.96-2.02(m,2H),2.50-2.55(m,2H),2.65-2.85(m,12H),3.06-3.12(m,2H),3.75(br,1H),5.20-5.35(m,13H),5.43-5.46(m,2H),5.66-5.70(d,1H,J=16.4),7.47-7.50(m,1H),7.61(s,1H),7.75-7.76(d,1H,J=2),8.17-8.20(d,1H,J=8.8).
HR-ESI Qq-LTMS:计算值[C44H50N2O6]+[M+H]+=703.3742;检测值:703.3741.
实施例8
将实施例1制备的丁酸-CA4偶联物化合物2(CA4含量0.5mg)、实施例3制备的LNA-SN38(SN38含量0.5mg)分别和mPEG5k-PLA16k(药物质量的20倍)溶解于1mL丙酮中,溶解均匀后滴加到10mL水中,滴加完毕后,减压去除丙酮,即可得到丁酸-CA4和LNA-SN38纳米药物(分别标记为2-NP、4-NP)。
实施例9
将CA4化合物1(0.5mg)、实施例3中制备的LNA-SN38化合物4(1.67mg)和mPEG5k-PLA16k(43.4mg)溶解于3mL丙酮中,溶解均匀后滴加到10mL水中,滴加完毕后,减压去除丙酮,即可得到负载抗血管生成药物和抗肿瘤细胞增殖药物的纳米药物(记为1/4-NP)。电镜下纳米粒形貌如图1所示,DLS测得粒径大小31±4nm。
实施例10
将实施例1中纯化得到的丁酸-CA4化合物2(0.6mg)、实施例3中制备的LNA-SN38化合物4(1.67mg)和mPEG5k-PLA16(45.4mg)溶解于3mL丙酮中,溶解均匀后滴加到10mL水中,滴加完毕后,减压去除丙酮,即可得到负载抗血管生成药物和抗肿瘤细胞增殖药物的纳米药物(记为2/4-NP)。电镜下纳米粒形貌如图2所示,DLS测得粒径大小38±17nm。
实施例11
将实施例2中纯化得到的庚酸-CA4化合物3(0.63mg)、实施例3中制备的LNA-SN38化合物4(1.67mg)和mPEG5k-PLA8k(46mg)溶解于3mL丙酮中,溶解均匀后滴加到10mL水中,滴加完毕后,减压去除丙酮,即可得到负载抗血管生成药物和抗肿瘤细胞增殖药物的纳米药物(记为3/4-NP)。电镜下纳米粒形貌如图3所示,DLS测得粒径大小38±14nm。
以下通过测试例进一步阐明本发明所述纳米粒对肿瘤的治疗效果:
测试例1体外细胞毒性实验
取对数生长期细胞(HT-29、HUVEC),胰酶消化后,种板(96孔板,5×103个细胞/孔),37℃孵育24h使细胞贴壁,以SN38为对照组,加入不同浓度的实施例8、9、10、11中制备的纳米粒(100μL/孔),培养48h后,每孔加入30μL噻唑蓝(MTT,5mg/mL),继续培养4h后去除上清,每孔加入100μL二甲基亚砜(DMSO),振荡,使结晶产物充分溶解,492nm处于酶标仪上检测各孔吸光度,绘制出细胞存活曲线,并计算各组纳米粒对细胞的半抑制浓度(IC50)值。抗肿瘤药物脂质体对各种肿瘤细胞的体外毒性结果见图4和图5和表1。
表1:实施例8、9、10、11中纳米粒对肿瘤细胞的IC50(μM)
从图4和图5和表1可看出,由SN38前药组成的纳米粒4-NP与自由的SN38具有相似的细胞毒性,但与CA4前药1、2、3构成的联用纳米粒1/4-NP、2/4-NP、3/4-NP细胞毒性明显增强,证明了两药联用的有效性。
测试例2:迁移实验
静止的HUVEC细胞培养于6孔板中,用枪头在孔中间位置对细胞做一个笔直的划痕,去掉培养基,加入自由CA4药物组以及实施例9、10、11中分别制备的1/4-NP、2/4-NP、3/4-NP(以CA4计,其浓度为5nM),以空白未加药组做对照组。各组细胞置于培养箱中培养24h后,拍照,并对划痕的宽度量化处理。结果显示(图6),与空白对照组相比,自由CA4药物组以及实施例9、10、11中制备的纳米粒均能显著性抑制HUVEC细胞的迁移能力。
测试例3:侵袭实验
取对数生长期HUVEC细胞,按4×104个细胞/孔的密度接种至铺有30μL Matrigel的Transwell小室的上室,下室加入700μL培养基,均匀摇晃使细胞分布均匀,将细胞置于37℃、5%CO2培养箱中培养,24h,细胞贴壁后进行下一步操作。取出上室培养基,加入200μL含有药物(自由CA4药物组以及实施例9、10、11中制备的纳米粒,药物浓度以CA4浓度5nM计算)的培养基,下室加入700μL含20%胎牛血清的培养基,培养24h后,弃上室培养基,PBS清洗两次,甲醇固定,结晶紫染色,用棉签擦去上室胶和细胞,显微镜下观察穿透上室的细胞,拍照,计数。
结果如图7所示,各加药组HUVEC细胞的侵袭得到明显抑制,空白组侵细胞数目为834,而自由CA4药物组以及实施例9、10、11中制备的纳米粒组中HUVEC细胞侵袭数目分别为252、330、325、308个,各组均与空白对照组有非常显著性差异(p<0.01)。
测试例4:血管管腔形成能力实验
Matrigel加入96孔板中,30μL/孔,37℃凝固1h,加入100μL含2×104个HUVEC的培养基,加入自由CA4药物组以及实施例9、10、11中分别制备的1/4-NP、2/4-NP、3/4-NP(以CA4计,其浓度为5nM),以DMSO为空白对照组。培养4h后,显微镜下观察细胞形成的管腔形貌,分析药物对管腔形成的影响。空白组细胞形成明显的管腔圆形,而加药组CA4及1/4-NP、2/4-NP、3/4-NP细胞散乱,较少形成管腔形貌。证实本发明中制备的纳米粒能够抑制HUVEC形成血管管腔的能力。
测试例5:体内抗肿瘤效果评价
5周龄Balb/c裸鼠皮下注射含5×106HT-29细胞悬液200μL,待瘤体长至70mm3大小后,分成4组(每组7只):生理盐水、实施例8中制备的2-NP(CA4等同剂量为15mg/kg)和4-NP(SN38等同剂量为15mg/kg)、实施例10制备的2/4-NP(CA4和SN38等同剂量均为15mg/kg)。每隔三天一次尾静脉给药,总共3次。以第一次给药为0天,间隔一定时间测量瘤体体积,并对结果进行统计分析。结果显示,4-NP、2/4-NP相对于生理盐水组对抑制肿瘤生长具非常显著的效果,且抗血管生成药物和抗肿瘤细胞增殖药物联合组(2/4-NP)优于由单独用药的2-NP和4-NP组。体内试验进一步证实,本发明中制备的抗血管生成药物和抗肿瘤细胞增殖药物联合用药纳米粒具有较强的抑制肿瘤增长的能力。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种抗肿瘤药物奈拉滨化合物的制造方法与工艺
- 四苯基卟啉连二胺芳基钌化合物及其制备方法和用途与制造工艺
- 一种具抗肿瘤活性的不对称双1‑取代5‑N杂靛红席夫碱类化合物的合成方法与制造工艺
- 一种具抗肿瘤活性的不对称双7‑N杂靛红席夫碱类化合物的合成方法与制造工艺
- 一种具抗肿瘤活性的不对称双取代靛红席夫碱类化合物及其合成方法与制造工艺
- 一种抗肿瘤药物奈拉滨组合物的制造方法与工艺
- 含Micranthanone A用于抗肿瘤的药物的制造方法与工艺
- 一种小分子靶向药物脂质体制剂的制备方法与制造工艺
- 一种5?溴?1H?吡咯并[2,3?b]吡啶的合成方法
- 一种作用于EGFR敏感突变激酶EGFR<sup>L858R</sup>,EGFR<sup>(d746-750)</sup>的6-取代氨基嘌呤类化合物及 ...的制作方法