蟾毒灵在制备L‑型钙通道阻断剂方面的应用的制作方法
本发明涉及生物化学领域,具体涉及一种蟾酥成分Bufalin在制备Cav1.2型钙通道阻断剂方面的应用。
背景技术:
电压门控型钙通道按电生理特性可分为:高电压门控型钙通道及低电压门控性钙通道。前者分为:L-型、N-型、P/Q-型及R-型;后者又称之为T-型。L-型钙通道是一种高电压门控性钙离子通道,普遍存在于体内各型细胞膜上。按其药理学特性及表达不同,可分为Cav1.1、Cav1.2、Cav1.3、Cav1.4四种。Cav1.2型钙通道分布广泛,介导的钙离子(Ca2+)内流诱导细胞产生钙依赖的钙释放机制,使细胞发生相应的生理和生化反应。在心肌细胞膜上,Cav1.2亚型是L-型钙通道的主要亚型,也是心肌细胞兴奋过程中钙离子内流的主要通道。Ca2+可通过L-型钙通道的内流构成心室肌细胞动作电位平台期。随着Ca2+通过L-型钙通道内流,激活了Ca2+从肌浆网中释放,对钙稳态和工作心肌细胞的兴奋-收缩偶联过程都起到重要作用。此外L-型钙通道电流与慢传导动作电位及某些心律失常的细胞机制有关。因此,临床治疗过程中,Cav1.2型钙通道抑制药物在心血管疾病(如高血压)的治疗中具有重要意义。
蟾酥为我国传统名贵中药,《中国药典》2010年版明确规定本品为蟾蜍科动物中华大蟾蜍或黑眶蟾蜍的干燥分泌物。中医认为其性温,有毒,归心经,具有消肿,清热解毒,开窍醒神,止痛之功效,主要用于痈疽疔疮,牙痛,瘰疬,咽喉肿痛,神昏吐泻和痧胀腹痛等疾病。现代药理学研究表明蟾酥具有抗肿瘤、镇痛、局麻、抗炎等作用。目前蟾酥已广泛应用于临床中,在治疗心血管疾病,如心律失常,心绞痛等方面疗效显著。蟾毒灵(bufalin)是从中药蟾酥中提取的一种化合物,分子式C24H34O4,相对分子质量为386.5。近年来研究发现,蟾毒灵还具有广泛的抗肿瘤作用,可以诱导包括白血病、前列腺癌、胃癌、肝癌等多种肿瘤细胞分化和凋亡。但蟾毒灵对L-型钙离子通道,尤其是对Cav1.2亚型是否产生作用,目前并无任何报道。
技术实现要素:
本发明目的在于提供蟾酥成分蟾毒灵(Bufalin)在制备Cav1.2型钙离子通道阻断剂方面的应用。
为了解决这些问题,本发明提供的技术方案是:蟾毒灵在制备L-型钙通道阻断剂方面的应用。
本发明的一优选技术方案,蟾毒灵在制备Cav1.2型钙通道阻断剂方面的应用。
本发明的一优选技术方案,所述蟾毒灵通过抑制Cav1.2型通道发挥在心脑血管疾病治疗中的作用,特别是用于制备治疗心脑血管疾病药物的应用。
本发明的第二方面提供了一种药物组合物,为L-型Cav1.2钙通道抑制剂,其含有有效成分的蟾毒灵及药学上可接受的辅料。
相对于现有技术中的方案,本发明的优点在于:本发明揭示了蟾毒灵在制备Cav1.2型钙通道阻断剂方面的应用,所述蟾毒灵可通过抑制Cav1.2型通道发挥在心脑血管疾病的临床治疗。
附图说明
下面结合附图及实施例对本发明作进一步描述:
图1:Cav1.2转染HEK293细胞,膜片钳电生理检测并验证其介导的L-型钙通道电流。
图2:蟾毒灵(bufalin)可剂量依赖性抑制Cav1.2型钙通道电流。
图3:蟾毒灵(bufalin)通过非G蛋白及非酪氨酸受体途径抑制Cav1.2型通道电流。
具体实施方式
以下结合具体实施例对上述方案做进一步说明。应理解,这些实施例是用于说明本发明而不限于限制本发明的范围。实施例中采用的实施条件可以根据具体厂家的条件做进一步调整,未注明的实施条件通常为常规实验中的条件。
本实施例运用全细胞膜片钳中电压钳的记录方法,记录Cav1.2介导的L-型钙通道电流,研究蟾毒灵(bufalin)对转染Cav1.2的HEK293细胞L-型钙通道电流的影响。
实施例1 HEK293细胞转染及电流验证
实验材料
HEK293细胞购自美国ATCC公司;转染用试剂购自美国SIGMA公司。
实验方案
1)细胞培养及转染:
取一瓶培养良好的细胞(判断标准:贴瓶壁70-80%,光镜下细胞色泽较亮,无明显的漂浮细胞),弃取培养液,加入磷酸盐缓冲液2ml轻洗两遍后加入约1mL的0.25%Trypsin消化液消化,约3分钟后加入DMEM高糖培养液吹打,使细胞悬浮,将细胞悬液转入一离心管中,离心,1000转/分,约5分钟,弃去上清液,加入约5mLDMEM高糖培养液,吹打使细胞悬浮。然后取1ml细胞悬液至已有10mlDMEM高糖培养液的离心管中,缓慢吹打再取1ml细胞悬液至1ml的培养基中,传代至35mm的培养皿中(含有已用PDL包被的玻璃爬片)。24h后进行转染。细胞转染采用磷酸钙转染法。具体如下,恒温培养箱中取出24h前的HEK293细胞,换液(不含有双抗的DMEM培养基),放入培养箱中待用。Cav1.2钙离子通道亚单位(质粒):Cav1.2 1.5μg、α2δ1.25μg,β2α1.25μg,TAG 0.25μg,按比例混合后,往其中加入75μl CaCl2溶液,混合均匀后逐滴加入到75μl 2×HBS溶液中,缓慢吹打,静置12min后逐滴加入到已贴壁有细胞的爬片上,移入恒温培养箱,48h-72h后运用全细胞膜片钳记录。
2)电流记录:应用全细胞膜片钳记录带有荧光的HEK293细胞L-型钙电流,每组记录4-7个细胞。如图1A所示,1‰DMSO作为阴性对照对L-型钙电流无明显作用,抑制率为1.55%(n=5,二者无统计学意义);如图1B所示,10μM Nifedipine(L-型钙通道阻断剂)作为阳性对照能够显著抑制L-型钙电流,抑制率为86.00(n=5,p<0.01)。
图1显示了Cav1.2介导的L-型钙通道电流验证。HEK293细胞钳制在-70mV,刺激方波采用-60mV至0mV,刺激时程为150ms。图1A为DMSO溶剂对HEK293细胞转染的Cav1.2钙通道电流的作用,显示DMSO溶剂(0.001%)对HEK293细胞转染的Cav1.2电流无任何作用(n=5)。图1B为硝苯地平对L-型Cav1.2钙通道电流的作用,显示硝苯地平(nifedipine)(5μM)可显著阻断L-型Cav1.2电流(n=4)。***p<0.001vs.control。
实施例2 蟾毒灵(bufalin)可剂量依赖性抑制Cav1.2型钙通道电流。
实验材料:
蟾毒灵(bufalin)(批号:SLBQ5349V)购自美国Sigma公司。
实验方案:
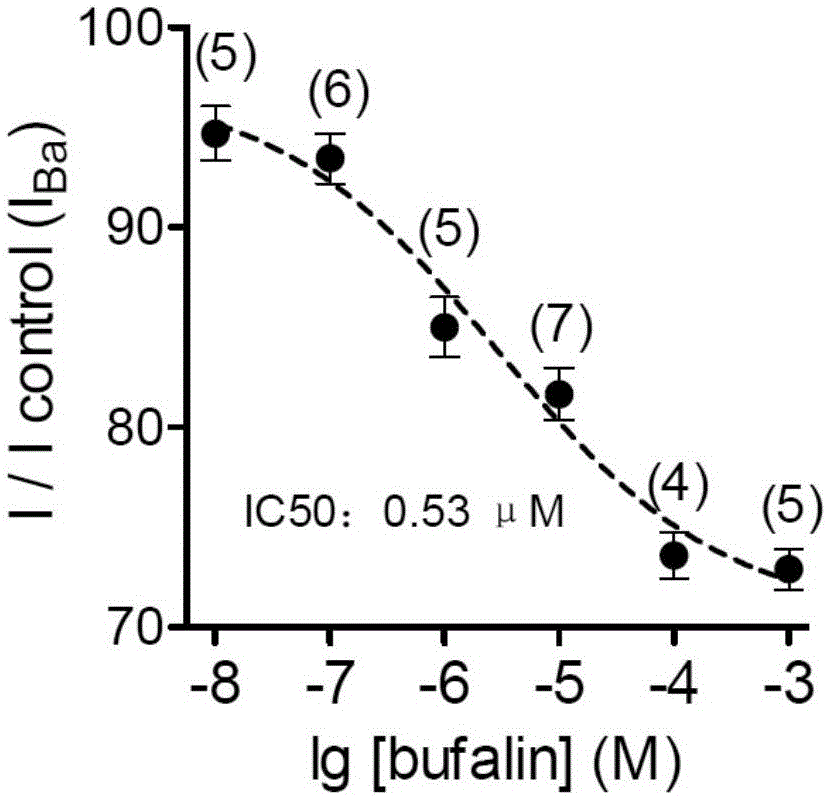
实施例应用全细胞膜片钳记录带有绿色荧光的HEK293细胞电流,每组记录4-7个细胞。检测蟾毒灵(bufalin)对转染Cav1.2钙离子通道亚单位(质粒)后48h的HEK293细胞L-型钙电流的影响。结果如图2所示,全细胞膜片钳结果显示蟾毒灵能够抑制HEK293细胞L-型钙电流,并具有剂量依赖性。其最大抑制率为19.51±5.06%(n=5,p<0.001)。半数有效量(EC50)为0.53μM。
图2显示了蟾毒灵(bufalin)浓度依赖性抑制Cav1.2介导的L-型钙通道电流。HEK293细胞钳制在-70mV,刺激方波采用-60mV至0mV,刺激时程为150ms。浓度依赖曲线采用sigmoidal Hill方程[(Y=1/(1+10(log IC50-X)nH),其中X是浓度的对数值,IC50是半数有效剂量]经Prism 5.0(Graph-Pad Software Inc.,La Jolla,CA,USA)软件拟合。括号内数字为各浓度蟾毒灵的细胞记录个数。
实施3 蟾毒灵(bufalin)通过非G蛋白受体途径抑制Cav1.2型钙通道电流;
实验材料:
实验用G蛋白阻断剂GDP-β-S、受体酪氨酸激酶阻断剂protein kinase inhibitor peptide A(PKI pep.A)均购自美国SIGMA公司。
实验方案:
实施例通过GDP-β-S及PKI pep.A分别阻断G-蛋白及受体酪氨酸激酶介导的信号通路,来检测蟾毒灵(bufalin)的Cav1.2钙离子通道的抑制机理。如图3所示,蟾毒灵(bufalin)通过非G-蛋白及非PI3K依赖的通路途径抑制L-型钙电流。G-蛋白拮抗剂GDP-β-S,1μM)和酪氨酸激酶抑制剂均不能够阻断蟾毒灵(bufalin),0.5μM)对L-型钙通道的抑制(抑制率%=3.8±1.5,n=6;抑制率%=3.2±1.1,n=6)。此结果表明直接抑制而非G-蛋白藕联或酪氨酸受体激酶途径参与蟾毒灵(bufalin)对L-型电流的抑制。
图3为蟾毒灵(bufalin)对Cav1.2介导的L-型钙通道电流的抑制作用不通过G-蛋白及酪氨酸偶联的蛋白受体。HEK293细胞钳制在-70mV,刺激方波采用-60mV至0mV,刺激时程为150ms。图3A,记录电极内给予G蛋白的阻断剂GDP-β-S(10μM,n=6)并不影响蟾毒灵对Cav1.2的电流抑制作用。图3B,电极内给予酪氨酸激酶阻断剂PKI pep.A(1μM)亦不影响蟾毒灵对Cav1.2的电流抑制作用。**p<0.01,***p<0.001vs.control。图3C为图3A,3B的柱状图体现。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实例的限制,上述实例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等同物界定。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种大电导钙激活钾通道阻断剂-Martentoxin及其制备方法和用途的制作方法
- 虎纹捕鸟蛛毒素-xvi的制作方法
- 异丁酸(1R<sup>*</sup>,2R<sup>*</sup>,4R<sup>*</sup>)-2-(2-{[3-(4,7-二甲氧基-1H-苯并咪唑-2-基)-丙基]-甲基 ...的制作方法
- 制备s-(-)-氨氯地平或其盐的方法以及其中所用的中间体的制作方法
- 在疼痛的治疗中用作钠或钙通道阻断剂的杂芳基氨基磺酰基苯基衍生物的制作方法
- 治疗脂质代谢障碍的氮杂环丁酮衍生物的制作方法
- 作为钙通道阻断剂的新化合物的制作方法
- 龙胆酸氨氯地平及其制备方法
- 在疼痛的治疗中用作钠或钙通道阻断剂的杂芳基氨基磺酰基苯基衍生物的制作方法
- 用作钙通道阻断剂的哌嗪取代化合物的制作方法