将莫西沙星应用于耳的方法和组合物与流程
本申请要求2010年1月7日提交的美国临时申请序列号61/293,019的优先权。现有申请的公开内容视作本申请公开内容的一部分(且通过引用纳入)。
技术领域
本发明涉及将莫西沙星应用于耳的方法和材料。更具体地,本发明特征为将莫西沙星应用于鼓膜的外、表皮面的方法和材料,用以治疗中耳疾病。
发明背景
中耳炎(OM)非常普遍,尤其是在儿童中。OM通常起始于上呼吸道病毒感染,其改变上呼吸道、咽鼓管和中耳的微环境,从而驻留于鼻咽的细菌侵入中耳并聚集于中耳。此侵入可使咽鼓管发炎并产生阻断,干扰中耳通气、压力平衡和耳引流。液体在正常充气中耳腔中聚集且压力增加,产生剧痛。在OM的严重病例中,声音感知结构可受损。持续性或复发性OM可由中耳内结束休眠的细菌引起,所述细菌通过薄生物膜与抗生素隔离。
OM目前用抗生素和/或通过经鼓膜中的手术切口插入鼓膜穿刺管来治疗,从而使耳腔引流和减压。抗生素治疗受限于递送途径。抗生素可全身递送,但通常需要高剂量以在中耳内达到治疗水平(即高于最小抑菌浓度),这种水平通常在明显时滞后达到。抗生素还可通过灌洗递送,或经滴剂进入耳道。这种递送途径可能难以控制,通常不能有效获得中耳内延长的抗生素治疗水平。抗生素还可通过注射递送,或用抗生素涂层材料插入中耳,但这种方法涉及刺穿或切割鼓膜,需要全身麻醉且可能损伤鼓膜。手术插入鼓膜穿刺管也会产生风险,包括鼓膜瘢痕(即鼓膜和中耳组织钙化)、听觉损失、持续性耳漏(即脓液从管内流出)和感染。
国立卫生研究院的组成部分-国立失聪和其他沟通障碍研究院(NIDCD)近期启动了$2,000,000资助计划以支持开发预防和治疗OM的替代策略及新方法。在对申请(RFA-DC-02-002)的要求中,NIDCD阐明:(1)OM导致显著儿童发病率且日益影响公众健康;(2)OM是急诊患者的主要原因;(3)OM是诊所就诊的第二大原因;(4)OM是儿童抗生素处方的主要原因,占门诊抗生素处方的40%以上;(5)OM是儿童听觉损失的主要原因;和(6)OM是儿童进行全身麻醉的主要原因。另外,NIDCD批评使用广谱抗生素治疗OM会造成可使导致OM的3种菌属(肺炎链球菌(Streptococcus pneumoniae)、不可分型流感嗜血杆菌(Haemophilus influenzae)和卡他莫拉菌(Moraxella catarrhalis))中出现令人担忧的多重耐药菌。因此,许多一线和二线抗生素针对OM和包括肺炎及脑膜炎在内的其他疾病的效果日益降低。NIDCD得出结论“迫切需要开发研究、治疗和预防OM的新方法以:1)减少OM发病率和相关费用;和2)保持用于治疗OM和其他常见严重疾病的抗生素功效。”
发明概述
本发明部分基于发现可配制含莫西沙星的组合物,从而能以液体样形式递送到鼓膜的外、表皮面,随之在递送后,转化成固体样凝胶状态以使所述组合物保持相对鼓膜定位。递送这种组合物到鼓膜可提供治疗中和内耳疾病(例如OM)的更有效方法。
一方面,提供将莫西沙星给予哺乳动物(例如,啮齿动物或人)的方法。所述方法包括将制剂应用于哺乳动物鼓膜表皮面,其中所述制剂包括增粘剂和莫西沙星,其中所述制剂粘度小于100,000cps,且其中所述制剂应用于鼓膜后产生的屈服应力足以相对鼓膜维持该制剂。所述增粘剂可以是结冷胶、N-异丙基丙烯酰胺与丙烯酸钠和n-N-烷基丙烯酰胺、聚丙烯酸与聚乙二醇、聚甲基丙烯酸与聚乙二醇、(聚丙烯酸)与羟丙基甲基纤维素、纤维醋法酯乳胶、藻酸钠或逆热固性凝胶如泊咯沙姆或泊洛沙胺。莫西沙星可跨鼓膜转移至中耳腔。所述至少一种药物试剂可包括抗生素且所述制剂还可包括抗炎剂、麻醉剂、粘附促进剂、渗透或穿透增强剂、生物粘附剂、吸湿剂、耳垢软化剂(ear war softener)或防腐剂。
另一方面,采用的药盒包括制剂和指示所示制剂应用于鼓膜的说明书。这种制剂包括增粘剂和莫西沙星,其中所述制剂粘度小于100,000cps,且其中所述制剂应用于鼓膜后产生的屈服应力足以相对鼓膜维持该制剂。
还提供了包括应用于鼓膜外表面的制剂的啮齿动物(例如南美栗鼠),其中所述制剂包括增粘剂和莫西沙星,其中所述制剂粘度小于100,000cps,且其中所述制剂产生的屈服应力足以相对鼓膜维持该制剂。
除非另有定义,本文所用全部技术和科学术语具有与发明所属领域普通技术人员通常理解相同的意义。尽管与本文所述类似或等同的方法和材料可用于实施本发明,合适的方法和材料描述于下。本文提及的所有发表物、专利申请、专利和其他参考文献通过引用全文纳入本文。发生冲突时,以本说明书为准,包括定义。另外,材料、方法和实施例仅用于阐明而不意在限制。
发明的其他特征和优点通过以下详述和权利要求将显而易见。
附图说明
图1显示体外释放的莫西沙星含量的累积百分比。
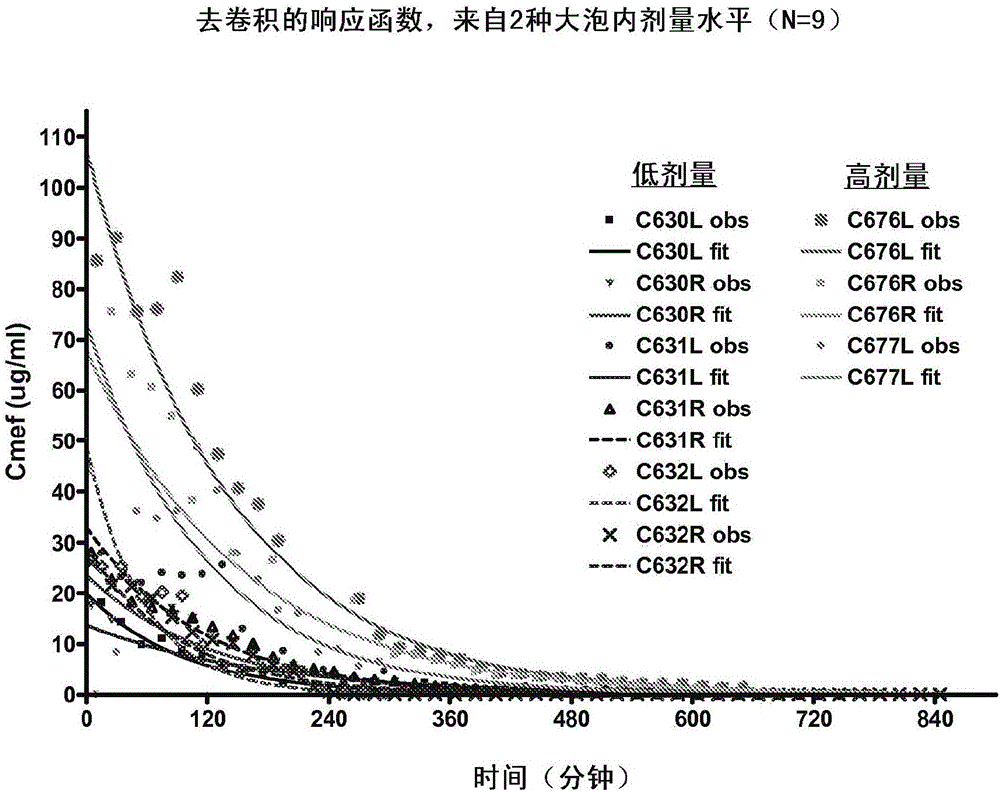
图2显示从2个大泡内(intrabulla)剂量水平去卷积的响应函数(N=9)。
图3显示从大泡内高剂量水平去卷积的响应函数(N=3)。
图4A显示组1和组2在外耳给药1%莫西胶(moxigel)后MEF中的莫西沙星浓度。
图4B显示组3和组4在外耳给药1%莫西胶后MEF中的莫西沙星浓度。
图5显示外耳给药1%莫西胶后MEF中的莫西沙星浓度(均值,SD)(N=23)。
图6显示组1和组2在外耳给药3%莫西胶后MEF中的莫西沙星浓度。
图7显示外耳给药3%莫西胶后MEF中的莫西沙星浓度(均值,SD)(N=13)。
图8显示外耳给药1%和3%莫西胶后MEF中的莫西沙星浓度(均值,SD)。
图9显示1%和3%莫西胶的Cmax和Tmax比较。
图10显示外耳给药1%莫西胶后MEF中递送的累积量(N=23)。
图11A显示外耳给药1%莫西胶后MEF中的输入率。第1组,N=6;第2组,N=6。
图11B显示外耳给药1%莫西胶后MEF中的输入率。第3组,N=6;第4组,N=5。
图12显示外耳给药3%莫西胶后MEF中递送的累积量(N=13)。
图13显示外耳给药3%莫西胶后MEF中的输入率。第1组,N=6;第2组,N=7。
图14显示外耳给药1%和3%莫西胶后MEF中的输入率。
图15显示外耳给药1%莫西胶后达到中耳液内目标浓度的时间和高于该浓度的持续时间。
图16显示外耳给药3%莫西胶后达到中耳液内目标浓度的时间和高于该浓度的持续时间。
图17显示外耳给药后3天内MEF中的AUIC。
图18显示外耳给药后MEF中的Cmax/MIC。
图19A显示50%IPM处理(N=9)后的MEF莫西沙星浓度(均值,SEM);图19B显示同一数据的对数形式。
发明详述
本发明一般提供使用含莫西沙星和一种或多种增粘剂的组合物将莫西沙星应用于耳的方法。特定配制组合物,从而其能以液体样状态即可流动形式递送到鼓膜的外、表皮面。然而,所述组合物在给予后转化成固体样状态,从而该组合物保持与鼓膜接触。因此,所述组合物保持相对鼓膜定位,莫西沙星可跨鼓膜转移到例如中耳腔,提供治疗中耳和内耳疾病(例如OM)的更有效方法。合适组合物还可包括其他组成,例如用于促进制剂粘附鼓膜和/或增加鼓膜渗透性从而提高莫西沙星穿透。
与中耳炎相关的常见病原体包括肺炎链球菌、流感嗜血杆菌和卡他莫拉菌。这些生物对莫西沙星敏感;MIC90值分别为0.13、0.06和0.06μg/ml。如本领域技术人员所理解,MIC90指抑制90%生物生长所需的最小抑菌浓度。使用本文所述经鼓室递送莫西沙星的治疗目的是获得比MIC90值高>10倍(例如大于约0.6μg/ml;约0.6-约1.3μg/ml)的中耳液水平并维持此水平>24小时。这些目标浓度用本文所述莫西沙星凝胶制剂通过单次应用获得。
本发明组合物在25℃的粘度小于100,000厘泊(cps)。粘度指组合物的流体阻力。体积为0.5mL的组合物可于25℃通过合理受力而不需机械装置辅助在少于1分钟时间内穿过连接1-mL结核菌素注射器的19号针,其粘度通常小于100,000cps。可用粘度计(例如来自博勒菲(Brookfield))以市售粘度标准测定组合物的粘度。
本发明组合物还具有足以相对鼓膜维持制剂的最小屈服应力。屈服应力指应用于固体材料时引起固体材料显示持续变形而压力没有进一步增加的液体样表现的力量。本发明组合物的最小屈服应力取决于应用凝胶的厚度,但不依赖于该凝胶的几何形状和环境温度。如本文所用,组合物的最小屈服应力涉及厚度为4mm且密度为1g/L的应用凝胶。屈服应力(σ0)表示为σ0=ρgh,其中ρ是密度,g是重力加速度,和h是层厚度。通常,最小屈服应力约为39帕斯卡(Pa)。本文所述方法还可用于估计组合物是否具有足以相对鼓膜维持的屈服应力。例如,测试组合物可给予动物如南美栗鼠的耳朵,可监控动物耳朵以测定该组合物是否转化成更类似固体状态并相对鼓膜维持。参见例如本文的实施例部分。
增粘剂
本文所用的增粘剂指增加液体粘度的聚合物或其他化学部分。本发明组合物包括合适的增粘剂时,允许该组合物在接触鼓膜后于25℃从液体样状态(例如可流动)转化成固体样状态(例如凝胶),且可为非生物可降解,即不由哺乳动物中天然存在的化学物或酶分解,或为生物可降解。组合物包括在25℃有效产生小于100,000cps(例如,小于90,000、60,000、30,000、20,000或10,000cps)的组合物粘度的增粘剂量,且一般在应用于鼓膜后的最小屈服应力为39Pa。通常,组合物包括0.05-50%的增粘剂(例如,0.15-25、5-45、10-40、12-37、15-35、17-33或20-30%的增粘剂)。
示例性增粘剂包括结冷胶(或),940(聚丙烯酸)与羟丙基甲基纤维素(HPMC),N-异丙基丙烯酰胺(NiPAAm)与丙烯酸钠和n-N-烷基丙烯酰胺,聚丙烯酸与聚乙二醇(PEG)或聚甲基丙烯酸与PEG,纤维醋法酯乳胶(CAP),藻酸钠,和非离子型表面活性剂如泊咯沙姆及洛泊沙胺可逆温度依赖性凝胶体系。结冷胶是伊乐藻假单胞菌(Pseudomonas elodea)分泌的天然聚合物,阴离子脱乙酰胞外多糖。所述四糖重复单元由一个α-L-鼠李糖、一个β-D-葡萄糖醛酸和两个β-D-葡萄糖部分组成。结冷胶的原位成胶机制是阳离子诱导(例如,存在钙离子)和温度依赖性(例如,生理温度)。结冷胶是热可逆的。940与HPMC以pH依赖性方式原位成胶。是成胶剂且HPMC用于提高凝胶粘度。NiPAAm与丙烯酸钠和n-N-烷基丙烯酰胺是可经历基于温度的可逆性溶胶-凝胶转化的三元共聚物水凝胶。丙烯酸钠和n-N-烷基丙烯酰胺用于改良水凝胶性质,具体为转变温度。认为聚丙烯酸与PEG或聚甲基丙烯酸与PEG基于氢键成胶。聚丙烯酸可溶于乙醇溶液且在注射后,乙醇扩散导致聚合物沉淀和溶液成胶。CAP是以pH依赖性方式成胶的纳米颗粒体系。活性化合物(莫西沙星)可部分吸附于聚合物颗粒表面。藻酸钠在钙或其他多价离子存在时成胶。
非离子型表面活性剂如泊咯沙姆和洛泊沙胺特别有用。泊咯沙姆在制药领域熟知且描述于例如Polymers for Controlled Drug Delivery(《用于受控药物递送的聚合物》),第10章(Peter J.Tarcha编辑,1990)的Irving R.Schmolka,Poloxamers in the Pharmaceutical Industry(《制药工业中的泊咯沙姆》)。泊咯沙姆是三嵌段共聚物,因为它们由2种不同聚合物嵌段(即亲水性聚氧乙烯嵌段和疏水性聚氧丙烯嵌段)构成,配置成聚氧乙烯-聚氧丙烯-聚氧乙烯的三嵌段。泊咯沙姆是一类具有环氧丙烷嵌段疏水物和环氧乙烷亲水物的嵌段共聚物表面活性剂。泊咯沙姆市售可得(例如,多元醇来自BASF公司(BASF Corporation))。另外,泊咯沙姆可通过已知技术合成。
鉴于泊咯沙姆的非生物降解性、其水溶性和其相对迅速的药物释放动力学,先前认为泊咯沙姆缺乏给予药物试剂的实用性(参见例如美国专利号6,201,072)。然而,如本文所述,泊咯沙姆共有宜应用制剂于鼓膜的性质:泊咯沙姆的水制剂显示逆热凝胶化或逆热固化。泊咯沙姆水制剂加热至超过其凝胶化温度时,其粘度增加并转化成凝胶。泊咯沙姆水制剂冷却到低于其凝胶化温度时,其粘度降低并转化成液体。凝胶和液体间的转变不涉及制剂化学组成的变化,且可逆并可重复。泊咯沙姆水制剂的凝胶-液体转变温度可由本领域普通技术人员用常规实验(例如,通过操控泊咯沙姆浓度、pH和制剂中存在其他成分)调整。在一些实施方式中,组合物具有大于环境温度且小于或等于鼓膜温度的凝胶化温度。这种组合物可通过个体耳道作为液体方便地应用且随后可相对鼓膜转化成凝胶,从而保持制剂中的莫西沙星紧邻鼓膜。
莫西沙星
本文所述组合物还包含莫西沙星或其盐。莫西沙星是具有化学式C21H24FN3O4的第三代合成氟喹诺酮。莫西沙星结合并抑制细菌酶DNA旋转酶(拓扑异构酶II)和拓扑异构酶IV,导致敏感细菌种类中DNA复制和修复的抑制及最终的细胞死亡。本文所述组合物中莫西沙星或其盐含量可为约0.1%-约50%(例如,约0.25%-约45%;约0.5%-约25%;约0.75%-约10%;约1%-约5%;或约1%-约3%)。莫西沙星盐包括例如但不限于,盐酸、硫酸、乙酸、乳酸、氢氧化钠和氢氧化钾。
莫西凝胶组合物的其他组成
在一些实施方式中,本文所述组合物包括增粘剂和莫西沙星以外的一种或多种化合物。例如,组合物可包括一种或多种药物试剂,包括例如肾上腺皮质激素(如皮质类固醇、类固醇)、镇痛剂、辅助镇痛剂、镇痛-麻醉剂、麻醉剂、莫西沙星以外的抗生素、抗细菌剂、抗感染剂、抗生素治疗佐剂,解毒剂、止吐剂、抗真菌剂、抗炎剂、抗眩晕剂、抗病毒剂、生物反应调节剂、细胞毒素、诊断用辅助药、免疫剂、免疫调节剂、蛋白、肽、和其他可用于治疗耳病的试剂。除了莫西沙星,本文所述组合物可包括一种或多种药物试剂。例如,为抗击细菌感染、为减少组织炎症和为缓解刺激,组合物可包含莫西沙星、抗炎剂、和麻醉剂或镇痛剂。本领域技术人员可鉴定药物试剂并在需要时组合它们以获得所需效果。以下仅提供可能药物试剂的代表性列表。
示例性肾上腺皮质激素包括倍他米松、可的松、地塞米松、氢化可的松、甲基强的松龙、帕拉米松、泼尼松龙、强的松和去炎松。示例性镇痛剂包括对乙酰氨基酚、阿司匹林、丁丙诺啡、布他比妥、布托啡诺、可待因、地佐辛、二氟尼柳、二氢可待因、依托度酸、非诺洛芬、芬太尼、氟喹氨苯酯、氢可酮、氢吗啡酮、布洛芬、酮基布洛芬、酮咯酸、左啡诺、水杨酸镁、甲氯芬那酸、甲灭酸、哌替啶、眠尔通、美沙酮、左美丙嗪、吗啡、纳布啡、萘普生、阿片、氧可酮、羟吗啡酮、镇痛新、苯巴比妥、丙氧芬、双水杨酯、和水杨酸钠。一种示例性辅助镇痛剂是咖啡因。示例性麻醉剂包括阿替卡因-肾上腺素、布比卡因、氯普鲁卡因、依替卡因、克他命、利多卡因、甲哌卡因、美索比妥、丙胺卡因、异丙酚、丙氧卡因、丁卡因和硫喷妥钠。一种示例性镇痛-麻醉剂是安替比林(antipiyrne)-苯坐卡因。
示例性抗生素(除了莫西沙星以外)、抗菌剂和抗感染剂包括磺胺类药(例如,磺胺、磺胺嘧啶、磺胺甲恶唑、磺胺异恶唑、对氨基苯甲酸或磺胺醋酰),甲氧苄氨嘧啶-磺胺甲恶唑,喹诺酮(例如,环丙沙星、氧氟沙星或萘啶酸),β-内酰胺类抗生素如青霉素或头孢菌素,氨基糖甙类(例如,卡那霉素、妥布霉素、庆大霉素C、阿米卡星、新霉素、奈替米星、链霉素或万古霉素)、四环素、氯霉素和大环内酯类(例如,红霉素、克拉霉素或阿奇霉素)。合适青霉素的非限制性示例包括青霉素G、青霉素V、甲氧西林、苯唑西林、萘夫西林、氨苄青霉素和阿莫西林。合适头孢菌素的非限制性示例包括先锋霉素、头孢地尼、头孢唑啉、头孢氨苄、头孢羟氨苄(cefadroxal)、头孢羟唑、头孢西丁、头孢克洛、头孢尼西、头孢乐坦(cefoletan)、头孢噻肟、头孢唑肟、头孢曲松钠,头孢托仑和头孢吡肟。用于治疗OM的示例性抗生素包括青霉素如阿莫西林和阿莫西林-克拉维酸基于磺胺类的组合如红霉素-磺胺异恶唑(Pediazole)、甲氧苄氨嘧啶-磺胺甲恶唑大环内酯类/内酯类如阿奇霉素或克拉霉素第二代头孢菌素如头孢克洛头孢丙烯头孢呋辛酯或氯碳头孢和第三代头孢菌素如头孢地尼头孢克肟头孢泊肟酯头孢布烯头孢托仑(SPECTRACEFTM)、和头孢曲松钠
合适的止吐剂包括安其敏、氯丙嗪、赛克利嗪、乘晕宁、苯海拉明、敌芬尼朵、多潘立酮、屈大麻酚、氟哌啶醇、羟嗪、氯苯甲嗪、甲氧氯普胺、大麻隆、昂丹司琼、奋乃静、普鲁氯嗪、异丙嗪、莨菪碱、硫乙拉嗪、三氟丙嗪、和曲美苄胺。示例性抗真菌剂包括两性霉素B、克清诺、克霉唑、氟康唑、氟胞嘧啶、灰黄霉素、酮康唑、咪康唑、和碘化钾。示例性抗炎剂包括醋酸铝、阿司匹林、倍他米松、丁苯羟酸、塞来昔布、地塞米松、双氯芬酸、依托度酸、氟比洛芬、氢化可的松、吲哚美辛、水杨酸镁、萘普生、泼尼松龙、罗非昔布、双水杨酯、苏灵大、和去炎松。示例性合适抗眩晕剂包括颠茄、乘晕宁、苯海拉明、敌芬尼朵、氯苯甲嗪、异丙嗪、和莨菪碱。示例性合适抗病毒剂包括阿昔洛韦、金刚烷胺、地拉韦啶、地达诺新、依法韦仑、膦甲酸钠、更昔洛韦、茚地那韦、奈非那韦、病毒唑、利托那韦、扎西他滨、和齐多夫定。示例性生物反应调节剂包括阿地白介素、干扰素α-2a、干扰素α-2b、干扰素α-n1、干扰素α-n3、干扰素γ和左旋咪唑。示例性细胞毒性药物包括鬼臼毒素和足叶草。示例性免疫剂包括流感病毒疫苗、多价肺炎球菌疫苗和免疫球蛋白。示例性免疫调节剂是干扰素γ。其他适用于发明的药物试剂包括倍他司汀(例如,用于治疗梅尼埃病中出现的恶心、头晕和耳鸣)、普鲁氯嗪和东莨菪碱。
或者或另外,组合物可包括一种或多种下列化合物:溶剂或稀释剂如盐水,生物粘附剂,渗透或穿透增强剂,吸湿剂,耳垢软化剂,防腐剂(例如抗氧化剂)或其他添加剂。这种化合物可以0.01%-99%的量存在于组合物中(例如,0.01-1,0.01-10,0.01-40,0.01-60,0.01-80,0.5-10,0.5-40,0.5-60,0.5-80,1-10,1-40,1-60,1-80,5-10,5-40,5-60,5-80,10-20,10-40,10-60,10-80,20-30,30-40,40-50,50-60,60-70,或70-80%)。例如,组合物可包括一种或多种增粘剂(如F-127和),莫西沙星,和一种或多种渗透或穿透增强剂(如维生素E)。在其他实施方式中,组合物可包括一种或多种增粘剂,莫西沙星,和一种或多种耳垢软化剂。组合物还可包括包括一种或多种增粘剂,莫西沙星,一种或多种吸湿剂,和一种或多种防腐剂。应注意某些试剂可在制剂内履行不同作用。例如,可根据其浓度起增粘剂作用或作为生物粘附剂。维生素E可起渗透或穿透增强剂、防腐剂和抗氧化剂作用。
生物粘附剂有利于组合物附着鼓膜。合适生物粘附剂包括水解胶体如:阿拉伯树胶;琼脂;海藻酸盐(例如,海藻酸和藻酸钠);羧甲基纤维素钠;羧甲基纤维素钙;右旋糖酐;明胶;瓜尔豆胶;肝素;透明质酸;羟乙基纤维素;刺梧桐胶;甲基纤维素;果胶;聚丙烯酸;聚乙二醇;聚-N-乙烯基-2-吡咯烷酮;和黄芪胶。
渗透或穿透增强剂增加鼓膜的渗透性以使其对莫西沙星更透化。示例性渗透或穿透增强剂包括:醇类(例如,乙醇或异丙醇);多元醇(例如,正烷醇、柠檬烯、萜烯、二氧戊环、丙二醇、乙二醇、和甘油);亚砜(例如,二甲亚砜、二甲基甲酰胺、十二烷基甲基亚砜、和二甲基乙酰胺);酯(例如,肉豆蔻酸异丙酯/棕榈酸异丙酯,乙酸乙酯,乙酸丁酯,丙酸甲酯,和辛酸/癸酸三酸甘油酯);酮;酰胺(例如,乙酰胺);油酸盐(例如,三油精);表面活性剂(例如,十二醇硫酸钠);链烷酸(例如,辛酸);内酰胺(例如,氮酮);烷醇(例如,油醇);二烷基氨基乙酸酯;多不饱和脂肪酸(例如,亚麻油酸、α-亚麻酸、和花生四烯酸);油酸;鱼肝油;薄荷醇衍生物(例如,l-薄荷醇);鲨烯;衍生自线性饱和脂肪醇的甘油单乙醚;黄酮(例如,洋甘菊芹菜素、木犀草素、和芹菜素7-O-β-葡萄糖苷);维生素E(α-生育酚)和其酯及类似物;和Senkyu(川芎(Ligustici Chuanxiong Rhizome))醚提取物。
吸湿剂如果糖、邻苯二甲酸和山梨醇,促进液体从中耳跨鼓膜移入凝胶基质。吸湿剂可有助于缓解与中耳积液和增压相关的疼痛,能使中耳内的莫西沙星浓缩成更小液体体积。
耳垢软化剂(例如,多库酯、橄榄油、碳酸氢钠、尿素或过氧化氢)促进鼓膜与组合物间的接触。抗氧化剂如抗坏血酸和苯甲酸或其他防腐剂能用于延长制剂在存储期间的保存期。
将组合物应用于鼓膜的方法
发明组合物可经外耳道应用于鼓膜表皮面,以例如治疗中耳或内耳疾病(如OM)。发明组合物还可预防性应用(例如,用于防止中耳或内耳疾病发展)。组合物可靶向任何鼓膜部分,包括鼓膜下部即紧张部(pars tensa),或鼓膜上部即松弛部(pars flaccida)。成人中,鼓膜直径约为9-10mm,厚度为30-230μm(平均约100μm)。松弛部构成人和动物如猫、豚鼠及南美栗鼠中少于3%的鼓膜面积。在其他哺乳动物(例如,沙鼠、兔、大鼠和小鼠)中,松弛部构成10%-25%的鼓膜面积。薄表皮层(约15-30μm厚)覆盖人鼓膜,而厚表皮层(约75-150μm厚)覆盖其他人体区域。5-10层细胞覆盖松弛部,3-5层细胞覆盖紧张部。因此,紧张部通常比鼓膜其他部分薄,可能对莫西沙星或另一药物试剂渗透性更高。本领域技术人员应理解紧张部的中间部分提供响应声音的主动振动区。
可采用本领域已知任何方法将发明组合物应用于鼓膜。例如,组合物可用流体分配装置应用于鼓膜。分配装置通常具有与导管联接的储器,所述导管直接或间接接受来自储器的可流动组合物并将该组合物导入分配出口。普通技术人员可按常规从连接挠性管的注射器制作简单的分配装置。分配装置还可通过用流体导管取代鼓膜穿刺装置如窥器(美国怀俄明州凯斯普尔的沃尔斯精密仪器公司LLC(Walls Precision Instruments LLC))的针来制作。分配装置可连接气动或诊断耳镜头(例如,来自美国纽约州斯卡尼阿特勒斯市的Welch)以建立将组合物应用于鼓膜的精确平台。
根据组合物和中耳或内耳疾病,可能需要在莫西沙星跨鼓膜转移后从耳中移除该组合物。这可用棉签或镊子手工完成。注射器或球还可用于注射水、盐水或其他生物相容水溶液以软化、溶解和/或排出制剂。在其他实施方式中,组合物可在一段时间后简单地脱离鼓膜并从耳中排出(例如在锻炼或沐浴中)。或者,可生物降解制剂可能不需从耳中移除。
制品
本文所述组合物可联合包装材料并作为制品或药盒出售。熟知生产制品的组分和方法。制品可联合一种或多种本文所述组合物。另外,制品还可包括一种或多种药物试剂、无菌水或盐水、药物载体、缓冲剂或流体分配装置。描述组合物如何递送至耳以治疗内耳或中耳疾病的标注或说明可包括在这类药盒中。组合物可以足以用于单次或多次给药的量并以预包装形式提供。
本发明将通过下列实施例进一步描述,所述实施例不对权利要求所述的发明范围构成限制。
实施例
实施例1-化学品和试剂
盐酸莫西沙星粉末由爱尔康实验室公司(Alcon Labs,Inc.)(德克萨斯州沃思堡市)提供。普朗尼克(Pluronic)F-127、盐酸环丙沙星、牛血清白蛋白、甲酸、肉豆蔻酸异丙酯、和磷酸二氢铵购自西格玛—奥德里奇公司(Sigma-Aldrich,密苏里州圣路易斯)。购买下列化学品并按收到的原样使用:乙腈和甲醇来自博迪克和杰克逊实验室(Burdick and Jackson Laboratories,密歇根州马斯基根)或飞世尔科技(Fisher Scientific,新泽西州费尔劳恩);氯化钠来自马林克罗公司(Mallinckrodt,Inc.,肯塔基州巴黎);磷酸氢二钠七水合物来自美国生化(United States Biochemical,俄亥俄州克利夫兰);磷酸二氢钠来自飞世尔科技(新泽西州费尔劳恩);丙二醇来自明尼苏达大学(明尼苏达州明尼阿波里斯);PEG 4000和PEG 6000来自鲁格化学公司(Ruger Chemical Co,Inc.,新泽西州林登)。溶剂是HPLC级,所有其他化学品是分析级。
实施例2-微透析探针
采用CMA/20微透析探针(马萨诸塞州北切姆斯福德的CMA/微透析公司(CMA/Microdialysis))获得中耳液透析液样品。探针的聚碳酸酯膜具有20,000道尔顿的截留分子量。探针的透析液膜长度为10mm。探针膜的外直径为0.5mm。
实施例3-人工中耳液(AMEF)
咽鼓管阻塞的非感染南美栗鼠中积聚的浆液性中耳液(MEF)体积变化很大。就微透析积累足够MEF的成功率显著低于50%。这是由于需要配制模拟MEF的人工中耳液(AMEF)。对于外耳的凝胶制剂给药,磷酸盐缓冲盐水溶液(PBS,0.015M磷酸盐,pH=7.4)与3%牛血清白蛋白在探针临植入前滴注入南美栗鼠中耳大泡。
实施例4-确认环丙沙星作为莫西沙星的反向透析校准物
环丙沙星是莫西沙星的化学类似物,且两者都是喹诺酮类抗生素。环丙沙星具有与莫西沙星有点类似的物理和化学性质。因此,它选定为潜在的反向透析校准物。AMEF研究的体外同步损失以0.4、0.5、0.6和0.7μl/分钟的灌注流速进行,透析液收集间隔为10分钟。透析液包含1μg/ml的莫西沙星和环丙沙星。通过从整体中减去透析液与灌注液的浓度之比来测定各化合物损失。发现所有4个流速中莫西沙星的体外损失与环丙沙星没有显著差异,确认环丙沙星作为微透析校准物的效用。
实施例5-测定人工和培养南美栗鼠中耳液内的游离(未结合)莫西沙星部分
先前的内部研究显示人工中耳液(AMEF)在滴注入南美栗鼠中耳后18-24小时开始类似天然MEF并支持细菌生长。为了测定游离部分,从前一天滴注AMEF后的中耳收获液体,此液体称为培养中耳液(IMEF)。
通过超滤测定AMEF和IMEF中莫西沙星的蛋白结合。研究在生理温度(37℃)进行,名义浓度为220和492μg/ml。加入的120μl AMEF或IMEF等分溶液置于离心装置(马萨诸塞州贝德福德的密理博公司(Millipore Corporation))的顶部,用Clay Adams Triac 0200吊桶式转头离心机(新泽西州派西派尼市的BD公司(Becton,Dickinson and Company))以2000×g离心15-20分钟。为检测莫西沙星与装置的非特异性结合程度(如果有),在磷酸盐缓冲盐水中加入同一药物浓度并类似MEF等分样品经该装置离心。超滤液中浓度与MEF中总浓度的之比计算为莫西沙星的游离部分。
实施例6-制剂开发
基础制剂
选择F-127(PF-127)作为形成热固性凝胶基底的聚合物。PF-127在较低温度溶于水形成溶液且当温度增加高于溶胶-凝胶转变温度时成胶。PF-127溶液在室温流动很快且遵循其所应用的表面轮廓。研究的初始制剂由溶于水的20%(w/v)PF-127构成。
PF-127溶液由冷法制备。将称取量的PF-127缓慢加入到所需量的冷水(重量)中,温和搅拌并4℃保存过夜以使聚合物充分水合和溶解。
转变温度测定
将少量等分(100-200μl)最终制剂移入微量离心管。然后,管在水浴中室温孵育。水浴温度逐步增加。微量滴定管中凝胶溶液的弯液面在90°或更大角度倾斜时不扭曲,则认为发生凝胶化。发生凝胶化的2个温度值取作转变温度。基础制剂(20%PF-127)的转变温度为22-23℃。最终制剂的目标转变温度为28℃-32℃。
添加剂
测试几个添加剂以评价其对凝胶转变温度和其他性质的影响-这些包括乙醇、丙二醇、聚乙二醇4000(PEG 4000)、PEG 6000、和肉豆蔻酸异丙酯(IPM)。仅发现PEG 6000和乙醇显著提高凝胶基底的转变温度。表1和2显示PEG 6000和乙醇对20%PF-127溶液转变温度的影响。
表1.含不同PEG 6000浓度的20%PF-127溶液的转变温度
表2.含不同浓度醇和2%PEG 4000的20%PF-127溶液的转变温度
还测试更高浓度的PF-127(21和22%),但这些制剂充分水合的时间延长(多至3天)且由于高粘度而难以处理。它们还显示远低于室温的转变温度,22%凝胶加入PEG 6000后转变温度从基础凝胶的零下温度到低于10℃,21%凝胶为23-24℃。
最具前景的基础凝胶制剂表现出23-24℃的转变温度,室温下的良好流动性,且具有以下组成:
PEG 6000 2%(v/w)
丙二醇 20%(v/w)
PF-127 20%(w/w)
将2种水平的盐酸莫西沙星纳入基础凝胶:1和3%(w/w)。1%莫西胶是呈亮黄色的澄清溶液,而3%莫西胶是有白色粉末分散在黄色液体中的精细悬液。2种莫西胶都显示29-31℃的终转变温度。
为制备一批10-ml的1%莫西胶,确立下列过程:
1.向闪烁管中加入5.0ml PEG 6000水溶液(40mg/ml);
2.添加2.0ml丙二醇;
3.缓慢加入100mg盐酸莫西沙星;
4.混合物超声处理3-5分钟;
5.添加1.3ml水;
6.添加2克PF-127;
7.温和涡旋闪烁管以湿润PF-127粉末;
8.混合物在冰箱中过夜保存以完全水合;和
9.充分涡旋溶液待用。
制备3%莫西胶的过程与1%莫西胶基本相同,除了加入300mg盐酸莫西沙星和仅需要1.1ml水。
体外释放研究
研究体外释放莫西沙星的目的是测定从凝胶制剂释放的速度和程度。对于各释放研究,在Hanson Microette设备(加利福尼亚州查茨沃思的汉森研究公司(Hanson Research))中建立弗兰兹扩散池(Franz diffusion cells)。接受室填充有8.0ml释放介质、溶于水的15%PF-127,以250rpm进行磁力搅拌。温度维持于37℃,各弗兰兹池较低部分周围有水循环夹套。纤维素透析膜片(截留分子量=6kD,美国新泽西州Pequannock的Bel-Art制品公司(Bel-Art Products))切成小圆(直径3cm)并置于各接受室顶部。将环形特氟隆(Teflon)盘置于各膜顶部以形成供体室。然后,350μl的各等分莫西沙星凝胶制剂加载入给药室。在密封弗兰兹池前可有5分钟的等待时间以确保凝胶形成完全。样品臂覆盖有薄膜以防止蒸发。在凝胶给予后0.5、1、2、3、4、6、12、24、36、48、60、72、84和96小时从接受室中取出40μl的各样品。样品于-20℃保存直至分析。
体外样品中的莫西沙星浓度由离线HPLC-荧光方法如本文所述测定。向10μl的各等分样品中加入125μl磷酸盐缓冲盐水(PBS)以获得与标准曲线样品相等的体积。然后加入内标(65μl的100μg/ml环丙沙星),然后用流动相稀释到5.0ml终体积。从PBS中1000、100、10和1μg/ml标准母液制备0.05-20.0μg/ml莫西沙星标准样品。在各标准曲线样品中加入65μl内标、10μl 15%PF-127和不同体积的PBS以实现与体外样品等体积,然后用流动相稀释到5.0ml终体积。混合物以高速涡旋30秒。注射体积为50μl。
实施例7-手术
动物
此研究使用390–670g的雄性毛丝鼠(Chinchilla laniger)(俄亥俄州普利茅斯的瑞尔森或明尼苏达州罗切斯特的莫尔顿)。操作方案获得明尼苏达大学机构动物管理及使用委员会(IACUC)的批准。
咽鼓管阻塞(ETO)
ETO过程的目的是防止人工中耳液引流入鼻咽以确保合适液体在微透析期间保持在大泡内。牙胶尖的中间部分(尺寸15,韩国DiaDent国际集团公司(DiaDent Group International Inc.))切成4mm长度并用于阻塞咽鼓管。
ETO手术根据Jossart等所述(Jossart等,1990,Pharm.Res.,7:1242-7)改良进行。简要地,动物用克他命(40-50mg/kg,IM)和戊巴比妥(5-10mg/kg,IP)麻醉。然后在软腭中割出小切口以暴露咽鼓管。各咽鼓管开口用4mm所述尖区段阻塞。手术结束时,切口用组织粘合剂(明尼苏达州圣保罗的3M公司)封闭。
人工中耳液滴注
人工中耳液(AMEF)在微透析探针植入前的给药日滴入各大泡。进入南美栗鼠中耳腔是通过头盖骨背面的向头侧大泡。用15GA 11/2B皮下针(密苏里州圣路易斯的舍伍德医疗公司(Sherwood Medical Company))在骨头较薄的右和左大泡顶部手动钻出小孔。将足量AMEF经一段PE-50管滴注入各大泡,直到其完全填满至顶部。用耳镜检测鼓膜完整性。显示AMEF渗漏到外耳道迹象的耳没有给药。
植入微透析探针
AMEF滴注后立即植入微透析探针。进入南美栗鼠中耳腔是通过向头侧大泡上的同一孔。然后,将CMA/20微透析探针通过孔小心插入各中耳腔。根据Huang等开发的方法(Huang等,2001,J.Pharm.Sci.,90:2088-98)用牙骨质和锚定针固定的塑料冠将探针固定在南美栗鼠头盖骨上。
实施例8-分析方法
在线HPLC-MS-MS分析微透析液中的莫西沙星和环丙沙星
建立在线微透析HPLC-MS-MS系统。微透析灌注流速用配有1-ml、2.5-ml(马萨诸塞州北切姆斯福德的CMA/微透析)或5-ml(内华达州里诺的哈密顿公司(Hamilton Company))微量注射器的哈佛(Harvard)微注射泵(型号22;哈佛仪器公司(Harvard Apparatus Inc.);马萨诸塞州南纳蒂克)控制。将2只耳的微透析液交替收集到序列程序(得克萨斯州休斯敦的瓦尔科仪器公司(Valco Instruments Co.Inc.))控制的10端口阀体的2个10-μl或25-μl样品环内。本研究采用0.5μl/分钟的微透析灌注流速。HPLC柱是YMCM80 4-μm反相柱(2×100mm,4μm,马萨诸塞州米尔福德的沃特斯公司(Waters Corporation))。流动相由溶于水的0.1%甲酸(pH=2.8-2.9,80%v/v)和乙腈(20%v/v)组成,流速为0.1ml/分钟。由于柱性质随着时间变化,使用不同百分比的乙腈(范围为19-25%)来最优化峰形和保留时间而同时维持40℃的柱温。采用岛津10-A HPLC系统(日本京都的岛津公司)与瓦尔科(Valco)在线样品收集系统连接。它由LC-10ADvp泵、SIL-10A系统控制器、CTO-10A柱加热器、FCV-10ALvp比例调节器、和DGU-14A脱气器组成。HPLC流出物进入PE-Sciex API-365三重四极杆MS-MS质谱仪(加拿大安大略省康科德的PE-Sciex仪器公司(Perkin-Elmer Sciex Instruments))的电喷雾离子(Turbo Ionspray)源(400℃,7升/分钟氮)。检测以多重反应监测(MRM)模式进行,对莫西沙星的母产物离子对为402.5–358.2且反向透析校准物环丙沙星为332–288。应用于各实验的浓度范围根据中耳液透析液中观察到的浓度而变化。所用最低标准浓度为0.1μg/ml而最高为118μg/ml。随着标准浓度范围增加,似乎略微呈现非线性,信号增加低于随着浓度增加的成比例增加。为解决此问题,在进行统一重量的线性回归前对信号(峰面积)和标准浓度应用对数转化。
在线HPLC-荧光分析微透析液中的莫西沙星和环丙沙星
为提高产率,开发了另外的在线试验以同时进行多重动物实验以及在设备发生故障时作为备用。此试验包括使用激发波长为295nm和发射波长为490nm的荧光检测。采用YMC ODS-A 5μm,(4.6x 100mm,马萨诸塞州米尔福德的沃特斯公司)柱,流动相组成为磷酸铵(20mM,pH=2.8,76或78%)和乙腈(24或22%)且流速为0.5ml/分钟。采用45℃的柱温以获得莫西沙星7.4分钟的保留时间和环丙沙星3.6分钟。荧光检测器为岛津RF 535(日本京都的岛津公司)或Jasco 821FP(马里兰州伊斯顿的分光公司(Jasco Inc.))。其他在线系统组成和设置与本文所述相同。此分析所用标准浓度范围为0.1-205μg/ml。尽管看来此分析的反应信号没有出现任何非线性,但出于一致性目的在线性回归前进行信号(峰面积)和标准浓度的对数转化以获得斜率和y-截距。
通过在线HPLC-MS-MS和在线HPLC-荧光分析莫西沙星中耳液微透析样品的准确性和精确性
2种用于中耳液微透析液内莫西沙星的分析方法的准确性和精确性从标准曲线回读中评价。在线HPLC-MS-MS分析通常使用6个标准,浓度范围为0.5-100(0.1-118)μg/ml。准确性计算为0.5-50μg/ml范围的96-105%。100μg/ml的准确性为91%,表明此范围的微透析液水平测定略有向下偏差。精确性(%CV)为HPLC-MS-MS标准曲线完整范围的1.1-6.2%。在线HPLC-荧光分析通常使用5或6个标准,浓度范围为0.1-200μg/ml。准确性计算为标准曲线完整范围的98-102%。精确性(%CV)在0.5-200μg/ml范围上为0.3-3.6%,且在0.1μg/ml时为13.3%。
中耳液和体外释放样品中总体及未结合浓度的分析
蛋白结合研究样品和体外释放样品中的莫西沙星浓度用HPLC(日本京都的岛津公司)通过荧光检测测定。组分和色谱条件与本文所述类似。体外释放样品的处理如本文所概括。对于蛋白结合研究样品,使用3种单独的标准曲线;1种用于超滤液和PBS样品且另2种用于通过其各自空白基质测定AMEF和IMEF样品中的总药物浓度。具有所加入PBS、AMEF和IMEF中最高浓度的样品用相应空白基质稀释3倍,来自最高浓度组的超滤液用PBS稀释2倍,然后取50-μl等分样品用于分析。向包括标准样品在内的所有样品加入内标(125μl的10μg/ml环丙沙星)。向各样品加入200μl乙腈以沉淀蛋白。然后涡旋样品并以2000×g离心10分钟,随后将100μl上清加入300μl经过滤20mM磷酸二氢铵,从而终样品类似流动相。使用25μl的注射体积。
实施例9-大泡内给药研究
进行这些研究以确定用于去卷积分析的单位脉冲响应函数。为此,从大泡内丸剂给药研究中估计中耳内初始莫西沙星浓度和半衰期。所有动物在大泡内给药前经历本文所述的咽鼓管阻塞过程。南美栗鼠在剂量给予和植入微透析探针期间用克他命(40-50mg/kg,IM)和戊巴比妥(20-30mg/kg,IP)麻醉,但麻醉恢复用于剩余实验。目标为2种剂量水平。50和150μg莫西沙星的大药丸剂量用本文所述过程在1ml AMEF中直接递送到中耳((n=9只耳)。对4-5个半衰期,用连接HPLC-MS-MS或HPLC-荧光的微透析每20分钟监控各耳(中耳)的未结合莫西沙星浓度,直至给药后845分钟。
实施例10-外耳凝胶制剂给药研究
动物在给药前1天接受双侧咽鼓管阻塞(ETO)手术(除了在给药日进行ETO时的1只动物)。动物在鼓室压测量中显示负压力读数表明咽鼓管阻塞成功。对于在给药日经历ETO的南美栗鼠(#638),绕开鼓室压测量。在AMEF滴注、探针植入后和给药前用耳镜鼓膜检测鼓膜完整性。显示鼓膜受损的耳未给药。
在给药日,动物用克他命(40-50mg/kg,IM)和戊巴比妥(20-30mg/kg,IP)麻醉,置于加热垫上以维持正常体温。鼓室压测量后,南美栗鼠随之置于嘴杆夹上以进行本文所述的AMEF滴注和探针植入。一旦用牙骨质缝合冠,从嘴钳中移出动物并置于其边侧。再次用耳镜确认鼓膜完整性。
用50μl 100%肉豆蔻酸异丙酯(IPM)形式的渗透增强剂预处理鼓膜,使用连接1-ml结核菌素注射器的一段聚乙烯(PE-50)管。PE-50管通过耳镜顶部推进入外耳中并借助耳镜置于鼓膜附近。一旦肉豆蔻酸异丙酯应用于耳,激活定时器并取回PE-50管。包括4个预处理时间,0.5(紧接着肉豆蔻酸异丙酯滴注后)、2、5和20分钟。一旦达到预处理时间,另一段连接填充有凝胶制剂的1-ml结核菌素注射器的PE管(用于1%莫西胶的PE-50和用于3%莫西胶的PE-160)借助耳镜推进到鼓膜附近的外耳道。缓慢应用凝胶制剂,直到其到达耳镜顶部。启动定时器,收回PE管和耳镜,同时温和上拉外耳瓣至少5分钟以允许制剂成胶。放开外耳瓣,在给药对侧耳前允许10分钟的总凝胶时间。持续监控整个过程中的动物心率、呼吸率、体温和麻醉深度。
一旦完成任一耳或两耳给药,在动物上固定伊丽莎白项圈,然后将其置于自由移动的动物饲养设备系统(印第安纳州西拉法叶的BAS公司(Bioanalytical Systems,Inc.))并可从麻醉中完全恢复。每20分钟从各耳中收集中耳液微透析液样品并在线注射以用于HPLC-MS-MS系统或HPLC-荧光系统分析。动物在整个实验持续期间可自由获取食物和水。每10-14小时提供丁丙诺啡(0.05mg/kg IM)和皮下补液(6mL正常盐水)。在用1%莫西胶给药外耳后多至5375分钟和3%莫西胶给药后多至6180分钟监控中耳液微透析液的莫西沙星浓度。
实施例11-数据分析
就探针回收和滞后时间校正中耳液微透析液浓度
根据连接微透析探针与样品环的管长度和微透析灌注流速,估计滞后时间。该值代表从探针顶部到样品收集环的透析液转变时间。滞后时间通常为约45分钟。实际样品时间是10分钟收集间隔的中点,就滞后时间校正并四舍五入到最接近的5分钟。
对各透析液样品,通过从整体中减去透析液与灌注液的校准物峰面积之比来测定探针回收。为减少实验进程中的误差和反映探针性质变化,使用移动平均数为5的估值来校正探针回收而不是“点对点”校正方法。为获得实际中耳液药物浓度,各透析液的莫西沙星浓度除以平均探针回收。
大泡内给药后中耳液内的莫西沙星浓度-时间数据
根据单指数型下降分析九(9)个数据集中每一个的莫西沙星中耳液水平,其中初始体积和消除率常数是估计的参数。采用非线性回归分析(SAAM II,v1.2.1,华盛顿州西雅图的华盛顿大学)鉴定单房室模型的参数。假定变化系数为5%的权重函数和选定方差模型与数据相关,而不是拟合函数。
外耳给药1%和3%莫西沙星(莫西胶)制剂后中耳液的莫西沙星浓度分析
检验数据包括仔细分析中耳液浓度远高于预期的数据集。有确定性证据表明结果来自受损耳鼓膜时,该数据集从进一步分析中排除。有23个用于1%莫西胶应用的可用数据集和用于3%莫西胶应用的13个数据集。莫西沙星中耳液浓度-时间数据及时调整到最近的10分钟以对数据分箱(bin)用于随后非房室分析和去卷积过程。此“分箱”步骤需要从实际时间到标定时间调整不超过10分钟。
各中耳液浓度数据集的非房室分析用WinNonlin Professional(v 5.2,加利福尼亚州山景城的Pharsight公司(Pharsight Corporation))进行。选择血管外给药(型号200),以及线性梯形和线性插值选项。选择有对数回归和均匀加权的“λ_z最佳拟合”(终端速度常数)选项。从外耳剂量的各数据集、时间0到无穷大(AUCinf)的曲线下面积和大泡内给药研究测定的中耳液平均消除(CL)来计算莫西沙星进入中耳液的程度(生物利用度,%F):
去卷积在WinNonlin Professional(v 5.2,加利福尼亚州山景城的Pharsight公司)内进行以测定输入函数(莫西沙星渗透入中耳液的速度),其中用测定自大泡内给药数据分析的平均分布体积和平均消除率常数定义二项分布单位脉冲响应函数。未配对t检验显示2种大泡内剂量水平的体积和速度常数参数没有显著差异。
实施例12-从1%和3%莫西胶体外释放莫西沙星
图1显示释放自凝胶制剂的莫西沙星累积百分比图,参考凝胶中莫西沙星测定浓度表示。在中等初始释放速率后,2种制剂都显示在约2-6小时体外产生最大释放率。释放速率之后缓慢下降。
数据插值显示1%莫西胶在5小时释放其约50%含量,9.5小时释放75%,16小时释放90%。1%莫西胶制剂观察到的最大释放速率为约每小时12%,对应于500μl制剂的约9.4μg/分钟释放速率,500μl是用1%莫西胶给药外耳的典型凝胶体积。
3%莫西胶在7.5小时释放其约50%含量,15小时释放75%,26小时释放90%。3%莫西胶制剂观察到的最大释放速率为约每小时9.1%,对应于350μl制剂的约15μg/分钟释放速率,350μl是用3%莫西胶给药外耳的典型凝胶体积。
尽管3%莫西胶制剂显示的莫西沙星绝对释放速率体外高于1%莫西胶,3%莫西胶部分释放速率较慢可能是由于部分剂量存在于悬液中,因此在从凝胶中释放前需要一些时间溶解。
实施例13-人工和培养中耳液内的莫西沙星游离部分
表3概括了蛋白结合研究的结果。PBS观察到的游离部分都接近100%,表明很少或没有药物吸附到超滤装置的膜上。对于AMEF,整个浓度范围中计算出很高的未结合百分比(84-92%),表明莫西沙星与牛血清白蛋白结合最少。IMEF中,莫西沙星游离部分低于类似浓度AMEF中观察到的游离部分,表明此基质中存在另一种结合蛋白。
总体上,莫西沙星游离部分在测试浓度范围中保持相对较高。因此,微透析测量的药物浓度代表中耳液内存在的大部分总莫西沙星水平。给药后头几个小时中,样品基质很类似AMEF。随着实验时间接近18或更多小时,预期样品基质优于IMEF所示。根据表3所示结果,2种基质的游离部分间有显著差异。然而,此差异不太可能对解释MEF微透析数据产生任何有意义的影响。
表3.培养中耳液(IMEF)、人工中耳液(AMEF)和磷酸盐缓冲盐水(PBS)中的未结合莫西沙星百分比
实施例14-大泡内给药后的中耳液莫西沙星浓度
图2和3显示微透析测定的在以约50和150μg直接给药到中耳后的未结合中耳液莫西沙星浓度(Cmef)图。中耳液莫西沙星浓度单指数型下降,显示相对适度的个体间变化。这些浓度-时间概况用于定义跨鼓膜递送后Cmef数据去卷积分析中的单位脉冲响应函数(UIRF)。中耳液的莫西沙星分布体积对低和高大泡内剂量分别估计为1.75±0.79和1.90±0.43ml(均值±SD)。消除率常数分别估计为0.0102±0.0040和0.0075±0.0010分钟-1。体积或消除率常数都不是剂量依赖性。因此,这2种参数的平均值用于定义去卷积过程中的UIRF。
实施例15-用1%和3%莫西胶给药外耳后的中耳液莫西沙星浓度
用1%莫西胶给药外耳
图4A和4B显示组内用1%莫西胶给药外耳后的中耳液莫西沙星浓度(Cmef)图。获得给药后多至4天(5375分钟)的可测量水平。用IPM(0.5、2、5或20分钟)预处理时间长度对这些研究中测定的Cmax或AUCinf值没有影响。
这些数据表示为图5中线性和对数浓度图尺上的均值±SD。最大平均莫西沙星浓度为约48μg/ml,在给药后约900分钟(15小时)出现。10μg/ml的平均浓度在约90分钟达到并保持高于该水平直到给药后约2100分钟(35小时)。20μg/ml的平均浓度在约230分钟达到并保持高于该水平直到给药后约1610分钟(27小时)。
表4概括了未结合(游离)中耳液浓度-时间数据的非房室分析结果。观察到Cmax和终末速度常数λz的显著变化。后一个参数描述Cmef下降的部分速率,反映莫西沙星进入和离开中耳的限速步骤。在此,限速步骤是抗生素跨鼓膜的渗透速度。这很明显,因为大泡内给药研究测定的与从中耳液清除相关的平均速度常数为0.008-0.010分钟-1,显著高于此处测定的0.0043的平均值。
表4.用1%莫西胶给药外耳后Cmef数据的NCA的莫西沙星参数(N=23)
未结合Cmef的最大平均值为57.8μg/ml,是人口服给药400mg后血浆中观察到的(2.0μg/ml)20-30倍(Owens&Ambrose,2002,Pharmacodynamics of Quinolones(《喹诺酮类药效学》),收录于“Antimicrobial Pharmacodynamics in Theory and Clinical Practice(《抗微生物药效学的理论和临床实践》),第162页,Nightingale,Marakawa和Ambrose编,巴塞尔城市州巴塞尔的马塞尔,德克尔公司(Marcel Dekker))。莫西沙星从1%莫西胶到中耳液内的生物利用度(%F)如等式1所述计算。
表5概括了Cmef达到、低于和持续高于10μg/ml所需的时间。用1%莫西胶给药后通过检验各数据集获得列表值(N=23)。Cmef水平保持高于10μg/ml的平均时间超过1700分钟(约29小时)。
表5A.用1%莫西胶给药外耳后达到、低于和大于10μg/ml的时间
表5B概括了Cmef达到、低于和持续高于20μg/ml所需的时间。用1%莫西胶给药后通过检验各数据集获得列表值(N=23)。Cmef水平保持高于20μg/ml的平均时间超过1100分钟(约19小时)。2个数据集的Cmef未上升到20μg/ml,使2个数据集的“高于20μg/ml时间”产生0分钟值。
表5B.用1%莫西胶给药外耳后达到、低于和大于20μg/ml的时间
用3%莫西胶给药外耳
图6显示各组用3%莫西胶给药外耳后的中耳液莫西沙星浓度(Cmef)图。获得给药后多至4天(6180分钟)的可测量水平。如1%莫西胶给药数据的情况,用IPM预处理时间长度对这些研究测定的Cmax或AUCinf没有影响。
这些数据表示为图7中线性和对数浓度图尺上的均值±SD。最大平均莫西沙星浓度为约120μg/ml,在给药后约1300分钟(22小时)出现。10μg/ml的平均浓度在约60分钟达到并在给药后整个研究期间(500分钟)保持高于该水平。20μg/ml的平均浓度在约230分钟达到并保持高于该水平直到约5340分钟(89小时)。由于仅2个数据集显示57小时后的可检测水平,此观察剂量不反映数据整体趋势。
表6概括了外耳给药3%莫西胶后未结合中耳液浓度-时间数据的非房室分析结果。
表6.用3%莫西胶给药外耳后Cmef数据的NCA的莫西沙星参数(N=13)
如用1%莫西胶,观察到Cmax和终末速度常数λz的显著变化。此速度常数的平均值为0.0029分钟-1,显著低于大泡内给药后测定的消除率常数。这对应于约350分钟的几何平均半衰期,远高于莫西沙星直接给药到中耳液时观察到的消除半衰期。显然如1%莫西胶研究的情况,莫西沙星跨鼓膜渗透限制从中耳液消失的速度。外耳给药到中耳液的平均生物利用度为约35%,但可大幅变化。这可能是由于凝胶与鼓膜接触的可变性,也许部分缘自凝胶与膜接触不足。尽管有此%F变化,该研究中观察到很高的最大中耳液莫西沙星浓度,平均为130μg/ml。确实,显示2.9%生物利用度的数据集表现出27.7μg/ml的Cmax,比400mg莫西沙星口服剂量后通常观察到的最大未结合血浆浓度高10倍以上(Owens等,同上)。
表7A概括了Cmef达到、低于和持续高于10μg/ml所需的时间。用3%莫西胶给药后通过检验各数据集获得列表值(N=13)。Cmef水平保持高于10μg/ml的平均时间超过2800分钟(约48小时)。
表7A.用3%莫西胶给药外耳后达到、低于和大于10μg/ml的时间
表7B概括了Cmef达到、低于和持续高于20μg/ml所需的时间。用3%莫西胶给药后通过检验各数据集获得列表值(N=13)。Cmef水平保持高于20μg/ml的平均时间超过2500分钟(约42小时)。
表7B.用3%莫西胶给药外耳后达到、低于和大于20μg/ml的时间
实施例16-用1%和3%莫西胶给药外耳后的莫西沙星比较度量
图8提供了用1%和3%莫西胶给药外耳后中耳液浓度(Cmef)-时间概况的比较,其绘出中耳液莫西沙星浓度相对时间的均值和SD。由于引入外耳的各制剂体积不同(对1%莫西胶和3%莫西胶分别平均为约500和350μl),3%莫西胶组中置于外耳的剂量平均约为1%莫西胶组的2倍(9900相较4800μg)。另外,3%莫西胶组的渗透时程显著延长,可能是由于其莫西沙星相对释放速度较慢(见图1)。这些剂量和释放速度的差异在图8中明显,证明3%莫西胶组的平均Cmax值较高且达到最大平均Cmef值的时间明显较晚。
这2种制剂观察到的中耳液莫西沙星水平的Cmax和Tmax值比较示于图9的对比盒须图。这些图显示这些度量的中值和四分位范围。这些图还表明尽管2种制剂的Tmax中值(1%莫西胶和3%莫西胶分别为900与1180分钟)通过非参数曼怀特尼检验没有不同,但Cmax中值差异显著(1%莫西胶和3%莫西胶分别为41.2与109μg/ml),p值为0.0084。
实施例17-莫西沙星渗透到中耳液的速度和程度
使用大泡内给药研究结果和外耳给药莫西胶后的Cmef时程,去卷积用于计算莫西沙星跨鼓膜渗透的速度和程度。
用1%莫西胶的莫西沙星渗透入中耳液
图10显示外耳给药1%莫西胶后累积量的莫西沙星到达中耳液的时程。递送到中耳液的累积量范围为约250-2300μg,此范围反映用1%莫西胶给药观察到的AUCinf值范围。
对应的渗透率(输入率)也由去卷积计算,在图11A和11B中分组图示。样条函数与各组拟合以反映该数据集组的输入率总体趋势。这用局部加权回归散点平滑法完成,过程中采用10个数据点的跨度。检验图11A和11B的样条表明莫西沙星到中耳液的最大渗透率范围为约0.2-2μg/分钟,显著低于体外条件下相当剂量1%莫西胶估计的相应释放速度(9.4μg/分钟)。这些最大渗透率大致对应于约12-120μg/小时的体内莫西沙星递送速度。
用3%莫西胶的莫西沙星渗透入中耳液
图12显示外耳给药3%莫西胶后累积量的莫西沙星到达中耳液的时程。递送到中耳液的累积量范围为约200-6000μg,这反映用3%莫西胶给药观察到的AUCinf值范围。
由去卷积计算的对应渗透率(输入率)在图13中分组图示。还显示了拟合各组的样条函数,反映了这些数据中输入率的总体趋势。检验图13的样条表明莫西沙星到中耳液的最大渗透率范围为约0.5-5μg/分钟,显著低于就体外条件下相当剂量3%莫西胶估计的相应释放速度(15μg/分钟)。这些最大渗透率大致对应于约30-300μg/小时的体内莫西沙星递送速度。
用1%莫西胶和3%莫西胶的莫西沙星到中耳液的比较渗透率
由各1%莫西胶和3%莫西胶数据集(N=36)通过去卷积估计的渗透率(输入率)通过上述样条函数与数据拟合,根据剂量分组。数据和对应输入率样条在图14中以图形表示。这些图显示1%莫西胶的通常最大渗透(输入)率为约0.7μg/ml,在约700-800分钟出现(约12-13小时)。3%莫西胶的对应最大渗透率为约2μg/分钟,在1600-2000分钟出现(约27-33小时)。用3%莫西胶发现的较高最大输入率与此制剂相关剂量较高相一致。应注意用1%莫西胶的通常外耳剂量为约4800μg,用3%莫西胶的对应剂量为约9900μg,其通常以较小体积给予。因此,与3%莫西胶相关的剂量约为1%莫西胶的2倍。用3%莫西胶观察到的稍后峰值渗透率反映莫西沙星体内且可能体外从此制剂释放更慢,因为它部分悬于3%凝胶制剂。
实施例18-达到和持续高于中耳液目标莫西沙星浓度的时间
此研究的具体目标是开发跨鼓膜递送系统以在最少24-48小时内维持中耳液莫西沙星浓度高于10μg/ml。图15显示研究中发现的达到10和20μg/ml所需时间中值和四分位范围,所述实验包括外耳给药1%莫西胶。获得10和20μg/ml中耳液水平所需的时间中值分别为180和300分钟。图还显示维持这些水平的时间中值。这些分别为1660和1160分钟,或约28和19小时。因此,看来用1%莫西胶制剂符合此目标。
另外,图16显示3%莫西胶研究观察到的达到10和20μg/ml所需时间中值和四分位范围。获得10和20μg/ml中耳液水平所需的时间中值分别为180和240分钟。图还显示维持这些水平的时间中值。这些分别为2740h和2420分钟,或约46和40小时。上述有关持续高于10μg/ml的目标用3%莫西胶制剂也达到。另外,尽管未明确定为目标,3%莫西胶制剂提供几乎2天的高于20μg/ml持续时间中值。此制剂看来包括悬液以及溶液中的莫西沙星,可能提供延长的体内释放速度,与其体外较慢相对释放速度一致。
图15和16所示1%莫西胶和3%莫西胶的时间和持续时间分别概括于表8A和8B以及表9A和9B。还列出个体数据集中观察到的平均时间以及最小和最大时间。
表8A.用1%莫西胶给药外耳后达到、低于和大于10μg/ml的时间
表8B.用1%莫西胶给药外耳后达到、低于和大于20μg/ml的时间
表9A.用3%莫西胶给药外耳后达到、低于和大于10μg/ml的时间
表9B.用3%莫西胶给药外耳后达到、低于和大于20μg/ml的时间
实施例19-1%和3%莫西胶外耳给药后的莫西沙星AUIC比率
提出氟喹诺酮的3个重要折点,与Schentag等(2003,Ann.Pharmacother.,37:1287-98)的杀菌率相关联。根据此类抗生素的表观浓度依赖性杀死确立体外和动物模型中的这些折点。AUIC定义为24小时的曲线下面积(血浆或血清浓度),除以所测试氟喹诺酮对特定生物体的最小抑菌浓度。Schentag等(同上)报导了氟喹诺酮的以下折点:
a. AUIC值<30–50或峰值时:MIC比率范围为5:1,氟喹诺酮抑制细菌。
b. AUIC值>100但<250时以较慢速度杀死生物体,通常在治疗第7天
c. AUIC>250或峰值:MIC为25:1时,氟喹诺酮显示快速浓度依赖性杀死,且细菌清除在24小时内发生。
对外耳给药后各连续24小时段计算1%莫西胶和3%莫西胶研究中所有数据集的AUIC值。这些计算假定莫西沙星的MIC为0.25μg/ml。1%莫西胶给药(N=23)后中耳液的AUIC中值在第1、2和3天分别为2398、7756和62,如图17所示。对于第1天和第2天,1%莫西胶的这些值落在上面鉴定的c类内,即细菌在24小时内消除。第3天1%莫西胶研究测定的AUIC中值在b和a类之间。
3%莫西胶给药(N=13)后中耳液的AUIC中值在第1、2和3天分别为5930、4901和570,如图17所示。对于外耳给药后的所有3天,3%莫西胶的这些值落在上面鉴定的c类内,即细菌在24小时内消除。此发现表明用3%莫西胶后南美栗鼠中耳液的莫西沙星浓度时程会提供相对应用1%莫西胶观察到的实际优点。然而,如果Schentag等的推荐正确,外耳给药1%莫西胶产生的莫西沙星水平可能合适,因为第1天和第2天的相关AUIC看来足以在24小时内引起细菌消除。
上面AUIC计算中0.25μg/ml的莫西沙星MIC是合理的,且也许是保守的。在随后的论文中,Schentag等(2003,Ann.Pharmacotherap.,37:1478-88)聚焦于使用折点评价氟喹诺酮的抑菌效果,报导了针对中耳炎中遇到的常见病原体肺炎链球菌(S.pneumoniae)菌株的莫西沙星的MIC90为0.125μg/ml。令人感兴趣的是,此发表物检测人临床试验的结果并确认先前报导的折点。实际上,作者阐述氟喹诺酮的浓度依赖性杀菌在1-2小时内引起人中的细菌消除,其中AUIC高于250,或Cmax与MIC之比是超过15:1。
这些公开的折点看来不考虑蛋白结合。目前研究中的测量中耳液浓度是未结合水平,且如果总水平用于计算产生的AUIC,则这些会稍高一点,更坚定地将它们放入c类-其中氟喹诺酮显示快速浓度依赖性杀死且细菌清除在24小时内发生。
实施例20-1%莫西胶和3%莫西胶外耳给药后的莫西沙星Cmax/MIC之比
上面实施例19讨论的折点还包括涉及Cmax/MIC(“峰值:MIC”)之比的标准。聚焦上面a和c类的这些比率,Schentag等(2003,Ann.Ann.Pharmacother.,37:1287-98)阐明:
a.峰值:MIC之比在5:1范围内时,氟喹诺酮抑制细菌。
c.峰值:MIC为25:1时,氟喹诺酮显示快速浓度依赖性杀死,且细菌清除在24小时内发生。
所述折点在第二发表物(Schentag等,2003,Ann.Pharmacotherap.,37:1478-88)中略有修改,报导a、b和c类的Cmax/MIC之比分别为3:1、6:1和15:1。对外耳给药后各连续24小时段计算1%莫西胶和3%莫西胶研究中所有数据集的Cmax/MIC。这些计算依然如前假定莫西沙星的MIC为0.25μg/ml。1%莫西胶给药(N=23)后中耳液的Cmax/MIC中值为165:1,如图18所示。此值数倍于鉴定为c类的值(或者报导为25:1或15:1),c类中预期细菌在24小时内清除。
3%莫西胶给药(N=13)后中耳液的Cmax/MIC中值为436:1,如图18所示。此值比鉴定为c类的值高许多倍,再次表明细菌在24小时内清除。
如上所示,公开的折点不考虑蛋白结合。目前研究中测量的中耳液浓度是未结合水平,且如果用总水平计算所报导折点中考虑的Cmax/MIC之比,则这些比率会稍高一点,更坚定地将它们放入c类,其中氟喹诺酮显示快速浓度依赖性杀死,细菌清除在24小时内发生。
实施例21-比较10%与50%渗透增强剂预处理的方法
动物在给药前1天接受双侧咽鼓管阻塞的(ETO)手术。耳在鼓室压测量中显示负压力读数表明咽鼓管阻塞成功。在人工中耳液(AMEF)滴注入大泡、探针植入后和给药前用耳镜鼓膜检测鼓膜完整性。显示鼓膜受损的耳未给药。
在给药日,动物用克他命(40-50mg/kg,IM)和戊巴比妥(20-30mg/kg,IP)麻醉,置于加热垫上以维持正常体温。鼓室压测量后,南美栗鼠置于嘴杆/钳以进行AMEF滴注和微透析探针植入。进入南美栗鼠中耳腔是通过头盖骨背面的向头侧大泡。用15GA皮下注射针在骨头较薄的右和左大泡顶部手动钻出小孔。将AMEF经一段PE-50管滴注入各大泡,直到其完全填满至顶部。
AMEF滴注后立即在左和右中耳大泡都植入有10mm膜的微透析探针(MD-2310)(印第安纳州西拉法叶的BASi公司)。进入南美栗鼠中耳腔是通过向头侧大泡上的同一孔。将探针通过检查孔小心插入各中耳腔。用耳镜检测鼓膜的完整性。用牙骨质和锚定针固定的塑料冠将探针固定在南美栗鼠头盖骨上。
在上述3%莫西胶溶液给药到外耳前,用溶于矿物油的10%或50%v/v肉豆蔻酸异丙酯(IPM)溶液形式的渗透增强剂进行预处理。这由借助耳镜通过外耳将50μL预处理溶液应用到鼓膜区域组成。这用连接1-ml结核菌素注射器的一段聚乙烯(PE-50)管完成。允许预处理溶液在给药前停留于鼓膜0.5分钟。
小体积(0.3mL)3%莫西沙星制剂借助耳镜通过外耳以液体滴注入鼓膜区域。溶胶-凝胶转变温度约为29-31℃的液体制剂随着其温度缓慢提升而成胶。给药对侧耳前可有10分钟的总凝胶时间。持续监控整个过程中的动物心率、呼吸率、体温和麻醉深度。
单次应用9mg剂量(0.3mL制剂,含有30mg/mL)后,如下所述用在线微透析监控给药后多至7200分钟的中耳液内未结合莫西沙星浓度。
采用在线微透析HPLC系统定量透析液中的莫西沙星和环丙沙星。微透析灌注流速用配有5-ml(内华达州里诺的哈密顿公司)微量注射器的哈佛微注射泵(型号H11;哈佛仪器公司;马萨诸塞州南纳蒂克)控制。将2只耳的微透析液交替收集到序列程序(得克萨斯州休斯敦的瓦尔科仪器公司)控制的10端口阀体的2个25-μl样品环内。探针用反向透析校准物(环丙沙星,PBS中5μg/mL)灌注,流速为0.5μL/分钟。
采用岛津10-A HPLC系统(日本京都的岛津公司)与瓦尔科在线样品收集系统连接。它由LC-10ADvp泵、SIL-10A系统控制器、CTO-10A柱加热器、FCV-10ALvp比例调节器、和DGU-14A脱气器组成。还使用激发波长为295nm和发射波长为490nm的岛津荧光光谱检测器(RF-10A)。采用YMC ODS-A5μm,(4.6x 100mm,马萨诸塞州米尔福德的沃特斯公司)柱分离化合物,用76%磷酸铵(20mM,pH=2.8)和24%乙腈构成的流动相洗脱,流速为0.5ml/分钟。40℃的柱温产生约6分钟的莫西沙星保留时间且校准物环丙沙星为3分钟。
实施例22-10%渗透增强剂与50%渗透增强剂预处理的比较结果
鼓膜用10%IPM预处理下外耳给药3%莫西胶后,中耳液中未结合莫西沙星浓度(Cmef)通常低于定量限度。鉴于预处理采用10%IPM时观察到极少的可检测水平,不能计算涉及莫西沙星递送的参数。
相反,鼓膜用50%IPM预处理下外耳给药3%莫西胶后,中耳液的未结合莫西沙星浓度在多至7200分钟或5天阶段完全可测量。在研究的9只耳中,中耳液的Cmax(最大未结合莫西沙星浓度)(均值±SD)为33.3±23.3μg/mL。据报导在人中30%-50%结合血清蛋白的莫西沙星在400mg口服剂量后显示血浆中观察到3.1μg/mL总(结合加上游离)最大浓度。血浆中的对应未结合Cmax为约1.9μg/mL。因此,本研究中单次给药9mg到外耳后南美栗鼠中耳液内观察到的未结合莫西沙星平均最大浓度约为接受400mg剂量人血浆中所观察平均未结合Cmax的约15-20倍。
观察到最大浓度的时间Tmax为1410±486分钟。0到结束时间(tlast)的AUC为约74,400±52,100μg-分钟/mL,0到无穷大AUC(AUC inf)为约93,400±79,200μg-分钟/mL。接受单次400mg口服剂量的健康人的平均AUC报导为2170μg-分钟/mL。相应未结合AUC约为该值的60%,或约1300μg-分钟/mL。因此,单次9mg给药南美栗鼠外耳后中耳液与未结合莫西沙星水平的平均接触约为接受单次400mg莫西沙星口服剂量的健康人血浆所见的75倍。
在直接给药莫西沙星到中耳腔(大泡内给药)后,用微透析测量的单指数浓度-时间概况计算跨鼓膜递送莫西沙星到中耳液中的程度。中耳液中莫西沙星分布体积估计为1.8mL。消除率常数估计为0.0093分钟-1。因此,中耳液的平均莫西沙星清除(CL)计算为0.0167mL/分钟。从外耳剂量的各数据集、时间0到无穷大(AUCinf)的曲线下面积和大泡内给药研究测定的中耳液平均消除(CL)来计算莫西沙星进入中耳液的递送程度(生物利用度,%F):
递送到中耳腔的外耳剂量部分(均值±SD)测定为17.4±14.7%。
检测9mg莫西沙星剂量和50%肉豆蔻酸异丙酯预处理鼓膜后莫西沙星跨鼓膜递送到南美栗鼠中耳液(MEF)的本研究结果示于图19A和19B。对应参数和度量示于表10。
表10.渗透增强剂预处理后的莫西沙星递送
其他实施方式
应理解虽然本发明结合其详细描述来阐明,以上描述意在说明而非限制发明范围,所述发明范围由所附权利要求范围定义。其他方面、优点和改良在下列权利要求范围内。
- 还没有人留言评论。精彩留言会获得点赞!