蛋白质缀合物的制作方法
本发明的领域是蛋白质缀合物及其制备方法。
背景技术:
蛋白质缀合物可用于多种情况,并且复杂性增加的生物治疗性化合物的鉴定和开发已提高了对用于制备这类化合物的有吸引力的方法的关注。由于蛋白质不像传统化学部分那样稳定,并且传统反应化学通常不能在不损害蛋白质的情况下应用,因此连接两个或更多个蛋白质出现了困难。
已通过多种方法获得蛋白质与改性剂的缀合,这些方法连接多种氨基酸残基,如N-末端、C-末端和内部氨基酸残基,如Cys、Lys、Gln和Ser,这些氨基酸残基可与例如置于改性剂末端的多种反应性基团发生反应。
传统上,已通过表达可能经由肽连接体连接的融合蛋白而重组地连接蛋白质。这一策略可导致非常大的蛋白质分子的表达,这可能遭遇生产问题,并因此限制可有效生产的化合物的范围。
关于融合蛋白的替代物,WO2005001025还描述了天然连接,例如,硫酯与N-末端半胱氨酸的连接,从而导致酰胺键形成。这种连接也局限于蛋白质的N-末端。
已利用二卤亚甲基-苯、叠氮化物与乙炔单元之间的‘点击’化学以及如WO201001196中所述在末端具有丙醛的PEG连接体研究了蛋白质的化学连接。
需要进一步研究连接技术来扩大可容易且有效地生产的化合物形式的范围。
技术实现要素:
本发明涉及蛋白质缀合物以及制备这类缀合物的方法。该方法可用于以有序且区域选择性的方式共价连接两个或更多个蛋白质。所述蛋白质缀合物可包含一个或多个治疗性蛋白质以及一个或多个效应蛋白质。本发明提供借助于硫醇反应性连接体实现蛋白质-蛋白质缀合的有效方法。通过利用例如具有不同离去基团的卤乙酰胺,可以控制反应物的连接并获得经由一个或多个硫醇-醚的连接。
这类缀合物的实例为:
如本文所示,已成功地利用所述方法形成了Fc-缀合物。Fc结构域具有两个Fc多肽,并且通过利用三价连接体,Fc结构域可经由两个半胱氨酸残基与感兴趣的蛋白质共价键合,例如,在通用结构中代表两个单独蛋白质的每个Fc多肽中有一个半胱氨酸残基。
本发明的一方面涉及蛋白质-连接体-Fc缀合物,其包含连接体与Fc结构域的每个多肽之间的共价连接。
因此,本发明涉及具有以下结构的化合物
与Fc多肽的连接是经由来源于Fc多肽中的半胱氨酸残基的硫原子(-S-)。
连接体为化学部分,蛋白质1因而经由该连接体和硫原子与蛋白质2和蛋白质3共价连接。
本发明的一方面涉及如本文所用的用于制备多种蛋白质缀合物的三价连接体。在实施方案中,该连接体包含被称为-U=的中心单元,该中心单元具有至少三个键合机会。该连接体的其他特征为连接中心单元与反应性末端(R1-R3)的间隔区元件1-3(S1-S3),所述间隔区元件用来实现连接体与蛋白质的缀合。
在一个实施方案中,所述三价连接体具有结构:
其中U表示中心单元,
S1、S2和S3表示单独的间隔区,且
R1、R2和R3分别表示反应性末端。
本文提供的实例显示,氮原子是合适的中心单元,并且硫醇反应性末端适合于连接至待缀合的一种或多种蛋白质中的游离半胱氨酸。
本发明的一方面涉及用于制备蛋白质缀合物的方法,其中至少两个蛋白质有待缀合。利用具有两个不同反应性末端的连接体使得能够实现有序反应过程,从而提高特异性、纯度和/或产率。在一个实施方案中,连接体的反应性末端具有两个卤乙酰胺,这两个卤乙酰胺具有不同的卤素,从而提供具有不同反应性的反应性末端。在第一个缀合步骤之后,缀合物中间体可与2个(或3个)蛋白质反应。如果将卤乙酰胺的一个卤素由Cl换成I,则该方法的效率会提高。可利用该方法缀合两个或更多个蛋白质,并且如果这些蛋白质中有两个是相同的且将要同时与连接体缀合,则也可利用该方法。
本发明的实施方案涉及用于制备蛋白质缀合物的方法,其中蛋白质1-SH、蛋白质2-SH和硫醇反应性连接体偶联在一起,获得了式II的蛋白质缀合物
蛋白质1-S-CH2-C(=O)-NH-连接体-NH-C(=O)-CH2-S-蛋白质2
(式II)
其中该硫醇反应性连接体具有结构:
LG1-CH2-C(=O)-NH-连接体-NH-C(=O)-CH2-LG2,
其中LG1具有高于LG2的反应性,
该方法包括以下步骤:
a)使蛋白质1-SH与所述连接体的-NH-C(=O)-CH2-LG1反应
b)获得缀合物中间体:蛋白质1-S-CH2-C(=O)-NH-连接体-NH-C(=O)-CH2-LG2
c)进行离去基团交换反应,以提高LG2的反应性
d)使c)的中间体与蛋白质2-SH反应
e)获得所述蛋白质缀合物。
从本文的公开内容中可预见,所公开的方法、连接体和化合物可具有多种用途,如在治疗性产品的开发中使用。
附图说明
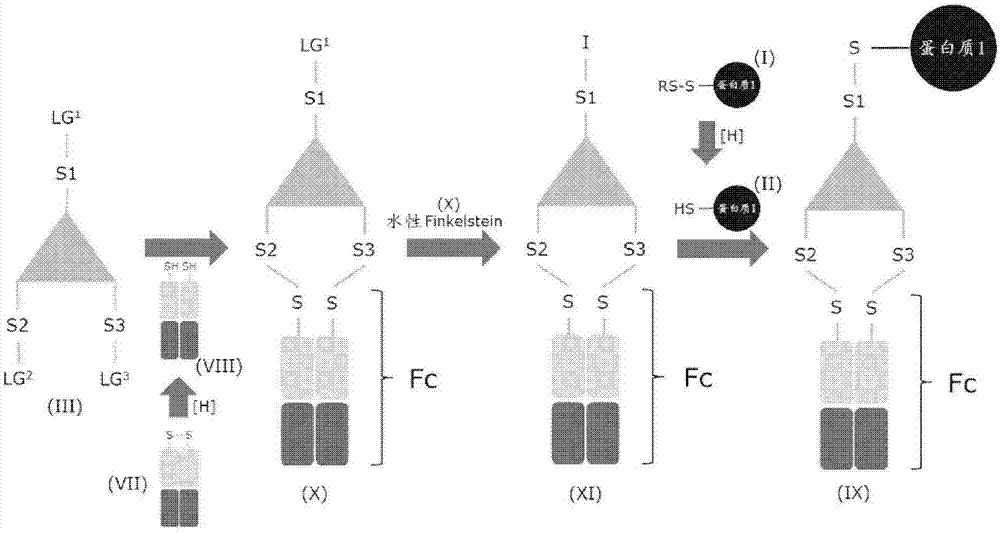
图1显示了根据本发明的蛋白质与Fc缀合的示意图。三价连接体包含中心单元(此处用三角形示出)、独立的间隔区元件S1、S2和S3以及离去基团LG1、LG2和LG3。所述方法描述如下:
1)任选地还原待缀合的蛋白质的混合二硫化物(I),获得具有游离Cys(-SH)的蛋白质(II)
2)用三价连接体(III)对游离Cys(-SH)(II)进行烷基化,得到Cys缀合的蛋白质连接体中间体缀合物(IV)
3)经由水性Finkelstein碘交换反应(V)激活缀合物中间体(IV)的离去基团LG2和LG3,得到碘活化的缀合物中间体(VI)
4)选择性还原Fc结构域二硫键(VII),得到具有两个还原的半胱氨酸(-SH)的Fc结构域(VIII)
5)使所述Fc结构域(VIII)与碘活化的缀合物中间体(VI)偶联,得到蛋白质-Fc缀合物(IX)。
图2显示了根据本发明的Fc蛋白质缀合的示意图。三价连接体包含中心单元(此处用三角形示出)、独立的间隔区元件S1、S2和S3以及离去基团LG1、LG2和LG3。所述方法描述如下:
1)选择性还原Fc结构域二硫键(VII),得到具有两个还原的半胱氨酸(-SH)的Fc结构域(VIII)
2)用三价连接体(III)对Fc结构域(VIII)进行烷基化,得到LG1-A-B-Fc缀合物中间体(X)
3)任选地还原待缀合的蛋白质的混合二硫化物(I),获得具有游离Cys(-SH)的蛋白质(II)
4)经由水性Finkelstein碘交换反应(V)激活缀合物中间体(X)的离去基团LG1,得到碘活化的缀合物中间体(XI)
5)使所述具有游离Cys(-SH)的蛋白质(II)与碘活化的缀合物中间体(XI)偶联,得到蛋白质-Fc缀合物(IX)。
序列信息
IgG1和IgG4的标准Fc多肽序列在序列表中提供,并复制于此处以方便获得信息。
SEO ID NO 1:IgG1 C2-C3
对应于根据EU编号的全长重链的AA231-447
加下划线的氨基酸残基对应于L234、L235、G237以及A330和P331。
SEQ ID NO 2:IgG1铰链
对应于根据EU编号的全长重链的AA217-230
PKSCDKTHTCPPCP
SEO ID NO 3:IgG4C2-C3
对应于根据EU编号的全长重链的AA231-447
SEQ ID NO 4:IgG4铰链
对应于根据EU编号的全长重链的AA217-230
SKYGPPCPSCP
粗体且加下划线的S对应于根据EU编号的全长IgG4重链的S228。
描述
本发明涉及蛋白质缀合物以及制备这类缀合物的方法。所述方法可用于共价连接两个或更多个多肽。
蛋白质缀合物
本发明涉及蛋白质缀合物,例如包含通过翻译后化学反应而共价连接的两个或更多个蛋白质或多肽的化合物。这类化合物和分子可用于多个领域,特别是与治疗性化合物的开发有关的领域。
蛋白质/多肽
所述蛋白质或多肽可以是技术人员希望共价连接在一起的任何蛋白质或多肽。由于技术人员可以容易地将所述方法适用于其他蛋白质和多肽,因此本发明超出所举例说明的化合物的范围。在下文中,将关注涉及治疗性蛋白质和效应蛋白质的缀合,其目的是改变治疗性蛋白质的性质。此外,可预见本发明化合物的替代用途。
如本文可见,开发的技术对于不同大小的蛋白质/多肽是有效的。众所周知,处理蛋白质/多肽比处理小肽明显更具挑战性,小肽可大致上作为小分子来处理。在一个实施方案中,一个或多个蛋白质/多肽的长度为至少40个氨基酸,如至少60、80或100个氨基酸。
在一个实施方案中,所述蛋白质/多肽的长度全部为至少40个氨基酸,如至少60、80或100个氨基酸。
治疗性蛋白质
治疗性蛋白质是在疾病或病症的治疗方法中有用的蛋白质或多肽,例如氨基酸序列。
生长激素
如本文所用的术语“生长激素化合物”泛指基本上保留了由SEQ ID NO 5表示的成熟人生长激素的功能特征的生长激素分子。因此,该化合物可以是生长激素、生长激素融合蛋白、生长激素变体或类似物或生长激素缀合物或衍生物,其还包括酰化或烷基化的生长激素。
可在基于细胞的体外试验如BAF试验(本文中的试验2)中测定生长激素化合物刺激通过生长激素受体(GHR)的信号传导的能力。
由于包含变异氨基酸序列或其他修饰的GH变体或GH化合物可能具有其他优点,因此尽管如在BAF试验中测定的GH活性可能低于人生长激素(hGH)的活性,但只要这些分子能够在合理的程度上刺激受体以及细胞增殖,则该变体或化合物仍是有吸引力的分子。
在一个这样的实施方案中,在BAF试验中测定体外活性。在一个实施方案中,与由SEQ ID NO 5表示的hGH相比,GH变体在BAF试验中具有相同的体外活性。如在试验2中所述,BAF试验的结果(BAF比)可表示为测试化合物(变体/GH化合物)的EC50与参考物(hGH/具有hGH序列的GH化合物)的EC50之间的比值。在一个实施方案中,GH变体或GH化合物的体外活性与hGH或包含hGH序列的等同GH化合物的体外活性是相当的。此处的“相当”意指BAF活性比在1/100-100/1,或如1/10-10/1的区间内。
经常使用大鼠模型来测试GH变体和化合物的生物效应。测试可以在正常大鼠和/或切除垂体的大鼠中进行。经常使用Sprague Dawley大鼠,并在试验3和试验4中描述了测试方法。这样的测试可提供关于几种相关的药代动力学参数如AUC、T1/2(半衰期)和MRT(平均停留时间)的信息,以确定给定化合物在接受者血液中的总暴露和存在的持续时间。此外,可以测量IGF-1响应的诱导——hGH的生物效应的多种特征之一(试验5)。
作为替代或补充,如在试验6中所述,可以使用小型猪。
在一个实施方案中,GH缀合物与hGH(SEQ ID NO 5)相比具有延长的半衰期。
在一个实施方案中,根据本发明的GH缀合物与hGH(SEQ ID NO 5)相比具有延长的体内T1/2。
注意到,在本文描述的试验3中,hGH具有约12-14分钟的T1/2。尽管与人类中的半衰期不等同,但预计在大鼠或小型猪中体内T1/2的增加也将转化为在治疗环境中延长的体内存在。
在一个实施方案中,GH缀合物的T1/2大于30分钟,或大于60分钟,或大于90分钟,或大于120分钟。在进一步的实施方案中,T1/2大于60分钟或1小时,如大于2小时或优选大于4小时。在一个实施方案中,GH缀合物的T1/2为2-10小时,如4-8小时。
在一个实施方案中,延长的T1/2是静脉内(iv.)或皮下(sc.)施用于大鼠或小型猪之后的测量值。技术人员将会知晓根据可用于检测GH变体或GH化合物的工具,可以如何对这种试验进行修改。
在一个实施方案中,GH化合物与hGH相比具有延长的半衰期。在一个实施方案中,GH化合物的T1/2大于8小时,如大于12小时,如大于24小时。在一个实施方案中,当在对正常大鼠单次静脉内给予15nmol之后进行测量时,GH化合物的T1/2大于8小时,如大于12小时,如大于24小时。
在一个实施方案中,当在对切除垂体的大鼠单次静脉内给予15nmol之后进行测量时,GH化合物的T1/2大于8小时,如大于12小时,如大于24小时(参见本文试验4)。
在一个实施方案中,当在对切除垂体的大鼠单次静脉内给予15nmol之后进行测量时,GH化合物的T1/2大于48小时,如大于60小时,如大于72小时。
如本文试验5中所述,可以在GH化合物的给药之后测量IGF-1响应,但是技术人员也将会知晓应用替代方法。在GH的单次给药之后,在一段时间内,大鼠中IGF-1的血浆浓度应优选增加,对应于GH化合物的血浆浓度的增加。
在一个实施方案中,根据本发明的GH化合物能够诱导IGF-1响应。
因此,通过达到较高的IGF-1血浆浓度,IGF-1响应可强于对于hGH所观察到的响应。可在72小时内,如48小时内,如36小时内,如24小时内检测到血浆IGF-1的浓度。为了比较不同化合物的效果,可在不同时间点测量其值,并在每个单独时间点进行比较,如在给药后6、12、24、36、48、72、96、144、192、240、288、336小时。
在一个实施方案中,GH化合物诱导增强的IGF-1响应。在一个实施方案中,GH化合物诱导IGF-1响应,其中在所述GH变体或化合物的单次给药后至多96小时,或如6、12、24、36、48、72小时,作为提高的血浆IGF-1浓度检测到IGF-1响应。在一个实施方案中,GH化合物诱导延长的IGF-1响应。如果与hGH相比,IGF-1的血浆浓度经一段延长的时间仍然很高,则GH化合物诱导延长的IGF-1响应。在一个实施方案中,与野生型(wt)hGH的IGF响应相比,GH化合物诱导延长的IGF-1响应。在一个实施方案中,IGF-1响应持续超过24小时,如超过48小时。
生长激素蛋白质的结构由通过三个环(L1-3)连接的四个螺旋(螺旋1-4)和一个C末端区段组成。在人生长激素(SEQ ID NO 5)中,螺旋1由氨基酸残基6-35限定,螺旋2由氨基酸残基71-98限定,螺旋3由氨基酸残基107-127限定,而螺旋4被限定为氨基酸残基155-184。
包括人生长激素变体和缀合物在内的生长激素分子已在多个文件中描述,所述文件包括WO2011089250、WO2011089255和WO2012010516。
在一个实施方案中,根据本发明的生长激素化合物或缀合物相对于hGH包含具有少于8个修饰(置换、缺失、添加)的GH蛋白质。
在一个实施方案中,GH蛋白质相对于hGH包含少于7个修饰(置换、缺失、添加)。在一个实施方案中,生长激素蛋白质相对于人生长激素包含少于6个修饰(置换、缺失、添加)。
在一个实施方案中,生长激素蛋白质相对于人生长激素包含少于5个修饰(置换、缺失、添加)。在一个实施方案中,生长激素蛋白质相对于人生长激素包含少于4个修饰(置换、缺失、添加)。在一个实施方案中,生长激素蛋白质相对于人生长激素包含少于3个修饰(置换、缺失、添加)。在一个实施方案中,生长激素蛋白质相对于人生长激素包含少于2个修饰(置换、缺失、添加)。
在一系列实施方案中,生长激素的生长激素蛋白质与由SEQ ID NO:5表示的人生长激素至少95%、96%、97%、98%或99%相同。
在一个实施方案中,生长激素蛋白质是对蛋白水解降解稳定(由通过编码DNA序列的突变产生的特定氨基酸置换引起)的变体。
对蛋白水解降解稳定的生长激素蛋白质的非限制性实例可见于WO2011089250中。
蛋白酶稳定的生长激素蛋白质变体包括在其中引入额外的二硫键的变体。所述额外的二硫键优选地将L3与螺旋2连接。这可以通过引入两个额外的半胱氨酸氨基酸残基来实现,所述半胱氨酸残基在优选的实施方案中置换在对应于SEQ ID NO:5的H2中的AA84或AA85以及L3中的AA143或AA144的位置处的野生型氨基酸残基。因此,根据本发明的生长激素变体可优选包含对应于SEQ ID NO:5中的L73C/S132C、L73C/F139C、R77C/I138C、R77C/F139C、L81C/Q141C、L81C/Y143C、Q84C/Y143C、Q84C/S144C、S85C/Y143C、S85C/S144C、P89C/F146C、F92C/F146C或F92C/T148C的一对氨基酸置换。在进一步的实施方案中,该生长激素变体包含对应于SEQ ID NO:5中的L81C/Y143C、Q84C/Y143C、S85C/Y143C、S85C/S144C或F92C/T148C的一对氨基酸置换。
在一个实施方案中,所述生长激素蛋白质是这样的生长激素变体,其除了上述任何蛋白酶稳定化氨基酸变化外,还适合于可能通过氨基酸置换(通过DNA序列的突变)而引入的单一置换/位点特异性修饰,例如用一个化学部分对游离半胱氨酸的烷基化。适合于烷基化的生长激素变体的非限制性列表可见于WO2011089255中。
术语“游离Cys”或“游离半胱氨酸”在本文中用于表示半胱氨酸氨基酸残基,其在还原形式时可用于缀合,因此具有游离巯基(-SH)。一般而言,游离Cys不参与二硫键。通常,游离Cys是引入到蛋白质中的变异氨基酸,但是天然Cys可以用作游离Cys。通过在蛋白质中的插入或氨基酸置换引入游离Cys的能力大大增强了关于创造新分子的选择。
在进一步的实施方案中,所述蛋白质是包含游离半胱氨酸的生长激素变体。在进一步的实施方案中,所述蛋白质是包含在由SEQ ID NO.:5表示的人生长激素中引入的游离半胱氨酸的生长激素变体。在进一步的实施方案中,所述蛋白质是包含通过选自T3C、P5C、S7C、D11C、H18C、Q29C、E30C、E33C、A34C、Y35C、K38C、E39C、Y42C、S43C、D47C、P48C、S55C、S57C、P59C、S62、E65C、Q69C、E88C、Q91C、S95C、A98C、N99C、S100C、L101C、V102C、Y103C、D107C、S108C、D112C、Q122C、G126C、E129C、D130C、G131C、P133C、T135C、G136C、T142C、D147C、N149C、D154C、A155C、L156C、R178C、E186C、G187C和G190C的氨基酸置换而引入的附加半胱氨酸的生长激素变体。这类引入的Cys残基是所谓的游离Cys置换。在进一步的实施方案中,所述蛋白质是包含选自T3C、P5C、S7C、D11C、H18C、Q29C、E30C、E33C、A34C、Y35C、E88C、Q91C、S95C、A98C、N99C、S100C、L101C、V102C、Y103C、D107C、S108C、D112C、Q122C和G126C的附加半胱氨酸的生长激素变体。
在进一步的实施方案中,游离Cys置换位于hGH中的氨基酸93-106内或hGH变体中的相应残基内。在进一步指定的实施方案中,游离Cys置换位于L2内,诸如氨基酸99-106或氨基酸99-103内或相应的残基内。
在进一步的实施方案中,游离Cys置换选自:E30C、Y42C、S55C、S57C、S62C、Q69C、S95C、A98C、N99C、L101C、V102C和S108C。
在实施方案中,生长激素变体包含一个游离Cys置换。
在进一步的实施方案中,游离Cys置换是E30C。在进一步的实施方案中,游离Cys置换是Y42C。在进一步的实施方案中,游离Cys置换是S55C。在进一步的实施方案中,游离Cys置换是S57C。在进一步的实施方案中,Cys置换是S62C。在进一步的实施方案中,游离Cys置换是Q69C。在进一步的实施方案中,游离Cys置换是S95C。在进一步的实施方案中,游离Cys置换是A98C。在进一步的实施方案中,游离Cys置换是N99C。在进一步的实施方案中,游离Cys置换是S100C。在进一步的实施方案中,游离Cys置换是L101C。在进一步的实施方案中,游离Cys置换是V102C。在进一步的实施方案中,游离Cys置换是S108C。
在进一步的实施方案中,所述蛋白质是包含选自Y42C和L101C的半胱氨酸置换的生长激素变体。
效应蛋白质
效应蛋白质是能够改变(治疗性)蛋白质的性质的多肽。效应蛋白质的实例是(但不限于)PEG、白蛋白、XTEN和Fc结构域,后一种是本申请的关键实例。
Fc结构域
抗体的片段可结晶区(Fc区或Fc结构域)是抗体的尾部。对于IgG、IgA和IgD抗体,Fc区含有两个相同的多肽,二者均包含重链的第二和第三恒定域(CH2和CH3)。IgM和IgE抗体的Fc区在每个多肽链中均含有三个重链恒定域(CH结构域2-4)。Fc结构域的蛋白质序列在本文中称为Fc多肽,并且通常至少包含CH2和CH3结构域。Fc结构域也可称为二聚体,因为这两个Fc多肽非共价相互作用并且由于铰链半胱氨酸可形成二硫键因而也可能共价相互作用。
Fc结构域介导与被称为Fc受体的细胞表面受体以及补体系统的一些蛋白质的相互作用。与Fc新生受体(FcRn)的相互作用特别令人感兴趣。
Fc区使抗体能够与免疫系统相互作用。抗体的Fc区至少部分地是抗体分子的长体内半衰期的原因,IgG在人类中的体内半衰期约为720小时。因此,Fc结构域是用于延长潜在治疗性化合物的体内半衰期的有吸引力的延长物(protractor)。
根据本发明,已发现使用Fc结构域作为生长激素的延长物导致生长激素缀合物具有有吸引力的功能。
在一个实施方案中,Fc结构域的同种型为IgG,如亚型IgG1,如IgG2,如IgG4。
在一个实施方案中,Fc结构域包含由SEQ ID NO:1定义的人IgG1或由SEQ ID NO3定义的IgG4的CH2和CH3结构域。在一个实施方案中,生长激素缀合物包含各自由SEQ ID NO 1或SEQ ID NO 3定义的两个相同的Fc多肽。
铰链区是抗体恒定区的CH1与CH2之间的蛋白质区段。在一个实施方案中,Fc多肽包含铰链区,该铰链区包含一个或多个半胱氨酸。在一个实施方案中,Fc结构域的多肽各自包含由SEQ ID NO:2或4所定义的序列。
在一个实施方案中,Fc多肽包含铰链以及CH1和CH2结构域。
在一个实施方案中,修饰铰链区,使得铰链区中的半胱氨酸残基数目得到改变,例如增加或减少。
在一个实施方案中,Fc多肽的铰链区仅包含一个半胱氨酸。在一个实施方案中,该半胱氨酸能够与第二个Fc多肽的相同半胱氨酸形成二硫键。因此,在一个实施方案中,Fc结构域的两个多肽在铰链区中具有两个半胱氨酸,例如每个多肽中有一个。正如在描述制备蛋白质缀合物的章节中所见,这样的二硫键可被还原,并且巯基用于偶联至连接体,从而与其他蛋白质偶联。
Fc多肽的半胱氨酸能够形成二硫键,但在还原时可充当游离Cys。在一个实施方案中,Fc多肽包含Cys残基。特别地,如本文所示,可还原连接两个Fc多肽的铰链区中的二硫键,以产生可类似于游离半胱氨酸起作用的两个半胱氨酸。在一个实施方案中,Fc多肽在铰链序列中包含Cys残基。
在一个实施方案中,Fc多肽的铰链区仅包含天然氨基酸残基。在一个实施方案中,铰链区包含铰链区中的氨基酸插入或置换。对于异源表达,甲硫氨酸可由表达载体中的DNA编码,但甲硫氨酸不总是存在于缀合物的Fc结构域中。在一个实施方案中,Fc多肽在N-末端不包含甲硫氨酸。
在一个实施方案中,铰链序列是IgG铰链序列如本文具体提及的IgG1或IgG4铰链序列的截短形式。
在一个实施方案中,Fc铰链的铰链序列来源于IgGl铰链序列PKSCDKTHTCPPCP(SEQ ID NO:2)。
在一个实施方案中,铰链序列选自:PKSCDKTHTCPPCP、PPCP、PCP和CP。
在一个实施方案中,Fc铰链的铰链序列来源于IgG4铰链序列SKYGPPCPSCP(SEQ ID NO:4)。在一个实施方案中,铰链序列选自:SKYGPPCPS*CP、PSCP、SCPL和CP。
在一个实施方案中,Fc多肽在铰链序列中包含Cys残基。在一个实施方案中,Fc多肽在铰链中仅包含一个Cys残基。
在一个实施方案中,可修饰恒定区以稳定分子,例如,在lgG4铰链区中,残基S228(以上标记为*,残基编号根据EU索引)可被脯氨酸置换(S228P)。在一个实施方案中,Fc多肽在位置228处或在IgG4来源的铰链序列中对应于228的位置处包含脯氨酸残基。
因此,Fc结构域的Fc多肽可通过二硫键共价连接或备选地非共价结合。
在一个实施方案中,Fc区可被工程化为包含Fc区内的修饰,通常被工程化为改变其功能性质中的一种或多种,如血清半衰期、补体固定、Fc受体结合、蛋白质稳定性和/或抗原依赖性细胞毒性或其缺乏等。
在一个实施方案中,Fc结构域包含FcRn结合位点,因此类似于WO05001025中描述的,相对于野生型Fc多肽的任何氨基酸缺失、插入或置换不应破坏或大幅降低Fc结构域与Fc新生受体相互作用的能力。针对这类受体相互作用的结合试验是本领域公知的。
此外,可对本发明的Fc结构域进行化学修饰(例如,一个或多个化学部分可附接至Fc部分)以改变其糖基化的程度,于是改变抗体的一种或多种功能性质。
先前已经描述了Fc结构域的各种各样的这类突变,并且只要保持功能,例如延长与其连接的蛋白质的体内半衰期的能力,根据本发明的Fc结构域便可包含这样的突变。
IgG1 Fc结构域可包含一个或多个以及可能全部以下氨基酸置换,所述氨基酸置换将会导致对某些Fc受体的亲和力降低(选自L234A、L235E和G237A),和/或C1q介导的补体固定减少(分别选自A330S和P331S)。
为了改善对FcRn的结合亲和力,可包含Fc中的突变以获得IgG1同种型的Fc结构域中的氨基酸置换,如M428L和/或N434S。
连接体
连接体是用来共价连接蛋白质的化学部分。连接体是单独的部分,例如,仅仅通过二硫键连接的蛋白质被认为不包含根据本发明的连接体。如下文所见,连接体可包括氨基酸、氨基酸样元件和非氨基酸元件,而连接体本身不作为缀合物的一个或多个蛋白质的一部分通过异源表达而产生。
随着连接体与蛋白质反应,形成了连接体基团。因此,术语“-连接体-”旨在表示蛋白质缀合物的化学单元,其与蛋白质缀合物的每一个蛋白质的氨基酸残基共价连接。
连接体末端的反应性将根据附接点而变化。连接体可根据要获得的所需产物而具有多种形式。如在本文的实施方案中所述的概念涉及有序缀合,以确保不同的蛋白质在连接体的每个末端均附接。
反应性末端是可用于连接体与蛋白质的氨基酸残基缀合的化学子结构。反应性末端可适合于连接至N-末端、C-末端或内部的氨基酸残基。在本领域中已知多种形式,包括对于氨基酸残基特定的化学结构以及对于氨基酸残基非特定的结构。根据靶蛋白质,可能需要靶向特定的氨基酸残基以获得高产率的所需产物。
反应性末端(或基团)将根据其应当靶向的氨基酸残基而不同。
如实施例中所示,可利用多种半胱氨酸或硫醇反应性末端来实现与硫醇的缀合,而其他反应性基团适合于与供替代的氨基酸残基缀合。得到的缀合物包含作为连接体的一部分的反应性末端的基团。得到的反应性末端的基团将与附接的氨基酸残基共价键合。反应性末端的基团可称为-RR-。因此,缀合物的-连接体-部分可进一步通过指定反应性末端基团(-连接体-RR-)来描述。
N-末端氨基酸可被醛或酮靶向。在一个实施方案中,N-末端反应性末端包含-CHO。Lys残基可被2,5-二氧代吡咯烷-1-基靶向。
在一个实施方案中,反应性末端包含Lys反应性末端,如二氧基吡咯烷。可通过WO2005070468中描述的两步法利用转谷氨酰胺酶靶向Gln残基,以产生与胺或羟胺反应的醛。在一个实施方案中,反应性末端包含醛或酮。Ser残基可利用高碘酸钠(NaIO4)氧化为醛(乙醛基),后者可在还原胺化条件下被胺靶向。如WO2009027369中所述,Lys残基同样可适合于逆向转谷酰胺酶反应。
为了进一步详细地描述连接体,可以使用R1、R2等来描述单独的反应性末端。
在一个实施方案中,单独的反应性末端选自C-末端、N-末端、Gln、Lys、Ser或Cys反应性末端。在一个实施方案中,R1、R2等是N-末端反应性末端。在一个实施方案中,R1、R2等是Gln反应性末端。在一个实施方案中,R1、R2等是Lys反应性末端。在一个实施方案中,R1、R2等是Ser反应性末端。在一个实施方案中,R1、R2等是Cys反应性末端。
为了获得区域选择性,可优选反应性末端不同,如提供具有一个Lys反应性末端和一个Cys反应性末端的连接体。如果使用两个Cys反应性末端,则可以控制反应性,如以下对于二价和三价连接体所描述的。
根据本发明的连接体可包含被间隔区分隔开的一个或多个硫醇反应性末端或半胱氨酸反应性末端。在实施方案中,连接体的反应性末端可被称为Cys或硫醇反应性末端。优选地,反应性末端能够与硫醇反应,而与硫醇的位置无关。在一个实施方案中,硫醇反应性末端能够实现与N-末端半胱氨酸的连接。在一个实施方案中,硫醇反应性末端能实现与C-末端半胱氨酸的连接。在一个优选的实施方案中,硫醇反应性末端能实现与内部氨基酸残基例如本文所述的游离半胱氨酸的连接。
技术人员知道几种能实现与半胱氨酸偶联的途径。两种关键的反应性末端是具有合适的离去基团的α取代的乙酰胺(例如,α-卤素乙酰胺)(LG-乙酰胺)和α-β-不饱和的羰基化合物(例如,马来酰亚胺)。因此,反应性末端可以是诸如马来酰亚胺或LG-乙酰胺,其中所述离去基团为例如磺酸酯(如甲苯磺酸酯或甲磺酸)或卤化物(形成α卤乙酰胺)。所述卤素可以为Cl、Br或I。在供替代的实施方案中,离去基团(LG)可以为提供相同功能的供替代分子。
因此,Cys反应性末端(或硫醇反应性末端)为允许与感兴趣蛋白质中的半胱氨酸残基缀合的化学实体。Cys反应性末端基团的实例是诸如末端醛、吡咯烷-2,5-二酮(2,5-吡咯二酮)(也称为马来酰亚胺)和离去基团-乙酰胺(如卤乙酰胺)。
在一个实施方案中,Cys反应性末端包含-吡咯烷-2,5-二酮。
在一个实施方案中,Cys反应性末端包含-NHC(=O)-CH2-吡咯烷-2,5-二酮。
在一个实施方案中,Cys反应性末端包含离去基团,如卤素,例如溴化物、氯化物或碘化物。
在一个实施方案中,Cys反应性末端包含卤乙酰胺。对于卤乙酰胺,反应性末端-NH-C(=O)-CH2-I的反应性高于-NH-C(=O)-CH2-Br,后者的反应性又高于NH-C(=O)-CH2-Cl。
卤乙酰胺对Cys残基是反应性的,因此可用于偶联各自包含游离Cys的两个蛋白质,所述游离Cys是野生型残基或者更可能是为了缀合的目的而引入的变异氨基酸残基。
如下文进一步描述的,连接体的反应性末端可包含不同的离去基团,因此连接体可具有总体结构:LG1-连接体-LG2。在一个实施方案中,离去基团为卤素,特别是具有不同反应性的卤素。当离去基团作为卤乙酰胺的一部分而包含在内时,反应性为I>Br>>Cl。
在一个实施方案中,本发明涉及以下结构的连接体:
LG1-连接体-LG2,其中两个末端为Cys反应性的且LG1和LG2的反应性不同。反应性末端之间的部分在此处称为间隔区。间隔区可由下文所述的一个或多个间隔区元件组成。间隔区元件可通过肽键连接。当Cys反应性末端为卤乙酰胺时,反应性末端包含肽键(-C(=O)-NH-/-NH-C(=O)-)。
在一个实施方案中,连接体具有以下结构:
卤素1-CH2-C(=O)-NH-间隔区-NH-C(=O)-CH2-卤素2、
Cl-CH2-C(=O)-NH-间隔区-NH-C(=O)-CH2-Br或
Br-CH2-C(=O)-NH-间隔区-NH-C(=O)-CH2-Cl。
三价连接体
如上所述,本发明涵盖蛋白质与Fc结构域的连接。值得注意的是,Fc结构域由两个通常通过共价键和非共价键(也包括多肽间二硫键)维系在一起的多肽组成。利用传统二价连接体的共价连接将从蛋白质连接到仅一个Fc多肽。利用根据本发明的三价连接体,可获得这样的蛋白质缀合物,其中两个Fc多肽链均与蛋白质连接。显然,这类三价连接体的用途不限于Fc结构域的缀合。
三价连接体可具有包含被称为“U”的中心单元的结构,该中心单元至少为三价基团(tri-radical)。该中心单元可以是允许从该单元延伸出至少三个键的任何化学结构(-U=)。在一个实施方案中,该中心单元可以是氮原子(-N=)。在一个实施方案中,该中心单元可以是四价碳原子(=C=),在该情况下第四个“臂”可以是-H、-CH3,或不妨碍连接体功能的任何其他结构。在一个实施方案中,该中心单元可以是苯环。
三价连接体结构可包含三个可以相同或不同的连接体臂。连接体臂各自包含间隔区部分(S)和反应性末端(R)。总体结构为:
其中
U表示三价基团(中心单元)
S1、S2和S3表示单独的间隔区,并且
R1、R2和R3表示(适合)用于与蛋白质分子缀合的单独反应性末端。
在一个实施方案中,R1、R2和R3不相同。在一个实施方案中,R2和R3相同。在一个实施方案中,R2和R3相同但R1不同。
在一个实施方案中,反应性末端R1、R2和R3中的一个或多个为硫醇反应性末端。在一个实施方案中,R2和R3为硫醇反应性末端。在一个实施方案中,至少R2和R3为硫醇反应性末端。在一个实施方案中,R2和R3为硫醇反应性末端,而R1不是硫醇反应性末端。在一个实施方案中,R1、R2和R3为硫醇反应性末端。在一个实施方案中,R1、R2和R3对半胱氨酸具有不同的反应性。
在一个实施方案中,R2和R3为硫醇反应性末端,而R1不是硫醇反应性末端。在这类实施方案中,R1可以是选自C-末端、N-末端、Gln、Lys和Ser反应性末端的反应性末端。
在一个实施方案中,硫醇反应性末端包含马来酰亚胺。在一个实施方案中,硫醇反应性末端包含离去基团(LG),这样的离去基团可以是无机离去基团,如卤素,例如溴化物、氯化物或碘化物,或者是有机离去基团,例如甲磺酸酯或甲苯磺酸酯。
在一个实施方案中,离去基团为卤素,如溴化物、氯化物或碘化物。在一个实施方案中,一个或多个反应性末端为卤乙酰胺。
在一个实施方案中,R2和R3为硫醇反应性末端,如-NH-C(=O)-CH2-LG,从而提供具有以下结构的连接体:
其中LG2和LG3为离去基团,且R1为反应性末端,并且S1、S2和S3表示如上所述的单独间隔区。
在一个实施方案中,离去基团2(LG2)和3(LG3)相同,而在进一步的实施方案中,离去基团2和3不同。不同的离去基团可具有不同的反应性并能实现顺序缀合。
在一个实施方案中,R1包含硫醇反应性末端。在一个实施方案中,R1为硫醇反应性末端。在一个实施方案中,该硫醇反应性末端为卤乙酰胺。
在一个实施方案中,R1包含离去基团(LG1),这样的离去基团可以是无机离去基团,如卤素,例如溴化物、氯化物或碘化物,或者是有机离去基团,如甲磺酸酯或甲苯磺酸酯。
在一个实施方案中,第一连接体臂具有结构:LG1-CH2-C(=O)-NH-S1。在一个实施方案中,R1包含离去基团(LG),如卤素,如溴化物、氯化物或碘化物。
在一个实施方案中,R1与R2和R3不同。在一个实施方案中,R1包含与R2和R3不同的离去基团。
在一个实施方案中,LG1与LG2和LG3不同。
为了连接体臂与待缀合的不同蛋白质的直接顺序缀合,可以使用不同的反应性末端。
在所有臂都包含含有LG的硫醇反应性末端的一个实施方案中,LG可以不同,以获得对蛋白质的不同反应性。在一个实施方案中,硫醇反应性末端的反应性是不同的。
在一个实施方案中,LG1的反应性高于LG2和LG3的反应性。在一个实施方案中,LG2和LG3的反应性高于LG1的反应性。
对于卤乙酰胺的反应性的顺序为I>Br>>Cl。因此,-NH-C(=O)-CH2-Br的反应性末端的反应性将高于-NH-C(=O)-CH2-Cl,而-NH-C(=O)-CH2-I将对(还原的)半胱氨酸残基具有甚至更高的反应性。
因此,根据本发明的连接体可包含一个或多个硫醇反应性基团或Cys反应性基团。Cys反应性基团和反应性末端基团的关键实例为:
曲折线和N-*表示与连接体的其余部分附接,而左边的*-表示与Cys氨基酸残基的-S-附接。
本发明的连接体可进一步包含连接反应性末端与中心单元的单独的间隔区段。间隔区段被命名为S1、S2和S3。如上所述,连接体允许Fc结构域的对称缀合,这在例如R2-S2和R3-S3相同时获得,而经由第一臂与感兴趣蛋白质的连接可以是不同的。在其他实施方案中,缀合物是非对称的,并且全部R1-S1、R2-S2和R3-S3可以是不同的。
间隔区S1、S2和S3可包含不同的间隔区元件。在希望蛋白质2和3紧密靠近的情况下,可对S2和S3使用短间隔区。通过对在最短距离上结合的原子数目进行计数,短间隔区的长度可以为1-10个原子,如2-5个原子。在一个实施方案中,短间隔区为-(CH2)n-,其中n为1-5范围内的整数。在一个实施方案中,短间隔区为-(CH2)n-,其中n为1-3范围内的整数,如n=2以及如n=3,因此S2和S3为-(CH2)2-或-(CH2)3-。
在一个实施方案中,通过延长一个或多个间隔区来增加距中心单元的距离。
在一个实施方案中,连接体包含至少一个延长的间隔区。如果仅针对缀合物的一个蛋白质增加到中心单元的距离,则应仅延长一个间隔区。在一个实施方案中,延长的间隔区为S1。延长的间隔区比以上对S2和S3列举的短间隔区长。通过对在最短距离上结合的原子数目进行计数,延长的间隔区的长度可以为10-50个原子,如20-30个原子。
在中心单元包含氮(N)的一个实施方案中,连接体的一个臂可经由酰胺键与N连接。在进一步的实施方案中,S1(其连接R1与中心单元(此处为N))在末端具有羰基(C=O),该羰基可与氮原子形成酰胺键。
在进一步的实施方案中,间隔区可包含一个或多个氨基酸样间隔区元件。间隔区元件可通过酰胺键连接。因此,这样的间隔区元件具有N-末端和C-末端,像多肽中的氨基酸一样。这样的间隔区元件可以是氨基酸残基或经修饰的氨基酸残基或能够通过酰胺键连接的供替代的化学实体。实例为如下面a)到d)所示的甘氨酸、丙氨酸、谷氨酸和gamma-Glu(γ-Glu)。
在一个连接体臂中,羰基端可与中心氮形成酰胺键。
在一个连接体臂中,供替代的氨基酸样元件,包括另外的氨基基团(而不是羰基基团),例如下面的e)和f),也可以紧挨着中心氮使用。当与其偶联时,脲/尿素基团存在于连接体结构中。
可通过包含聚乙二醇单元延长甘氨酸间隔区元件。
在进一步的实施方案中,间隔区包含聚乙二醇(PEG)部分。PEG部分为双价基团(bi-radical),其包含以下结构
其中n’为大于1的整数。在一个这样的实施方案中,n’为选自2-20的整数。在一个这样的实施方案中,n’为选自2-10或2-5的整数。在一个实施方案中,n’为2。
在一个实施方案中,PEG部分可具有以下结构
在一个实施方案中,PEG部分包含在如上所述的氨基酸或氨基酸样间隔区元件中。
在一个实施方案中,间隔区元件具有下式
其中k为1-5范围内的整数,并且n为1-5范围内的整数。在一个具体的实施方案中,k=1且n=1,从而提供以下间隔区元件
在一个实施方案中,通过k=1且n=1限定间隔区元件g),从而提供*-NH-(CH2)2-O-(CH2)2-O-CH2-C(=O)-*(e1),其可称为OEG或8-氨基-3,6-二氧杂辛酸的双价基团。
在上述结构中,曲折线表示与间隔区、中心单元或反应性末端连接的键。在间隔区与反应性末端连接的情况下,“-NH-”可被认为是反应性末端的一部分。在反应性末端具有卤乙酰胺的上述实施方案中,可以是这样。
在一个实施方案中,R1-S1-包含3-8个由酰胺键连接的间隔区元件。在一个实施方案中,R1-S1-包含4-6个由酰胺键连接的间隔区元件。
在一个实施方案中,三价连接体的结构为
其中离去基团LG2和LG3相同。
在一个这样的实施方案中,R1不是硫醇反应性末端。
在一个实施方案中,三价连接体的结构为
其中,离去基团LG2和LG3相同,并且R1为Ser、Lys、G1、C-末端或N-末端反应性末端。
在一个供替代的实施方案中,所有反应性末端均为Cys反应性的。在一个实施方案中,R2和R3相同,而R1为不同的Cys反应性末端。这类不同的反应性末端将允许蛋白质的所选择的连接。在一个实施方案中,R2和R3包含卤乙酰胺。
在一个实施方案中,LG2和LG3为Cl,其中连接体具有以下总体结构:
在一个实施方案中,LG2和LG3为Br,其中连接体具有以下总体结构:
在一个实施方案中,所有反应性末端均为卤乙酰胺。在一个实施方案中,R1包含含有LG1的卤乙酰胺。
在一个实施方案中,三价连接体的结构为:
在一个实施方案中,三价连接体的结构为:
在一个实施方案中,三价连接体的结构为:
在一个实施方案中,三价连接体的结构为:
在一个实施方案中,三价连接体的结构为:
在一个实施方案中,三价连接体的结构为:
在第2个臂和第3个臂相同的实施方案中,连接体部分可由通用结构A-B来描述,其中A-为第1个臂且-B包含中心单元以及第2个臂和第3个臂。如果使用与以上类似的结构,则A为R1-S1-且B为-N-(S2-R2)2。
因此,连接体的总大小可以变化,但通常相对较小,如本文中的实例所见。当测量连接体的大小时,仅包括缀合物中剩余的连接体部分,这意味着不包括离去基团。
在一个实施方案中,连接体的大小低于10kDa,如低于5kDa,如低于2kDa,如低于1kDa,如低于500kDa。在一个实施方案中,连接体为250Da至20kDa,如为500Da至10kDa。
在一个实施方案中,连接体为500至2000Da,如600-1500Da,如700-100Da。
可通过对两个蛋白质之间的最短距离上的原子数目进行计数来估算缀合物的整个连接体的长度。在第2个臂和第3个臂相同且第1个臂最长的实例中,在两个原子相同的情况下,长度为例如从蛋白质1到蛋白质2的最长距离。当中心原子为N时,其计为一个原子,而如果臂对称地定位,则作为中心单元的苯环计为3个原子。由于离去基团不是最终缀合物的一部分,因此不予计数,而只对反应性末端基团进行计数。
在一个实施方案中,连接体的长度为5-200个原子,如长度为8-150个原子或10至100个原子。在进一步的实施方案中,连接体的长度为10-80个原子。在进一步的实施方案中,连接体的长度为10-60个原子。在进一步的实施方案中,连接体的长度为10-40个原子,如15-40个原子或如20-35个原子。
此处,以下表1中提供了根据本发明的三价连接体的实例。
表1.三价连接体的实例.
蛋白质缀合物
因此,本发明的蛋白质缀合物将包含经由连接体部分彼此共价结合的2个或更多个单独的多肽(蛋白质1、蛋白质2和/或蛋白质3)。在一个实施方案中,蛋白质1、蛋白质2和蛋白质3为单独的多肽。在一个实施方案中,单独的多肽可以相同,或者蛋白质1、蛋白质2和蛋白质3中的两个可以相同。因此,单独的多肽各自具有N-末端和C-末端氨基酸残基。所述单独的多肽可另外经由例如二硫键彼此附接,或甚至附接至其他多肽/蛋白质。
由于蛋白质经由连接体彼此结合,连接体部分将会是所有这类化合物的一部分,包括也被本发明所涵盖的中间体。
在一个实施方案中,本发明的缀合物具有以下结构
其中
连接体为化学部分
S为硫原子,并且
蛋白质1经由所述连接体和硫原子与蛋白质2和蛋白质3连接。
在一个实施方案中,硫原子为硫醚的一部分,例如键从硫原子延伸到两个单独的碳原子,C-S-C,其中碳原子可以是任何有机结构的一部分。最常见的硫醚为-CH2-S-CH2-,其中在目前情况下,一个CH2基团来自与连接体连接的蛋白质,并且最常来自提供硫原子以供缀合的半胱氨酸残基。
在一个实施方案中,缀合物的硫原子不是二硫键的一部分。
在-S2-R2与-S3-R3相同且蛋白质2的两个拷贝有待于与蛋白质1缀合的一个实施方案中,连接体的结构可用-A-B=来描述,并且所得缀合物具有结构蛋白质1-A-B-(蛋白质2)2。当B被认为是连接体臂时,该结构可以是蛋白质1-A-(B-蛋白质2)2。
当讨论用于制备缀合物的方法时,在下文中描述了本发明化合物的其他实例。
Fc缀合物
在一个实施方案中,蛋白质2和蛋白质3为相同的Fc多肽,其共同形成Fc结构域。如本文所述,可通过还原铰链区的二硫键并将每一个半胱氨酸例如经由连接体臂2和3与连接体连接来实现与Fc多肽的连接。第3个连接体臂(此处为连接体臂1)预先或稍后与感兴趣的蛋白质1缀合。如关于蛋白质缀合物制备的章节中所述,缀合物可具有以下形式:
在反应性末端2和3为卤乙酰胺的实施方案中,缀合物具有以下形式:
在一个实施方案中,缀合物具有以下结构:
蛋白质1-RR1-S1-U-[S2-NH-C(=O)-CH2-S-Fc]2
其中
RR1表示反应性末端基团,
U表示中心单元,
S1和S2表示单独的间隔区,并且
Fc为Fc多肽。
如果使用上述的替代描述,则可用蛋白质1-A-(B-Fc)2来描述Fc缀合物。
如果包含用于与Fc连接的硫原子,则结构为:
蛋白质1-A-(B-S-Fc)2,并且包括硫醚,如果也显示Fc的半胱氨酸的-CH2-,则结构为蛋白质1-A-(B-CH2-S-Fc)2或蛋白质1-A-(B-CH2-S-CH2-Fc)2。当通过硫醇和卤乙酰胺偶联实现连接时,因此B至少包含从硫醇和卤乙酰胺反应中剩余的-NH-C(=O)-CH2-元件,从而提供了:
蛋白质1-A-(B’-NH-C(=O)-CH2-S-Fc)2。
另外,S2和B′似乎是相似的,因为它们象征着连接体臂的其余部分。在优选的实施方案中,S2或B’为-CH2-CH2-,从而提供了以下结构的缀合物:
蛋白质1-A-(CH2-CH2-NH-C(=O)-CH2-S-Fc)2
其中A为与蛋白质1连接的连接体单元,如本申请中其他地方已经描述的,该连接体单元包含中心单元(具有至少三个键的选择)和合适的间隔区以及提供与蛋白质1的连接的反应性末端基团。
生长激素Fc缀合物
在一方面,本发明涉及生长激素Fc缀合物,与野生型人生长激素相比,这类GH缀合物优选具有延长的体内半衰期(T1/2)。此外,该生长激素Fc缀合物优选保持人生长激素的治疗能力,所述治疗能力可以通过如试验1和试验2中所述测试受体结合以及在BAF试验中的活性进行体外测定。可使用动物模型来进一步评价生长激素Fc缀合物的治疗潜力(试验3-试验5)。
在此,以下表3中包含根据本发明的生长激素缀合物的实例。
表3实例2的GH-Fc化合物
药物组合物
根据本发明的蛋白质缀合物可配制为药物组合物。
制剂可进一步包含合适的缓冲液、防腐剂、张度剂、螯合剂、稳定剂和/或表面活性剂及其多种组合。
在药物组合物中使用防腐剂、等渗剂、螯合剂、稳定剂和表面活性剂是技术人员公知的。可利用本领域已知的标准程序制备制剂。可以参考Remington:The Science and Practice of Pharmacy,第19版,1995。
在本发明的一个实施方案中,药物组合物为液体制剂。在本发明的一个实施方案中,药物组合物为水性组合物,即,组分溶解或悬浮于水中的组合物。这样的组合物通常为溶液或悬浮液。如果组合物包含不能溶解于水的组分,则该组合物可能是两种液体的乳液,通常为水和油或基于脂肪酸的液体。在另一个实施方案中,药物组合物为冷冻干燥的组合物,使用前医生或患者向其中加入溶剂和/或稀释剂。
在一个实施方案中,本发明的组合物的pH为5.0-8.5,如6.0-8.5,如6.0-8.2,如6.0-8.0,如7.0-8.5,如7.0-8.0,如7.5-8.0,如6.0-7.5,如6.2-7.5,如6.4-7.2,如6.5-7.0,如6.6-7.0。pH还可以为6.6-6.9或6.7-6.9。在进一步的实施方案中,组合物的pH为6.6、6.7、6.8、6.9或7.0。
在本发明的进一步实施方案中,所述缓冲液选自乙酸钠、碳酸钠、柠檬酸盐、甘氨酰甘氨酸、组氨酸、甘氨酸、赖氨酸、精氨酸、磷酸二氢钠、磷酸氢二钠、磷酸钠和三(羟甲基)-氨基甲烷、N,N-二羟乙基甘氨酸(bicine)、N-三(羟甲基)甲基甘氨酸(tricine)、苹果酸、琥珀酸盐、马来酸、富马酸、酒石酸、天冬氨酸,或其混合物。
在一个实施方案中,药物组合物不包含甘氨酸。在一个实施方案中,该组合物包含组氨酸作为缓冲液。
在一个实施方案中,药物组合物包含表面活性剂,如聚氧丙烯-聚氧乙烯嵌段共聚物。在一个实施方案中,表面活性剂选自非离子型表面活性剂,如泊洛沙姆,其包括F68、泊洛沙姆188和泊洛沙姆407以及Triton X-100。在一个实施方案中,表面活性剂选自聚氧乙烯和聚乙烯衍生物,如烷基化衍生物和烷氧基化衍生物(吐温,例如吐温-20、吐温-40、吐温-80和Brij-35)。在一个实施方案中,表面活性剂为聚山梨酯80。
在进一步的实施方案中,药物组合物包含药学上可接受的防腐剂。在本发明的进一步的实施方案中,该防腐剂选自苯酚、邻甲酚、间甲酚、对甲酚、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、2-苯氧乙醇、对羟基苯甲酸丁酯、2-苯基乙醇、苄醇、氯丁醇和硫柳汞(thiomerosal)、溴硝醇、苯甲酸、咪唑啉基脲、氯己定(chlorohexidine)、脱氢乙酸钠、氯甲酚、对羟基苯甲酸乙酯、苄索氯铵、氯苯甘醚(chlorphenesine)(3-(对-氯苯氧基)丙烷-1,2-二醇),或其混合物。
治疗方法
根据缀合物的蛋白质的联合治疗效果,如本文所述的蛋白质缀合物可用于治疗各种疾病和病症。
已知生长激素化合物适合于治疗生长激素缺乏。基本上,包含缀合的生长激素蛋白质的根据本发明的药物组合物可用于任何疾病或病症的治疗,在这些疾病或病症中,患者将受益于循环生长激素活性的增加。在目前的治疗中,施用生长激素蛋白质。作为替代方案,可施用生长激素变体或化合物以提供生长激素活性。本发明的一方面是在治疗方法中使用的生长激素缀合物。
本发明的一方面涉及生长激素缀合物在制备药物中的用途,该药物用于治疗,特别是用于治疗儿童和/或成人中的生长激素缺乏,或患者将会受益于本文所述生长激素的水平提高的其他疾病或状况。
本发明进一步涉及以下方面:制备用于在治疗方法中使用的根据本发明的药物组合物,以及包含蛋白质缀合物(包括生长激素缀合物)的用于在治疗方法中使用的药物组合物。
在这样的实施方案中,根据本发明的药物组合物用于在儿童和/或成人中的生长激素缺乏的治疗或预防方法中使用。循环生长激素的浓度提高可能对其有帮助的其他疾病或病症也可以使用本发明的药物组合物进行治疗或预防。在一个实施方案中,本发明的药物组合物用于在治疗疾病或状况的方法中使用,其中观察到循环生长激素的量的增加带来的益处。这类疾病或状况包括生长激素缺乏(GHD);Turner综合征;Prader-Willi综合征(PWS);努南综合征(Noonan syndrome);唐氏综合征(Down syndrome);慢性肾病、幼年型类风湿性关节炎;囊性纤维化,在接受HAART治疗的儿童中的HIV感染(HIV/HALS儿童);出生时胎龄不足(SGA)的矮小儿童;极低出生体重(VLBW)但不是SGA的儿童的身材矮小;骨骼发育不良;软骨发育不良;软骨发育不全;特发性身材矮小(ISS);成人GHD;在长骨中的骨折或长骨骨折,如胫骨、腓骨、股骨、肱骨、桡骨、尺骨、锁骨、掌骨、跖骨和指/趾骨;在松质骨中的骨折或松质骨骨折,如头骨、手的根部、脚的根部;例如手、膝或肩中的肌腱或韧带手术后的患者;具有或经历牵拉骨生成的患者;髋关节或椎间盘置换、半月板修复、脊柱融合或如膝、髋、肩、肘、腕或颌中假体固定之后的患者;骨缝合术材料如钉子、螺钉和钢板已固定到其中的患者;骨折不愈合或畸形愈合的患者;例如从胫骨或第一趾截骨术后的患者;移植物植入后的患者;由创伤或关节炎引起的膝中的关节软骨退变;Turner综合征患者中的骨质疏松症;男性骨质疏松症;慢性透析的成年患者(APCD);APCD中的营养不良相关的心血管疾病;APCD中的恶病质逆转;APCD中的癌症;APCD中的慢性阻塞性肺病;APCD中的HIV;患有APCD的老年人;APCD中的慢性肝病,APCD中的疲劳综合征;克罗恩病;IBD、UC、肝功能受损;HIV感染的男性;短肠综合征;向心性肥胖;HIV相关的脂肪营养不良综合征(HALS);男性不育;重大的选择性手术后的患者,酒精/药物解毒或神经创伤;衰老;虚弱老人;骨关节炎;创伤性受损软骨;勃起功能障碍;纤维肌痛;记忆障碍;抑郁症;创伤性脑损伤;蛛网膜下腔出血;极低出生体重;代谢综合征;糖皮质激素性肌病;或儿童因糖皮质激素治疗而引起的身材矮小。生长激素也已用于加快肌肉组织、神经组织或伤口的愈合;加快或改善通向受损组织的血流;或降低受损组织的感染率。
在一个实施方案中,所述生长激素缀合物及其组合物用于治疗儿童中的GHD、成人中的GHD(AGHD)、Turner综合征(TS)、努南综合征、特发性身材矮小(ISS)、小于胎龄(SGA)、Prader-Willi综合征(PWS)、慢性肾功能不全(CRI)、骨骼发育不良、SHOX缺乏、AIDS消瘦、HIV相关的脂肪代谢障碍(HARS)、短肠综合征,任选包括类固醇依赖性疾病、囊性纤维化和纤维肌痛。
在一个实施方案中,所述生长激素缀合物或组合物用于如本文所述的药物组合物的制备。
在一个实施方案中,本发明涉及治疗上述疾病或状况的方法,其中根据本发明的药物组合物的活性可用于治疗所述疾病或状况。该药物组合物,例如生长激素缀合物的施用产生了与患者中的循环生长激素活性量的增加有关的治疗益处。在实施方案中,所述方法包括向患者施用有效量的包含生长激素缀合物的药物组合物,从而改善所述患者的症状。
在一个实施方案中,本发明涉及一种方法,其包括向有需要的患者施用有效量的治疗有效量的根据本发明的药物组合物。因此,本发明提供用于治疗这些疾病或状况的方法,该方法包括向有需要的患者施用根据本发明的药物组合物中的治疗有效量的生长激素变体或化合物。
如本文所用的本发明化合物的“治疗有效量”意指一定的量,该量足以治愈、减轻或部分抑制给定疾病及其并发症的临床表现。足以完成此目的的量被定义为“治疗有效量”。
用于各个目的的有效量将依赖于,例如疾病或损伤的严重程度以及受试者的体重、性别、年龄和一般状况。
如本文所述,所述药物组合物的生长激素变体或化合物可具有延长的半衰期,其目的在于使每次剂量之后增加患者暴露于该化合物,并且应调整药物组合物的施用方案以达到有效暴露。
蛋白质缀合物的制备方法
本发明的一个方面涉及用于制备如本文所述的蛋白质缀合物的方法。待缀合的蛋白质(蛋白质1、蛋白质2和可选的蛋白质3)和连接体单独地产生并在合适的反应中偶联在一起。
蛋白质的制备
根据感兴趣的蛋白质,技术人员可利用多种来源。可仅通过在合适的宿主如大肠杆菌(E.coli)、酵母或哺乳动物细胞中的异源表达来重组产生蛋白质(Molecular Cloning:A Laboratory Manual,Joseph Sambrook、E.F.Fritsch和J.Sambrook(作者))。
在本文的实施例部分中提供了GH制备的实例,并可按照技术人员的需要进行修改。
本申请提供包含Fc-结构域的实例。可以从分离自人类和其他动物的全长抗体中获得Fc结构域,或者可以重组产生以及从经转化的哺乳动物细胞或微生物中获得Fc结构域。在本领域中已知多种获得Fc结构域的技术。
可以通过用蛋白水解酶如木瓜蛋白酶或胃蛋白酶消化由全长抗体产生Fc结构域。可使用蛋白A亲和色谱法和DEAE阴离子交换色谱法分离得到的Fab和F(ab’)2与Fc结构域。基于SEC-HPLC分析,可以确定Fc片段的纯度。
当使用重组方法时,可以表达所需的多肽并随后纯化Fc结构域。在一个实施方案中,Fc结构域为人来源的Fc结构域,如从经转化的微生物或哺乳动物细胞中获得的人IgG Fc结构域。
此外,本发明的Fc片段可以是具有天然糖链、与天然形式相比增加的糖链或与天然形式相比减少的糖链的形式,或者可以是无糖基化形式。Fc片段的糖链的增加、减少或去除可通过本领域常见的方法来实现,如化学法、酶法以及利用微生物如大肠杆菌的遗传工程法。
来自大肠杆菌的Fc片段(其将为无糖基化的)将分别具有减少的或弱的与Fcγ受体I、IIa、IIb、IIIa的结合,这些结合具有低ADCC和CDC的优点。优选无糖基化hIgG4 Fc片段,其天然地不与Fcγ受体III结合。
硫原子和游离半胱氨酸
如上所述,连接体经由硫原子与一个或多个蛋白质共价键合。在实施方案中,硫原子来源于蛋白质硫醇。蛋白质硫醇的最常见来源为氨基酸半胱氨酸。半胱氨酸可以参与二硫键,并且可能优选的是提供硫醇的半胱氨酸通常不参与二硫键。或者,可以还原二硫键,以提供可用于缀合的两个硫原子。
在一个实施方案中,硫原子来源于缀合物的蛋白质中存在的半胱氨酸氨基酸的硫醇。由于蛋白质缀合物可包含一个或多个硫原子,因此硫原子可来源于一个或多个蛋白质半胱氨酸。因此,蛋白质半胱氨酸为该蛋白质的多肽的半胱氨酸残基。
在一个实施方案中,半胱氨酸可以是野生型残基,而在其他实施方案中,半胱氨酸可以是变异半胱氨酸,如野生型残基的氨基酸置换。由于多个Cys可以参与缀合物,一些-S-可以来自野生型Cys,而其他的可以是变异Cys。
在一个实施方案中,本发明涉及根据任何一个先前实施方案的缀合物,其中一个或多个蛋白质半胱氨酸为变异氨基酸残基。
本文所述的方法适合于制备蛋白质缀合物,其中至少一个待缀合的蛋白质包含游离半胱氨酸。游离半胱氨酸(Cys)是可用于经由硫醇反应性连接体缀合的半胱氨酸残基。游离Cys通常是不参与内部蛋白质二硫键的半胱氨酸残基。如以上对于人生长激素所述,游离Cys可通过在感兴趣的蛋白质中的适当位置引入氨基酸而重组产生。通常,氨基酸插入将是非必要氨基酸的置换,但是Cys也可以作为附加的氨基酸引入。
游离半胱氨酸常常需要在缀合反应之前释放,因为具有游离Cys的蛋白质可与其他硫分子形成混合二硫化物,所述其他硫分子通常是在蛋白质产生和纯化时存在于细胞提取物中的有机小分子。
也可以通过还原现有的二硫键来生成游离半胱氨酸,该二硫键将提供两个可用的游离半胱氨酸。在一个实施方案中,可以通过还原Fc结构域来生成两个等价的半胱氨酸,在该Fc结构域的两个多肽之间包含至少一个二硫键。在一个实施方案中,制备在两个Fc多肽之间具有单个二硫键的Fc结构域。在一个实施方案中,Fc结构域在Fc结构域的铰链区中包含单个二硫键。如实施例2所示,可以使用本文所述的方法将这样的分子与三价连接体的两个臂连接。得到的蛋白质缀合物(或缀合物中间体)将具有与Fc结构域的对称连接以及可用于与第二蛋白质缀合的第三臂。如下所述,缀合的顺序可以变化。
连接体的制备
可通过标准化学技术产生本发明的连接体,本文包含了多个实例。蛋白质缀合物的反应流程
根据在缀合中使用的蛋白质和待使用的单独连接体,可以应用多种方法,并且可以预见,技术人员能够在不偏离本发明概念的情况下针对任何具体需要调整如本文所述的方法。
待缀合的蛋白质和连接体单独地进行制备和纯化。
本发明的一个方面涉及用于偶联至少两个蛋白质的方法。通过使用具有不同反应性末端的连接体获得与两个蛋白质的顺序反应。在两个蛋白质均包含游离半胱氨酸的实施方案中,利用具有两个硫醇反应性末端的连接体将这类蛋白质偶联在一起。
所述方法利用如针对连接体所述具有卤乙酰胺作为反应性末端的连接体进一步得到例证。
在实施方案中,本发明涉及用于制备蛋白质缀合物的方法,其中利用硫醇反应性连接体将蛋白质1-SH和蛋白质2-SH偶联在一起,获得了式II的蛋白质缀合物
式II蛋白质1-S-CH2-C(=O)-NH-连接体-NH-C(=O)-CH2-S-蛋白质2
所述硫醇反应性连接体为:
LG1-CH2-C(=O)-NH-连接体-NH-C(=O)-CH2-LG2,
其中LG1具有高于LG2的反应性,
所述方法包括以下步骤:
a)使蛋白质1-SH与所述连接体的-NH-C(=O)-CH2-LG1反应
b)获得缀合物中间体:蛋白质1-S-CH2-C(=O)-NH-连接体-NH-C(=O)-CH2-LG2
c)进行离去基团交换反应,以提高LG2的反应性
d)使c)的中间体与蛋白质2-SH反应
e)获得所述蛋白质缀合物。
在只有一个蛋白质2包含游离半胱氨酸的情况下,蛋白质1可通过替代途径偶联,以提供具有以下结构的中间体:蛋白质1-连接体-NH-C(=O)-CH2-LG。
方法步骤c)、d)和e)仍可用于稍作修改的方法中,其中步骤a)的缀合使用具有以下结构的中间体进行:蛋白质1-连接体-NH-C(=O)-CH2-LG。
在一个实施方案中,本发明涉及用于制备蛋白质缀合物的方法,其中蛋白质1-连接体-NH-C(=O)-CH2-LG2和蛋白质2-SH偶联在一起,获得了以下蛋白质缀合物
式I:蛋白质1-连接体-NH-C(=O)-CH2-S-蛋白质2
其中LG2为低反应性的离去基团,
所述方法包括以下步骤:
b)获得缀合物中间体:蛋白质1-连接体-NH-C(=O)-CH2-LG2
c)进行离去基团交换反应,以提高LG2的反应性
d)使c)获得的中间体与蛋白质2-SH反应
e)获得所述蛋白质缀合物。
离去基团交换反应可以按照水性Finkelstein卤素交换反应进行,由此提高离去基团的反应性。
在一个实施方案中,LG2为Cl。在这样的实施方案中,在步骤c)中-NH-C(=O)-CH2-Cl转化为-NH-C(=O)-CH2-I,后者随后与蛋白质2-SH反应以获得蛋白质缀合物。以这种方式,可用相当低活性形式的LG2制备第一中间体。
在一个实施方案中,LG1为Br且LG2为Cl。由于溴乙酰胺比氯乙酰胺的反应性更高,因此离去基团将决定缀合的顺序,并且将LG2从Cl变为I的后续激活将确保第二中间体的连接体末端对蛋白质2具有反应性。
本发明还涉及超过两个蛋白质如三个蛋白质的偶联,例如本文实施例2的GH和Fc缀合。
在一个实施方案中,所述方法用于制备蛋白质缀合物,其中蛋白质1-SH和蛋白质2-SH的两个拷贝偶联在一起,获得了式IV的蛋白质缀合物。
在一个实施方案中,本发明涉及用于制备蛋白质缀合物的方法,其中利用硫醇反应性连接体将蛋白质1-SH和2×(蛋白质2-SH)偶联在一起,获得了以下蛋白质缀合物
式IV
所述硫醇反应性连接体为:
其中LG1具有高于LG2的反应性,
所述方法包括以下步骤:
a)使蛋白质1-SH与所述连接体的-NH-C(=O)-CH2-LG1(R1)反应
b)获得缀合物中间体:蛋白质1-S-CH2-C(=O)-NH-连接体[-NH-C(=O)-CH2-LG2]2
c)进行离去基团交换反应,以提高LG2的反应性
d)使c)的中间体与蛋白质2-SH反应
e)获得所述蛋白质缀合物。
如上所述,离去基团交换反应转化用于激活连接体的第二和第三反应性末端。在一个实施方案中,LG2从Cl变为I,提高了反应性。在一个实施方案中,LG1从Cl变为I,提高了反应性。在一个实施方案中,在最终中间体中的R2和R3反应性末端均包含-NH-C(=O)-CH2-I。
如果通过替代手段获得b)的中间体,或者如果蛋白质连接体缀合物仅在第二(和/或第三)臂中包含硫醇反应性末端,则可以从步骤2开始应用所述方法。
b)获得缀合物中间体:蛋白质1-连接体[-NH-C(=O)-CH2-LG2]2
c)进行离去基团交换反应,以提高LG2的反应性
d)使c)的中间体与蛋白质2-SH和蛋白质3-SH反应
e)获得所述蛋白质缀合物。
在一个这样的实施方案中,所述方法用于制备蛋白质缀合物,其中蛋白质1-连接体和蛋白质2-SH偶联在一起,获得了式III的蛋白质缀合物,其中蛋白质2的两个拷贝经由硫原子连接。
式III
所述方法包括以下步骤:
a)获得以下结构的缀合物中间体:
其中LG2为低反应性的离去基团,
b)进行离去基团交换反应,以提高LG2的反应性
c)使b)的中间体与蛋白质2-SH反应
d)获得所述蛋白质缀合物。
可使用具有以下结构的蛋白质连接体中间体:
并且如上所述,LG可以是卤素,其被交换为具有更高反应性的替代卤素,并且如前所述,Cl可以被交换为对Cys残基具有高度反应性的I。
基于以上流程,反应性末端的反应性是重要的,并且在一个实施方案中,LG1具有比LG2更高的反应性。在一个实施方案中,LG1为Br或I。在一个实施方案中,LG2为Cl。
在一个实施方案中,LG2为Cl且被交换为I。该交换反应可以按照水性卤素交换的方式进行,如水性Finkelstein反应。该反应可以在KI水溶液中进行。该溶液可进一步包含抗坏血酸。在一个实施方案中,该反应在0.1-5M KI和10-50mM抗坏血酸的存在下进行。
缀合方法的各个步骤的持续时间可以针对待缀合的单独蛋白质进行调整。
与蛋白质1的反应步骤可进行1-24小时,如过夜。
与蛋白质2的反应步骤可进行1-24小时,如过夜。
以上方法可利用上文所述的连接体进行,如视情况而定的两臂或三臂连接体。
在本文提供的全部实例中,卤乙酰胺与还原的游离半胱氨酸之间的反应导致硫醚(-CH2-S-CH2-)的形成,该硫醚连接所述连接体结构与多肽。该硫醚的-CH2-基团可被认为是连接体和/或蛋白质的一部分,但可以被包含在结构中以说明该连接的性质。
中间体
基于上述方法的总体设置,所述的一系列产物和中间体是本发明的一部分。
从上面可以清楚看出,在许多情况下蛋白质缀合可以以相反顺序进行。在本概述中,将蛋白质1视为待缀合的第一蛋白质。在本申请的实施例3中还阐述了缀合的两个不同顺序。
在一个实施方案中,所述中间体是具有与连接体的两个臂单独连接的两个Fc多肽的结构,而第一臂用于与不同的蛋白质/肽缀合。因此,根据本发明的中间体可通过三价连接体结构,包括与臂2和臂3连接的Fc多肽,而臂1仍然是游离的。在替代方案中,中间体是与三价连接体的臂1的蛋白质缀合物,因此该三价连接体适合于经由臂2和臂3与Fc多肽缀合。
不依赖于连接体的反应性末端,包含两个Fc多肽的蛋白质缀合物的整体结构为
在实施方案中,所述缀合物包含通过卤乙酰胺离去基团介导的Fc的硫醇连接,从而提供在蛋白质缀合物中插入的结构-NH-C(=O)-CH2-:
本申请的其他地方已经提供了关于三价连接体的详情,并可被解读成以上结构。
虽然本发明的某些特征已经在本文中进行了描述,并在后续实施例中进行了说明,但本领域普通技术人员将会想到许多修改、替换、变化和等同物。因此,应当理解,所附实施方案和权利要求旨在涵盖落在本发明真正精神内的所有这样的修改和变化。
实施方案
1.具有以下结构的蛋白质缀合物
其中
连接体为化学部分
S为硫原子,并且
蛋白质1经由所述连接体和硫原子与蛋白质2和蛋白质3共价连接。
2.根据实施方案1所述的蛋白质缀合物,其中所述缀合物具有以下结构
3.根据实施方案1所述的蛋白质缀合物,其中所述缀合物具有以下结构
其中U表示中心单元,RR1为反应性末端基团,并且S1、S2和S3表示单独的间隔区。
4.根据任一项前述实施方案所述的缀合物,其中所述硫原子(-S-)是硫醚(-CH2-S-CH2-)的一部分。
5.根据任一项前述实施方案所述的缀合物,其中U包含氮原子或由氮原子组成。
6.根据任一项前述实施方案所述的缀合物,其中U包含苯环结构或由苯环结构组成。
7.根据任一项前述实施方案所述的缀合物,其中蛋白质2和蛋白质3为Fc多肽。
8.根据任一项前述实施方案所述的缀合物,其中所述缀合物具有以下结构:
9.根据任一项前述实施方案所述的缀合物,其中所述缀合物具有以下结构:
蛋白质1-RR1-S1-U-[S2-NH-C(=O)-CH2-S-Fc]2
其中
RR1为反应性末端基团,
S1和S2表示单独的间隔区,
U表示中心单元,并且
Fc为Fc多肽。
10.根据任一项前述实施方案所述的缀合物,其中蛋白质1为生长激素。
11.根据任一项前述实施方案所述的缀合物,其中所述缀合物具有以下结构:
其中GH表示生长激素分子。
12.根据任一项前述实施方案所述的缀合物,其中所述缀合物具有以下结构:
GH-RR1-S1-U-[S2-NH-C(=O)-CH2-S-Fc]2
其中
GH表示生长激素分子,
RR1为反应性末端基团,
S1和S2表示单独的间隔区,
U表示中心单元,并且
Fc为Fc多肽。
13.根据实施方案7至12所述的缀合物,其中所述Fc多肽来源于IgG,如IgG1、IgG2、IgG3或IgG4。
14.根据实施方案7-13中任一项所述的缀合物,其中所述Fc多肽包含铰链区。
15.根据实施方案7-14中任一项所述的缀合物,其中每个Fc多肽的铰链区包含Cys残基。
16.根据实施方案7-15中任一项所述的缀合物,其中所述Fc多肽的铰链区选自由IgG1衍生的铰链序列和IgG4衍生的序列组成的序列的组。
17.根据实施方案16所述的缀合物,其中所述IgG1衍生的铰链序列选自:PKSCDKTHTCPPCP、PPCP、PCP和CP。
18.根据实施方案16所述的缀合物,其中所述IgG1衍生的铰链序列选自:SKYGPPCPSCP、PSCP、SCPL和CP。
19.根据任一项前述实施方案所述的缀合物,其具有以下结构
20.根据任一项前述实施方案所述的缀合物,其中所述缀合物具有以下结构:
21.根据任一项前述实施方案所述的缀合物,其中所述缀合物具有以下结构:
22.根据任一项前述实施方案所述的缀合物,其中所述硫原子(-S-)来源于蛋白质硫醇。
23.根据任一项前述实施方案所述的缀合物,其中所述硫原子(-S-)来源于蛋白质半胱氨酸。
24.根据任一项前述实施方案所述的缀合物,其中所述硫原子(-S-)来源于游离Cys。
25.根据任一项前述实施方案所述的缀合物,其中一个或多个所述蛋白质半胱氨酸为野生型残基。
26.根据任一项前述实施方案所述的缀合物,其中一个或多个所述蛋白质半胱氨酸为变异氨基酸残基。
27.根据任一项前述实施方案所述的缀合物,其中连接蛋白质2和蛋白质3与连接体的-S-来自野生型半胱氨酸。
28.根据前述实施方案19-27中任一项所述的缀合物,其中连接蛋白质1与连接体的-S-来源于变异半胱氨酸。
29.根据前述实施方案19-28中任一项所述的缀合物,其中连接蛋白质1的-S-来源于游离Cys。
30.根据前述实施方案19-29中任一项所述的缀合物,其中连接蛋白质1的-S-来源于生长激素变体中的游离半胱氨酸,所述变体选自T3C、P5C、S7C、D11C、H18C、Q29C、E30C、E33C、A34C、Y35C、K38C、E39C、Y42C、S43C、D47C、P48C、S55C、S57C、P59C、S62、E65C、Q69C、E88C、Q91C、S95C、A98C、N99C、S100C、L101C、V102C、Y103C、D107C、S108C、D112C、Q122C、G126C、E129C、D130C、G131C、P133C、T135C、G136C、T142C、D147C、N149C、D154C、A155C、L156C、R178C、E186C、G187C和G190C。
31.根据前述实施方案19-30中任一项所述的缀合物,其中连接蛋白质1的-S-来源于选自A98C、N99C、L101C、V102C和S108C的生长激素变体中的游离半胱氨酸。
32.根据前述实施方案19-31中任一项所述的缀合物,其中连接蛋白质1的-S-来源于位于生长激素变体中氨基酸93-106内的Cys置换。
33.具有以下结构的三价连接体:
其中U表示中心单元,
S1、S2和S3表示单独的间隔区,并且
R1、R2和R3单独地表示反应性末端。
34.根据实施方案33所述的连接体,其中R1、R2和R3是不相同的。
35.根据前述实施方案33-34中任一项所述的连接体,其中R2和R3是相同的。
36.根据前述实施方案33-35中任一项所述的连接体,其中R2和R3是相同的,但R1是不同的。
37.根据前述实施方案33-36中任一项所述的连接体,其中R2和R3是硫醇反应性末端。
38.根据前述实施方案33-37中任一项所述的连接体,其中R2和R3各自包含卤素离去基团,如溴化物、氯化物或碘化物。
39.根据前述实施方案33-38中任一项所述的连接体,其中R2和R3包含-NH-C(=O)-CH2-LG,从而提供以下结构的连接体:
其中LG2和LG3是卤素离去基团
40.根据前述实施方案33-39中任一项所述的连接体,其中反应性末端R2和R3是相同的cys反应性末端。
41.根据前述实施方案33-40中任一项所述的连接体,其中R1与R2和R3不同。
42.根据前述实施方案33-41中任一项所述的连接体,其中R1具有与R2和R3不同的反应性。
43.根据前述实施方案33-42中任一项所述的连接体,其中R1是硫醇反应性末端。
44.根据前述实施方案33-43中任一项所述的连接体,其中R1为硫醇反应性的,其包含离去基团,如溴化物、氯化物或碘化物。
45.根据前述实施方案33-44中任一项所述的连接体,其中第一连接体臂具有结构LG1-CH2-C(=O)-S1-。
46.根据前述实施方案33-45中任一项所述的连接体,其中R1包含Cl作为LG1,且R2和R3包含Br作为LG2。
47.根据前述实施方案33-46中任一项所述的连接体,其中R1包含Br作为LG1,且R2和R3包含Cl作为LG2。
48.根据前述实施方案33-47中任一项所述的连接体,其中S2和S3是相同的。
49.根据前述实施方案33-48中任一项所述的连接体,其中连接体的长度为10至60个原子,如12-45个或如15-40个原子。
50.根据前述实施方案33-49中任一项所述的连接体,其中S2和S3是短间隔区,如-(CH2)2-。
51.根据前述实施方案33-50中任一项所述的连接体,其中S1与S2和S3不同。
52.根据前述实施方案33-51中任一项所述的连接体,其中S1是长度为10-50个原子的延长间隔区。
53.根据前述实施方案33-52中任一项所述的连接体,其中S1包含通过肽键连接的一个或多个间隔区元件。
54.根据前述实施方案33-53中任一项所述的连接体,其中S1的间隔区元件选自:
和
其中k为1-5范围内的整数,并且n为1-5范围内的整数。
55.根据前述实施方案33-54中任一项所述的连接体,其中间隔区元件为*-NH-(CH2)2-O-(CH2)2-O-CH2-CO-*(OEG或8-氨基-3,6-二氧杂辛酸的双价基团)。
56.根据前述实施方案33-55中任一项所述的连接体,其中所述连接体选自:
(S)-4-(2-{2-[((S)-1-{二-[2-(2-氯-乙酰基氨基)-乙基]-氨基甲酰基}-3-羧基-丙基氨基甲酰基)-甲氧基]-乙氧基}-乙基氨基甲酰基)-2-(2-溴-乙酰基氨基)-丁酸
(4S,18S)-4-(二(2-(2-氯乙酰胺基)乙基)氨基甲酰基)-18-(2-(2-(2-(2-溴乙酰胺基)乙氧基)乙氧基)乙酰胺基)-6,15-二氧代-8,11-二氧杂-5,14-二氮杂十九烷二酸
2-(2-溴乙酰胺基)-N,N-二(2-(2-氯乙酰胺基)乙基)乙酰胺
2-(2-(2-(2-(2-溴乙酰胺基)乙氧基)乙氧基)乙酰胺基)-N,N-二(2-(2-氯乙酰胺基)乙基)乙酰胺
(13R,18S)-18-(二(2-(2-氯乙酰胺基)乙基)氨基甲酰基)-1-溴-13-羧基-2,11,16-三氧代-6,9-二氧杂-3,12,17-三氮杂二十一烷-21-酸
(18R,23S)-23-(二(2-(2-氯乙酰胺基)乙基)氨基甲酰基)-1-溴-18-羧基-2,7,16,21-四氧代-11,14-二氧杂-3,8,17,22-四氮杂二十六烷-26-酸
(R)-4-{2-[2-({二-[2-(2-氯-乙酰基氨基)-乙基]-氨基甲酰基}-甲氧基)-乙氧基]-乙基氨基甲酰基}-2-[(S)-2-(2-{2-[2-(2-溴-乙酰基氨基)-乙氧基]-乙氧基}-乙酰基氨基)-4-羧基-丁酰基氨基]-丁酸
(4S,18S)-4-(二(2-(2-溴乙酰胺基)乙基)氨基甲酰基)-18-(2-(2-(2-(2-氯乙酰胺基)乙氧基)乙氧基)乙酰胺基)-6,15-二氧代-8,11-二氧杂-5,14-二氮杂十九烷二酸
(4S)-5-[二[3-[(2-氯乙酰基)氨基]丙基]氨基]-4-[[2-[2-[2-[(2-溴乙酰基)氨基]乙氧基]乙氧基]乙酰基]氨基]-5-氧代-戊酸
(2R)-6-[二[2-[(2-氯乙酰基)氨基]乙基]氨基甲酰基氨基]-2-[[2-[2-[2-[(2-溴乙酰基)氨基]乙氧基]乙氧基]乙酰基]氨基]己酸
N-[2-[2-[2-[2-[(2-溴乙酰基)氨基]乙氧基]乙氧基]乙基氨基甲酰基-[2-[(2-氯乙酰基)氨基]乙基]氨基]乙基]-2-氯-乙酰胺
和
(2R)-2-[[2-[2-[2-[(2-溴乙酰基)氨基]乙氧基]乙氧基]乙酰基]氨基]-5-[2-[2-[2-[[(1S)-3-羧基-1-[2-[(2-氯乙酰基)-[2-[(2-氯乙酰基)氨基]乙基]氨基]乙基氨基甲酰基]丙基]氨基]-2-氧代-乙氧基]乙氧基]乙基氨基]-5-氧代-戊酸。
57.用于制备蛋白质缀合物的方法,其中蛋白质1-SH、蛋白质2-SH和硫醇反应性连接体偶联在一起,获得了式II的蛋白质缀合物
蛋白质1-S-CH2-C(=O)-NH-连接体-NH-C(=O)-CH2-S-蛋白质2
(式II)
其中所述硫醇反应性连接体具有以下结构:
LG1-CH2-C(=O)-NH-连接体-NH-C(=O)-CH2-LG2,
其中LG1具有高于LG2的反应性,
所述方法包括以下步骤:
a)使蛋白质1-SH与所述连接体的-NH-C(=O)-CH2-LG1反应
b)获得缀合物中间体:蛋白质1-S-CH2-C(=O)-NH-连接体-NH-C(=O)-CH2-LG2
c)进行离去基团交换反应,以提高LG2的反应性
d)使c)的中间体与蛋白质2-SH反应
e)获得所述蛋白质缀合物。
58.用于制备蛋白质缀合物的方法,其中蛋白质1-连接体-NH-C(=O)-CH2-LG和蛋白质2-SH偶联在一起,获得了式I的蛋白质缀合物
蛋白质1-连接体-NH-C(=O)-CH2-S-蛋白质2 (式I)
其中LG为低反应性的离去基团,
所述方法包括以下步骤:
b)获得缀合物中间体:蛋白质1-连接体-NH-C(=O)-CH2-LG
c)进行离去基团交换反应,以提高LG的反应性
d)使b)的缀合物中间体与蛋白质2-SH反应
e)获得所述蛋白质缀合物。
59.用于制备蛋白质缀合物的方法,其中蛋白质1-连接体和蛋白质2-SH偶联在一起,获得了式III的蛋白质缀合物:
所述方法包括以下步骤:
b)获得以下结构的缀合物中间体:
其中LG2为低反应性的离去基团,
c)进行离去基团交换反应,以提高LG2的反应性
d)使b)的中间体与蛋白质2-SH反应
e)获得所述蛋白质缀合物。
60.用于制备蛋白质缀合物的方法,其中蛋白质1-SH、蛋白质2-SH和硫醇反应性连接体偶联在一起,获得了式VI的蛋白质缀合物
其中该硫醇反应性连接体具有以下结构:
其中LG1具有高于LG2的反应性,
所述方法包括以下步骤:
a)使蛋白质1-SH与所述连接体的-NH-C(=O)-CH2-LG1反应
b)获得缀合物中间体:蛋白质1-S-CH2-C(=O)-NH-连接体-[NH-C(=O)-CH2-LG2]2
c)进行离去基团交换反应,以提高LG2的反应性
d)使c)的缀合物中间体与蛋白质2-SH反应
e)获得所述蛋白质缀合物。
61.根据上述实施方案57-60中任一项所述的方法,其中LG1为Br。
62.根据上述实施方案57-61中任一项所述的方法,其中LG2为Cl。
63.根据上述实施方案57-62中任一项所述的方法,其中LG1为Cl。
64.根据上述实施方案57-63中任一项所述的方法,其中LG2为Br。
65.根据上述实施方案57-64中任一项所述的方法,其中所述交换反应为Cl交换为I。
66.根据上述实施方案57-65中任一项所述的方法,其中所述交换反应在0.1-5M KI和10-50mM抗坏血酸的存在下进行。
67.根据上述实施方案57-66中任一项所述的方法,其中蛋白质-SH与硫醇反应性连接体或缀合物中间体反应过夜。
68.根据上述实施方案57-67中任一项所述的方法,其中所述蛋白质1-连接体-[NH-C(=O)-CH2-I]2与蛋白质2-SH反应过夜。
69.根据上述实施方案57-68中任一项所述的方法,其中Fc结构域经由两个Fc多肽链的共价连接与蛋白质1缀合。
70.根据上述实施方案57-69中任一项所述的方法,其中包括通过还原获得蛋白质-SH的步骤。
实施例
缩写:
amu=原子质量单位
Boc=叔丁氧羰基
O-t-Bu=叔丁酯
t-Bu=叔丁基
CDCl3=氘代氯仿
CD3OD=四氘代甲醇
CV=柱体积
DMSO-d6=六氘代二甲基亚砜
DCM=DCM,CH2Cl2,二氯甲烷
DIC=二异丙基碳二亚胺
DIPEA=二异丙基乙胺
DMF=N,N-二甲基甲酰胺
DMSO=二甲基亚砜
DTT=二硫苏糖醇
EDAC=1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐
Et2O=乙醚
EtOAc=乙酸乙酯
FA=甲酸
Fmoc=9H-芴-9-基甲氧羰基
Fmoc-Glu-O-t-Bu=N-Fmoc-谷氨酸-1-叔丁酯
Fmoc-Lys(Mtt)-OH=(S)-6-[(二苯基-对甲苯基-甲基)-氨基]-2-(9H-芴-9-基甲氧羰基氨基)-己酸
Fmoc-OEG-OH=(2[2-(Fmoc-氨基)乙氧基]乙氧基)乙酸
Fmoc-Thx-OH=N-Fmoc-反式-4-氨甲基环己烷羧酸
H2O=水
hr(s)=小时
Hz=赫兹
HOBt=1-羟基苯并三唑
HPLC=高压液相色谱法
HPLC-MS=高压液相色谱-质谱法
i.v.=静脉内
L=升
M=摩尔浓度
mbar=毫巴
mg=毫克
min.=分钟
mL=毫升
mM=毫摩尔浓度
mol=摩尔
mmol=毫摩尔
m/z=质荷比
MS=质谱法
MeCN=乙腈
MeOH=甲醇
μL=微升
N=当量浓度
nm=纳米
nmol=纳摩尔
NaCl=氯化钠
NaOH=氢氧化钠
NMR=核磁共振波谱法
OEG=(2[2-(氨基)乙氧基]乙氧基)乙酰基
ppm=百万分率
PyBrOP=三吡咯烷基溴化鏻六氟磷酸盐
p.o.=经口
RP=反相
rt或RT=室温
tr或Rt=保留时间
sec=秒
s.c.=皮下
TCTU=O-(6-氯-苯并三唑-1-基)-N,N,N′,N′-四甲基脲四氟硼酸盐
TEA=三乙胺
TFA=三氟乙酸
THF=四氢呋喃
TIS=三异丙基硅烷
TSTU=O-(N-琥珀酰亚胺基)-1,1,3,3-四甲基脲四氟硼酸盐
HATU=1-[二(二甲基氨基)亚甲基]-1H-1,2,3-三唑并[4,5-b]吡啶3-氧化物六氟磷酸盐
TCEP=三(2-羧乙基)膦
TPPDS=二(对磺酸苯基)苯基膦
TPPTS=三((间磺酸苯基)苯基膦
方法
方法1-生长激素蛋白质的制备和分析方法
将编码生长激素或生长激素变体的基因重组插入到质粒载体中。随后利用该质粒载体转化合适的大肠杆菌菌株。hGH或GH变体可以表达为具有N-末端甲硫氨酸或表达为MEAE融合物,MEAE序列随后从中切掉。
在25%甘油中制备细胞原液,并在-80℃下储存。将甘油原液菌株接种到LB板中,并随后在37℃下温育过夜。每个板的内容物用LB培养基洗涤,并稀释到500mL LB培养基中进行表达。将培养物在37℃下以220rpm摇动温育,直到达到OD600 0.6。随后的诱导在25℃下利用0.2mM IPTG进行16hr。最后通过离心收获细胞。
随后使细胞悬浮于含0.05%吐温20、2.5mM EDTA、10mM半胱胺和4M脲的10mM Tris-HCl,pH 9.0中,并使用细胞破碎器在30kPSI下进行破碎。通过离心收集上清液并随后进行层析纯化。
使用离子交换色谱法和疏水相互作用进行纯化,然后使用从CHO细胞中表达的人二肽基肽酶I(hDPPI)去除肽标签。通过等电沉淀和离子交换色谱法实现最终纯化。纯化也可以通过使用但不限于离子交换色谱法、疏水相互作用色谱法、亲和色谱法、大小排阻色谱法和本领域技术人员已知的基于膜的分离技术来实现。
生长激素制剂的表征
使用MALDI-MS分析完整的纯化蛋白质。所观测到的质量符合由氨基酸序列推断的理论质量。
可以在用DTT还原二硫键之前和之后,通过利用胰蛋白酶和AspN消化的肽作图以及随后对消化物的MALDI-MS分析,来证明预期的连接二硫键。
蛋白水解消化:
将碳酸氢铵缓冲液中1mg/mL的100μL测试化合物溶液在37℃下用酶降解24hr。在各个时间点采集子样品并通过10倍稀释到1%TFA中酸化该样品来终止蛋白水解反应。通过反相HPLC分析这些经稀释的样品以估算蛋白水解消化的程度。
HPLC方法:
将10μL的上述溶液注射在反相Vydac C4 2×150mm柱上,该柱经30min的时间段在0.2mL/min的流速下采用0.1%TFA水溶液至含0.1%TFA的100%MeCN的线性梯度洗脱。峰的检测在214nm UV吸收下进行。根据时间点t=T处的峰面积(AT)和t=0处的峰面积(A0)以(AT/A0)×100%计算时间点t=T处的完整化合物百分比(%)。使用GraphPad Prims软件5.01版,将完整化合物百分比(%)对时间作图。半衰期(T1/2)也通过GraphPad Prism软件按照单相衰减进行计算。可使用的酶的实例为弹性蛋白酶(Sigma,来自猪胰脂肪酶)和胰凝乳蛋白酶(Roche测序级)。缓冲液的实例为50mM碳酸氢铵,pH=8.5。
毛细管电泳:
使用Agilent Technologies 3DCE系统(Agilent Technologies)进行毛细管电泳。使用Agilent Technologies 3DCE ChemStation进行数据采集和信号处理。毛细管是来自Agilent的64.5cm(56.0cm有效长度)50μm i.d.“长光路毛细管”。在200nm(16nm Bw,参考380nm和50nm Bw)下进行UV检测。运行电解质为磷酸盐缓冲液50mM pH 7(方法A)。毛细管用0.1M NaOH适应3min,随后用Milli-Q水适应2min并且用电解质适应3min。每次运行之后,毛细管用milli-Q水冲洗2min,随后用磷酸冲洗2min并且用milli-Q水冲洗2min。流体动力学注射在50mbar下进行4.0sec。电压为+25kV。毛细管温度为30℃并且运行时间为10.5min。
Maldi-Tof质谱法:
使用Autoflex Maldi-Tof仪器(Bruker)测定分子量。使用α-氰基-4-羟基-肉桂酸作为基质制备样品。
RP-HPLC:
使用Vydac 218TP54 4.6mm×250mm 5μm C-18硅胶柱(The Separations Group,Hesperia)在Agilent 1100系统上进行RP-HPLC分析。通过在214nm、254nm、280nm和301nm处的UV进行检测。该柱用0.1%TFA/H2O平衡,并通过0%至90%MeCN相对于0.1%TFA/H2O的合适梯度洗脱样品。
LC-MS:
在装有两个Perkin Elmer Series 200微泵、Perkin Elmer Series 200自动进样器、Applied Biosystems 785A UV检测器和Sedex 75蒸发光散射检测器的PE-Sciex API 100或150质谱仪上进行LC-MS分析。Waters Xterra 3.0mm×50mm 5μC-18硅胶柱在室温下以1.5mL/min进行洗脱。该硅胶柱用5%MeCN/0.1%TFA/H2O平衡,并用5%MeCN/0.1%TFA/H2O洗脱1.0min,随后用90%MeCN/0.1%TFA/H2O的线性梯度洗脱7min。通过在214nm处的UV检测和蒸发光散射进行检测。将柱洗脱物的级分引入到PE-Sciex API 100质谱仪的离子喷射界面中。在运行过程中每2秒扫描质量范围300-2000amu。
蛋白质的定量:
通过使用NanoDrop ND-1000UV分光光度计测量280nm处的吸光度来估算蛋白质浓度。
用于确定衍生位点的酶促肽作图:
通过Asp-N消化经还原和烷基化的蛋白质进行肽作图。首先根据标准程序用DTT和碘乙酰胺处理蛋白质。使用HPLC纯化烷基化产物。随后用内切蛋白酶Asp-N(Boehringer)以1∶100的酶:底物之比将纯化的烷基化产物消化过夜。使用C-18柱和标准TFA/MeCN缓冲液体系HPLC分离消化物。将得到的肽图与未衍生的hGH的肽图进行比较,并收集具有不同保留时间的级分,并进一步使用Maldi-tof质谱法进行分析。
SDS聚丙烯酰胺凝胶电泳:
使用NuPAGE 4%-12%Bis-Tris凝胶(Invitrogen NP0321BOX)进行SDS聚丙烯酰胺凝胶电泳。凝胶经银染色(Invitrogen LC6100)或经考马斯染色(Invitrogen LC6065),并且在相关情况下还用碘化钡针对PEG进行染色,如M.M.Kurfurst在Anal.Biochem.200(2),244-248,(1992)中所述。
蛋白质色谱法:
在来自GE Health Care的Explorer色谱系统和柱上进行蛋白质色谱法。使用Q-Sepharose HP 26/10柱进行阴离子交换。起始缓冲液为20mM三乙醇胺缓冲液pH 8.5,而洗脱缓冲液为起始缓冲液+0.2M NaCl。通常用0%-75%洗脱缓冲液的梯度经15个柱体积洗脱化合物。使用HiPrep 26/10柱进行脱盐和缓冲液更换。
方法2-Fc结构域的制备方法
Fc结构域可通过本领域已知的技术表达,如通过在大肠杆菌中表达(WO05047334、WO05047335、WO05047336、WO05047337和WO05001025)或在哺乳动物细胞如HEC中表达(Farge,F.等人,Joumal ofChromatography(1976),第123卷,第247-250页)。以下总体方法已应用于本申请。
使用在铰链区的N-末端处截短的人IgG4的片段获得Fc结构域。将包括Met起始密码子的编码区插入pET11d衍生的载体中,以引导MPSCPAPEFLGGPSVF...N-末端的Fc多肽的表达。Fc多肽在大肠杆菌中表达。使用的菌株为如WO2010052335中所述的(BL21(DE3)_TKO::ybhE,其另外包括ybhE敲入。随后纯化Fc结构域。起始密码子ATG(Met密码子)包括在内,与截短的铰链符合读框,从而允许在大肠杆菌中表达。该甲硫氨酸由于宿主酶而被去除并且不存在于纯化的Fc中,因此该Fc在N-末端具有脯氨酸。使用确定成分培养基获得可溶Fc片段从大肠杆菌细胞质中的表达水平大于5g/L。纯化后获得1.4g/L的产率。包括体外二硫键形成步骤,以确保Fc结构域的正确折叠。
在37℃下在20-L发酵罐中的确定成分培养基中培养大肠杆菌细胞至光密度(OD600)为约80。随后用0.2mM IPTG诱导培养物并在25℃下继续培养过夜。最终通过离心收获细胞。
在含有Tris-HCl 50mM、NaCl 300mM、EDTA 5mM和DTT 1mM的pH 7.4缓冲液中均质化细胞沉淀物之后,通过用0.2%PEI(聚乙烯亚胺)处理30min,然后在6,000×g下离心来回收目标蛋白质。使用MabSelect SuR(GE Healthcare Life Sciences)通过亲和色谱法从细胞裂解物的上清液中纯化Fc,并随后在室温下通过加入脲3.5M、胱胺0.01mM,pH 8.5氧化过夜。最后,在pH 8.5下使用Q Sepharose HP(GE Healthcare Life Sciences)通过离子交换色谱法进一步纯化形成的Fc二聚体。最终的蛋白质在TEA(Tris-乙酸盐-EDTA)20mM、NaCl 500mM,pH 8.0中。
方法4-蛋白质缀合物的制备方法-先GH
化学法
缀合方法可用多种包含合适附接点的合适蛋白质进行,此处使用GH变体和Fc结构域举例,其全部包含充当连接体的连接物的一个或多个硫原子。
如下所示制备缀合物GH-A-B-蛋白质(IX):
连接体首先附接至hGH、随后附接至Fc的反应。
(I)中的半胱氨酸任选地以混合二硫化物(GH-S-S-R)的形式受到保护,R为有机小部分。混合二硫化物的非限制性实例可包括半胱胺(R=-CH2CH2NH2)、半胱氨酸(R=-CH2CH(C(=O)OH)NH2)、高半胱氨酸(R=-CH2CH2CH(C(=O)OH)NH2)和谷胱甘肽(R=-CH2CH(C(=O)NH-CH2C(=O)OH)NH-C(=O)CH2CH2CH(C(=O)OH)NH2)之间的二硫化物。
缀合过程利用三价连接体LG1-A-B-(LG2)2(III),其中LG1和LG2独立地表示无机离去基团如-Cl、-Br、-I和/或有机离去基团如甲磺酸酯或甲苯磺酸酯。还原的GH(II)与连接体LG1-A-B-(LG2)n(III)的缀合经由亲核取代而发生(II+III→IV)。通过利用LG1和LG2之间的离去基团能力的差异获得LG1相对于LG2的选择性。为了在下一步中LG2充当合适的离去基团,其经由与碘化钾的水性Finkelstein反应变为碘代(VI)。接着用感兴趣的蛋白质(VIII)(此处为Fc结构域)处理该缀合物中间体(VI),其中使用合适的还原剂如二硫苏糖醇(DTT)、TCEP、TPPTS和TPPDS选择性地还原二硫键(VII→VIII),得到GH-A-B-蛋白质缀合物(IX)。
这些反应步骤可描述如下:从具有内部游离Cys的GH化合物(I)开始,三价连接体(III),和包含可还原二硫键的Fc结构域。
1)任选地经由采用合适的选择性还原剂还原混合二硫化物(I)来释放游离Cys GH(II)
2)采用三价连接体(III)对游离Cys GH(II)进行烷基化,得到Cys缀合的GH蛋白质连接体中间体(IV)
3)经由水性Finkelstein碘交换反应(V)激活中间体(IV)中的离去基团LG2,得到活化的Cys GH缀合物中间体(VI)
4)经由采用合适的选择性还原剂选择性还原二硫键来释放Fc结构域(VII)中的游离半胱氨酸,得到(VIII)
5)使Fc结构域(VIII)与活化的Cys GH缀合物中间体(VI)偶联,得到Cys缀合的GH-Fc缀合物(IX)。
方法5-蛋白质缀合物的制备方法-先Fc
在替代方案中,如下所示制备缀合物GH-A-B-蛋白质(IX):
连接体首先附接至Fc、随后附接至GH的反应。
其中(I)中的半胱氨酸任选地以混合二硫化物(GH-S-S-R)的形式受到保护,R为有机小部分。混合二硫化物的非限制性实例可包括半胱胺(R=-CH2CH2NH2)、半胱氨酸(R=-CH2CH(C(=O)OH)NH2)、高半胱氨酸(R=-CH2CH2CH(C(=O)OH)NH2)和谷胱甘肽(R=-CH2CH(C(=O)NH-CH2C(=O)OH)NH-C(=O)CH2CH2CH(C(=O)OH)NH2)之间的二硫化物。
缀合过程利用三价连接体LG1-A-B-(LG2)2(III),其中LG1和LG2独立地表示无机离去基团如-Cl、-Br、-I和/或有机离去基团如甲磺酸酯或甲苯磺酸酯。连接体(III)经由亲核取代与还原的蛋白质(VIII),例如经由使用(DTT、TCEP、TPPTS和TPPDS或其他还原剂)选择性还原二硫键(VII→VIII)而从(VII)获得的Fc结构域缀合,得到LG1-A-B-蛋白质缀合物(X)。通过利用LG1和LG2之间的离去基团能力的差异获得LG1相对于LG2的选择性。为了在下一个偶联步骤中化合物(X)中的LG1充当合适的离去基团,其经由与碘化钾的水性Finkelstein反应变为碘代(XI)。化合物(XI)随后与还原的GH(II)偶联,得到GH-A-B-蛋白质缀合物(IX)。
这些反应步骤可描述如下:从具有内部游离Cys的GH化合物(I)开始,三价连接体(III),和包含可还原二硫键的Fc结构域。
1)经由采用合适的选择性还原剂选择性还原二硫键来释放Fc结构域(VII)中的游离半胱氨酸,得到(VIII)
2)用三价连接体(III)对Fc结构域(VIII)进行烷基化,得到LG1-A-B-Fc缀合物中间体(X)
3)任选地经由采用合适的选择性还原剂还原混合二硫化物(I)来释放游离Cys GH(II)
4)经由水性Finkelstein碘交换反应(V)激活中间体(X)的离去基团LG1,得到活化的缀合物中间体(XI)
5)使游离Cys GH(II)与活化的缀合物中间体(XI)偶联,得到Cys缀合的GH-Fc化合物(IX)。
试验
试验1-GH受体结合试验
使用表面等离子体共振(SPR)分析来分析GH化合物的受体相互作用。该方法对于GH化合物是通用的。
使用Biacore T100仪器(GE Healtcare,Sweden)通过表面等离子体共振研究了hGH和GH化合物经由位点1与hGH受体的相互作用。根据制造商的说明书,以通常5000RU的水平将抗-hGH mAb(Fitzgerald Industries Internatiohal,USA,#10G05B)固定于CM-5芯片上。hGH或GH以10-25μg/mL被捕获在运行缓冲液(10mM HEPES,0.15M NaCl,30mM EDTA,0.05%表面活性剂P20,pH7.4)中,这产生了250-400 RU捕获配体。随后将0-800nmol浓度的hGHR以30mL/min注射在表面上。具有固定化抗-hGh mAb而没有捕获的hGH的表面用作参考。
采用BiacoreTM评估软件2.0以1∶1朗缪尔结合模型分析动力学数据。
试验2-用以测定生长激素活性的BAF-3GHR试验
在基于细胞的受体效力增殖试验,即BAF试验中测量hGH化合物的生物活性。BAF-3细胞(衍生自骨髓的鼠前B淋巴细胞系)最初依赖IL-3生长和存活。IL-3激活JAK-2和STAT,JAK-2和STAT是相同的介质。GH在受到刺激时激活。在转染人生长激素受体之后,该细胞系变成生长激素依赖性细胞系。该克隆可用来评估不同生长激素样品对BAF-3GHR的存活的影响。
在37℃、5%CO2下将BAF-3GHR细胞在饥饿培养基(没有生长激素的培养基)中培养24hr。
将细胞洗涤并重悬于饥饿培养基中,并接种在培养板中。使用不同浓度的10μL的人生长激素和待测试的生长激素化合物,并将培养板在37℃、5%CO2下温育68hr。
向每个孔中加入随后将细胞温育另外4hr。是氧化还原指示剂,并且通过细胞代谢固有的反应被还原,因此提供对活细胞数的间接测量。
最后,在荧光读板器中测量细胞的代谢活性。以未受生长激素化合物或对照刺激的细胞%表示样品中的吸光度,并且可从浓度-响应曲线计算活性(刺激50%细胞的化合物的量)。
试验3:用于在正常大鼠中评价生长激素化合物的药代动力学参数的试验
在雄性Sprague Dawley大鼠中研究了静脉内(iv.)单剂量给药后实例化合物的药代动力学。
在由甘氨酸20mg/mL、甘露醇2mg/mL、NaHCO3 2.5mg/mL组成,pH调节至8.2的稀释缓冲液中将测试化合物稀释至150nmol/mL的最终浓度。
在体重约为250g的雄性Sprague Dawley大鼠中研究测试化合物。用27G针头以预先确定的剂量如在0.1mL体积中的15nmol/大鼠(浓度为150nmol/mL)或约60nmol/kg体重,以单次注射剂的形式将测试化合物静脉内施用于尾静脉中。
对于每种测试化合物,根据以下时间表进行血液采样:
在每个采样时间使用25G针头从尾静脉或舌下血管丛抽取200μL血液。将血液采样到EDTA包被的试管中并在冰上储存,直到在4℃下以1200×G离心10min。分两次将50μL血浆转移至两个单独的Micronic管并在-20℃下储存直到分析。
测试物质浓度通过发光氧通道免疫分析(LOCI)来测定,该分析是基于均质珠粒的分析。LOCI试剂包含两种乳胶珠粒试剂和生物素化GH结合蛋白质,该蛋白质是夹心结构的一部分。珠粒试剂之一是通用试剂(供体珠粒)且包被有链霉亲和素,并且含有光敏染料。第二种珠粒试剂(受体珠粒)包被有构成夹心结构的抗体。在分析过程中,三种反应物与分析物结合以形成珠粒-聚集体-免疫复合体。对该复合体进行照射使供体珠粒释放单线态氧,单线态氧传送至受体珠粒中并触发化学发光,该化学发光在EnVision读板器中测量。生成的光的量与hGH衍生物的浓度成正比。将2μL、40×的在LOCI缓冲液中稀释的样品/校准物/对照施加于384孔LOCI培养板中。向每个孔中加入生物素化GH结合蛋白质和mAb M94169抗-(hGH)缀合的受体珠粒的15μL混合物。将该培养板在21-22℃下温育1小时。向每个孔中加入30μL链霉亲和素包被的供体珠粒(67μg/mL)并全部在21-22℃下温育30分钟。在用680nmol激光激发后,采用具有520-645nmol带宽的滤波器在21-22℃下在Envision读板器中读取培养板。每孔的总测量时间为210ms,包括70ms的激发时间。生长激素化合物的检测限为50pM。使用WinNonlin Professional(Pharsight Inc.,Mountain View,CA,USA)对每种测试化合物的平均浓度-时间曲线进行非房室药代动力学分析。计算终末半衰期(T1/2)和平均停留时间(MRT)的药代动力学参数估计值。针对每种化合物生成IGF-1血浆浓度-时间曲线。
试验4:用于在切除垂体的Sprague Dawley大鼠中评估生长激素化合物的体内反应的试验
在切除垂体的Sprague Dawley大鼠中研究了体内反应。切除垂体的大鼠是生长激素缺乏的公知且公认的动物模型,其中在手术切除垂体之后不产生生长激素。切除垂体还导致胰岛素样生长因子-1(IGF-1)的低循环水平,这是人类中生长激素缺乏的另一种重要的临床特征。
通常对体重为90-100g的4周龄雄性大鼠进行垂体切除术。在手术后3-4周参加该研究的动物体重为100-110g。在手术后3-4周期间体重增加超过10%的动物不被允许参加该研究。
垂体切除术过程
麻醉和术前镇痛
用芬太尼-氟阿尼酮(Hypnorm,0.315mg芬太尼和10mg氟阿尼酮/mL)和咪达唑仑(Midazolam Accord,5mg咪达唑仑/mL)麻醉大鼠。用在无菌水中稀释的芬太尼-氟阿尼酮和咪达唑仑的混合物以2mL/kg对大鼠腹膜内给药。得到的混合物每mL含有0.079mg芬太尼、2.5mg氟阿尼酮和1.25mg咪达唑仑。
手术操作
大鼠为无菌手术作准备。将大鼠固定在为垂体切除术设计的Hoffman-Reiter立体固定器中。
将玻璃注射器上的18G针头插入大鼠的右耳内。在旋转移动过程中,针头穿过鼓膜、中耳和颞骨。从这个位置抽出垂体。
将大鼠从立体固定器上放下并转移到热板上进行恢复。当大鼠恢复时,将其转移到笼子中。
术后镇痛和护理
在恢复之前,使用在无菌水中稀释的每mL含有5mg卡洛芬的溶液,用卡洛芬(Rimadyl,50mg卡洛芬/mL)以1mL/kg皮下处理大鼠。通过向代替饮用水而提供给大鼠的5%右旋糖溶液中每mL加入0.05mg卡洛芬,在手术后持续术后镇痛2天。在术后的前2天,向大鼠提供5%右旋糖溶液作为饮用水直到术后10-14天。
将切除垂体的Sprague Dawley大鼠随机分配至不同的给药组,每组十只动物。一组仅接受媒介物并用作对照组。在所有测试组中,每只动物各自接受1、5、15、50和150nmol单一皮下剂量的测试化合物。在研究期间每天上午8-10点测量体重。在第0天、第1天、第3天、第5天、第7天、第10天和第14天的上午8-10点针对暴露和IGF-1测量进行血液采样。
在每个采样时间,使用25G针头从尾静脉或舌下血管丛抽取200μL血液。将血液采样到EDTA包被的试管中并在冰上储存,直到在4℃下以1200xG离心10min。将50μL血浆转移至Micronic管并在-20℃下储存直到分析。针对每种化合物生成IGF-1浓度-时间曲线。
试验5:用于检测大鼠中的IGF反应的试验
通过商业ELISA测定(来自Immunodiagnostic Systems Ltd.Octeia Rat/Mouse IGF-1的商业测定,目录号AC-18F1IDS Ltd.,England)来测定血浆IGF-1浓度。该测定是夹心ELISA,其使用高度IGF-1特异性的多克隆抗体作为捕获剂,并使用辣根过氧化物酶标记的高亲和力单克隆抗体作为检测剂。该测定的检测下限为63ng/mL。针对每种化合物生成IGF-1血浆浓度-时间曲线以及基线校正的IGF-1血浆浓度-时间曲线。基线校正曲线高于零的时间和程度用作化合物功效的度量。
试验6:用于在小型猪中评价生长激素化合物的药代动力学参数的试验
在雌性小型猪中研究了皮下(sc.)单剂量给药后实例化合物的药代动力学。在由甘氨酸20mg/mL、甘露醇2mg/mL、NaHCO3 2.5mg/mL组成,pH调节至8.2的稀释缓冲液中将测试化合物稀释至15mg/mL的最终浓度。在体重约为10-12kg的雌性小型猪中研究测试化合物。
将测试化合物以单一皮下注射剂的形式施用于颈部右侧,距耳约5-7cm且距颈部中间7-9cm。用带有限位器(stopper)的21G针头给予注射剂,以允许插入针头0.5cm。每只动物接受给药体积0.1mL/kg中20nmol/kg的剂量。
对于每种测试化合物,根据以下时间表从每只动物进行血液采样:给药前、给药后1、4、12、24、36、48、72、96、168、240、336、504、672、840和1008小时。通过使用插入颈静脉中的Vacutainer从未麻醉的小型猪收集2mL的血液样品至EDTA管中。血液收集后立即将管轻轻倒转以确保充分混合。将血液在冰上保持最长10min,然后在4℃下以1500g离心十分钟。移取200μL血浆至Micronic管中以供化合物浓度测定,并移取200μL血浆至Micronic管中以供IGF-1测定。将血浆样品在-20℃下储存直到分析。
测试物质浓度通过发光氧通道免疫分析(LOCI)来测定,该分析是基于均质珠粒的分析。LOCI试剂包含两种乳胶珠粒试剂和生物素化GH结合蛋白质,该蛋白质是夹心结构的一部分。珠粒试剂之一是通用试剂(供体珠粒)且包被有链霉亲和素,并且含有光敏染料。第二种珠粒试剂(受体珠粒)包被有构成夹心结构的抗体。在分析过程中,三种反应物与分析物结合以形成珠粒-聚集体-免疫复合体。对该复合体进行照射使供体珠粒释放单线态氧,单线态氧传送至受体珠粒中并触发化学发光,该化学发光在EnVision读板器中测量。生成的光的量与GH衍生物的浓度成正比。将2μL、40×的在LOCI缓冲液中稀释的样品/校准物/对照施加于384孔LOCI培养板中。向每个孔中加入生物素化GH结合蛋白质和mAb M94169抗-(hGH)缀合的受体珠粒的15μL混合物。将该培养板在21-22℃下温育1hr。向每个孔中加入30μL链霉亲和素包被的供体珠粒(67μg/mL)并全部在21-22℃下温育30min。在用680nmol激光激发后,采用具有520-645nmol带宽的滤波器在21-22℃下在Envision读板器中读取培养板。每孔的总测量时间为210ms,包括70ms的激发时间。生长激素化合物的检测限为50pM。
使用WinNonlin Professional(Pharsight Inc.,Mountain View,CA,USA)对每种测试化合物的平均浓度-时间曲线进行非房室药代动力学分析。计算终末半衰期(T1/2)和平均停留时间(MRT)的药代动力学参数估计值。
实施例1:
三价连接体1
(4S,18S)-4-(二(2-(2-氯乙酰胺基)乙基)氨基甲酰基)-18-(2-(2-(2-(2-溴乙酰胺基)乙氧基)乙氧基)乙酰胺基)-6,15-二氧代-8,11-二氧杂-5,14-二氮杂十九烷二酸
反应流程:
合成方案:
将2-(1-羟基-3-甲基丁亚基)-5,5-二甲基环己烷-1,3-二酮(2)(37.7g,168mmol)的DCM(200mL)溶液逐滴加入到二亚乙基三胺(1)(8.64mL,80.0mmol)的DCM(130mL)溶液中。将反应混合物搅拌过夜,随后蒸发溶剂,得到呈浅黄色油状物的2,2′-(((氮烷二基二(乙烷-2,1-二基))二(氮烷二基))二(3-甲基丁烷-1-基-1-亚基))二(5,5-二甲基环己烷-1,3-二酮)(3)。
产量:41.2g(100%)。
1H NMR谱(300MHz,CDCl3,δH):3.57(q,4H);3.06-2.89(m,8H);2.36(bs,8H);2.05-1.89(m,2H);1.09-0.94(m,26H)。
将上述胺(3)(33.4g,64.8mmol)的DMF(320mL)溶液加入到2-(9H-芴-9-基甲氧羰基氨基)-戊二酸5-叔丁酯(Fmoc-Glu(OtBu)-OH,63.4g,149mmol)、HATU(56.6g,149mmol)、DIPEA(40.0mL,227mmol)在DMF(530mL)中的溶液中。在室温下将反应混合物搅拌过夜。随后加入EtOAc(1.6L)和水(1.6L)。将分离的有机层用10%K2CO3水溶液(2×1.6L)洗涤,经无水Na2SO4干燥,过滤,并在真空中蒸发。通过快速柱色谱法(硅胶60,0.063-0.040mm;洗脱液:DCM/MeOH 50∶1-40∶1)纯化残留物,以得到呈浅黄色粘性油状物的4-((((9H-芴-9-基)甲氧基)羰基)氨基)-5-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)氨基)乙基)氨基)-5-氧代戊酸叔丁酯(4)。
产量:59.2g(99%)。
1H NMR谱(300MHz,CDCl3,δH):7.77(d,J=7.5Hz,2H);7.59(m,2H);7.40(t,J=7.5Hz,2Hz);7.36-7.26(m,2H);5.65(d,J=9.2Hz,1H);4.72-4.59(m,1H);4.46-4.27(m,2H);4.24-4.16(m,1H);4.12-3.99(m,1H);3.94-3.53(m,6H);3.48-3.33(m,1H);2.97(bs,4H);2.46-2.26(m,10H);2.08-1.83(m,4H);1.79-1.64(m,1H);1.43(s,9H);1.07-0.90(m,24H)。
将溶解在DCM(50mL)中的4-((((9H-芴-9-基)甲氧基)羰基)氨基)-5-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)氨基)乙基)氨基)-5-氧代戊酸叔丁酯(4)(59.2g,64.8mmol)加入到TFA/水混合物(95∶5,400mL)中并搅拌2hr。随后蒸发溶剂并将残留物与甲苯共蒸发三次。将残留物溶解在DCM(800mL)中并用水(3×800mL)洗涤。在减压下蒸发溶剂。通过柱色谱法(硅胶60,0.063-0.040mm;洗脱液:DCM/MeOH 60∶1-10∶1)纯化残留物,得到呈白色粉末的4-((((9H-芴-9-基)甲氧基)羰基)氨基)-5-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)-氨基)乙基)氨基)-5-氧代戊酸(5)。
产量:42.1g(76%)。
1H NMR谱(300MHz,AcOD-d4,80℃,δH):7.79(d,J=7.3Hz,2H);7.64(d,J=7.5Hz,2H);7.39(t,J=7.4Hz,2H);7.36-7.26(m,2H);4.83(bs,1H);4.48-4.30(m,2H);4.27-4.19(m,1H);4.19-3.62(m,7H);3.61-3.46(m,1H);3.28-2.90(m,4H);2.55(t,J=6.7Hz,2H);2.43(s,8H);2.01-1.81(m,4H);1.07-0.88(m,24H)。
使Wang树脂0.63mmol/g(25.7g,16.2mmol)在THF(250mL)中溶胀20min。将4-((((9H-芴-9-基)甲氧基)羰基)氨基)-5-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)-氨基)乙基)氨基)-5-氧代戊酸(5)(42.0g,48.5mmol)的THF(250mL)溶液加入到树脂中,随后加入DIC(7.60mL,48.5mmol)和4-二甲基氨基吡啶(DMAP,200mg,1.62mmol)。将该混合物摇动18hr。过滤树脂并用DCM(6×250mL)洗涤。用乙酸酐(40mL)、吡啶(40mL)在DMF(360mL)中的溶液处理树脂15min,并用DCM(6×250mL)洗涤,得到呈黄色固体的化合物(6)。
产量:36.0g。
加样:51%(0.321mmol/g)。
使上述化合物(6)(6.27g,2.01mmol)在DCM(50mL)中溶胀20min。通过用DMF中的20%哌啶(1×5min,1×30min,2×30mL)处理去除Fmoc基团。用DMF(3×30mL)、2-丙醇(3×30mL)和DCM(3×30mL)洗涤树脂。将{2-[2-(9H-芴-9-基甲氧羰基氨基)-乙氧基]-乙氧基}-乙酸(Fmoc-OEG-OH,1.25g,3.24mmol)、O-(6-氯-苯并三唑-1-基)-N,N,N′,N′-四甲基脲四氟硼酸盐(TCTU,1.15g,3.24mmol)和DIPEA(1.13mL,6.48mmol)在DMF(35mL)中的溶液加入到树脂中并摇动该混合物3hr。过滤树脂并用DMF(3×30mL)、DCM(3×30mL)和DMF(3×30mL)洗涤。通过用DMF中的20%哌啶(1×5min,1×30min,2×30mL)处理去除Fmoc基团。用DMF(3×30mL)、2-丙醇(3×30mL)和DCM(3×30mL)洗涤树脂。将(S)-2-(9H-芴-9-基甲氧羰基氨基)-戊二酸1-叔丁酯(Fmoc-LGlu-OtBu,1.38g,3.24mmol)、O-(6-氯-苯并三唑-1-基)-N,N,N′,N′-四甲基脲四氟硼酸盐(TCTU,1.15g,3.24mmol)和DIPEA(1.13mL,6.48mmol)在DMF(35mL)中的溶液加入到树脂中并摇动混合物2hr。通过用DMF中的20%哌啶(1×5min,1×30min,2×30mL)处理去除Fmoc基团。用DMF(3×30mL)、2-丙醇(3×30mL)和DCM(3×30mL)洗涤树脂。将{2-[2-(9H-芴-9-基甲氧羰基氨基)-乙氧基]-乙氧基}-乙酸(Fmoc-OEG-OH,1.25g,3.24mmol)、O-(6-氯-苯并三唑-1-基)-N,N,N′,N′-四甲基脲四氟硼酸盐(TCTU,1.15g,3.24mmol)和DIPEA(1.13mL,6.48mmol)在DMF(35mL)中的溶液加入到树脂中并摇动该混合物3.5hr。过滤树脂并用DMF(3×30mL)、DCM(3×30mL)和DMF(3×30mL)洗涤。通过用DMF中的20%哌啶(1×5min,1×30min,2×30mL)处理去除Fmoc基团。用DMF(3×30mL)、2-丙醇(3×30mL)和DCM(3×30mL)洗涤树脂。
将1-(氯-二苯基-甲基)-4-甲基苯(MttCl,2.02g,6.90mmol)和DIPEA(2.55mL,14.6mmol)在无水DCM(50mL)中的溶液加入到树脂中并摇动混合物2hr。过滤树脂并用DCM(4×30mL)和DMF(4×30mL)洗涤。通过用DMF中的2%一水合肼(3×30mL,3×3min)处理去除IvDde基团。用DMF(8×30mL)洗涤树脂。将氯乙酸(0.92g,9.74mmol)、三吡咯烷基溴化鏻六氟磷酸盐(PyBrOP,4.54g,9.74mmol)和DIPEA(3.39mL,19.5mmol)在DCM(60mL)中的溶液加入到树脂中并摇动混合物3hr。过滤树脂并用DMF(4×30mL)、DCM(4×30mL)、DMF(4×30mL)、DCM(10×30mL)洗涤。通过用DCM中的80%1,1,1,3,3,3-六氟-2-丙醇(4×30mL,2×10min,2×30min)处理去除Mtt基团。用DCM(5×30mL)和DMF(4×30mL)洗涤树脂。将溴乙酸(4.50g,32.4mmol)和DIC(4.27mL,27.6mmol)在DMF(50mL)中的溶液加入到树脂中并摇动混合物25min。过滤树脂并用DMF(4×30mL)、MeCN(2×30mL)和DCM(10×30mL)洗涤。通过用TFA/TIS/H2O的裂解混合物(95∶2.5∶2.5,50mL)处理2hr从树脂上裂解产物。过滤树脂并用TFA/DCM混合物(1∶1,50mL)和DMF(10×50mL)洗涤。合并溶液并蒸发溶剂至干。将溶剂与甲苯共蒸发三次。通过柱X-Bridge3C18,OBD,5μm,50×250mm(流动相:A=0.05%TFA/H2O,B=0.05%TFA/MeCN,梯度:5%至35%)纯化残留物,得到呈白色固体的(4S,18S)-4-(二(2-(2-氯乙酰胺基)乙基)氨基甲酰基)-18-(2-(2-(2-(2-溴乙酰胺基)乙氧基)乙氧基)乙酰胺基)-6,15-二氧代-8,11-二氧杂-5,14-二氮杂十九烷二酸(7)。
产量:694mg(37%)。
1H NMR谱(300MHz,AcOD-d4,80℃,δH):5.13(dd,J=9.3Hz,J=4.2Hz,1H);4.68(dd,J=8.3Hz,J=5.3Hz,1H);4.20-4.06(m,8H);3.95(s,2H);3.91-3.41(m,24H);2.61-2.08(m,7H);2.08-1.88(m,1H)。
LC-MS纯度:100%。
LC-MS Rt(Kinetex 4.6mm×50mm,MeCN/水5∶95至100∶0+0.1%FA):Rt=4.74min。
LC-MS m/z:926.6(M+H)+。
UPLC纯度:97.5%(214nm)。
UPLC Rt(Acquity UPLC BEHC 18,1.7μm,2.1×150mm;MeCN/水5∶95至95∶5+0.05%TFA):Rt=1.64min。
三价连接体2
2-(2-溴乙酰胺基)-N,N-二(2-(2-氯乙酰胺基)乙基)乙酰胺
反应流程:
合成方案:
将2-(1-羟基-3-甲基丁亚基)-5,5-二甲基环己烷-1,3-二酮(44.9g,200mmol)的MeOH(400mL)溶液在40min内加入到DCM(1.50L)中的二亚乙基三胺(1)(DETA,10.3g,100mmol)中。将反应混合物搅拌过夜。在减压下去除溶剂并通过快速柱色谱法(硅胶60,0.040-0.063mm;洗脱液:DCM/MeOH 25/1)纯化粗产物,得到呈淡黄色蜡状固体的纯化合物(2)。
产量:41.0g(80%)。
1H NMR谱(300MHz,CDCl3,δH):13.83(bs,2H);3.57(q,J=5.7Hz,4H);3.10-2.91(m,8H);2.36(bs,8H);1.97(sep,J=6.8Hz,2H);1.05-0.96(m,24H)。
向上述化合物(2)(3.09g,6.00mmol)的溶液中加入(叔丁氧羰基)甘氨酸(BocGlyOH,2.10g,12.0mmol)、HATU(4.56g,12.0mmol)和DIPEA(4.19mL,3.10g,24.0mmol)在DCM(200mL)和DMF(40mL)的混合物中的混合物。将反应混合物搅拌2hr。随后加入1M碳酸钾水溶液(200mL)。分离有机相并用1M盐酸溶液(200mL)洗涤,并且经无水Na2SO4干燥。在减压下去除溶剂。通过快速柱色谱法(硅胶60,0.040-0.063mm;洗脱液:EtOAc)纯化残留物,得到呈淡褐色粘性油状物的纯化合物(3)。
产量:3.98g(99%)。
RF(SiO2,EtOAc):0.50。
1H NMR谱(300MHz,CDCl3,δH):14.03(bs,1H);13.87(bs,1H);5.43(bs,1H);4.01(d,J=4.7Hz,2H);3.79-3.56(m,8H);3.06-2.89(m,4H);2.48-2.27(m,8H);1.95(sep,J=6.8Hz,2H);1.45(s,9H);1.05-0.95(m,24H)。
将上述化合物(3)(3.98g,5.91mmol)溶解在DCM(5mL)中并加入TFA(30mL)。2hr后,在减压下去除挥发物并加入饱和碳酸钾水溶液(60mL)。用EtOAc(3×40mL)萃取产物。有机相经无水Na2SO4干燥,并在减压下去除溶剂,得到呈灰白色固体泡沫的纯化合物(4)。
产量:3.38g(100%)。
1H NMR谱(300MHz,CDCl3,δH):14.01(s,1H);13.88(s,1H);3.80-3.70(m,2H);3.68-3.58(m,6H);3.52(s,2H);3.06-2.93(m,4H);2.45-2.29(m,8H),1.95(sep,J=6.8Hz,2H);1.06-0.95(m,24H)。
使2-氯三苯甲基树脂100-200目1.8mmol/g(4)(2g,7.43mmol)在无水DCM(100mL)中溶胀20min。将上述化合物(4)(2.83g,4.95mmol)和DIPEA(3.28mL,,18.8mmol)在无水DCM(60mL)中的溶液加入到树脂中并将该混合物摇动过夜。过滤树脂并用DIPEA(1.73mL,9.90mmol)在MeOH/DCM混合物(4∶1,100mL,2×5min)中的溶液处理。随后用DMF(3×90mL)、2-丙醇(2×90mL)和DCM(3×90mL)洗涤树脂。通过用一水合肼(DMF中的2%溶液,3×90mL,3×5min)处理去除保护基团。随后用DMF(3×90mL)、2-丙醇(2×90mL)和DCM(3×90mL)洗涤树脂。将氯乙酸(3.74g,39.6mmol)、2,4,6-三甲基吡啶(7.83mL,59.4mmol)和DIC(6.13mL,39.6mmol)在DMF(70mL)中的溶液加入到树脂中并摇动混合物45min。过滤树脂并用DMF(4×90mL)、2-丙醇(2×90mL)和DCM(8×90mL)洗涤。通过用裂解混合物(DCM中的50%TFA,80mL)处理1小时从树脂上裂解产物。过滤出树脂并用DCM(3×40mL)洗涤。合并溶液并蒸发溶剂至干,得到呈淡褐色稠油的所需化合物(5)。
产量:2.01g(95%)。
1H NMR谱(300MHz,AcOD-d4,δH):4.23(s,2H);4.19(s,2H);4.16(s,2H);3.71-3.51(m,8H)。
将碳酸氢钠(1.58g,18.8mmol)和溴乙酸酐(1.71g,6.59mmol)在MeCN(20mL)中的混合物加入到上述化合物(5)(2.01g,4.71mmol)的MeCN(20mL)溶液中。90min后,通过烧结玻璃过滤反应混合物并在减压下去除溶剂。通过HPLC(柱X-Bridge4C18,OBD,5μm,50×250mm,MeCN/H2O 5∶95至45∶55+0.05%TFA)纯化残留物。将得到的溶液冷冻干燥以得到呈无色粘性油状物的标题化合物。MeCN(8mL)的加入导致无色晶体的形成,并在减压下去除溶剂,得到呈无色固体的2-(2-溴乙酰胺基)-N,N-二(2-(2-氯乙酰胺基)乙基)乙酰胺(6)。
产量:900mg(44%)。
1H NMR谱(300MHz,AcOD-d4,δH):4.27(s,2H);4.19(s,2H);4.13(s,2H);4.02(s,2H);3.70-3.50(m,8H)。
LC-MS纯度:100%。
LC-MS Rt(Kinetex 4.6mm×50mm,MeCN/水5∶95至100∶0+0.1%FA):2.90min。
LC-MS m/z:433.0(M+H)+。
三价连接体3
2-(2-(2-(2-(2-溴乙酰胺基)乙氧基)乙氧基)乙酰胺基)-N,N-二(2-(2-氯乙酰胺基)乙基)乙酰胺
反应流程:
合成方案:
将TFA(30mL)加入到(2-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)氨基)乙基)氨基)-2-氧代乙基)氨基甲酸叔丁酯(1)(3.98g,5.91mmol,如实施例2中所述制备,化合物(3))的DCM(5mL)溶液中。2hr后,在减压下去除挥发物并加入饱和碳酸钾水溶液(60mL)。用EtOAc(3×40mL)萃取产物。有机相经无水Na2SO4干燥,并在减压下去除溶剂,得到呈灰白色固体泡沫的纯化合物(2)。
产量:3.38g(100%)。
1H NMR谱(300MHz,CDCl3,δH):14.01(s,1H);13.88(s,1H);3.80-3.70(m,2H);3.68-3.58(m,6H);3.52(s,2H);3.06-2.93(m,4H);2.45-2.29(m,8H);1.95(sep,J=6.8Hz,2H);1.06-0.95(m,24H)。
向上述化合物(2)(2.84g,4.97mmol)的溶液中加入2,2-二甲基-4-氧代-3,8,11-三氧杂-5-氮杂十三烷-13-酸(Boc-OEG-OH,1.31g,4.97mmol)、HATU(1.89g,4.97mmol)和DIPEA(1.74mL,9.94mmol)在DCM(200mL)和DMF(30mL)中的混合物。将反应混合物搅拌过夜。随后加入1M碳酸钾水溶液(200mL)。分离有机相并用1M盐酸溶液(200mL)洗涤,并且经无水Na2SO4干燥。在减压下去除溶剂。通过快速柱色谱法(硅胶60,0.040-0.063mm;洗脱液:DCM/MeOH 20∶1)纯化残留物,得到呈淡褐色粘性油状物的纯化合物(3)。
产量:3.19g(78%)。
RF(SiO2DCM/MeOH 20∶1):0.15。
1H NMR谱(300MHz,CDCl3,δH):14.06(bs,1H);13.91(bs,1H);7.66(bs,1H);5.45(bs,1H);4.19(d,J=4.7Hz,2H);4.05(s,2H);3.79-3.62(m,12H);3.57(t,J=5.1Hz,2H);3.38-3.29(m,2H);3.04-2.92(m,4H);2.45-2.27(m,8H);1.93(sep,J=6.8Hz,2H);1.43(s,9H);1.05-0.94(m,24H)。
将TFA(30mL)加入到上述化合物(3)(3.19g,3.89mmol)的DCM(5mL)溶液中。2hr后,在减压下去除挥发物并加入1M氢氧化钠水溶液(60mL)。用乙酸乙酯(7×30mL)萃取产物。有机相经无水硫酸钠干燥,并在减压下去除溶剂,得到呈灰白色固体泡沫的纯化合物(4)。
产量:2.97g(83%)。
1H NMR谱(300MHz,CDCl3,δH):13.95(bs,1H);13.79(bs,1H);7.69(bs,1H);4.17-4.10(m,2H);4.03(s,2H);3.74-3.56(m,12H);3.52(t,J=5.1Hz,2H);3.03-2.83(m,6H);2.32(s,8H);2.13(bs,2H);1.93(sep,J=6.8Hz,2H);1.43(s,9H);1.03-0.90(m,24H)。
使2-氯三苯甲基树脂100-200目1.8mmol/g(2.97g,5.35mmol)在无水DCM(100mL)中溶胀20min。将上述化合物(4)(2.92g,3.57mmol)和DIPEA(2.36mL,,13.6mmol)在无水DCM(40mL)中的溶液加入到树脂中并将该混合物摇动过夜。过滤树脂并用DIPEA(1.38mL,10.7mmol)在MeOH/DCM混合物(4∶1,2×5min,70mL)中的溶液处理。随后用DMF(3×70mL)、2-丙醇(2×70mL)和DCM(3×70mL)洗涤树脂。通过用一水合肼(DMF中的2%溶液,3×6min,3×70mL)处理去除保护基团。随后用DMF(3×70mL)、2-丙醇(2×70mL)和DCM(3×70mL)洗涤树脂。将氯乙酸(2.70g,28.6mmol)、2,4,6-三甲基吡啶(5.63mL,42.8mmol)和DIC(4.42mL,28.6mmol)在DMF(70mL)中的溶液加入到树脂中并摇动混合物45min。过滤树脂并用DMF(4×70mL)、2一丙醇(2×70mL)和DCM(8×70mL)洗涤。通过用裂解混合物(DCM中的50%TFA,80mL)处理14、时从树脂上裂解产物。过滤树脂并用DCM(3×40mL)洗涤。合并溶液并蒸发溶剂至干,得到呈淡褐色稠油的所需化合物(5)。
产量:1.84g(90%)。
1H NMR谱(300MHz,AcOD—d4,δH):4.32(s,2H);4.20(s,2H);4.18(s,2H);4.16(s,2H);3.84(t,J=4.8Hz,2H);3.81-3.72(m,4H);3.68-3.51(m,8H);3.38(t,J=4.8Hz,2H)。
将碳酸氢钠(0.81g,9.63mmol)和溴乙酸酐(1.67g,6.42mmol)在MeCN(20mL)中的混合物加入到上述化合物(5)(1.84g,3.21mmol)的MeCN(20mL)溶液中。90min后,通过烧结玻璃过滤反应混合物并在减压下去除溶剂。通过HPLC(柱labio DeltaPak C18,15μm,50×500mm,MeCN/水5∶95至45∶55+0.05%TFA)纯化残留物。将得到的溶液冷冻干燥以得到呈无色粘性油状物的2-(2-(2-(2-(2-溴乙酰胺基)乙氧基)乙氧基)乙酰胺基)-N,N-二(2-(2-氯乙酰胺基)乙基)乙酰胺(6)。
产量:516mg(33%)。
1H NMR谱(300MHz,AcOD-d4,δH):4.29(s,2H);4.19(s,2H);4.16(s,2H);4.14(s,2H);3.98(s,2H);3.75-3.49(m,16H)。
LC—MS纯度:100%。
LC—MS Rt(Kinetex 4.6mm×50mm.MeCN/水5∶95至100∶0+0.1%FA):3.02min。
LC—MS m/Z:480.2(M+H)+。
三价连接体4
(R)-4-{2-[2-({二-[2-(2-氯-乙酰基氨基)-乙基]-氨基甲酰基}-甲氧基)-乙氧基]-乙基氨基甲酰基}-2-[(S)-2-(2-{2-[2-(2-溴-乙酰基氨基)-乙氧基]-乙氧基}-乙酰基氨基)-4-羧基-丁酰基氨基]-丁酸
反应流程:
合成方案:
使2-氯三苯甲基树脂100-200目1.8mmol/g(1,41.7g,75.1mmol)在无水DCM(350mL)中溶胀20min。将{2-[2-(9H-芴-9-基甲氧羰基氨基)-乙氧基]-乙氧基}-乙酸(Fmoc-OEG-OH,19.3g,50.1mmol)和DIPEA(33.1mL,190mmol)在无水DCM(250mL)中的溶液加入到树脂中并将该混合物摇动过夜。过滤树脂并用DIPEA(17.4mL,100mmol)在MeOH/DCM混合物(4∶1,5min,200mL)中的溶液处理。随后用DCM(2×250mL)和DMF(2×250mL)洗涤树脂。通过用DMF中的20%哌啶(1×5min,1×15min,2×250mL)处理去除Fmoc基团。用DMF(2×250mL)、2-丙醇(2×250mL)、DCM(2×250mL)和DMF(2×250mL)洗涤树脂。将2-(9H-芴-9-基甲氧羰基氨基)-戊二酸1-叔丁酯(Fmoc-Glu-OtBu,42.6g,100mmol)、O-(6-氯-苯并三唑-1-基)-N,N,N′,N′-四甲基脲四氟硼酸盐(TCTU,35.6g,100mmol)和DIPEA(31.4mL,180mmol)在DMF(200mL)中的溶液加入到树脂中并摇动混合物4小时。过滤树脂并用DMF(2×250mL)和DCM(10×250mL)洗涤。通过用2,2,2-三氟乙醇(350mL)处理过夜从树脂上裂解产物。过滤树脂并用DCM(2×200mL)洗涤,蒸发溶剂并通过快速柱色谱法(硅胶60,0.040-063mm;洗脱液:DCM/MeOH 95∶5至85∶15)纯化粗产物,得到呈淡黄色蜡状固体的(R)-4-[2-(2-羧基甲氧基-乙氧基)-乙基氨基甲酰基]-2-(9H-芴-9-基甲氧羰基氨基)-丁酸叔丁酯(2)。
产量:18.6g(65%)。
1H NMR谱(300MHz,CDCl3,δH):7.77(d,J=7.5Hz,2H);7.65-7.50(m,2H);7.47-7.37(m,2H);7.37-6.72(m,2H);6.84-6.72(m,1H);5.92-5.81(m,1H);4.58-4.30(m,2H);4.30-3.95(m,4H);3.79-3.51(m,6H);3.43(q,J=4.6Hz,2H);2.39-1.90(m,4H);1.54-1.39(m,9H)。
LC-MS纯度:100%。
LC-MS Rt(Kinetex C18,4.6mm×50mm,MeCN/水20∶80至100∶0+0.1%FA):3.65min。
LC-MS m/z:570.6(M+H)+。
将二亚乙基三胺(3)(1.62mL,15.0mmol)加入到2-(1-羟基-3-甲基-丁亚基)-5,5-二甲基-环己烷-1,3-二酮(4)(6.73g,30.0mmol)的DCM(125mL)溶液中。将得到的溶液搅拌过夜,随后蒸发溶剂并在真空中干燥残留物,得到呈黄色油状物的2,2′-(((氮烷二基二(乙烷-2,1-二基))二(氮烷二基))二(3-甲基丁烷-1-基-1-亚基))二(5,5-二甲基环己烷-1,3-二酮)(5)。
产量:7.74g(100%)。
1H NMR谱(300MHz,CDCl3,δH):13.81(bs,2H);3.64-3.44(m,4H);3.12-2.83(m,8H);2.34(s,8H);2.06-1.86(m,2H);1.05-0.87(m,24H)。
将化合物(2)(18.5g,32.5mmol)溶解在DCM(220mL)中,然后加入HATU(12.4g,32.5mmol)、DIPEA(8.30mL,47.6mmol)和DCM(150mL)中的胺(5)(7.04g,13.6mmol)溶液。将得到的溶液搅拌过夜并随后蒸发溶剂。将残留物溶解在乙酸乙酯(250mL)中并用水(4×250mL)洗涤。将有机层经无水硫酸钠干燥,过滤并蒸发。通过快速柱色谱法(硅胶60,0.040-063mm;洗脱液:DCM/MeOH 97∶3至96∶4)纯化残留物,得到呈白色固体的(R)-4-(2-{2-[(二-{2-[1-(4,4-二甲基-2,6-二氧代-环己亚基)-3-甲基-丁基氨基]-乙基}-氨基甲酰基)-甲氧基]-乙氧基}-乙基氨基甲酰基)-2-(9H-芴-9-基甲氧羰基氨基)-丁酸叔丁酯(6)。
产量:11.6g(80%)。
1H NMR谱(300MHz,CDCl3,δH):14.02-13.78(m,2H);7.77(d,J=7.2Hz,2H);7.60(d,J=6.8Hz,2H);7.40(t,J=7.1Hz,2H);7.35-7.24(m,2H);6.76(bs,1H);5.85(d,J=8.5Hz,1H);4.50-4.13(m,6H);3.79-3.35(m,16H);3.06-2.85(m,4H);2.45-2.12(m,11H);2.09-1.82(m,3H);1.47(s,9H);1.07-0.85(m,24H)。
LC-MS纯度:100%。
LC-MS Rt(Kinetex C18,4.6mm×50mm,MeCN/水70∶30至100∶0+0.1%FA):2.12min。
LC-MS m/z:1068.3(M+H)+。
将上述制备的化合物(6)(11.6g,10.9mmol)溶解在TFA/H2O的混合物(95∶5,150mL)中并放置2.5hr。随后蒸发溶剂。将残留物溶解在DCM(30mL)中并加入乙醚(200mL)。将该混合物搅拌过夜;随后倾析乙醚。用乙醚(200mL)处理残留物并随后再次倾析。再次重复该过程。在真空中干燥残留物以得到呈浅黄色固体的(R)-4-(2-{2-[(二-{2-[1-(4,4-二甲基-2,6-二氧代-环己亚基)-3-甲基-丁基氨基]-乙基}-氨基甲酰基)-甲氧基]-乙氧基}-乙基氨基甲酰基)-2-(9H-芴-9-基甲氧羰基氨基)-丁酸(7)。
产量:10.7g(96%)。
1H NMR谱(300MHz,CDCl3,δH):13.90-13.65(m,2H);7.77(d,J=7.5Hz,2H);7.67-7.53(m,2H);7.40(t,J=7.2Hz,2H);7.35-7.23(m,3H);6.01(d,J=7.5Hz,1H);4.49-4.34(m,3H);4.31-4.15(m,3H);3.86-3.30(m,16H);3.14-2.84(m,4H);2.55-2.31(m,10H);2.30-2.05(m,2H);2.03-1.78(m,2H);1.11-0.88(m,24H)。
LC-MS纯度:100%。
LC-MS Rt(Kinetex C18,4.6mm×50mm,MeCN/水35∶65至100∶0+0.1%FA):3.68min。
LC-MS m/z:1012.2(M+H)+。
将Wang树脂0.68mmol/g(1)(4.97g,3.38mmol)在THF(110mL)中溶胀60min。将化合物(7)(10.3g,10.1mmol)、DIC(1.57mL,10.1mmol)和4-二甲基氨基吡啶(0.04g,0.34mmol)在THF(80mL)中的溶液加入到树脂中并将该混合物摇动过夜。将树脂过滤,用DCM(2×100mL)洗涤,并用乙酸酐(5.00mL,50.1mmol)和吡啶(5.00mL,61.6mmol)在DCM(70mL)中的溶液处理10分钟。用DCM(6×100mL)洗涤树脂。通过用DMF中的20%哌啶(1×5min,1×15min,2×80mL)处理去除Fmoc基团。用DMF(2×100mL)、2-丙醇(2×100mL)、DCM(2×100mL)和DMF(2×100mL)洗涤树脂。将(S)-2-((((9H-芴-9-基)甲氧基)羰基)氨基)-5-(叔丁氧基)-5-氧代戊酸(Fmoc-Glu(OtBu)-OH,4.31g,10.1mmol)、5-氯-1-((二甲基氨基)(二甲基亚氨基)甲基)-1H-苯并[d][1,2,3]三唑3-氧化物四氟硼酸盐(TCTU,3.60g,10.1mmol)和DIPEA(3.18mL,18.2mmol)在DMF(70mL)中的溶液加入到树脂中并摇动该混合物3小时。过滤树脂并用DMF(2×100mL)、DCM(2×100mL)和DMF(2×100mL)洗涤。通过用DMF中的20%哌啶(1×5min,1×15min,2×80mL)处理去除Fmoc基团。用DMF(2×100mL)、2-丙醇(2×100mL)、DCM(2×100mL)和DMF(2×100mL)洗涤树脂。将{2-[2-(9H-芴-9-基甲氧羰基氨基)-乙氧基]-乙氧基}-乙酸(Fmoc-OEG-OH,3.90g,10.1mmol)、5-氯-1-((二甲基氨基)(二甲基亚氨基)甲基)-1H-苯并[d][1,2,3]三唑3-氧化物四氟硼酸盐(TCTU,3.60g,10.1mmol)和DIPEA(3.18mL,18.2mmol)在DMF(70mL)中的溶液加入到树脂中并将该混合物摇动过夜。过滤树脂并用DMF(2×100mL)、DCM(2×100mL)和DMF(2×100mL)洗涤。通过用DMF中的20%哌啶(1×5min,1×15min,2×80mL)处理去除Fmoc基团。用DMF(2×100mL)、2-丙醇(2×100mL)、DCM(2×100mL)和DMF(2×100mL)洗涤树脂。将1-(氯-二苯基-甲基)-4-甲基苯(MttCl,2.97g,10.1mmol)和DIPEA(3.53mL,20.3mmol)在无水DCM(70mL)中的溶液加入到树脂中并摇动混合物4.5hr。过滤树脂并用DMF(2×100mL)、DCM(3×100mL)和DMF(3×100mL)洗涤。通过用DMF中的2%一水合肼(3×3min,3×80mL)处理去除IvDde基团。用DMF(6×100mL)洗涤树脂。将氯乙酸(1.91g,20.3mmol)、DIC(3.14mL,20.3mmol)和2,4,6-三甲基吡啶(5.35mL,40.5mmol)在DMF(80mL)中的溶液加入到树脂中并摇动混合物2.5hr。过滤树脂并用DMF(3×100mL)和DCM(3×100mL)洗涤。通过用DCM中的80%1,1,1,3,3,3-六氟-2-丙醇(2×10min,3×30min,5×75mL)处理去除Mtt基团。用DCM(3×100mL)和DMF(3×100mL)洗涤树脂。将溴乙酸(9.39g,67.6mmol)和DIC(8.90mL,57.5mmol)在DMF(80mL)中的溶液加入到树脂中并摇动混合物20min。过滤树脂并用DMF(3×100mL)和DCM(10×100mL)洗涤。通过用TFA和水的混合物(98∶2,100mL)处理1hr从树脂上裂解产物。过滤树脂并用DCM(2×80mL)洗涤。合并溶液并蒸发溶剂至干。通过HPLC(柱DeltaPak C18,15um;50×500mm;MeCN/水5∶95至60∶40+0.05%TFA)纯化残留物并冷冻干燥,以得到呈白色固体的标题化合物(9)。
产量:425mg(14%)。
1H NMR谱(300MHz,AcOD-d4,δH):4.76(dd,J=7.8和5.9Hz,1H);4.57(dd,J=8.9和4.9Hz,1H);4.36(s,2H);4.20(s,2H);4.14(s,4H);3.98(s,2H);3.81-3.41(m,24H);2.56(t,J=8.0Hz,2H);2.47(t,J=7.2Hz,2H);2.37-2.20(m,2H);2.20-2.05(m,2H)。
LC-MS纯度:100%。
LC-MS Rt(Kinetex C18,4.6mm×50mm,MeCN/水5∶95至100∶0+0.1%FA):3.58min。
LC-MS m/z:925.6(M+H)+。
三价连接体5
(13R,18S)-18-(二(2-(2-氯乙酰胺基)乙基)氨基甲酰基)-1-溴-13-羧基-2,11,16-三氧代-6,9-二氧杂-3,12,17-三氮杂二十一烷-21-酸
反应流程:
合成方案:
方案REaD-24247(批号218-004-1)中描述了Wang树脂结合化合物1(Wang resin-bound 1)的制备。
使Wang树脂结合化合物(1,2.85g,0.92mmol)在DCM(20mL)中溶胀20min。通过用DMF中的20%哌啶(1×5min,1×30min,2×20mL)处理去除Fmoc基团。用DMF(3×20mL)、2-丙醇(3×20mL)和DCM(3×20mL)洗涤树脂。将(S)-2-(9H-芴-9-基甲氧羰基氨基)-戊二酸1-叔丁酯(Fmoc-LGlu-OtBu,1.17g,2.75mmol)、TCTU(0.98g,2.75mmol)和DIPEA(0.96mL,5.49mmol)在DMF(20mL)中的溶液加入到树脂中并摇动混合物2hr。通过用DMF中的20%哌啶(1×5min,1×30min,2×20mL)处理去除Fmoc基团。用DMF(3×20mL)、2-丙醇(3×20mL)和DCM(3×20mL)洗涤树脂。将{2-[2-(9H-芴-9-基甲氧羰基氨基)-乙氧基]-乙氧基}-乙酸(Fmoc-OEG-OH,1.06g,2.75mmol)、TCTU(0.98g,2.75mmol)和DIPEA(0.96mL,5.49mmol)在DMF(20mL)中的溶液加入到树脂中并摇动该混合物3.5hr。过滤树脂并用DMF(3×20mL)、DCM(3×20mL)和DMF(3×20mL)洗涤。通过用DMF中的20%哌啶(1×5min,1×30min,2×20mL)处理去除Fmoc基团。用DMF(3×20mL)、2-丙醇(3×20mL)和DCM(3×20mL)洗涤树脂。
将1-(氯-二苯基-甲基)-4-甲基苯(MttCl,1.20g,4.10mmol)和DIPEA(1.44mL,8.27mmol)在无水DCM(40mL)中的溶液加入到树脂中并摇动混合物1小时。过滤树脂并用DCM(4×20mL)和DMF(4×20mL)洗涤。通过用DMF中的2%一水合肼(3×3min,3×20mL)处理去除IvDde基团。用DMF(8×20mL)洗涤树脂。将氯乙酸(0.52g,5.49mmol)、PyBroP(2.56g,5.49mmol)和DIPEA(1.91mL,11.0mmol)在DMF(25mL)中的溶液加入到树脂中并摇动混合物3hr。过滤树脂并用DMF(4×20mL)、DCM(4×20mL)、DMF(4×20mL)、DCM(10×20mL)洗涤。通过用DCM中的80%1,1,1,3,3,3-六氟-2-丙醇(2×10min,2×30min,4×25mL)处理去除Mtt基团。用DCM(5×20mL)和DMF(4×20mL)洗涤树脂。将溴乙酸(2.54g,18.3mmol)和DIC(2.41mL,15.6mmol)在DMF(30mL)中的溶液加入到树脂中并摇动混合物25分钟。过滤树脂并用DMF(4×20mL)、MeCN(2×20mL)和DCM(10×20mL)洗涤。通过用TFA/TIS/H2O的裂解混合物(95∶2.5∶2.5,30mL)处理1小时从树脂上裂解产物。过滤树脂并用DCM(10×30mL)洗涤。合并溶液并蒸发溶剂至干。将溶剂与甲苯共蒸发三次。通过HPLC(柱X-Bridge3C18,OBD,5μm,50×250mm,MeCN/水5%至35%+0.05%TFA)纯化残留物,得到呈白色固体的(13R,18S)-18-(二(2-(2-氯乙酰胺基)乙基)氨基甲酰基)-1-溴-13-羧基-2,11,16-三氧代-6,9-二氧杂-3,12,17-三氮杂二十一烷-21-酸(2)。
产量:333mg(47%)。
1H NMR谱(300MHz,AcOD-d4,80℃,δH):5.08(dd,J=9.5Hz,J=4.2Hz,1H);4.71(dd,J=8.1Hz,J=5.1Hz,1H);4.19-4.09(m,6H);3.96(s,2H);3.90-3.44(m,16H);2.59-2.07(m,7H);2.01-1.86(m,1H)。
LC-MS纯度:100%。
LC-MS Rt(Kinetex 4.6mm×50mm,MeCN/H2O 5∶95至100∶0+0.1%FA):4.56min。
LC-MS m/z:781.5(M+H)+。
UPLC纯度:99%(220nm)。
UPLC Rt(Acquity UPLC BEHC 18,1.7μm,2.1×150mm;MeCN/H2O 5∶95至100∶0+0.1%TFA):1.57min。
三价连接体6
(18R,23S)-23-(二(2-(2-氯乙酰胺基)乙基)氨基甲酰基)-1-溴-18-羧基-2,7,16,21-四氧代-11,14-二氧杂-3,8,17,22-四氮杂二十六烷-26-酸
———————————————————————————————————————————————
反应流程:
反应流程:
合成方案:
化合物(1)的制备。
将2-(1-羟基-3-甲基丁亚基)-5,5-二甲基环己烷-1,3-二酮(37.7g,168mmol)的DCM(200mL)溶液逐滴加入到二亚乙基三胺(8.64mL,80.0mmol)的DCM(130mL)溶液中。将反应混合物搅拌过夜,随后蒸发溶剂,得到呈浅黄色油状物的2,2′-(((氮烷二基二(乙烷-2,1-二基))二(氮烷二基))二(3-甲基丁烷-1-基-1-亚基))二(5,5-二甲基环己烷-1,3-二酮)。
产量:41.2g(100%)。
1H NMR谱(300MHz,CDCl3,δH):3.57(q,4H);3.06-2.89(m,8H);2.36(bs,8H);2.05-1.89(m,2H);1.09-0.94(m,26H)。
将上述胺(33.4g,64.8mmol)的DMF(320mL)溶液加入到2-(9H-芴-9-基甲氧羰基氨基)-戊二酸5-叔丁酯(Fmoc-Glu(OtBu)-OH,63.4g,149mmol)、HATU(56.6g,149mmol)、DIPEA(40.0mL,227mmol)在DMF(530mL)中的溶液中。在室温下将反应混合物搅拌过夜。随后加入乙酸乙酯(1.6L)和水(1.6L)。将分离的有机层用10%K2CO3水溶液(2×1.6L)洗涤,经无水Na2SO4干燥,过滤,并在真空中蒸发。通过快速柱色谱法(硅胶60,0.063-0.040mm;洗脱液:DCM/MeOH 50∶1-40∶1)纯化残留物,得到呈浅黄色粘性油状物的4-((((9H-芴-9-基)甲氧基)羰基)氨基)-5-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)氨基)乙基)氨基)-5-氧代戊酸叔丁酯。
产量:59.2g(99%)。
1H NMR谱(300MHz,CDCl3,δH):7.77(d,J=7.5Hz,2H);7.59(m,2H);7.40(t,J=7.5Hz,2Hz);7.36-7.26(m,2H);5.65(d,J=9.2Hz,1H);4.72-4.59(m,1H);4.46-4.27(m,2H);4.24-4.16(m,1H);4.12-3.99(m,1H);3.94-3.53(m,6H);3.48-3.33(m,1H);2.97(bs,4H);2.46-2.26(m,10H);2.08-1.83(m,4H);1.79-1.64(m,1H);1.43(s,9H);1.07-0.90(m,24H)。
将溶解在DCM(50mL)中的4-((((9H-芴-9-基)甲氧基)羰基)氨基)-5-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)氨基)乙基)氨基)-5-氧代戊酸叔丁酯(59.2g,64.8mmol)加入到TFA/H2O混合物(95∶5,400mL)中并搅拌2hr。随后蒸发溶剂并将残留物与甲苯共蒸发三次。将残留物溶解在DCM(800mL)中并用水(3×800mL)洗涤。在减压下蒸发溶剂。通过柱色谱法(硅胶60,0.063-0.040mm;洗脱液:DCM/甲醇60∶1-10∶1)纯化残留物,得到呈白色粉末的4-((((9H-芴-9-基)甲氧基)-羰基)氨基)-5-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)-氨基)乙基)氨基)-5-氧代戊酸。
产量:42.1g(76%)。
1H NMR谱(300MHz,AcOD-d4,80℃,δH):7.79(d,J=7.3Hz,2H);7.64(d,J=7.5Hz,2H);7.39(t,J=7.4Hz,2H);7.36-7.26(m,2H);4.83(bs,1H);4.48-4.30(m,2H);4.27-4.19(m,1H);4.19-3.62(m,7H);3.61-3.46(m,1H);3.28-2.90(m,4H);2.55(t,J=6.7Hz,2H);2.43(s,8H);2.01-1.81(m,4H);1.07-0.88(m,24H)。
使Wang树脂0.63mmol/g(25.7g,16.2mmol)在四氢呋喃(250mL)中溶胀20分钟。将4-((((9H-芴-9-基)甲氧基)羰基)氨基)-5-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)-氨基)乙基)氨基)-5-氧代戊酸(42.0g,48.5mmol)的THF(250mL)溶液加入到树脂中,随后加入DIC(7.60mL,48.5mmol)和4-二甲基氨基吡啶(DMAP,200mg,1.62mmol)。将该混合物摇动18hr。过滤树脂并用DCM(6×250mL)洗涤。用乙酸酐(40mL)、吡啶(40mL)在DMF(360mL)中的溶液处理树脂15min,并用DCM(6×250mL)洗涤,得到呈黄色固体的化合物(1)。
产量:36.0g。
加样:51%(0.321mmol/g)。
将Wang树脂结合化合物(1)(2.85g,0.92mmol)在DCM(20mL)中溶胀20min。通过用DMF中的20%哌啶(1×5min,1×30min,2×40mL)处理去除Fmoc基团。用DMF(3×70mL)、2-丙醇(3×70mL)和DCM(3×70mL)洗涤树脂。将(S)-2-(9H-芴-9-基甲氧羰基氨基)-戊二酸1-叔丁酯(Fmoc-LGlu-OtBu,1.17g,2.75mmol)、TCTU(0.98g,2.75mmol)和DIPEA(0.96mL,5.49mmol)在DMF(60mL)中的溶液加入到树脂中并摇动混合物3hr。通过用DMF中的20%哌啶(1×5min,1×30min,2×40mL)处理去除Fmoc基团。用DMF(3×70mL)、2-丙醇(3×70mL)和DCM(3×70mL)洗涤树脂。将{2-[2-(9H-芴-9-基甲氧基-羰基氨基)-乙氧基]-乙氧基}-乙酸(Fmoc-OEG-OH,1.06g,2.75mmol)、TCTU(0.98g,2.75mmol)和DIPEA(0.96mL,5.49mmol)在DMF(50mL)中的溶液加入到树脂中并摇动该混合物2hr。过滤树脂并用DMF(3×70mL)、DCM(3×70mL)和DMF(3×70mL)洗涤。通过用DMF中的20%哌啶(1×5min,1×30min,2×40mL)处理去除Fmoc基团。用DMF(3×70mL)、2-丙醇(3×70mL)和DCM(3×70mL)洗涤树脂。
将4-((((9H-芴-9-基)甲氧基)羰基)氨基)丁酸(Fmoc-GABA,0.88g,2.70mmol)、TCTU(0.96g,2.70mmol)和DIPEA(0.94mL,5.40mmol)在DMF(50mL)中的溶液加入到树脂中并摇动该混合物2hr。过滤树脂并用DMF(3×70mL)、DCM(3×70mL)和DMF(3×70mL)洗涤。通过用DMF中的20%哌啶(1×5min,1×30min,2×40mL)处理去除Fmoc基团。用DMF(3×70mL)、2-丙醇(3×70mL)和DCM(3×70mL)洗涤树脂。将1-(氯-二苯基-甲基)-4-甲基苯(MttCl,0.79g,2.70mmol)和DIPEA(0.94mL,5.4mmol)在无水DCM(60mL)中的溶液加入到树脂中并摇动混合物3hr。过滤树脂并用DCM(3×70mL)和DMF(3×70mL)洗涤。通过用DMF中的2%一水合肼(3×3min,3×30mL)处理去除IvDde基团。用DMF(5×40mL)洗涤树脂。将氯乙酸(0.51g,5.40mmol)、DIC(0.85mL,5.40mmol)和2,4,6-三甲基吡啶(1.43mL,10.8mmol)在DMF(50mL)中的溶液加入到树脂中并摇动该混合物2.5hr。过滤树脂并用DMF(3×70mL)和DCM(3×70mL)洗涤。通过用DCM中的80%1,1,1,3,3,3-六氟-2-丙醇(2×10min,2×30min,4×50mL)处理去除Mtt基团。用DCM(5×50mL)和DMF(4×50mL)洗涤树脂。将溴乙酸(0.38g,2.70mmol)和DIC(0.42mL,2.70mmol)在DMF(50mL)中的溶液加入到树脂中并摇动混合物2.5hr。过滤树脂并用DMF(3×70mL)和DCM(3×70mL)洗涤。通过用TFA/TIS/H2O的裂解混合物(95∶2.5∶2.5,26mL)处理1hr从树脂上裂解产物。过滤树脂并用DCM(6×40mL)洗涤。合并溶液并蒸发溶剂至干。通过HPLC(柱Gemini C18,5μm;50×250mm;MeCN/H2O在180min内5∶95至40∶60,且在60min内5∶95至35∶65,+0.05%TFA)纯化残留物并冷冻干燥,得到呈白色固体的标题化合物(2)。
产量:336mg(43%)。
1H NMR谱(300MHz,AcOD-d4,H):5.07(dd,J=9.9和2.9Hz,1H);4.72(dd,J=8.7和4.7Hz,1H);4.22-4.12(m,6H);3.96(s,2H);3.93-3.37(m,16H);3.33(t,J=6.8Hz,3H);2.59-2.29(m,7H);2.10(d,J=4.9Hz,2H);1.97-1.80(m,3H)。
LC-MS纯度:100%。
LC-MS Rt(Kinetex 4.6mm×50mm,MeCN/H2O 5∶95至100∶0+0.1%FA):2.86min。
LC-MS m/z:866.5(M+H)+。
UPLC纯度:98.7%(214nm)。
UPLC Rt(Acquity UPLC BEHC 18,1.7μm,2.1×150mm;MeCN/H2O 5∶95至100∶0+0.05%TFA):2.74min。
三价连接体6
(18R,23S)-23-(二(2-(2-氯乙酰胺基)乙基)氨基甲酰基)-1-溴-18-羧基-2,7,16,21-四氧代-11,14-二氧杂-3,8,17,22-四氮杂二十六烷-26-酸
反应流程:
合成方案:
化合物(1)的制备。
将2-(1-羟基-3-甲基丁亚基)-5,5-二甲基环己烷-1,3-二酮(37.7g,168mmol)的DCM(200mL)溶液逐滴加入到二亚乙基三胺(8.64mL,80.0mmol)的DCM(130mL)溶液中。将反应混合物搅拌过夜,随后蒸发溶剂,得到呈浅黄色油状物的2,2′-(((氮烷二基二(乙烷-2,1-二基))二(氮烷二基))二(3-甲基丁烷-1-基-1-亚基))二(5,5-二甲基环己烷-1,3-二酮)。
产量:41.2g(100%)。
1H NMR谱(300MHz,CDCl3,δH):3.57(q,4H);3.06-2.89(m,8H);2.36(bs,8H);2.05-1.89(m,2H);1.09-0.94(m,26H)。
将上述胺(33.4g,64.8mmol)的DMF(320mL)溶液加入到2-(9H-芴-9-基甲氧羰基氨基)-戊二酸5-叔丁酯(Fmoc-Glu(OtBu)-OH,63.4g,149mmol)、HATU(56.6g,149mmol)、DIPEA(40.0mL,227mmol)在DMF(530mL)中的溶液中。在室温下将反应混合物搅拌过夜。随后加入乙酸乙酯(1.6L)和水(1.6L)。将分离的有机层用10%K2CO3水溶液(2×1.6L)洗涤,经无水Na2SO4干燥,过滤,并在真空中蒸发。通过快速柱色谱法(硅胶60,0.063-0.040mm;洗脱液:DCM/MeOH 50∶1-40∶1)纯化残留物,得到呈浅黄色粘性油状物的4-((((9H-芴-9-基)甲氧基)羰基)氨基)-5-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)氨基)乙基)氨基)-5-氧代戊酸叔丁酯。
产量:59.2g(99%)。
1H NMR谱(300MHz,CDCl3,δH):7.77(d,J=7.5Hz,2H);7.59(m,2H);7.40(t,J=7.5Hz,2Hz);7.36-7.26(m,2H);5.65(d,J=9.2Hz,1H);4.72-4.59(m,1H);4.46-4.27(m,2H);4.24-4.16(m,1H);4.12-3.99(m,1H);3.94-3.53(m,6H);3.48-3.33(m,1H);2.97(bs,4H);2.46-2.26(m,10H);2.08-1.83(m,4H);1.79-1.64(m,1H);1.43(s,9H);1.07-0.90(m,24H)。
将溶解在DCM(50mL)中的4-((((9H-芴-9-基)甲氧基)羰基)氨基)-5-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)氨基)乙基)氨基)-5-氧代戊酸叔丁酯(59.2g,64.8mmol)加入到TFA/H2O混合物(95∶5,400mL)中并搅拌2hr。随后蒸发溶剂并将残留物与甲苯共蒸发三次。将残留物溶解在DCM(800mL)中并用水(3×800mL)洗涤。在减压下蒸发溶剂。通过柱色谱法(硅胶60,0.063-0.040mm;洗脱液:DCM/甲醇60∶1-10∶1)纯化残留物,得到呈白色粉末的4-((((9H-芴-9-基)甲氧基)羰基)氨基)-5-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)氨基)乙基)氨基)-5-氧代戊酸。
产量:42.1g(76%)。
1H NMR谱(300MHz,AcOD-d4,80℃,δH):7.79(d,J=7.3Hz,2H);7.64(d,J=7.5Hz,2H);7.39(t,J=7.4Hz,2H);7.36-7.26(m,2H);4.83(bs,1H);4.48-4.30(m,2H);4.27-4.19(m,1H);4.19-3.62(m,7H);3.61-3.46(m,1H);3.28-2.90(m,4H);2.55(t,J=6.7Hz,2H);2.43(s,8H);2.01-1.81(m,4H);1.07-0.88(m,24H)。
使Wang树脂0.63mmol/g(25.7g,16.2mmol)在四氢呋喃(250mL)中溶胀20分钟。将4-((((9H-芴-9-基)甲氧基)羰基)氨基)-5-(二(2-((1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基)-氨基)乙基)氨基)-5-氧代戊酸(42.0g,48.5mmol)的THF(250mL)溶液加入到树脂中,随后加入DIC(7.60mL,48.5mmol)和4-二甲基氨基吡啶(DMAP,200mg,1.62mmol)。将该混合物摇动18hr。过滤树脂并用DCM(6×250mL)洗涤。用乙酸酐(40mL)、吡啶(40mL)在DMF(360mL)中的溶液处理树脂15min,并用DCM(6×250mL)洗涤,得到呈黄色固体的化合物(1)。
产量:36.0g。
加样:51%(0.321mmol/g)。
将Wang树脂结合化合物(1)(2.85g,0.92mmol)在DCM(20mL)中溶胀20min。通过用DMF中的20%哌啶(1×5min,1×30min,2×40mL)处理去除Fmoc基团。用DMF(3×70mL)、2-丙醇(3×70mL)和DCM(3×70mL)洗涤树脂。将(S)-2-(9H-芴-9-基甲氧羰基氨基)-戊二酸1-叔丁酯(Fmoc-LGlu-OtBu,1.17g,2.75mmol)、O-(6-氯-苯并三唑-1-基)-N,N,N′,N′-四甲基脲四氟硼酸盐(TCTU,0.98g,2.75mmol)和DIPEA(0.96mL,5.49mmol)在DMF(60mL)中的溶液加入到树脂中并摇动混合物3hr。通过用DMF中的20%哌啶(1×5min,1×30min,2×40mL)处理去除Fmoc基团。用DMF(3×70mL)、2-丙醇(3×70mL)和DCM(3×70mL)洗涤树脂。将{2-[2-(9H-芴-9-基甲氧基-羰基氨基)-乙氧基]-乙氧基}-乙酸(Fmoc-OEG-OH,1.06g,2.75mmol)、O-(6-氯-苯并三唑-1-基)-N,N,N′,N′-四甲基脲四氟硼酸盐(TCTU,0.98g,2.75mmol)和DIPEA(0.96mL,,5.49mmol)在DMF(50mL)中的溶液加入到树脂中并摇动该混合物2小时。过滤树脂并用DMF(3×70mL)、DCM(3×70mL)和DMF(3×70mL)洗涤。通过用DMF中的20%哌啶(1×5min,1×30min,2×40mL)处理去除Fmoc基团。用DMF(3×70mL)、2-丙醇(3×70mL)和DCM(3×70mL)洗涤树脂。
将4-((((9H-芴-9-基)甲氧基)羰基)氨基)丁酸(Fmoc-GABA,0.88g,2.70mmol)、O-(6-氯-苯并三唑-1-基)-N,N,N′,N′-四甲基脲四氟硼酸盐
(TCTU,0.96g,2.70mmol)和DIPEA(0.94mL,5.40mmol)在DMF(50mL)中的溶液加入到树脂中并摇动该混合物2小时。过滤树脂并用DMF(3×70mL)、DCM(3×70mL)和DMF(3×70mL)洗涤。通过用DMF中的20%哌啶(1×5min,1×30min,2×40mL)处理去除Fmoc基团。用DMF(3×70mL)、2-丙醇(3×70mL)和DCM(3×70mL)洗涤树脂。将1-(氯-二苯基-甲基)-4-甲基苯(MttCl,0.79g,2.70mmol)和DIPEA(0.94mL,5.4mmol)在无水DCM(60mL)中的溶液加入到树脂中并摇动混合物3hr。过滤树脂并用DCM(3×70mL)和DMF(3×70mL)洗涤。通过用DMF中的2%一水合肼(3×3min,3×30mL)处理去除IvDde基团。用DMF(5×40mL)洗涤树脂。将氯乙酸(0.51g,5.40mmol)、DIC(0.85mL,5.40mmol)和2,4,6-三甲基吡啶(1.43mL,10.8mmol)在DMF(50mL)中的溶液加入到树脂中并摇动该混合物2.5hr。过滤树脂并用DMF(3×70mL)和DCM(3×70mL)洗涤。通过用DCM中的80%1,1,1,3,3,3-六氟-2-丙醇(2×10min,2×30min,4×50mL)处理去除Mtt基团。随后用DCM(5×50mL)和DMF(4×50mL)洗涤树脂。将溴乙酸(0.38g,2.70mmol)和DIC(0.42mL,2.70mmol)在DMF(50mL)中的溶液加入到树脂中并摇动混合物2.5hr。过滤树脂并用DMF(3×70mL)和DCM(3×70mL)洗涤。通过用TFA/TIS/H2O的裂解混合物(95∶2.5∶2.5,26mL)处理1hr从树脂上裂解产物。过滤树脂并用DCM(6×40mL)洗涤。合并溶液并蒸发溶剂至干。通过HPLC(柱Gemini C18,5um;50×250mm;MeCN/H2O在180min内5∶95至40∶60,且在60min内5∶95至35∶65,+0.05%TFA)纯化残留物并冷冻干燥,得到呈白色固体的标题化合物(2)。
产量:336mg(43%)。
1H NMR谱(300MHz,AcOD-d4,δH):5.07(dd,J=9.9和2.9Hz,1H);4.72(dd,J=8.7和4.7Hz,1H);4.22-4.12(m,6H);3.96(s,2H);3.93-3.37(m,16H);3.33(t,J=6.8Hz,3H);2.59-2.29(m,7H);2.10(d,J=4.9Hz,2H);1.97-1.80(m,3H)。
LC-MS纯度:100%。
LC-MS Rt(Kinetex 4.6mm×50mm,MeCN/H2O 5∶95至100∶0+0.1%FA):2.86min。
LC-MS m/z:866.5(M+H)+。
UPLC纯度:98.7%(214nm)。
UPLC Rt(Acquity UPLC BEHC 18,1.7μm,2.1×150mm;MeCN/H2O 5∶95至100∶0+0.05%TFA):2.74min。
三价连接体7
(S)-4-(2-{2-[((S)-1-{二-[2-(2-氯-乙酰基氨基)-乙基]-氨基甲酰基}-3-羧基-丙基氨基甲酰基)-甲氧基]-乙氧基}-乙基氨基甲酰基)-2-(2-溴-乙酰基氨基)-丁酸
反应流程:
合成方案:
使Wang树脂0.63mmol/g(1,5.08g,3.20mmol)在THF(60mL)中溶胀45分钟。将(S)-4-(二-{2-[1-(4,4-二甲基-2,6-二氧代-环己亚基)-乙基氨基]-乙基}-氨基甲酰基)-4-(9H-芴-9-基甲氧羰基氨基)-丁酸(7.52g,9.61mmol)、DIC(1.49mL,9.61mmol)和4-二甲基氨基吡啶(DMAP,0.04g,0.32mmol)在THF(50mL)中的溶液加入到树脂中并将该混合物摇动过夜。过滤树脂并用DMF(2×50mL)、DCM(2×50mL)和DMF(2×50mL)洗涤。通过用DMF中的20%哌啶(2×50mL,1×5min,1×20min)处理去除Fmoc基团。用DMF(2×50mL)、2-丙醇(2×50mL)、DCM(2×50mL)和DMF(2×50mL)洗涤树脂。将{2-[2-(9H-芴-9-基甲氧羰基氨基)-乙氧基]-乙氧基}-乙酸(Fmoc-OEG-OH,2.47g,6.41mmol)、TCTU(2.28g,6.41mmol)和DIPEA(2.01mL,11.5mmol)在DMF(50mL)中的溶液加入到树脂中并摇动混合物2hr。过滤树脂并用DMF(2×50mL)、DCM(2×50mL)和DMF(2×50mL)洗涤。通过用DMF中的20%哌啶(2×50mL,1×5min,1×20min)处理去除Fmoc基团。用DMF(2×50mL)、2-丙醇(2×50mL)、DCM(2×50mL)和DMF(2×50mL)洗涤树脂。将(S)-2-(9H-芴-9-基甲氧羰基氨基)-戊二酸1-叔丁酯(Fmoc-Glu-OtBu,2.04g,4.80mmol)、TCTU(1.71,4.80mmol)和DIPEA(1.67mL,9.61mmol)在DMF(50mL)中的溶液加入到树脂中并摇动混合物1.5hr。过滤树脂并用DMF(2×50mL)、DCM(2×50mL)和DMF(2×50mL)洗涤。通过用DMF中的20%哌啶(2×50mL,1×5min,1×20min)处理去除Fmoc基团。用DMF(2×50mL)、2-丙醇(2×50mL)、DCM(2×50mL)和DMF(2×50mL)洗涤树脂。将1-(氯-二苯基-甲基)-4-甲基苯(MttCl,1.13g,3.84mmol)和DIPEA(1.67mL,9.61mmol)在无水DCM(50mL)中的溶液加入到树脂中并摇动混合物2hr。过滤树脂并用DCM(4×50mL)和DMF(4×50mL)洗涤。通过用DMF中的2%肼(3×50mL,3×3min)处理去除Dde基团。用DMF(8×50mL)洗涤树脂。将氯乙酸(0.91g,9.61mmol)、PyBrOP(4.48g,9.61mmol)和DMF(3.35mL,19.2mmol)在DMF(50mL)中的溶液加入到树脂中并将混合物摇动过夜。茚三酮试验仍为阳性,因此进行再偶联。将氯乙酸(0.91g,9.61mmol)、PyBrOP(4.48g,9.61mmol)和DIPEA(3.35mL,19.2mmol)在DMF(50mL)中的溶液加入到树脂中并摇动混合物3hr。过滤树脂并用DMF(4×50mL)和DCM(4×50mL)洗涤。通过用DCM中的80%1,1,1,3,3,3-六氟-2-丙醇(7×50mL,2×10min,5×30min)处理去除Mtt基团。用DCM(5×50mL)和DMF(4×50mL)洗涤树脂。将溴乙酸(8.90g,64.1mmol)和DIC(8.43mL,54.5mmol)在DMF(50mL)中的溶液加入到树脂中并摇动混合物20分钟。过滤树脂并用DMF(4×30mL)和DCM(10×30mL)洗涤。通过用TFA(50mL)处理1.5hr从树脂上裂解产物。过滤树脂并用TFA(1×50mL)和DCM(2×50mL)洗涤。合并溶液并蒸发溶剂。将残留物与甲苯共蒸发两次,并通过制备型LC/MS(SunFire Prep C18 OBD 5m,19×100mm,梯度为0.1%FA中的5%-100%MeCN/H2O)纯化。合并含有纯产物的级分并冷冻干燥,得到呈米黄色固体的标题化合物。
产量:150mg(30%)。
1H NMR谱(300MHz,AcOD-d4,δH):5.19-5.05(m,1H);4.72-4.56(m,1H);4.27-4.07(m,6H);4.06-3.37(m,18H);2.60-2.37(m,4H);2.36-2.22(m,1H);2.21-1.87(m,3H)。
LC-MS纯度:100%。
LC-MS Rt(Kinetex 4.6mm×50mm,MeCN/水05∶95至100∶0+0.1%FA):294min。
LC-MS m/z:780.4(M+H)+。
三价连接体8
(4S,18S)-4-(二(2-(2-溴乙酰胺基)乙基)氨基甲酰基)-18-(2-(2-(2-(2-氯乙酰胺基)乙氧基)乙氧基)乙酰胺基)-6,15-二氧代-8,11-二氧杂-5,14-二氮杂十九烷二酸
反应流程:
合成方案:
通过用DMF中的2%一水合肼(3×3min,3×50mL)处理从一部分树脂(1)(8.25g,2.71mmol,如实施例5中所述制备)中去除IvDde基团。用DMF(6×50mL)洗涤树脂。将溴乙酸(2.26g,16.3mmol)、DIC(2.52mL,16.3mmol)和2,4,6-三甲基吡啶(4.30mL,32.5mmol)在DMF(50mL)中的溶液加入到树脂中并摇动混合物2.5hr。过滤树脂并用DMF(3×50mL)、DCM(3×50mL)、DMF(3×50mL)和DCM(4×50mL)洗涤。通过用DCM中的80%1,1,1,3,3,3-六氟-2-丙醇(2×10min,2×30min,4×50mL)处理去除Mtt基团。用DCM(5×50mL)和DMF(4×50mL)洗涤树脂。将氯乙酸(5.12g,54.2mmol)和DIC(7.13mL,46.1mmol)在DMF(50mL)中的溶液加入到树脂中并摇动混合物30min。过滤树脂并用DMF(4×50mL)和DCM(10×50mL)洗涤。通过用TFA/TIS/H2O的裂解混合物(95∶2.5∶2.5,50mL)处理2hr从树脂上裂解产物。过滤树脂并用TFA/DCM混合物(1∶1,50mL)和DMF(10×30mL)洗涤。合并溶液并蒸发溶剂至干。通过HPLC(柱X-Bridge3 C18,OBD,5μm,50×250mm,MeCN/H2O3∶35至35∶40+0.05%TFA)纯化残留物,得到呈白色固体的(4S,18S)-4-(二(2-(2-溴乙酰胺基)乙基)氨基甲酰基)-18-(2-(2-(2-(2-氯乙酰胺基)乙氧基)乙氧基)乙酰胺基)-6,15-二氧代-8,11-二氧杂-5,14-二氮杂十九烷二酸(2)。
产量:213mg(8%)。
1H NMR谱(300MHz,AcOD-d4,80℃,δH):5.12(dd,J=9.5和3.9Hz,1H);4.69(dd,J=8.0和5.4Hz,1H);4.19-4.10(m,6H);3.94(s,2H);3.90-3.43(m,24H);2.55(t,J=7.0Hz,2H);2.48(m,2H);2.41-1.99(m,4H)。
LC-MS纯度:100%。
LC-MS Rt(Kinetex 4.6mm×50mm,MeCN/H2O 5∶95至100∶0+0.1%FA):3.06min。
LC-MS m/z:970.5(M+H)+。
UPLC纯度:98.3%(214nm)。
UPLC Rt(Acquity UPLC BEHC 18,1.7μm,2.1×150mm;MeCN/H2O 5∶95至95∶5+0.05%TFA):1.66min。
三价连接体9
(4S)-5-[二[3-[(2-氯乙酰基)氨基]丙基]氨
基]-4-[[2-[2-[2-[(2-溴乙酰基)氨基]乙氧基]乙氧基]乙酰
基]氨基]-5-氧代-戊酸
以实施例1中针对三价连接体1所述类似的方式,用2,2′-(((氮烷二基二(丙烷-3,1-二基))二(氮烷二基))二(3-甲基丁烷-1-基-1-亚基))二(5,5-二甲基环己烷-1,3-二酮)代替2,2′-(((氮烷二基二(乙烷-2,1-二基))二(氮烷二基))二(3-甲基丁烷-1-基-1-亚基))二(5,5-二甲基环己烷-1,3-二酮)来制备三价连接体9。
通过制备型LC-MS(柱Labio C18,50×500mm,MeCN/水+0.05%TFA,梯度为在120min内10∶40)纯化粗(4S)-5-[二[3-[(2-氯乙酰基)氨基]丙基]氨基]-4-[[2-[2-[2-[(2-溴乙酰基)氨基]乙氧基]乙氧基]乙酰基]氨基]-5-氧代-戊酸,得到呈无色油状物的纯(4S)-5-[二[3-[(2-氯乙酰基)氨基]丙基]氨基]-4-[[2-[2-[2-[(2-溴乙酰基)氨基]乙氧基]乙氧基]乙酰基]氨基]-5-氧代-戊酸。
产量:0.25g(56%)。
LC-MS纯度:100%(ELSD)。
LC-MS Rt(Kinetex C18,4.6mm×50mm,MeCN/H2O 5∶95至100∶0+0.1%FA):3.01min。
LC-MS m/z:680.2(M+H)+。
1H NMR谱(300MHz,CDCl3,δH):7.71-7.60(m,2H);7.49-7.41(m,1H);7.35-7.29(m,1H);5.17-5.07(m,1H);4.43(bs,1H);4.12-3.98(m,6H);3.90(s,2H);3.76-3.57(m,8H);3.50-3.14(m,8H);2.50-2.42(m,2H);2.10-1.70(m,6H)。
三价连接体10
N-[2-[2-[2-[2-[(2-溴乙酰基)氨基]乙氧基]乙氧基]乙基氨基甲酰基-[2-[(2-氯乙酰基)氨基]乙基]氨基]乙基]-2-氯-乙酰胺
反应流程:
合成方案:
使Wang-OH树脂0.53mmol/g(1,3.85g,2.04mmol)在无水DCM(40mL)中溶胀30min。将4-硝基苯基氯甲酸酯(2,0.27g,1.36mmol)和吡啶(0.12mL,1.50mmol)在无水DCM(40mL)中的溶液加入到树脂(1)中并将混合物摇动过夜。用冰水(1×30mL)、冰水/1,4-二杂氧环己烷混合物(1∶1,1×30mL)、DMF(3×30mL)和DCM(3×30mL)洗涤树脂(3)。
将2,2′-(乙烷-1,2-二基二(氧基))二(乙烷-1-胺)(4)(0.59mL,4.08mmol)的DCM(30mL)溶液加入到树脂(3)中并将混合物摇动过夜。用DMF(4×30mL)、DCM(3×30mL)、DMF(2×30mL)和DCM(2×30mL)洗涤树脂(5)。
将4-硝基苯基氯甲酸酯(2)(1.10g,5.44mmol)和N,N-二异丙基乙胺(1.88mL,6.80mmol)在DMF/四氢呋喃混合物(1∶1,30mL)中的溶液加入到树脂(5)中并摇动混合物2hr。用DMF(4×30mL)、DCM(4×30mL)和DMF(4×30mL)洗涤树脂(6)。
将2,2′-(((氮烷二基二(乙烷-2,1-二基))二(氮烷二基))二(3-甲基丁烷-1-基-1-亚基))二(5,5-二甲基环己烷-1,3-二酮)(7)(1.40g,2.72mmol)和N,N-二异丙基乙胺(0.47mL,2.72mmol)在DMF(30mL)中的溶液加入到树脂(6)中并摇动混合物2hr。用DMF(4×30mL)、DCM(4×30mL)和DMF(4×30mL)洗涤树脂(8)。
通过用DMF中的2%一水合肼溶液(3×5min,3×30mL)处理去除ivDde保护基团。用DMF(3×30mL)、DCM(3×30mL)和DMF(3×30mL)洗涤树脂。将氯乙酸酐(0.93g,5.44mmol)和N,N-二异丙基乙胺(1.90mL,10.9mmol)在DMF(30mL)中的溶液加入到树脂中并摇动混合物1hr。过滤树脂并用DMF(3×30mL)、DCM(3×30mL)、DMF(3×30mL)和DCM(10×30mL)洗涤。通过用95%三氟乙酸水溶液(30mL)处理3hr从树脂上裂解产物(9)。过滤树脂并用DCM(3×10mL)洗涤。合并溶液并蒸发溶剂至干。将残留物溶解在60%MeCN水溶液(50mL)中并冷冻干燥,以得到呈黄色稠油的所需化合物(9)。
产量:240mg(42%)。
LC-MS纯度:93%(ELSD)。
LC-MS Rt(Kinetex C18,4.6mm×50mm,MeCN/H2O 5∶95至100∶0+0.1%FA):2.42min。
LC-MS m/z:430.29(M+H)+。
将上述化合物(9)(0.24g,0.56mmol)在MeCN(20mL)中的搅拌溶液在0℃下冷却并加入溴乙酸酐(0.22g,0.84mmol)和碳酸氢钠(0.18g,2.09mmol)。在0℃下搅拌反应混合物1hr。冷冻干燥该反应混合物得到呈无色油状的标题粗化合物(10)。
通过制备型LC/MS(SunFire Prep C18OBD,5μm,19×100mm,MeCN/H2O 5∶95至100∶0+0.1%FA)纯化粗化合物(10)两次,得到呈无色油状物的标题化合物N-[2-[2-[2-[2-[(2-溴乙酰基)氨基]乙氧基]乙氧基]乙基氨基甲酰基-[2-[(2-氯乙酰基)氨基]乙基]氨基]乙基]-2-氯-乙酰胺。
产量:35.0mg(12%)。
1H NMR谱(300MHz,CDCl3,δH):7.45(bs,2H);7.27(bs,1H);6.06-5.93(m,1H);4.06(s,4H);3.90(s,2H);3.64(s,4H);3.62-3.55(m,4H);3.53-3.38(m,12H)。
LC-MS纯度:100%(ELSD)。
LC-MS Rt(Kinetex C18,4.6mm×50mm,MeCN/H2O 5∶95至100∶0+0.1%FA):2.91min。
LC-MS m/z:552.3(M+H)+。
三价连接体11
(2R)-6-[二[2-[(2-氯乙酰基)氨基]乙基]氨基甲酰基氨基]-2-[[2-[2-[2-[(2-溴乙酰基)氨基]乙氧基]乙氧基]乙酰基]氨基]己酸
以针对三价连接体10所述类似的方式制备三价连接体11。
三价连接体12
(2R)-2-[[2-[2-[2-[(2-溴乙酰基)氨基]乙氧基]乙氧基]乙酰基]氨基]-5-[2-[2-[2-[[(1S)-3-羧基-1-[2-[(2-氯乙酰基)-[2-[(2-氯乙酰基)氨基]乙基]氨基]乙基氨基甲酰基]丙基]氨基]-2-氧代-乙氧基]乙氧基]乙基氨基]-5-氧代-戊酸
反应流程:
合成方案:
使Wang树脂结合化合物(1)(1.42g,0.70mmol)在DCM(20mL)中溶胀20min。通过用DMF中的20%哌啶(2×5min,1×20min,3×10mL)处理去除Fmoc基团。用DMF(3×15mL)、2-丙醇(3×15mL)和DCM(3×15mL)洗涤树脂。将{2-[2-(9H-芴-9-基甲氧羰基氨基)-乙氧基]-乙氧基}-乙酸(Fmoc-OEG-OH,0.77g,2.00mmol)、5-氯-1-((二甲基氨基)(二甲基亚氨基)甲基)-1H-苯并[d][1,2,3]三唑3-氧化物四氟硼酸盐(TCTU,0.71g,2.00mmol)和N,N-二异丙基乙胺(0.63mL,3.60mmol)在DMF(10mL)中的溶液加入到树脂中并摇动该混合物2hr。过滤树脂并用DMF(3×15mL)、DCM(3×15mL)和DMF(3×15mL)洗涤。通过用DMF中的20%哌啶(2×5min,1×20min,3×10mL)处理去除Fmoc基团。用DMF(3×15mL)、2-丙醇(3×15mL)和DCM(3×15mL)洗涤树脂。将(S)-2-(9H-芴-9-基甲氧羰基氨基)-戊二酸1-叔丁酯(Fmoc-L-Glu-OtBu,0.85g,2.00mmol)、5-氯-1-((二甲基氨基)(二甲基亚氨基)甲基)-1H-苯并[d][1,2,3]三唑3-氧化物四氟硼酸盐(TCTU,0.71g,2.00mmol)和N,N-二异丙基乙胺(0.63mL,3.60mmol)在DMF(10mL)中的溶液加入到树脂中并摇动混合物2hr。过滤树脂并用DMF(3×15mL)、DCM(3×15mL)和DMF(3×15mL)洗涤。通过用DMF中的20%哌啶(2×5min,1×20min,3×10mL)处理去除Fmoc基团。用DMF(3×15mL)、2-丙醇(3×15mL)和DCM(3×15mL)洗涤树脂。将{2-[2-(9H-芴-9-基甲氧羰基氨基)-乙氧基]-乙氧基}-乙酸(Fmoc-OEG-OH,0.77g,2.00mmol)、5-氯-1-((二甲基氨基)(二甲基亚氨基)甲基)-1H-苯并[d][1,2,3]三唑3-氧化物四氟硼酸盐(TCTU,0.71g,2.00mmol)和N,N-二异丙基乙胺(0.63mL,3.60mmol)在DMF(10mL)中的溶液加入到树脂中并摇动该混合物2hr。过滤树脂并用DMF(3×15mL)、DCM(3×15mL)和DMF(3×15mL)洗涤。通过用DMF中的20%哌啶(2×5min,1×20min,3×10mL)处理去除Fmoc基团。用DMF(3×15mL)、2-丙醇(3×15mL)和DCM(3×15mL)洗涤树脂。
将溶解于DCM(10mL)中的二碳酸二叔丁酯(0.44g,2.00mmol)和N,N-二异丙基乙胺(0.35mL,2.00mmol)的溶液加入到树脂中并摇动该混合物2hr。用DMF(3×15mL)、DCM(3×15mL)和DMF(3×15mL)洗涤树脂。用DMF中的一水合肼溶液(2%v/v溶液,3×10min,3×15mL)处理树脂。用DMF(3×15mL)、DCM(3×15mL)和DMF(3×15mL)洗涤树脂(2)。用乙酸(0.12mL,2.00mmol)和N,N-二异丙基乙胺(0.34mL,2.00mmol)在DMF(10mL)中的溶液处理树脂(2)16hr。用DMF(3×15mL)、DMF(10mL)中的N,N-二异丙基乙胺(0.34mL,2.00mmol)、DCM(2×15mL)和DMF(3×15mL)洗涤树脂。加入氯乙酸(0.53g,5.60mmol)、N,N’-二异丙基碳二亚胺(0.86mL,5.60mmol)和2,4,6-三甲基吡啶(0.74mL,5.60mmol)并摇动该混合物2hr。用DMF(3×15mL)、DCM(6×15mL)洗涤树脂。通过用三氟乙酸/水混合物(98∶2,20mL)处理2hr从树脂上裂解产物。在真空中浓缩溶液并通过与甲苯共蒸发去除三氟乙酸的残留。将溴乙酸(276mg,2.00mmol)和N,N’-二环己基碳二亚胺(DCC,0.21mL,1.00mmol)的溶液溶解在MeCN(5mL)中,搅拌15min并过滤。将该溶液加入到从树脂上裂解、冷却至0℃的粗产物中并加入碳酸氢钠(0.24mmol,2.80mmol)。搅拌混合物并使之温热至25℃3 hr。将该混合物过滤,蒸发,并通过制备型HPLC(Gemini NX C18,5μm,50×250mm,MeCN/H2O在180min内5∶95至45∶55且在10min内45∶55至50∶50,+0.05%TFA)纯化粗产物,得到标题化合物(2R)-2-[[2-[2-[2-[(2-溴乙酰基)氨基]乙氧基]乙氧基]乙酰基]氨基]-5-[2-[2-[2-[[(1S)-3-羧基-1-[2-[(2-氯乙酰基)-[2-[(2-氯乙酰基)氨基]乙基]氨基]乙基氨基甲酰基]丙基]氨基]-2-氧代-乙氧基]乙氧基]乙基氨基]-5-氧代-戊酸。
产量:33mg(5%)。
1H NMR谱(300MHz,AcOD-d4,δ):4.74-4.55(m,2H);4.33(s,1H);4.31(s,1H);4.23-4.10(m,6H);3.98(s,2H);3.83-3.42(m,24H);2.59-2.41(m,4H);2.38-2.08(m,4H)。
LC-MS纯度:100%(ELSD)。
LC-MS Rt(Kinetex C18,4.6mm×50mm,MeCN/水5∶95至100∶0+0.1%TFA):3.04min。
LC-MS m/z:927.0(M+H)+。
实施例2:
GH-Fc缀合物1
GH-三价连接体1中间体
[(二(2-(2-氯乙酰胺基)乙胺))-Glu-OEG-γGlu-OEG]-羰基亚甲基-S101-hGH[L101C]
步骤1
hGH[L101C]的制备:
如上获得的hGH[L101C],其游离半胱氨酸的一部分被谷胱甘肽和胱胺封闭。在含有GSH和GSSG的平衡缓冲液中使用谷氧还蛋白II(Grx2)酶促进行去封闭。通过在Sephadex G25柱上更换的缓冲液将去封闭的hGH[L101C]与低分子量GSH/GSSG分离开。
使用的hGH[L101C]:100mg(20.2mL),Mw=22190.93
使用的Fc:200mg(100mL,在50mM碳酸氢铵pH7.8中)。
浓度为2.03mg/mL
过程(步骤1):在室温下向含有hGH[L101C](50mg,4.95mg/mL,225μM,在20mM三乙胺,100mM NaCl,pH 8中)的小瓶中加入3个当量的二(对磺酸苯基)苯基膦(TPPDS,3.6mg)。温育1hr后,加入3个当量的(4S,18S)-4-(二(2-(2-溴乙酰胺基)乙基)氨基甲酰基)-18-(2-(2-(2-(2-氯乙酰胺基)乙氧基)乙氧基)乙酰胺基)-6,15-二氧代-8,11-二氧杂-5,14-二氮杂十九烷二酸(来自实施例1,6.3mg)以及NaCl(177mg,得到0.3M NaCl的最终浓度),并将得到的反应混合物在室温下温育18hr,之后将缓冲液更换为20mM HEPES,10mM EDTA,pH7.5,并且通过超滤浓缩至22mg/mL(2.2mL)。
产量=50mg(99%)。
LC-MS(电喷射):实测m/z=22959.43;计算m/z=22959.48
经HPLC测得的纯度:在214nm处为93%。
系统:Agilent 1200系列HPLC
柱:Zorbax 300SB-C3,4.6×50mm,3.5μ
检测器:Agilent Technologies LC/MSD TOF(G1969A)
检测器设置:DAD:280nm,(G1315A)
扫描范围:m/z最小为100,m/z最大为3000
线性反射器模式
阳性模式
条件:步长梯度:5%至90%B
运行时间:12分钟:0-1min 5%B,1-8min 5%-90%B,8-9min 90%B,9-9.1min 90%-5%B,9.1-12min 5%B
流速:1.00mL/min固定
柱温:40℃
洗脱液:溶剂A:99.9%H2O,0.1%甲酸
溶剂B:99.9%MeCN,0.1%甲酸
包括3个单独步骤的步骤2的反应概述描述如下
[(二(2-(2-Fc-S3-乙酰基氨基)乙胺))-Glu-OEG-γGlu-OEG]-羰基亚甲基-S101-hGH[L101C]
步骤2的过程:
1.氯代更换为碘代(Finkelstein反应):用2.2mL的水性5M KI、50mM抗坏血酸溶液稀释来自步骤1的上述化合物[(二(2-(2-氯乙酰胺基)乙胺))-Glu-OEG-γGlu-OEG]-羰基亚甲基-S101-hGH[L101C](2.2mL,22mg/mL,956μM),并在室温下在黑暗中温育18hr。最后,将反应混合物在20mM HEPES,10mM EDTA,pH7.5缓冲液(2.3mL,21.7mg/mL,945μM)中进行缓冲液更换,并在以下步骤3中直接使用。
2.Fc片段二硫键还原:向如上所述获得的Fc片段(50mL,2.03mg/mL,41μM,在50mM碳酸氢铵pH 7.8中)中加入5个当量的二硫苏糖醇(DTT,52μL的195mM溶液,在20mM HEPES,10mM EDTA,pH 7.5中)并在室温下温育2hr,之后对反应混合物进行缓冲液更换,并通过超滤浓缩至4.3mL(23.6mg/mL,475μM,为二聚体的形式),并在以下步骤3中直接使用。
3.hGH[L101C]-Fc缀合物形成:将来自步骤1的hGH[L101C]化合物(50mg,21.7mg/mL,945μM)与来自步骤2的还原的Fc片段(100mg,23.6mg/mL,475μM)混合,得到hGH[L101C]与Fc之间的摩尔比为1.1比1。将反应混合物(6.6mL)在黑暗中温育18hr,之后在以HIC模式运行的Capto Adhere 16/10柱上(CV=20mL;A:20mM TEA,pH 7.5;B:40mM MES,40mM甲酸,pH3.5;应用缓冲液:20mM TEA,200mM NaCl,pH 7.5;区段梯度:区段1:0%-30%B,1CV;区段2:30%-70%B,15CV;区段C:70%-100%B,1CV;流速3mL/min)从反应混合物中纯化所需的缀合物。将含有产物的级分在PBS中进行缓冲液更换,得到50mg的所需缀合物(25mL,2.0mg/mL,27.5μM)。
产量=50mg(34%)。
LC-MS(电喷射):实测m/z=72682.09;计算m/z=72682.13
经HPLC测得的纯度:214nm下为96%。
GH-Fc缀合物2
[(二(2-(2-Fc-S3-乙酰胺基)乙胺))-Gly]-羰基亚甲基
-S101-hGH[L101C]
使用实施例2中针对缀合物1所述的方法制备所述化合物,不同之处在于在HEPES/EDTA中用100mg 2-(2-溴乙酰胺基)-N,N-二(2-(2-氯乙酰胺基)乙基)乙酰胺(实施例1,连接体2)代替连接体(4S,18S)-4-(二(2-(2-氯乙酰胺基)-乙基)氨基甲酰基)-18-(2-(2-(2-(2-溴乙酰胺基)-乙氧基)乙氧基)乙酰胺基)-6,15-二氧代-8,11-二氧杂-5,14-二氮杂十九烷二酸(实施例1,连接体1)
纯化:
将上述反应混合物的缓冲液更换成加样缓冲液(TRIS+盐)并加载在G25柱上:
柱:50/30 Sephadex G25 fine
缓冲液A:10mM碳酸氢铵
流速:10mL/min
温度:RT
级分:每个级分40mL
合并级分A4+A5并将其加到Capto Adhere柱上:
柱:Capto Adhere 16/10
缓冲液A:20mM TEA pH7,5
缓冲液A2:40mM TEA+0.2M NaCl pH7.5
缓冲液B:40mM MES+40mM甲酸,pH3.5
梯度1:在1CV内0%-30%缓冲液B
梯度2:在15CV内30%-70%缓冲液B
梯度3:在1CV内70%-100%缓冲液B
流速:3mL/min
温度:RT
级分:在峰分级分离中每个级分1mL
合并级分A6-A10并通过UF(Amicon ultra 15K)将缓冲液更换成PBS缓冲液。
浓度=>7.22mg/mL=>共101mg
产量:101mg(31%)
LC-MS(电喷射):实测m/z=72193.48;计算m/z=72190.6444
经HPLC测得的纯度:在214nm处约100%。
GH-FC缀合物3
[(二(2-(2-Fc-S3-乙酰胺基)乙胺))-Gly-OEG]-羰基亚甲基-S101-hGH[L101C]
使用实施例2中针对缀合物1所述的方法制备所述化合物,不同之处在于在HEPES/EDTA中用100mg 2-(2-(2-(2-(2-溴乙酰胺基)乙氧基)乙氧基)乙酰胺基)-N,N-二(2-(2-氯乙酰胺基)-乙基)乙酰胺(实施例1,连接体3)代替连接体(4S,18S)-4-(二(2-(2-氯乙酰胺基)-乙基)氨基甲酰基)-18-(2-(2-(2-(2-溴乙酰胺基)-乙氧基)乙氧基)乙酰胺基)-6,15-二氧代-8,11-二氧杂-5,14-二氮杂十九烷二酸(实施例1)。
使用的hGH[L101C]:如上所述的100mg(20.2mL)。Mw=22190.93
使用的Fc:200mg(100mL,在50mM碳酸氢铵pH 7.8中)。
浓度为2.03mg/mL
纯化:
将上述反应混合物的缓冲液更换成加样缓冲液(TRIS+盐)并加载在G25柱上:
柱:50/30 Sephadex G25 fine
缓冲液A:10mM碳酸氢铵
流速:10mL/min
温度:RT
级分:每个级分40mL
合并级分A4+A5并将其加到Capto Adhere柱上:
柱:Capto Adhere 16/10
缓冲液A:20mM TEA pH 7.5
缓冲液A2:40mM TEA+0.2M NaCl pH 7.5
缓冲液B:40mM MES+40mM甲酸,pH 3.5
梯度1:在1CV内0%-30%缓冲液B
梯度2:在15CV内30%-65%缓冲液B
梯度3:在1CV内65%-100%缓冲液B
流速:3mL/min
温度:RT
级分:在峰分级分离中每个级分3mL
合并级分A4-A9并通过UF(Amicon ultra 15K)将缓冲液更换成PBS缓冲液,得到所需的hGH-连接体-Fc缀合物[(二(2-(2-Fc-S3-乙酰胺基)乙胺)))-Gly-OEG]-羰基亚甲基-S101-hGH[L101C]。
产量:91mg(28%)
LC-MS(电喷射):实测m/z=72338.69;计算m/z=72335.8008
经HPLC测得的纯度:在214nm处为81%。
GH-FC缀合物4
以如上针对缀合物1-3所述类似的方式,使用实施例1的三价连接体4制备缀合物4。
GH-FC缀合物5
以如上针对缀合物1-3所述类似的方式,使用实施例1的三价连接体6制备缀合物。
通过替代方法制备的GH-Fc缀合物
Fc-连接体中间体
步骤1
过程步骤1:
向采用vivaspin UF装置(CU 30kDa,PES膜)浓缩至1.9mL(22mg,11.6mg/mL,232μM)的如上所述获得的Fc片段(12mL,2.03mg/mL,41μM,在50mM碳酸氢铵pH 7.8中)中加入220μL的在PBS中的10mM TCEP溶液(4.3个当量),并在室温下温育1hr。将反应混合物的缓冲液更换为50mM磷酸盐缓冲液,400mM NaCl,10mM EDTA,以得到19.25mg还原的Fc(7.7mg/mL,154μM,为二聚体形式),向其中加入375μL的5mM新鲜制备的在相同缓冲液中的(4S,18S)-4-(二(2-(2-溴乙酰胺基)乙基)氨基甲酰基)-18-(2-(2-(2-(2-氯乙酰胺基)乙氧基)乙氧基)乙酰胺基)-6,15-二氧代-8,11-二氧杂-5,14-二氮杂十九烷二酸溶液(2.5个当量),并在室温下在黑暗中温育18hr,之后通过凝胶过滤将反应混合物的缓冲液更换为PBS,以定量地提供目标Fc-连接体缀合物。
产量=50mg(95%)。
LC-MS(电喷射):实测m/z=50605.58;计算m/z=50605.68
经HPLC测得的纯度:在214nm处为92%。
系统:Agilent 1200系列HPLC
柱:Zorbax 300SB-C3,4.6×50mm,3.5μ
检测器:Agilent Technologies LC/MSD TOF(G1969A)
检测器设置:DAD:280nm,(G1315A)
扫描范围:m/z最小为100,m/z最大为3000
线性反射器模式
阳性模式
条件:步长梯度:5%至90%B
运行时间:12分钟:0-1min 5%B,1-8min 5%-90%B,8-9min 90%B,9-9.1min 90%-5%B,9.1-12min 5%B
流速:1.00mL/min固定
柱温:40℃
洗脱液:溶剂A:99.9%H2O,0.1%甲酸
溶剂B:99.9%MeCN,0.1%甲酸
包括3个单独步骤的步骤2的反应概述描述如下
过程(步骤2):
1.氯代更换为碘代(Finkelstein反应):通过凝胶过滤在Zeba旋转柱(10mL大小,Pierce)中将来自步骤1的上述化合物Fc-连接体缀合物(2.5mL,7.7mg/mL,152μM)的缓冲液更换为50mM磷酸盐缓冲液,5M KI,50mM抗坏血酸,100mM NaCl,pH 6,并在室温下在黑暗中温育18hr。最后,采用vivaspin UF装置(CU 30kDa,PES膜)将反应混合物浓缩至1.3mL,并通过凝胶过滤在Zeba旋转柱(10mL大小,Pierce)中将缓冲液更换为50mM PB,1M NaCl,10mM EDTA,pH 7.6,并立即在步骤3中使用。
2.hGH[L101C]半胱氨酸的解封(decapping):向含有hGH[L101C](24.75mg,4.95mg/mL,225μM,在20mM三乙胺,100mM NaCl,pH8中)的小瓶中加入3个当量的二(对磺酸苯基)苯基膦(TPPDS,3.6mg),并在室温下温育18hr。接着,将反应混合物的缓冲液更换为50mM PB,1M NaCl,10mM EDTA,pH7.6,并通过超滤浓缩至17mg/mL(1.45mL),并立即在步骤3中使用。
3.hGH[L101C]-Fc缀合物形成:将来自步骤1的Fc活化的连接体缀合物(1.3mL,14.8mg/mL,300μM)与来自步骤2的游离Cys hGH[L101C]化合物(0.61mL,17mg/mL,770μM)混合在一起,得到Fc与hGH[101]之间的摩尔比为1比1.2。将反应混合物(1.91mL)在黑暗中温育18hr,之后在以HIC模式运行的Capto Adhere 16/10柱上(CV=20mL;A:20mM TEA,pH 7.5;B:40mM MES,40mM甲酸,pH 3.5;应用缓冲液:20mM TEA,200mM NaCl,pH 7.5;区段梯度:区段1:0%-30%B,1CV;区段2:30%-70%B,15CV;区段C:70%-100%B,1CV;流速3mL/min)从反应混合物中纯化所需的缀合物。将含有产物的级分在PBS中进行缓冲液更换,得到8.6mg的所需缀合物(4.3mL,2.0mg/mL,27.5μM)。
产量=8.6mg(30%)。
LC-MS(电喷射):实测m/z=72682.09;计算m/z=72682.13
经HPLC测得的纯度:在214nm处为94%。
实施例3GH化合物的评估
如试验2、试验3和试验5中所述对根据上述实施例2产生的GH化合物进行评估。所有化合物均静脉内施用,并计算平均停留时间(MRT)。针对每种化合物生成IGF-1血浆浓度-时间曲线。
序列表
<110> 诺和诺德股份有限公司
<120> 蛋白质缀合物
<130> 150010CN01
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 217
<212> PRT
<213> 智人
<400> 1
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 2
<211> 14
<212> PRT
<213> 智人
<400> 2
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10
<210> 3
<211> 217
<212> PRT
<213> 智人
<400> 3
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 4
<211> 11
<212> PRT
<213> 智人
<220>
<221> misc_feature
<222> (9)..(9)
<223> 对应于S228。可能的变体P)
<400> 4
Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro
1 5 10
<210> 5
<211> 191
<212> PRT
<213> 智人
<400> 5
Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe Asp Asn Ala Met Leu Arg
1 5 10 15
Ala His Arg Leu His Gln Leu Ala Phe Asp Thr Tyr Gln Glu Phe Glu
20 25 30
Glu Ala Tyr Ile Pro Lys Glu Gln Lys Tyr Ser Phe Leu Gln Asn Pro
35 40 45
Gln Thr Ser Leu Cys Phe Ser Glu Ser Ile Pro Thr Pro Ser Asn Arg
50 55 60
Glu Glu Thr Gln Gln Lys Ser Asn Leu Glu Leu Leu Arg Ile Ser Leu
65 70 75 80
Leu Leu Ile Gln Ser Trp Leu Glu Pro Val Gln Phe Leu Arg Ser Val
85 90 95
Phe Ala Asn Ser Leu Val Tyr Gly Ala Ser Asp Ser Asn Val Tyr Asp
100 105 110
Leu Leu Lys Asp Leu Glu Glu Gly Ile Gln Thr Leu Met Gly Arg Leu
115 120 125
Glu Asp Gly Ser Pro Arg Thr Gly Gln Ile Phe Lys Gln Thr Tyr Ser
130 135 140
Lys Phe Asp Thr Asn Ser His Asn Asp Asp Ala Leu Leu Lys Asn Tyr
145 150 155 160
Gly Leu Leu Tyr Cys Phe Arg Lys Asp Met Asp Lys Val Glu Thr Phe
165 170 175
Leu Arg Ile Val Gln Cys Arg Ser Val Glu Gly Ser Cys Gly Phe
180 185 190
- 还没有人留言评论。精彩留言会获得点赞!