一种抗癫痫药物组合物的制作方法
本发明属于药物组合物领域,特别涉及一种抗癫痫药物组合物。
背景技术:
癫痫是神经系统疾病仅次于脑血管疾病的第二大常见疾病,它是多种原因所致的慢性反复发作性短暂脑功能失调综合征,以脑神经元细胞异常放电为主要特征,其频繁发作导致脑神经元的进行性损伤。世界卫生组织数据表明全世界有超过5000万癫痫患者,其中2000万癫痫患者通过正规抗癫痫药物治疗仍然不能控制或缓解,称为难治性癫痫。因而不断深入研究和探索新的有效治疗方法是神经科学研究的焦点。
糖酵解过程是指细胞在细胞质中分解葡萄糖生成丙酮酸的过程,此过程中伴有少量ATP的生成。在痫性发作的大鼠大脑皮质中,糖酵解代谢率增高5倍;ATP下降15%,磷酸肌酸下降44%,而糖酵解代谢产物乳酸增加87%,这些研究结果表明在痫性发作的过程中,大脑皮质ATP水平下降,能量相对供应不足,无氧酵解增强参与痫性发作应激供能。糖酵解抑制剂2脱氧葡萄糖(2DG)、1,6二磷酸果糖(FDP)也通过抑制糖酵解发挥抗癫痫作用。
糖酵解抑制剂2-DG作为葡萄糖类似物,通过在细胞内大量蓄积以抑制糖酵解酶而发挥抗惊厥作用,其作用机制为2-DG通过竞争性抑制葡萄糖,生成6磷酸2-脱氧D葡萄糖,其不能被磷酸葡萄糖异构酶转换为6-磷酸果糖,从而抑制糖酵解代谢的后续步骤。因而2-DG可以作为糖酵解抑制剂。在诸多研究已发现2-DG在诸多癫痫模型中具有急性及慢性抗癫痫作用。在体外水平上,2-DG能降低高钾、荷包牡丹碱、4-AP致痫的海马脑片CA3区阵发性癫痫放电频率,并且能够降低高钾致痫后的海马脑片CA3区脑电图癫痫样发作。在体内水平上,2-DG能够在6HZ刺激癫痫模型[在0.5%丁卡因角膜麻醉的雄性白化病大鼠中通过角膜刺激(6HZ,0.2ms宽度矩形脉冲刺激,22mA强度刺激3s)形成癫痫点燃模型。]、耳源性癫痫模型(将大鼠在暴露于110dB,11KHZ声音刺激20s或直到强直发作以建立癫痫点燃模型)抑制癫痫发作;在匹罗卡品致痫模型中,2-DG能延长癫痫潜伏期,减少癫痫发作程度和持续时间;在通过perforant路径的癫痫点燃模型中,2-DG能增加后放电阈。
1,6-二磷酸果糖(FDP)作为糖酵解途径产生的中间产物,它能产生反馈抑制磷酸果糖激酶,从而抑制糖酵解反应。最近研究发现FDP在匹罗卡品、海仁酸和戊四氮所致的癫痫急性发作实验动物模型中,其剂量依赖的抗癫痫作用要比2DG或KD更有效。而且FDP能降低化学致痫剂所致癫痫的发作持续时间和严重程度,也能抑制匹罗卡品所致癫痫持续状态以后的自发性癫痫发作。
癫痫作为多种原因所致的慢性反复发作性短暂脑功能失调综合征,其发作形式均不相同,不同的药物在不同癫痫发作类型中抗癫痫效果强弱不一,因此研究一种具有更好疗效的抗癫痫药物具有重要意义。
技术实现要素:
神经细胞兴奋性的代谢调节作为控制癫痫发作的一个重要的因素已经逐步被认识到。本发明的目的在于提供一种抗癫痫的药物组合物,具有更好的抗癫痫作用。
本发明公开了一种抗癫痫药物组合物,由2脱氧葡萄糖和1,6二磷酸果糖组成,其中按照质量比2脱氧葡萄糖:1,6二磷酸果糖=1:(1-3)。
优选方案,所述抗癫痫药物组合物质量比2脱氧葡萄糖:1,6二磷酸果糖=1:2。
进一步优选方案,所述癫痫为颞叶癫痫。
下面对本发明做进一步解释和说明
癫痫是神经科最常见疾病之一,目前国际上大部分癫痫患者都能通过口服常规抗癫痫药物后均能控制癫痫发作,且疗效良好,但目前仍有少数患者给予常规和新型抗癫痫药物以及外科手术方法等诸多抗痫治疗方法仍不能抑制其痫性发作最后发展成为难治性癫痫。
颞叶癫痫(temporal lobe epilepsy,TLE)在难治性癫痫诸多类型中一种,目前临床上的
各种抗癫痫药物治疗效果均欠佳,且长期药物治疗可伴随严重副反应;手术切除癫痫
灶或切断癫痫放电播散途径效果不确切,且对病人选择性较强,因而癫痫发作治疗
欠佳,迄今为止TLE的发病机制仍然需要进一步研究。因此进一步明确TLE的发病
机制,探索癫痫治疗的新靶点成为目前急需解决的关键问题。
体内癫痫模型
颞叶癫痫的主要特点包括:1.边缘系统,包括海马,杏仁核和嗅皮质等是癫痫发作的病灶的常见起源部位2.在发现颞叶癫痫以前存在神经损伤事件如脑外伤、肿瘤、感染、缺氧、卒中、癫痫持续状态、出生时脑损伤、中毒等;3.在出现神经损伤事件后可出现一段或长或短的潜伏期;4.行为上表现重复性、发作性的、短暂性的的自发性痫性发作;5.在病理学上有海马硬化和门区中间神经元丢失等特点。
目前国际上存在诸多体内癫痫动物模型,比较常用的是匹罗卡品癫痫模型、戊四氮癫痫模型、4-氨基吡啶癫痫模型、海仁酸癫痫模型等。
众多的证据表明在行为学、神经电生理学以及海马神经元损伤等病理学改变等方面,匹罗卡品致痫小鼠模型均与人类颞叶癫痫非常相似,因此匹罗卡品致痫模型可以作为目前国际上颞叶癫痫的相关研究的理想模型之一。因为其在行为、脑电图、病理及药理特性上与人类颞叶癫痫非常相似,所以匹罗卡品致痫小鼠模型最近已经广泛用于癫痫发病机制和抗癫痫药物研究。按照其行为改变过程和脑电图改变可分为三个时期:1)急性期,小鼠被匹罗卡品诱发出现全身强直-阵挛发作,其临床表现以面部肌肉抽搐为首发症状,随着很快发展为持续性的全身强直阵挛发作即癫痫持续状态,痫性发作期以及发作间期的脑电图表现为异常痫样放电,为癫痫持续状态前24小时;2)静止期,又称为潜伏期,小鼠不出现痫性发作,其脑电图和行为学改变大致正常,约4-14天;3)慢性痫性发作期,静止期后反复出现自发性痫样发作与人类癫痫复杂部分性发作似。
4-氨基吡啶作为一种瞬时钾通道阻滞剂,其致痫机制是其在中枢通过促进神经末梢释放乙酰胆碱、多巴胺和去甲肾上腺素等递质而导致痫性发作。其在行为学方面主要表现为:在给予给予4氨基吡啶后的数分钟内出现如胡须抽动、摆尾,随后出现节律性点头、面肌痉挛、四肢阵挛,伴跌倒或翻转,大部分动物出现强直阵挛发作,持续时间为数分钟,强直阵挛发作后痫性发作强度逐渐减弱,整个痫性发作持续时间最长可达数小时。而在脑电图方面表现为:在4-氨基吡啶致痫成功的动物模型体内可以迅速记录到快速、成串出现的尖波、棘波及尖-慢复合波、棘-慢复合波。
戊四氮是通过兴奋脑干促进痫性发作。在行为学改变方面,动物在注射戊四氮后其迅速出现四肢强直阵挛发作症状,其痫性发作特点为持续时间短,发作程度高,癫痫潜伏期短,因而其发作形式与急性发作或全身性发作癫痫模型相似。根据其药代动力学特点,癫痫的形成需要长期反复阈下剂量导致一次较长时间的癫痫持续状态发作后才能出现,而不是单次大剂量腹腔注射戊四氮所致的癫痫持续状态形成。其行为学改变主要表现为它可以在短时间内(数分钟)致动物抽搐迅速发生,短时间使动物处于癫痫持续状态后,持续较短时间后痫性发作终止,其后的痫性发作形式与人类慢性癫痫反复发作类似。而在脑电图方面表现为:可见高波幅棘波、棘慢波。其作用机制可能为戊四氮首先引起脑干网状结构兴奋,然后传导到其他脑区,导致大脑痫性放电。
海人酸又称红藻氨酸或海藻氨酸(kainic acid,KA)主要通过使兴奋性突触后电流增加诱发痫性发作。其行为学变化主要为大鼠在注射海仁酸数分钟后迅速出现出现凝视、面部抽搐、上肢抖动等痫性发作症状,随后大部分大鼠可出现四肢强直-阵挛样发作,强直阵挛发作持续时间较长,一般持续时间大约为数小时,痫性发作间期,大鼠完全停止活动。因而其行为学改变与人类复杂部分性发作行为改变相似,是国内外广泛应用目前研究人类复杂部分性发作常见癫痫模型。其脑电图主要表现为:EEG出现痫性样脑电图改变在时间上与痫性行为发作行为学改变相对应,不同脑区的痫性样脑电图改变不同。其作用机制主要可能为海人酸可以通过激活神经元细胞兴奋性神经递质谷氨酸受体以及增加脑内兴奋性神经递质谷氨酸的水平诱发痫性发作。
2脱氧葡萄糖、1、6二磷酸果糖的抗癫痫作用
在行为学改变方面,有研究发现在戊四氮癫痫模型中,2-DG有轻度抗癫痫作用,但是戊四氮痫性模型痫性发作行为学特点是痫性发作持续时间短,发作程度高,癫痫潜伏期短,因而其癫痫潜伏期太短其不能很好的模拟颞叶癫痫的痫性发作过程。4-氨基吡啶痫性模型与戊四氮痫性模型行为学改变相似,能迅速出现痫性发作,而且能持续较长时间,因而其癫痫潜伏期太短其不能很好的模拟颞叶癫痫。目前国际上暂无2-DG在海仁酸致痫模型中发挥抗癫痫作用的文献。而最近研究发现1、6二磷酸果糖在匹罗卡品、海仁酸和戊四氮所致的癫痫急性发作实验动物模型中,其剂量依赖的抗癫痫作用要比2DG或KD更有效。而且1、6二磷酸果糖能降低化学致痫剂所致癫痫的发作持续时间和严重程度,也能抑制匹罗卡品所致癫痫持续状态以后的自发性癫痫发作。本实验发现2DG、1、6二磷酸果糖在体内匹罗卡品癫痫模型、戊四氮癫痫模型、4-氨基吡啶癫痫模型、海仁酸癫痫模型均通过延长癫痫潜伏期、降低癫痫发作时间及癫痫发作评分发挥抗癫痫作用,与以前实验结果相同,本实验还发现相对于2DG、1、6二磷酸果糖组,2DG与1、6二磷酸果糖联用组小鼠癫痫潜伏期增加、癫痫发作时间及癫痫发作评分均降低,这些结果显示2DG与1、6二磷酸果糖联用抗癫痫疗效优于单用2DG、1、6二磷酸果糖。
在脑电图改变方面,2-DG、1、6二磷酸果糖能通过降低痫性发作频率及幅度发挥抗痫作用,本实验结果发现对照组脑电图是以α、β波为主且波幅较小;匹罗卡品癫痫模型、戊四氮癫痫模型、4-氨基吡啶癫痫模型、海仁酸癫痫模型可见大量的尖波、棘波和尖慢波;2-DG、1、6二磷酸果糖组干预组脑电图是也主要是以α、β波为主且波幅较小。这些实验结果显示在匹罗卡品等体内致痫模型上,2-DG、1、6二磷酸果糖能通过降低痫性的发作频率及幅度发挥抗痫作用。而相对于2DG、1、6二磷酸果糖组,2DG与1、6二磷酸果糖联用组小鼠降低痫性发作频率及幅度更加明显,这些结果也显示2DG与1、6二磷酸果糖联用抗癫痫疗效优于单用2DG、1、6二磷酸果糖。
体外海马脑片痫性模型
60年前最早出现采用电生理实验方法在离体脑片上进行研究,因为诸多优点此技术广泛的应用于各领域中,其中其在癫痫发病机制方面的研究进展较快[60-62]。这些都是离体脑片的诸多突出的优点所致:(l)在解剖显微镜下可以直接观察脑片的结构和电极的动态变化;(2)可以通过诸如pH值、温度、渗透压、离子浓度等的改变影响脑片外环境;(3)不存在血脑屏障,相关研究药物可以直接作用在脑片上;(4)排除了麻醉、呼吸、心跳等对实验结果的影响。(5)不同实验动物的遗传因素不同,在电生理实验中,一个动物可产生很多脑片,因而不存在遗传因素影。而在癫痫发病机制研究方面,除了脑片共有的优点外,离体海马脑片还具有其它特有特点:(l)脑组织对缺氧最敏感和癫痫发作阈值最低的结构就是海马:(2)海马脑片中神经元和纤维组织的排列非常有序而且其神经解剖通路未受影响而非常完整,这些是海马组织的重要结构特点之一,因而海马组织不同区在电生理实验中非常容易定位:(3)有完整的神经环路,(4)而且在离体海马脑片上,采用惊厥药可以迅速诱发痫样放电,因而海马脑片是非常理想而且简便并且可用于细胞水平研究癫痫发病机制的实验模型[63]。
膜片钳技术作为电生理实验方法中最重要的实验方法,近年来其已经大量用于离体脑片的相关研究[65-66]。可视法膜片钳技术和盲法膜片钳技术是目前国际上最主要的两种膜片钳技术方法[64]。其中盲法膜片钳技术是在无法看见神经元的条件下完成缝接,因此要求实验人员有较高的实验操作水平和丰富的实验经验,但是实验步骤简单,实验设备要求不高,适合在国内实验室开展。
目前国际上存在诸多体外海马脑片痫性模型,如高钾致痫模型、荷包牡丹碱致痫模型、高频电刺激致痫模型等,其中荷包牡丹碱致痫模型中荷包牡丹碱作为GABAA受体的特异拮抗剂,即它能和GABA特异地竞争在神经元上的GABAA受体一离子通道复合体的结合位点从而抑制GABAA受体功能,导致痫性样放电;高钾致痫模型是通过增加人工脑脊液中细胞外的钾离子浓度发挥抗痫作用[67]。它们都是典型的体外海马脑片致痫模型,本研究发现1、6二磷酸果糖、2-DG可以降低高钾、荷包牡丹碱致痫模型的神经元细胞高频痫性样发作频率。而相对于2DG、1、6二磷酸果糖组,2DG与1、6二磷酸果糖联用组小鼠降低痫性发作频率更加明显,这些结果也进一步说明2DG与1、6二磷酸果糖联用抗癫痫疗效优于单用2DG、1、6二磷酸果糖。
本发明研究结果显示,2-DG、1、6二磷酸果糖在体内、体外癫痫模型上具有抗痫作用,2DG与1、6二磷酸果糖联用抗癫痫疗效优于单用2DG、1、6二磷酸果糖
附图说明
图1为匹罗卡品癫痫模型组小鼠癫痫潜伏期结果对比;
图2为匹罗卡品癫痫模型组小鼠痫性发作持续时间结果对比;
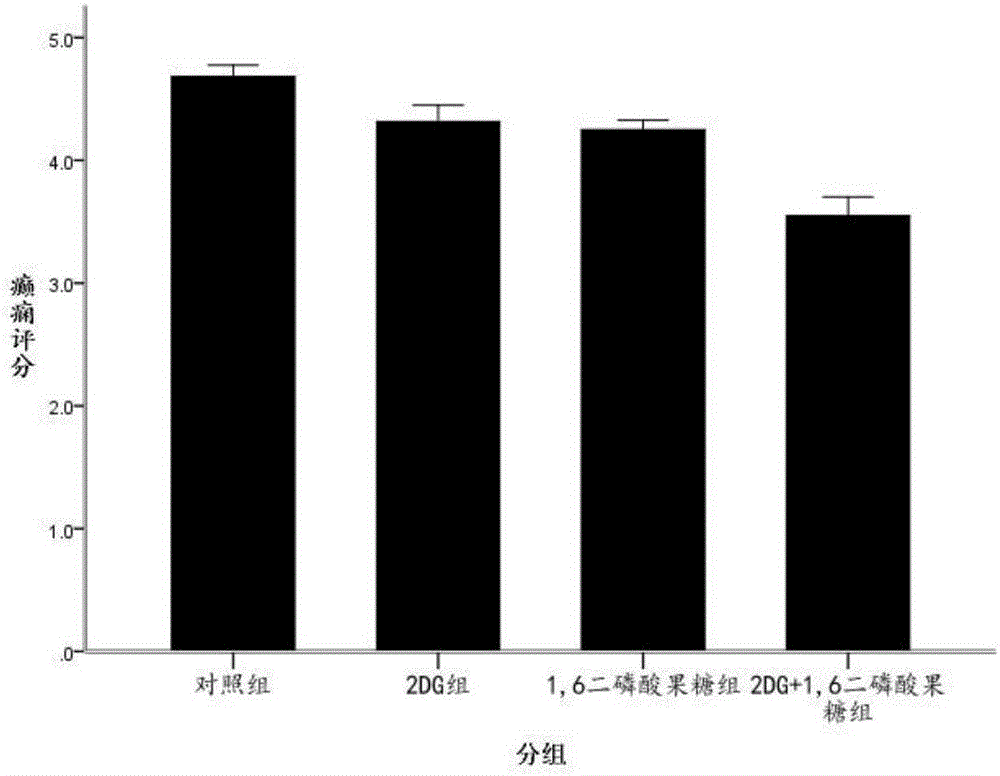
图3为匹罗卡品癫痫模型组小鼠痫性癫痫评分结果对比;
图4为4AP癫痫模型组小鼠癫痫潜伏期结果对比;
图5为4AP癫痫模型组小鼠痫性发作持续时间结果对比;
图6为4AP癫痫模型组小鼠痫性癫痫评分结果对比;
图7为戊四氮癫痫模型组小鼠癫痫潜伏期结果对比;
图8为戊四氮癫痫模型组小鼠痫性发作持续时间结果对比;
图9为戊四氮癫痫模型组小鼠痫性癫痫评分结果对比;
图10为海人酸癫痫模型组小鼠癫痫潜伏期结果对比;
图11为海人酸癫痫模型组小鼠痫性发作持续时间结果对比;
图12为海人酸癫痫模型组小鼠痫性癫痫评分结果对比;
图13为不同模型组小鼠的脑电图记录结果对比,图13A为正常小鼠脑电图,图13B为匹罗卡品癫痫模型组小鼠脑电图,图13C为2DG治疗组小鼠脑电图(匹罗卡品癫痫模型),图13D为1,6二磷酸果糖治疗组小鼠脑电图(匹罗卡品癫痫模型),图13E为2DG+1,6二磷酸果糖治疗组小鼠脑电图(匹罗卡品癫痫模型);
图14为不同模型组小鼠的脑电图记录结果对比,图14A为正常小鼠脑电图,图14B为4AP癫痫模型组小鼠脑电图,图14C为2DG治疗组小鼠脑电图(4AP癫痫模型),图14D为1,6二磷酸果糖治疗组小鼠脑电图(4AP癫痫模型),图14E为2DG+1,6二磷酸果糖治疗组小鼠脑电图(4AP癫痫模型);
图15为不同模型组小鼠的脑电图记录结果对比,图14A为正常小鼠脑电图,图14B为戊四氮癫痫模型组小鼠脑电图,图14C为2DG治疗组小鼠脑电图(戊四氮癫痫模型),图14D为1,6二磷酸果糖治疗组小鼠脑电图(戊四氮癫痫模型),图14E为2DG+1,6二磷酸果糖治疗组小鼠脑电图(戊四氮癫痫模型);
图16为不同模型组小鼠的脑电图记录结果对比,图14A为正常小鼠脑电图,图14B为海人酸癫痫模型组小鼠脑电图,图14C为2DG治疗组小鼠脑电图(海人酸癫痫模型),图14D为1,6二磷酸果糖治疗组小鼠脑电图(海人酸癫痫模型),图14E为2DG+1,6二磷酸果糖治疗组小鼠脑电图(海人酸癫痫模型);
图17为体外海马脑片CA3区用7.5mM高钾模拟痫性发作神经元细胞动作电位频率的变化图;
图18为体外海马脑片CA3区用7.5mM高钾模拟痫性发作,使用10mM 2-DG后神经元细胞动作电位频率的变化图;
图19为体外海马脑片CA3区用7.5mM高钾模拟痫性发作,使用10mM 1,6二磷酸果糖后神经元细胞动作电位频率的变化图;
图20为为体外海马脑片CA3区用7.5mM高钾模拟痫性发作,使用10mM 2-DG+10mM1,6二磷酸果糖后神经元细胞动作电位频率的变化图;
图21为体外海马脑片CA3区10uM荷包牡丹碱模拟痫性发作神经元细胞动作电位频率的变化图;
图22为体外海马脑片CA3区用10uM荷包牡丹碱模拟痫性发作,使用10mM 2-DG后神经元细胞动作电位频率的变化图;
图23为体外海马脑片CA3区用10uM荷包牡丹碱模拟痫性发作,使用10mM 1,6二磷酸果糖后神经元细胞动作电位频率的变化图;
图24为为体外海马脑片CA3区用10uM荷包牡丹碱模拟痫性发作,使用10mM 2-DG+10mM1,6二磷酸果糖后神经元细胞动作电位频率的变化图。
具体实施方式
实施例
1.分别建立匹罗卡品、戊四氮、4AP、海仁酸癫痫小鼠模型,应用糖酵解抑制剂2-DG、1,6二磷酸果糖、1,6二磷酸果糖和2-DG联合处理小鼠,采用行为学观察方法、脑电图方法检测处理前后小鼠行为学、脑电图变化。
2.建立体外原代神经元细胞模型,应用高钾、荷包牡丹碱诱导惊厥模型,采用膜片钳使用应用糖酵解抑制剂2-DG、1,6二磷酸果糖、1,6二磷酸果糖和2-DG联合使用后动作到位的变化。
实验方法
1.实验动物及分组
本实验入选动物均为6-8周健康雄性C57BL/6小鼠,体重22-24克,均购自中南大学湘雅三医院动物实验中心并各实验组小鼠均在此中心监护喂养,不同组的C57BL/6小鼠均放至在人工昼夜12小时循环照明环境中(7:00AM-7:00PM)中饲养,入组的小鼠分为4-6只分别分笼饲养,在笼中小鼠能自由摄食及饮水;定时更换小鼠日用食物及饮水。所有的动物实验方法均通过中南大学湘雅三医院伦理委员会以及中南大学湘雅三医院动物实验中心批准使用。
入选6-8周健康雄性C57BL/6小鼠,随机平均分为4组:正常对照组;癫痫模型组(匹罗卡品癫痫模型组、戊四氮癫痫模型组、4AP癫痫模型组、海仁酸癫痫模型组);2-DG干预组;1,6二磷酸果糖干预组;1,6二磷酸果糖和2-DG联合干预组。
2.银-氯化银微电极的安装
90mg/kg苯巴比妥钠腹腔注射麻醉不同组小鼠,然后将其固定在脑立体定位仪上。脑定位方法以前囟作参考点,小鼠海马区按照小鼠脑定位图谱定位(一个记录电极为前囟后3.0mm,矢状线右侧旁1.8mm,硬膜下3mm,另一个记录电极放置在小鼠额区)。然后在定位点上采用牙科钻垂直颅骨缓慢钻透颅骨。使用银-氯化银微电极作为记录电极置入,然后用牙托粉和502胶搅匀在微电极上并将其固定在颅骨上,最后逐层缝合皮肤。经过7天的恢复期之后进行实验[29]。
3.建立癫痫模型以及行为学监测
将不同组C57BL/6小鼠做好标记,6只一笼分别喂养,(1)匹罗卡品致痫模型组:取6-8周健康雄性C57BL/6小鼠。首先给予致痫组小鼠注射东莨菪碱硝酸甲酯(注射剂量:1mg/kg,浓度:0.2mg/ml,ip)其目的主要是为了将外周的M胆碱受体反应减少到最少程度,30分钟后给予匹罗卡品(其作为毒蕈碱胆碱能受体激动剂注射剂量:320mg/kg,浓度:40mg/ml,ip)、(2)4AP剂量:4AP(2.5mg/kg,浓度:0.5mg/ml组;ip)(3)海人酸剂量:侧脑室内注入0.1μg(0.1μg/5μl)的海人酸,(4)戊四氮慢速点燃癫痫模型:腹腔注射给药:隔天给药,26天内给药13次,每次均为上午9:00-11:30进行。给药前称体重,致痫组每只小鼠腹腔注射0.5%的PTZ,剂量为32mg/kg,合0.0064ml/g,以诱发癫痫持续状态(SE)。
2-DG、1,6二磷酸果糖以及1,6二磷酸果糖和2-DG联合干预组:(1).2-DG干预组;取6-8周健康雄性C57BL/6小鼠标记,腹腔注射东莨菪碱硝酸甲酯(注射剂量:1mg/kg,浓度:0.2mg/ml,ip)以及2-DG(注射剂量:250mg/kg,浓度:400mg/ml,ip),分别给予不同致痫剂诱发癫痫持续状态(SE)。并将已经进入癫痫持续状态的致痫组以及2-DG干预组小鼠单独放置在鼠笼中(一笼一只),为避免外界刺激使其处于安静的环境中,如小鼠的癫痫持续状态达到两小时以上而仍未得到完全控制,立即给予地西泮终止痫性发作(注射剂量:7.5mg/kg,浓度:2.5mg/ml,ip)。(2).1,6二磷酸果糖干预组;取6-8周健康雄性C57BL/6小鼠标记,腹腔注射1,6二磷酸果糖(500mg/kg FDP,ip),分别给予不同致痫剂诱发癫痫持续状态(SE)。并将已经进入癫痫持续状态的致痫组以及2-DG干预组小鼠单独放置在鼠笼中(一笼一只),为避免外界刺激使其处于安静的环境中,如小鼠的癫痫持续状态达到两小时以上而仍未得到完全控制,立即给予地西泮终止痫性发作(注射剂量:7.5mg/kg,浓度:2.5mg/ml,ip)。(3).1,6二磷酸果糖和2-DG联合干预组;取6-8周健康雄性C57BL/6小鼠标记,腹腔注射东莨菪碱硝酸甲酯(注射剂量:1mg/kg,浓度:0.2mg/ml,ip)以及2-DG(注射剂量:250mg/kg,浓度:400mg/ml,ip)以及1,6二磷酸果糖(500mg/kg FDP,ip),分别给予不同致痫剂诱发癫痫持续状态(SE)。并将已经进入癫痫持续状态的致痫组以及2-DG干预组小鼠单独放置在鼠笼中(一笼一只),为避免外界刺激使其处于安静的环境中,如小鼠的癫痫持续状态达到两小时以上而仍未得到完全控制,立即给予地西泮终止痫性发作(注射剂量:7.5mg/kg,浓度:2.5mg/ml,ip)。
正常对照组:选择与造模成功体重相似的致痫组以及2-DG干预组小鼠作为对照,除了与注射匹罗卡品等剂量的生理盐水,其余除了与干预组相同。本实验所有所需的药物溶液均在使用前制备,所有实验步骤都是在上午08:00至11:00之间进行。将不同实验组小鼠置于索尼DV的摄像头下(不影响小鼠昼夜生活节律前提下观察和记录行为学变化),连续监测小鼠的行为学变化以及监测不同组小鼠癫痫潜伏期、痫性发作程度、癫痫持续时间。
小鼠痫性发作级别按照改良后的Racine标准[30]:0级-无阵挛;1级-面肌阵挛;2级-面肌阵挛+节律性点头;3级-面肌阵挛+节律性点头+前肢阵挛;4级-前肢阵挛+后肢站立+面肌阵挛+节律性点头;5级-跌倒+后肢站立+前肢阵挛+面肌阵挛+节律性点头;6级-乱窜惊叫+跌倒+后肢站立+前肢阵挛+面肌阵挛+节律性点头;7级-全身肌强直+乱窜惊叫+跌倒+后肢站立+前肢阵挛+面肌阵挛+节律性点头。
4.脑电图测定
将金属微电极安装在不同组小鼠的海马区,并全时程脑电图监测不同组小鼠脑电图的变化,其中记录电极植入海马区及额区,小鼠耳电极为参考电极。致痫组小鼠注射东莨菪碱硝酸甲酯以及匹罗卡品、戊四氮、海人酸、4-AP,2-DG干预组、1,6二磷酸果糖组、2-DG+1,6二磷酸果糖联用组,正常对照组注射相应剂量的生理盐水,观察不同组的小鼠的脑电图变化。
5.在体外海马脑片CA3区,给予10uM荷包牡丹碱、7.5mM高钾模拟痫性发作,诱发动作电位频率增加,应用盲法膜片钳技术监测使用10mM 2-DG(分子量164)、10mM 1,6二磷酸果糖(分子量354)、10mM 2-DG+10mM 1,6二磷酸果糖(换算成质量比约为1:2)前后神经元细胞动作电位频率的变化。
(1)实验动物及分组
将不同组出生后2周左右的C57BL/6小鼠做好标记,6只一笼分别喂养,分为癫痫组、1,6二磷酸果糖组、2DG组、1,6二磷酸果糖+2DG组,所有药物溶液使用前制备,所有实验都是在上午08:00至11:00之间。
(2)海马切片的制备
将C57BL/6小鼠给予腹腔注射1%戊巴比妥钠(60~75mg/kg)麻醉后,用眼科剪快速断头,去除颅骨后取出全脑,并将其迅速置于用已经准备好的氧气混合(95%O2+5%CO2)饱和的低温人工脑脊液artificial cerebrospinal fluid(ACSF)中冷却30s。事先取出通过制冰机已经制好的冰粒并放至在玻璃培养皿周围,将已用ACSF浸湿的滤纸放至在玻璃培养皿上,将大脑取出并放至在滤纸上。从大脑半球腹内侧分离出海马,迅速把海马放至在琼脂上,固定于振动切片机标本托上,在0~4℃和供氧混合气体条件下,连续切取厚400μm的脑片,每切一次,用沾有人工脑脊液的柔软毛笔尖将已切完的脑片与琼脂分开,随后迅速将悬浮在人工脑脊液中脑片放入冰冷的、事先已经通95%O2和5%CO2混合气的人工脑脊液中,室温下20~25℃孵育90-120分钟待用。重复上述过程,一直到脑片完全被切完为止,一般一侧海马切片可以切8-14片。室温下记录。浴槽的温度为22℃,从断头到脑片转移至浴槽之间的时间应控制在5-6分钟。
(3)脑片固定
在灌流槽中放入脑片,将附着有尼龙丝的U形金属架轻轻覆盖在脑片上,ACSF从恒流泵中恒速流入灌流槽中,流速为1~2L/min,液面高于脑片约1~2mm。采用具有红外线DIC系统的显微镜监测实验数据和图像,将实验数据和图像通过成像系统与电脑连接,采用图像采集软件对实验图片和数据进行观察和分析。所有实验操作以及实验数据的采集与分析均在室温下进行。
(4)盲法膜片钳技术监测正常海马脑片的CA3区神经元动作电位频率
1、将Ag/AgCl电极置于灌流槽中构成电流回路。
2、双手接触屏蔽罩以释放操作者身体静电。
3、打开膜片钳放大器POWER→ON,记录模式选择SEARCH档。
4、打开patch-clamp软件,点击按钮,监测电阻及电流变化。
5、电极内液充灌玻璃微电极,并安装。用放大器检测电极电阻是否在最佳范围内(2-5M欧姆)。
6、用注射器给电极内施加适度正压。
7、降低电极入水,用微电极操纵器步进马达以每次2微米的速度斜下穿插,并接近脑片。
8、封接:盲法膜片钳技术形成膜片钳记录的封接方法与传统方法相同即用微操纵仪操纵记录电极尖端接近、但不接触标本的海马CA3区表面。在电极后部用一个玻璃注射器(总量为20ml)给予其正压,以防止海马组织内堵塞电极尖端。调整好放大器并施与方波刺激,在示波器上可以看到矩形的变化。此时将注射器正压释放并转为给予负压吸引即可形成封接。等待约1min,待封接完全形成,再适当加大负压,直至抽破细胞膜。此时神经元特有的电容特征波形可在示波器上见到,这就说明形成封接的是神经元。解除刺激方波。
9、迅速点击按钮,记录模式选择VC档。
10、观察,记录动作电位变化。
(5).建立网络致痫模型
将致痫剂荷包牡丹碱(10μM)或高钾(7.5mM)加入氧混合气饱和的ACSF配置10μM荷包牡丹碱、7.5mM高钾溶液,输液泵持续灌流10μM荷包牡丹碱、7.5mM高钾溶液1分钟,灌流速度10-15ml/分钟,建立网络致痫模型
(6)在.2DG组、1,6二磷酸果糖组、1,6二磷酸果糖+2DG组分别加入10mM 2-DG、10mM 1,6二磷酸果糖、10mM 2-DG+10mM 1,6二磷酸果糖加入氧混合气饱和的ACSF配置中,输液泵持续灌流1分钟,灌流速度10-15ml/分钟
(7).盲法膜片钳技术记录2-DG干预后海马脑片神经元细胞动作电位频率的变化,具体操作同前。
(8)实验数据以均数±标准差表示,采用SPSS16.0软件对数据进行统计分析并作图。所有数据均进行正态性检验,符合正态分布的两个独立样本间均数比较采用两样本t检验,多个样本间均数比较采用单因素方差分析(ANOVA)。如满足方差齐性采用LSD法,如不满足方差齐性则采用Games-Howell法。P<0.05认为具有统计学意义。
实验结果
1.不同组小鼠癫痫潜伏期、痫性发作持续时间、癫痫评分结果(见图1-12)
匹罗卡品癫痫模型:
1)潜伏期:与对照组相比,2DG组、1,6二磷酸果糖组及2DG+1,6二磷酸果糖组时间延长;其中,2DG+1,6二磷酸果糖组时间长于2DG组和1,6二磷酸果糖组。
2)癫痫评分:与对照组相比,2DG组、1,6二磷酸果糖组及2DG+1,6二磷酸果糖组癫痫发作评分降低;其中,2DG+1,6二磷酸果糖组评分低于2DG组和1,6二磷酸果糖组。
3)癫痫持续时间:与对照组相比,2DG组、1,6二磷酸果糖组及2DG+1,6二磷酸果糖组癫痫持续时间缩短;其中,2DG+1,6二磷酸果糖组时间短于2DG组和1,6二磷酸果糖组。
4AP癫痫模型:
1)潜伏期:与对照组相比,2DG组、1,6二磷酸果糖组及2DG+1,6二磷酸果糖组时间延长;其中,2DG+1,6二磷酸果糖组时间长于2DG组和1,6二磷酸果糖组。
2)癫痫评分:与对照组相比,2DG组、1,6二磷酸果糖组及2DG+1,6二磷酸果糖组癫痫发作评分降低;其中,2DG+1,6二磷酸果糖组评分低于2DG组和1,6二磷酸果糖组。
3)癫痫持续时间:与对照组相比,2DG组、1,6二磷酸果糖组及2DG+1,6二磷酸果糖组癫痫持续时间缩短;其中,2DG+1,6二磷酸果糖组时间短语2DG组和1,6二磷酸果糖组。
戊四氮癫痫模型:
1)潜伏期:与对照组相比,2DG组、1,6二磷酸果糖组及2DG+1,6二磷酸果糖组时间延长;其中,2DG+1,6二磷酸果糖组时间长于2DG组和1,6二磷酸果糖组。
2)癫痫评分:与对照组相比,2DG组、1,6二磷酸果糖组及2DG+1,6二磷酸果糖组癫痫发作评分降低;其中,2DG+1,6二磷酸果糖组评分低于2DG组和1,6二磷酸果糖组。
3)癫痫持续时间:与对照组相比,2DG组、1,6二磷酸果糖组及2DG+1,6二磷酸果糖组癫痫持续时间缩短;其中,2DG+1,6二磷酸果糖组时间短语2DG组和1,6二磷酸果糖组。
海人酸癫痫模型:
1)潜伏期:与对照组相比,2DG组、1,6二磷酸果糖组及2DG+1,6二磷酸果糖组时间延长;其中,2DG+1,6二磷酸果糖组时间长于2DG组和1,6二磷酸果糖组。
2)癫痫评分:与对照组相比,2DG组、1,6二磷酸果糖组及2DG+1,6二磷酸果糖组癫痫发作评分降低;其中,2DG+1,6二磷酸果糖组评分低于2DG组和1,6二磷酸果糖组。
3)癫痫持续时间:与对照组相比,2DG组、1,6二磷酸果糖组及2DG+1,6二磷酸果糖组癫痫持续时间缩短;其中,2DG+1,6二磷酸果糖组时间短语2DG组和1,6二磷酸果糖组。
2.不同组小鼠的脑电图记录结果,见图13-16。
3.在体外海马脑片CA3区,给予10uM荷包牡丹碱、7.5mM高钾模拟痫性发作,诱发动作电位频率增加,应用盲法膜片钳技术监测使用10mM 2-DG、10mM 1,6二磷酸果糖、10mM 2-DG+10mM 1,6二磷酸果糖前后神经元细胞动作电位频率的变化。
荷包牡丹碱、高钾模拟痫性发作CA3区神经元的动作电位频率增加,1、6二磷酸果糖、2-DG均能降低CA3区神经元的动作电位频率增加的作用,1、6二磷酸果糖+2DG组降低CA3区神经元的动作电位频率增加的作用更加明显。
见图17-20,在体外海马脑片CA3区上,给予7.5mM高钾模拟痫性发作,10mM2-DG、10mM 1、6二磷酸果糖降低荷包牡丹碱致痫模型的动作电位频率.1、6二磷酸果糖+2DG组降低CA3区神经元的动作电位频率增加的作用更加明显。
见图21-24,在体外海马脑片CA3区上,给予10uM荷包牡丹碱模拟痫性发作,10mM2-DG、10mM 1、6二磷酸果糖降低荷包牡丹碱致痫模型的动作电位频率.1、6二磷酸果糖+2DG组降低CA3区神经元的动作电位频率增加的作用更加明显。
- 还没有人留言评论。精彩留言会获得点赞!