L‑岩藻糖在治疗消化道病变的药品和保健品中应用的制作方法
本发明涉及治疗消化道病变领域,具体地指一种L-岩藻糖在消化道病变的药品和保健品中应用。
背景技术:
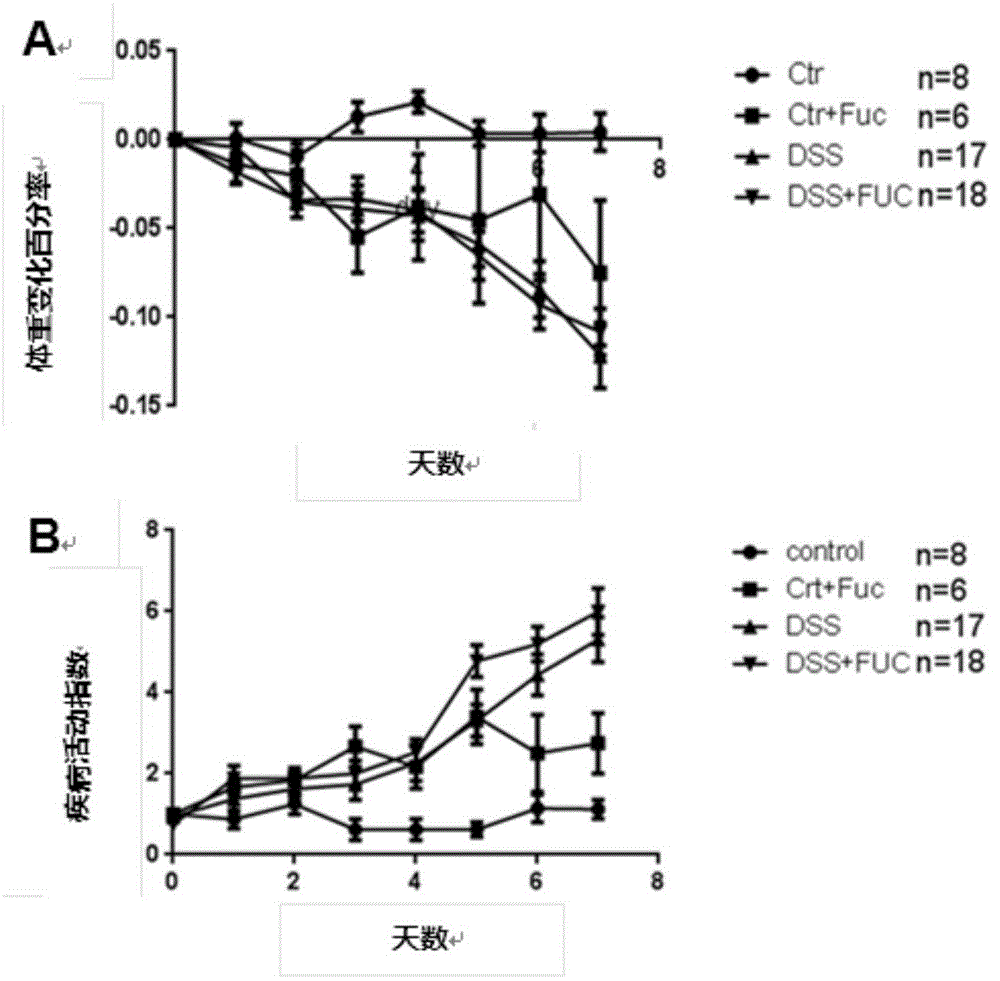
:消化道病变(GastrointestinalLesions,疾病编码:K92.902,拼音码:XHDBB)是人类疾病谱的重要组成部分,包含功能性胃肠病、炎性肠病等多种疾病,因其高发病率和对生活质量严重破坏成为长期威胁各国人类健康的严峻问题。其中,消化道病变后所致的肠道功能改变、炎症上调和体重下降造成不少患者生活质量下降和乃至致残致死的主要原因。大量研究发现,消化道病变后的肠道功能改变、炎症上调和体重下降是涉及机体免疫、胃肠动力、肠道菌群等多因素的调控影响,且对上述多因素平衡的破坏会加重病情而适当调控可以有利于上述因素间的平衡,而平衡的恢复则是改善患者长期预后决定性因素。如今,对消化道病变及其相关肠道功能改变、炎症上调和体重下降相应治疗疗效尚不理想。既往传统治疗相对局限,如使用盐酸洛哌丁胺等止泻药针对腹泻,氢化可的松等糖皮质激素处理自身免疫紊乱,枯草杆菌.肠球菌二联活菌肠溶胶囊等肠道菌制剂治疗肠道菌群紊乱,其具有副作用大,患者用药多,医从性差等弊端。而肠内营养是治疗消化道病变愈加收到重视的治疗手段。研究证明,肠内营养在除了营养支持作用外,还有助于肠道粘膜细胞结构与功能的完整性,保持胃肠道菌群的稳态,防止细菌易位的发生。另一方面,肠内营养使营养物质代谢更加符合生理,有利于内脏的蛋白质的合成和代谢调节;肠内营养还可参与机体调控免疫与生理功能,减少器官功能障碍的发生。同时,通过大量的循证医学证据进一步显示了它们在消化道病变临床治疗中的应用。但其中各种组分的在营养作用外的药理作用多不明确。L-岩藻糖作为食物中(尤其是海藻)中多见的单糖,其对消化道病变的药用价值并未明确。目前研究认为其与肠道稳态的维持关系密切,如东京大学和芝加哥大学的研究者发现当发生全身炎症反应时机体会上调肠上皮岩藻糖表达来支持共生菌的生存以维持肠道稳态。而岩藻糖本身作为人乳寡糖(HMO)的组成成分之一,其大剂量口服的安全性亦得到了验证。此外,另一研究则提示其具有抑制致病菌粘附及毒力的作用。技术实现要素:本发明的目的是提供了一种L-岩藻糖在消化道病变的药品中应用,其解决了现有治疗在改善消化道病变长期预后中高副作用,低功效的缺陷。为实现上述目的,本发明提供的一种L-岩藻糖在治疗消化道病变的药品和保健品中应用。L-岩藻糖(L-Fucose,化学式C6H12O5)为一种脱氧己糖。它常见于在哺乳动物、昆虫和植物细胞表面的N型-连接聚糖和哺乳动物肠道黏液和上皮中的O型-连接聚糖,是岩藻基聚糖多糖的基本亚单位。L-岩藻糖可通过称为α-岩藻糖苷酶的酶从含有岩藻糖的聚合物中释放。L-岩藻糖作为肠道上皮与黏液糖基化的重要组成部分,其对肠道菌群和免疫的调控作用已被多项高质量研究所报道,例如,现已发现L-岩藻糖基化可减少抗体与天然杀伤细胞Fc受体结合,从而减低抗原依赖性细胞毒性,由此可通过调节核心岩藻糖基化酶(FUT8)影响机体细胞杀伤能力。遗憾的是,尽管实验室内涌现出大量涉及岩藻糖影响消化道病变的证据,其在临床的作用除去作为疾病观察指标外,在治疗消化道病变方面的作用并无报道。L-岩藻糖应用于消化道病变的治疗。首先,实验组通过肠道病变动物模型明确了L-岩藻糖可使其获得显著的长期预后获益。其次,在免疫调控方面L-岩藻糖可通过DC细胞调控肠系膜淋巴结Treg细胞活化,抑制结肠Th1和Th17分化的潜能。另一方面,L-岩藻糖可能通过对肠道菌群的调节,抑制胆汁酸的生成减轻炎症反应。最后,我们明确了L-岩藻糖通过nNOS途径抑制肠道肌肉收缩痉挛的作用,可最终减轻腹痛腹泻的症状。综上所述,L-岩藻糖通过调节机体DC细胞免疫应答调控肠道Treg细胞活化,调节肠道菌群胆汁酸生成,同时L-岩藻糖可以通过调节nNOS抑制肠道肌肉收缩痉挛。本发明还提供了一种治疗消化道病变的药物或保健品制剂,所述制剂包括L-岩藻糖。其中,药物或保健品制剂为口服制剂。口服制剂为片剂、胶囊剂或颗粒剂。本发明的有益效果在于:在消化道病变发生时,本发明的L-岩藻糖通过调节机体免疫,肠道菌群和肌肉生理,进而减少炎症损伤和腹泻等病情,最终降低消化道病变相关的临床不良事件(体重过轻,死亡)的发生率。附图说明图1为L-岩藻糖干预DSS慢性结肠炎小鼠体重变化的趋势图;图2为L-岩藻糖干预DSS急性结肠炎小鼠的体重变化的趋势图,图2A为各组小鼠疾病活动指数图,图2B为各组小鼠体重变化率图,图2C为各组小鼠结肠长度对比图,图2D为各组小鼠结肠病理改变图;图3为L-岩藻糖对树突状细胞调控情况图,图3A为L-岩藻糖干预DSS诱导急性结肠炎小鼠,对结肠和肠系膜淋巴结中DC亚型的调控图,图3B为L-岩藻糖直接干预DC2.4细胞,可激活其下游不同效应因子表达的变化图;图4为L-岩藻糖对肠道菌群代谢的作用图,图4A为L-岩藻糖干预急性DSS诱导肠炎小鼠回肠肠内容物pH值,图4B为回肠内容物代谢产物液相色谱-质谱分析图;图5为L-岩藻糖对离体结肠平滑肌条的自发性收缩的影响图图5A为蔗糖对照作用于大鼠远端结肠纵行肌平滑肌收缩活动图,图5B为L-岩藻糖作用于大鼠远端结肠纵行肌平滑肌收缩活动图,图5C为L-岩藻糖作用于大鼠近端结肠纵行肌平滑肌收缩活动图,图5D为L-岩藻糖糖作用于人结肠纵行肌平滑肌收缩活动图,图5E为L-岩藻糖(蔗糖对照)对人及大鼠结肠平滑肌条的影响图;图6为痉挛状态下L-岩藻糖对大鼠结肠平滑肌条的影响图;图6A为(蔗糖对照)Ach刺激后对大鼠远端结肠纵行肌条的影响图(L-岩藻糖),图6B为蔗糖对照Ach刺激后对大鼠远端结肠纵行肌条的影响图(蔗糖对照);图7为L-岩藻糖抑制离体结肠纵行肌自发性收缩的机制图,图7A为大鼠结肠纵行肌条给予不同浓度岩藻糖平滑肌收缩活动图,图7B为大鼠结肠纵行肌条给予TTX阻断后,再给予不同浓度岩藻糖平滑肌收缩活动图,图7C为大鼠结肠纵行肌条给予L-NAME阻断后,再给予不同浓度岩藻糖平滑肌收缩活动图,图7D为大鼠结肠纵行肌条给予SMT阻断后,再给予不同浓度岩藻糖平滑肌收缩活动图,图7E为大鼠结肠纵行肌条给予DMSO对照孵育后,再给予不同浓度岩藻糖平滑肌收缩活动图,图7F为大鼠结肠纵行肌条给予7-NI阻断后,再给予不同浓度岩藻糖平滑肌收缩活动图。具体实施方式为了更好地解释本发明,以下结合具体实施例进一步阐明本发明的主要内容,但本发明的内容不仅仅局限于以下实施例。名字简写简写中文全称FUC岩藻糖FGID功能性胃肠病DSS硫酸葡聚糖钠FL岩藻糖基乳糖TTX河豚毒素L-NAMEN-硝基-L-精氨酸甲酯盐酸盐SMTS-甲基异硫脲7-NI7-硝基吲唑NOS一氧化氮合酶nNOS神经元一氧化氮合酶iNOS诱导型一氧化氮合酶eNOS内皮一氧化氮合酶DAI疾病活动指数实施例1DSS诱导肠炎模型建立及干预分组1.实验对象150只6-8周龄的CD57雄性小鼠体重20-22g,购于湖北省疾病控制与预防中心,依照2011年美国国家科学院颁布之《实验动物饲养和使用指南》,饲养动物于华中科技大学动物实验中心SPF级实验动物房;2.模型分组对照组:单纯生理盐水灌胃,不做处理,共10只。单纯岩藻糖干预组:单纯给予L-岩藻糖灌胃处理,共10只。DSS模型组:按DSS诱导肠炎模型标准造模,生理盐水灌胃,共20只。DSS模型岩藻糖干预组:按DSS诱导肠炎模型标准造模,给予L-岩藻糖灌胃处理,共20只3.给药剂量、频率及途径剂量:L-岩藻糖1mmol/kg、DSS质量分数2.5%;频率:DSS加入饮用水自由饮用7天,同时给予灌胃给药,之后休息3周,再行下轮给药,总计3轮途径:DSS口服,L-岩藻糖灌胃实施例2L-岩藻糖对小鼠体重的影响1.材料:L-岩藻糖购置于美国Sigma-Aldrich公司,灌胃前溶于PBS等渗缓冲液中动物及分组:6-8周龄的CD57雄性小鼠,分为对照组;DSS模型组;DSS模型L-岩藻糖干预组三组2.试剂及仪器:小动物灌胃器械(上海医疗器械厂,中国)3.方法:1)DSS诱导急性肠炎模型:于造模每天记录各组小鼠的DAI变化和体重变化至7天,统计并绘制DAI评分及体重变化曲线2)DSS诱导慢性肠炎模型:于造模每天记录各组小鼠的体重变化至3轮完成,统计并绘制体重变化曲线4.结果:如图1所示,对于慢性DSS诱导肠炎组,L-岩藻糖干预组体重在恢复后期显著高于DSS组而与对照组无显著差异;同时对于急性DSS诱导肠炎模型,如图2所示,L-岩藻糖干预组于DSS组无论在体重,DAI评分,病理上无显著差异。这表明L-岩藻糖可于消化道病变缓解期的表现出保护作用,而这种作用并非由于其对机体的直接营养而产生,而是经由相对间接的长期的方式改善DSS诱导性肠炎小鼠的机体状况,从而说明L-岩藻糖对炎性肠病具有治疗作用。实施例3L-岩藻糖对免疫系统的影响1.材料:L-岩藻糖购置于美国Sigma-Aldrich公司,灌胃前溶于PBS等渗缓冲液中2.动物及分组:6-8周龄的CD57雄性小鼠,分为对照组;DSS模型组;DSS模型岩藻糖干预组三组3.试剂及仪器:PBS、Percoll分离液、台酚蓝、抗CD103、CD11b抗体等;容声冰箱BCD-575WYM(容声公司,中国)、ThermoForma-86℃冰箱(Thermo公司,美国)、低温、高速离心机(Eppendorf公司,德国)4.方法:(1)断椎法处死小鼠,75%酒精浸泡3min,取全部小肠标本,灭菌PBS溶液中充分漂洗。(2)剪成0.5cm左右的片状,置入含1mmol/LDTT、1mmol/LEDTA、1%抗生素(Penicillin+Streptomycin)和5%小牛血清的灭菌PBS溶液40ml中,37℃孵育20min,轻微振荡,去除上皮组织和黏液,重复此步骤2次。(3)取出组织置于灭菌PBS中充分漂洗,剪碎后置于1mg/ml胶原酶Ⅳ(也可以用胶原酶D)溶液40ml中,37℃水浴孵育60min。(4)先后以200目及400目滤网过滤后,300×g,离心10min;弃上清,以含1%抗生素(Penicillin+Streptomycin)、5%小牛血清的RPMI1640全培养基4ml悬浮细胞。(5)配置75%percoll溶液及40%percoll溶液各2ml,并分层置入玻璃试管中,在其上层加入细胞悬液,离心(2000rpm,20min,20℃)获取单个核细胞,悬浮于含5%小牛血清的RPMI1640全培养基。(6)细胞计数后,离心(300g,10min),弃上清。以MACSBuffer重新悬浮细胞(80ulbuffer/107cell),加入CD11c磁珠抗体(20ul/107cell),充分混匀后,4~8℃孵育15min,分选。与CD11b和CD103荧光抗体孵育,离心,溶于流式缓冲液,流式仪检测。5.结果:如图3所示,DSS模型导致的肠系膜淋巴结归巢的调控Treg的DC亚型比例下降,L-岩藻糖可改善这一下降,指示L-岩藻糖可能具有通过DC细胞调控肠系膜淋巴结Treg活化,抑制结肠Th1和Th17分化的潜能。实施例4L-岩藻糖对肠道菌群的影响1.材料:L-岩藻糖购置于美国Sigma-Aldrich公司2.动物及分组:6-8周龄的CD57雄性小鼠,DSS模型组;DSS模型岩藻糖干预组二组3.试剂及仪器:PBS,色谱级乙腈,甲醇,异丙醇,甲酸购自CNW公司;容声冰箱BCD-575WYM(容声公司,中国)、ThermoForma-86℃冰箱(Thermo公司,美国)、低温、高速离心机(Eppendorf公司,德国)4.方法:(1)取50mg样本,匀浆加入1ml甲醇,震荡30s,匀浆2min,冰浴超生30min,12000rpm,4℃离心10min,取200微升于进样小瓶中待测(2)色谱条件:仪器:ACQUITYTMUPLC系统色谱柱:WatersACQUITYUPLCHSST3柱(2.1mm×100mm,1.8μm);柱温:40℃流动相:A:水(V/V)(含0.1%甲酸),流动相B:乙腈(含0.1%甲酸)流速:0.3mL/min进样量:4μL(3)质谱条件:ESI源,扫描方式:ESI+、ESI-模式,毛细管电压:1.4kV和1.3kV,锥孔电压:40V和23V,离子源温度:120℃,脱溶剂气温度:350℃,锥孔气流量:50L/h,脱溶剂气流量:600L/h,碰撞能量(10-40V),离子能量:1V,每0.2s采集1次图谱;准确质量测定采用芦丁溶液为锁定质量溶液。质量扫描范围:50-1500m/z。5.结果:如图4所示,DSS组PH值高于Control组和岩藻糖干预组。肠道内容物PH值与肠道内部代谢产物密切相关故经由液质联合质谱分析法对其代谢产物进行了初步的检测。色谱结果显示岩藻糖组和DSS组代谢产物存在差异。质谱检测牛磺鹅去氧胆酸,胆红素等物质在DSS组中的丰度远高于岩藻糖干预组,而L-粪胆,D-尿胆素等物质在岩藻糖组中的丰度则远高于DSS组。因相关的肠道内胆汁酸代谢和胆红素代谢与肠道菌群代谢关系密切,本实验认为L-岩藻糖可能通过调节肠道菌群影响机体功能。实施例5L-岩藻糖对离体结肠平滑肌条的自发性收缩的影响1.材料:岩藻糖购置于美国Sigma-Aldrich公司2.动物:SD雄性大鼠购置于湖北省疾病控制与预防中心,行SPF级饲养3.试剂及仪器:5600露点渗透压仪;器官浴槽系统(OrganBath)4.方法:(1)露点渗透压仪测定各浓度蔗糖对照组与岩藻糖实验组渗透压。(2)离体平滑肌条实验检测L-Fucose对SD雄性大鼠近端及远端结肠纵行肌、远端结肠环行肌及人结肠纵行肌的自发性收缩的影响。(3)通过离体平滑肌条实验检测L-Fucose在SD雄性大鼠远端结肠纵行肌痉挛状态时(给予AchChloride10-5M)对其自发性收缩的影响;5.结果:如图5~6所示,(1)离体平滑肌条体外实验显示:L-fucose在0.25%-1.5%浓度梯度下,对大鼠远端结肠纵行肌的自发性收缩有明显抑制作用,且随着浓度增加抑制作用逐渐增强(p<0.05);且各浓度点均显著大于相应浓度蔗糖渗透压对照组,在1.5%浓度时抑制作用ΔAUC%为27.75±3.22%vs12.21±0.83%(p<0.05);L-fucose同样能抑制大鼠近端结肠纵行肌、大鼠远端结肠环行肌以及人结肠纵行肌的自发性收缩,各浓度对大鼠不同结肠肌条(远端结肠纵行肌、近端结肠纵行肌、远端结肠环行肌)抑制作用并无差异(p>0.05);(2)离体大鼠远端结肠纵行肌平衡后给予10-5MACHChloride刺激待其自发性收缩稳定后,再给予L-Fucose,与蔗糖对照组相比浓度在0.5%时对肌条自发性收缩的影响无差异,当浓度在1%及1.5%时与对照组相比均能显著抑制肌条收缩(p<0.05)。以上表明L-fucose与蔗糖渗透压对照相比能显著抑制大鼠远端结肠纵行肌的自发性收缩,且具有浓度依赖性;且其亦能抑制大鼠近端结肠纵行肌、远端结肠环行肌以及人结肠纵行肌的自发性收缩;大鼠远端结肠纵行肌条在外源性Ach作用下处于痉挛状态时,L-Fucose亦能抑制其自发性收缩活动。表1L-岩藻糖(蔗糖对照)对人及大鼠结肠平滑肌条的影响注:AUC%用Mean±SEM%表示n=肌条数。表2Ach作用后L-岩藻糖对大鼠远端结肠纵行肌条的影响注:AUC%用Mean±SEM%表示n=肌条数实施例6L-岩藻糖对离体结肠纵行肌自发性收缩的影响1.材料:L-岩藻糖购置于美国Sigma-Aldrich公司2.动物及分组:SD雄性大鼠购置于湖北省疾病控制与预防中心,行SPF级饲养3.试剂及仪器:器官浴槽(OrganBath)4.方法:通过给予离体平滑肌条神经钠通道阻滞剂TTX及多种一氧化氮合成酶(NOS)抑制剂L-NAME、SMT及7-NI孵育后,再给予L-Fucose观察其作用效果变化。5.结果:如图7所示,离体大鼠结肠纵行肌给予10-5g/L河豚毒素TTX,10-4M总NOS抑制剂L-NAME孵育20min以上,再给予不同浓度(0.5%、1.0%、1.5%)L-Fucose,与对照组相比L-Fucose对肌条自发性收缩的抑制能力显著降低(p<0.05);而给予iNOS抑制剂10-3MSMT孵育后与对照组相比并未减弱L-Fucose抑制肌条收缩的能力(p>0.05);给予10-5MnNOS抑制剂7-NI孵育后亦能降低L-Fucose对肌条自发性收缩的抑制作用。以上表明L-Fucose抑制肌条收缩的作用可能为肠神经(ENS)依赖性,并且其可能通过诱导神经型一氧化氮合成酶nNOS合成NO来抑制平滑肌收缩,促进舒张作用。表3两种抑制剂对岩藻糖作用的影响注:AUC%用Mean±SEM%表示n=肌条数综上所述:实施例2~4共同说明L-岩藻糖对减轻机体免疫反应具有显著效果,并且其对菌群具有调控作用,减少初级胆汁酸等有害代谢产物生成,其对炎性肠病的改善作用,从而治疗炎性肠病;实施例5~6说明L-岩藻糖对肠道平滑肌收缩的抑制作用,说明了其对以肠道功能改变、炎症上调和体重下降为表现的炎性肠病和功能性胃肠病的治疗作用。其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1