一种MMT‑Gd‑DTPA复合物及其合成方法和在消化道磁共振诊断中的应用与流程
本发明属于化学制备和药物研发技术领域,具体涉及一种MMT-Gd-DTPA复合物及其合成方法和作为T1造影剂在消化道磁共振诊断中的应用。
背景技术:
目前T1加权磁共振成像在临床上应用较为广泛,用于磁共振成像的造影剂发展迅速,但是MR口服造影剂的发展缓慢,限制了磁共振成像技术在胃肠道疾病诊断方面的使用。
美国《物理化学学报》(J.Phys.Chem,1996年,第100卷,第16429–16434页),报道了通过对膨润土进行钆离子插层,得到的膨润土-钆离子的复合物,实验证明了这种复合物的混悬剂具有良好的T1造影效果,可以作为MR口服造影剂用于消化道疾病的诊断。但是这种复合物在酸性环境下易发生钆离子的泄露,大大降低了材料本身作为MR口服造影剂的安全性,造成了对人体健康的潜在威胁。故而膨润土-钆离子的复合物因生物相容性和安全性欠佳而不适于推广使用。
英国《生物医学核磁共振》(NMR IN BIOMEDICINE.,2016,第29卷,第475-482页)报道了将商用临床血管造影剂马根维显(Magnevist)和钆贝葡胺(MultiHance)作为口服造影剂进行动物的体内实验。结果显示部分马根维显和钆贝葡胺会经肾脏代谢后通过尿液被排出体外。但是由于钆具有肾毒性,这种代谢途径可能会对患有肾脏疾病的患者的健康造成潜在的威胁,而且这类商用临床造影剂造价较高,不宜于被广泛推广。
综上所述,现有的MR口服造影剂在许多方面仍存在着不足,比如会引起患者的不适、诱发其他疾病、或者产生不必要的副作用,对人体健康造成潜在的威胁;而且现有的可供口服的MR造影剂大多生产成本较高、价格昂贵、不利于推广应用。
技术实现要素:
本发明为避免上述现有技术所存在的不足之处,提供了一种MMT-Gd-DTPA复合物及其合成方法和在消化道磁共振诊断中的应用,所要解决的技术问题是现有MR口服造影剂生物相容性欠佳、合成产率较低、价格昂贵等缺点。
本发明为解决技术问题,采用如下技术方案:
本发明首先公开了MMT-Gd-DTPA复合物的合成方法,包括如下步骤:
a、称取1~3g的MMT(蒙脱土)粉末于烧杯中,加入20~40mL去离子水,分散均匀,得到溶液A;
b、向所述溶液A中加入0.5~3g的GdCl3分散均匀,得到溶液B;
c、将所述溶液B转入高温反应釜后放入烘箱,在150℃~180℃下反应12~24小时,得到反应液C;
d、将所述反应液C离心分离,所得产物冷冻干燥24小时后取出,获得MMT-Gd复合物粉末;
e、称取0.5~2.5g的MMT-Gd复合物于烧杯中,加入20~40mL去离子水,分散均匀,得到溶液D;
f、将0.5~2.5g的DTPA(二乙基三胺五乙酸)加入到溶液D中,经搅拌超声分散均匀后,得到溶液E;
g、在60~80℃下,将所述溶液E油浴搅拌6~8h,得到反应液F;
h、将所述反应液F离心分离,所得产物冷冻干燥24小时后取出,即获得MMT-Gd-DTPA复合物粉末。
本发明进一步公开了上述合成方法所合成的MMT-Gd-DTPA复合物,其直径为9~10μm,具有较好的生物相容性和较高的纵向弛豫率r1,r1值为5.1-5.563mM-1S-1。
本发明还公开了上述MMT-Gd-DTPA复合物在消化道磁共振诊断中的应用,即作为T1磁共振分子影像造影剂(MR口服造影剂),用于消化道疾病的诊断。
本发明采用蒙脱土(MMT)作为载体制备的MMT-Gd-DTPA复合物表现出良好的纵向弛豫率r1和较好的生物相容性。另外,以蒙脱土作为载体不仅安全性高,而且蒙脱土本身所具有的高吸附性能使它均匀的分布在胃肠道内壁上,从而使MMT-Gd-DTPA复合物作为消化道造影剂具有良好的成像效果。所以,本发明制备的MMT-Gd-DTPA复合物作为MR口服造影剂运用于消化道疾病的诊断具有重要的意义。同时,本发明以目前比较成熟的水热反应法为基本实验方法,实验过程简单、可操作性强。本发明制备的MMT-Gd-DTPA复合物所需成本较低,合成产率高,适于作为商业化的临床MR口服造影剂推广使用。
与已有技术相比,本发明的有益效果体现在:
1、本发明通过简单的水热合成、离心分离、冷冻干燥即可获得MMT-Gd-DTPA复合物,方法简单、易于实现、合成产率高、成本较低,可进行大规模生产;所得复合物不仅具有良好的纵向弛豫率r1和很好的生物相容性,且在消化道壁上有很好的粘覆效果,是较好的T1磁共振分子影像口服造影剂,在消化道疾病诊断等领域具有很多重要的应用,具有较大的临床应用潜力。
2、本发明所获得的MMT-Gd-DTPA复合物,低毒且无其它污染性杂质产生。
附图说明
图1为实施例1的MMT-Gd-DTPA复合物分散在水中的扫描电镜(SEM)照片;
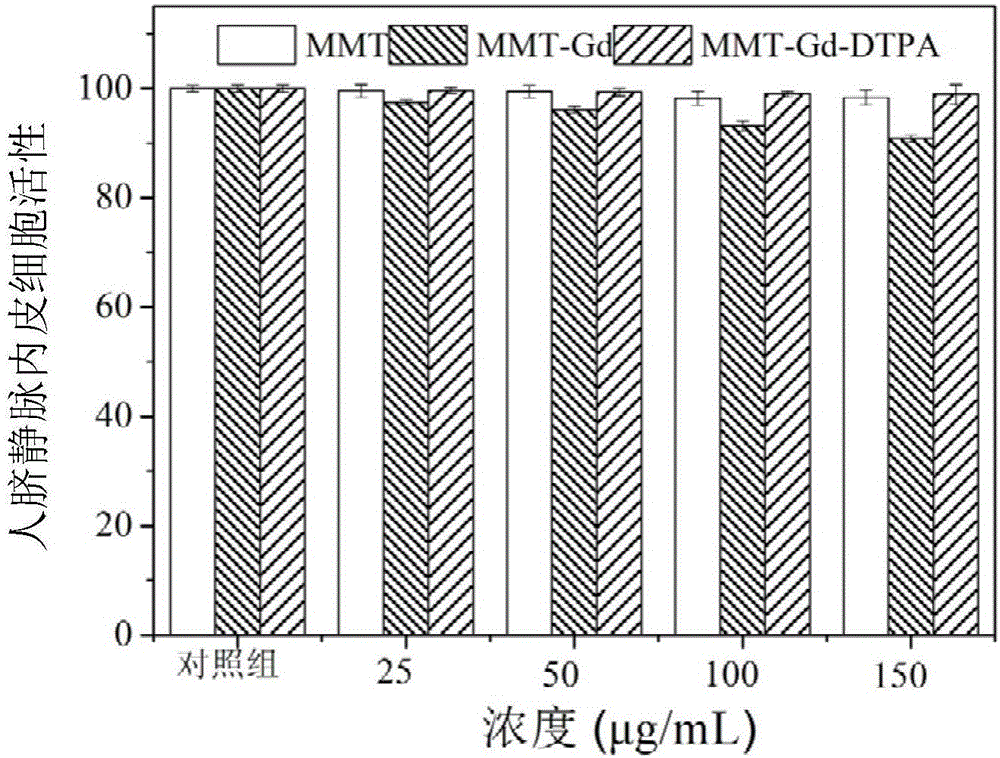
图2为实施例1的MMT-Gd-DTPA复合物的体外细胞毒性试验结果;
图3为实施例1的MMT-Gd-DTPA复合物在模拟肠液中钆离子的泄露情况;
图4为实施例1的MMT-Gd-DTPA复合物在模拟胃液中钆离子的泄露情况;
图5为实施例1的MMT-Gd-DTPA复合物的纵向弛豫率r1。
具体实施方式
下面对本发明的实施例作详细说明,下述实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1
本实施例按如下步骤进行MMT-Gd-DTPA复合物的制备:
a、称取1g的MMT粉末于烧杯中,加入20mL的去离子水,分散均匀,得到溶液A;
b、向溶液A中加入0.5g的GdCl3分散均匀,得到溶液B;
c、将溶液B转入高温反应釜后放入烘箱,在150℃下放置12小时,得到反应液C;
d、将反应液C离心分离,所得产物转入冷冻干燥机中冷冻干燥24小时后取出,获得MMT-Gd复合物;
e、称取0.5g的MMT-Gd复合物于烧杯中,加入20mL的去离子水,分散均匀,得到溶液D;
f、将0.5g的DTPA加入到溶液D中,经搅拌超声分散均匀后,得到溶液E;
g、在60℃下,将步骤f制备的溶液E油浴搅拌6h,得到反应液F;
h、将反应液F离心分离,所得产物转入冷冻干燥机中冷冻干燥24小时后取出,获得MMT-Gd-DTPA复合物。
图1为本实施例所制备的MMT-Gd-DTPA复合物的扫描电子显微镜照片,从图中可以看出本产物直径约为9.5μm。
图2为本实施例所制备的MMT-Gd-DTPA复合物的体外细胞毒性试验结果,具体试验方法是:将浓度为1×104的人脐静脉内皮细胞种植在96孔板中,浓度为每孔1×104个细胞,孵育24小时,然后加入不同浓度MMT、MMT-Gd、MMT-Gd-DTPA的水溶液与人脐静脉内皮细胞共培养。24小时后将基质去除,并将人脐静脉内皮细胞用PBS溶液洗涤3遍,再加入浓度为5mg/mL的MTT并孵育4小时。将最终产物加入到120mL的DMSO中摇晃10分钟后,通过使用ELx800Absorbance酶标仪测量产物在490nm波长处的吸光度来确定人脐静脉内皮细胞的存活率。从图2中可以看出,与对照组(浓度为0μg/mL)相比,加入MMT的人脐静脉内皮细胞的活性基本上没有变化。在MMT-Gd浓度为100μg/mL和150μg/mL时,加入MMT-Gd的人脐静脉内皮细胞的活性出现明显下降,与对照组相比,细胞活性下降了约20%,这可能是因为钆离子的泄露而造成的。与之相比,即使在MMT-Gd-DTPA浓度为100μg/mL和150μg/mL时,加入MMT-Gd-DTPA的细胞仍然能够保持较高的细胞活性(细胞活性约98%),与对照组基本无差异,说明DTPA与MMT-Gd螯合之后有效的阻止了钆离子的泄露有关。由此可知MMT-Gd-DTPA复合物具有极低的细胞毒性,生物安全性良好,具有很大的临床应用潜力。
图3和图4分别为本实施例所制备的MMT-Gd-DTPA复合物在模拟肠液和模拟胃液中的钆离子析出情况,具体试验方法是:分别将1mg的MMT-Gd和MMT-Gd-DTPA加入到5mL的模拟肠液或模拟胃液中,然后将含有MMT-Gd和MMT-Gd-DTPA的模拟胃肠道液分别加入到分子量为500-1000的透析袋中。将透析袋放入含有100mL去离子水的烧杯中,并将烧杯放入摇床(摇床的摇动速度设定为150转/分钟,温度设定为37℃,时间设置为72小时)。分别于24h、48h和72h取烧杯中的去离子水,通过ICP-AES检测去离子水中钆离子的含量来确定钆离子的析出情况。图中以10μg/mL和1μg/mL的Gd水溶液及DIW(去离子水)作为参照。可以看出,MMT-Gd在模拟胃液和模拟肠液中72h内的钆离子析出量与钆离子总质量比分别约为97%和95%。与之相比,MMT-Gd-DTPA在模拟胃液和模拟肠液中72h内的钆离子析出量与钆离子总质量比分别约为0.9%和0.7%,远远低于MMT-Gd在模拟胃液和模拟肠液中钆离子的析出量,说明DTPA与MMT-Gd螯合之后有效的阻止了钆离子的泄露,大大提高了MMT-Gd-DTPA的生物安全性。
图5为本实施例所制备的MMT-Gd-DTPA复合物的纵向弛豫率r1,从图中可以看出产物的纵向弛豫率r1达到5.563mM-1S-1,有很好的临床应用前景。
实施例2
本实施例按如下步骤进行MMT-Gd-DTPA复合物的制备:
a、称取3g的MMT粉末于烧杯中,加入40mL的去离子水,分散均匀,得到溶液A;
b、向溶液A中加入3g的GdCl3分散均匀,得到溶液B;
c、将溶液B转入高温反应釜后放入烘箱,在180℃下放置24小时,得到反应液C;
d、将反应液C离心分离,所得产物转入冷冻干燥机中冷冻干燥24小时后取出,获得MMT-Gd复合物;
e、称取2.5g的MMT-Gd复合物于烧杯中,加入40mL的去离子水,分散均匀,得到溶液D;
f、将2.5g的DTPA加入到溶液D中,经搅拌超声分散均匀后,得到溶液E;
g、在75℃下,将步骤f制备的溶液E油浴搅拌8h,得到反应液F;
h、将反应液F离心分离,所得产物转入冷冻干燥机中冷冻干燥24小时后取出,获得MMT-Gd-DTPA复合物。
经扫描电子显微镜对样品进行表征(ZEISS MERLIN Compact),可知本实施例所获得的MMT-Gd-DTPA复合物直径约为9.4μm。本实施例所制备的MMT-Gd-DTPA复合物体外细胞毒性试验结果良好,生物安全性良好。本实施例所制备的MMT-Gd-DTPA复合物在模拟的胃肠道溶液中基本上没有出现钆离子的析出。本实施例所制备的MMT-Gd-DTPA复合物的体外纵向弛豫率r1达到5.1mM-1S-1。
实施例3
本实施例按如下步骤进行MMT-Gd-DTPA复合物的制备:
a、称取1.5g的MMT粉末于烧杯中,加入40mL的去离子水,分散均匀,得到溶液A;
b、向溶液A中加入1.5g的GdCl3分散均匀,得到溶液B;
c、将溶液B转入高温反应釜后放入烘箱,在180℃下放置16小时,得到反应液C;
d、将反应液C离心分离,所得产物转入冷冻干燥机中冷冻干燥24小时后取出,获得MMT-Gd复合物;
e、称取1g的MMT-Gd复合物于烧杯中,加入40mL的去离子水,分散均匀,得到溶液D;
f、将1g的DTPA加入到溶液D中,经搅拌超声分散均匀后,得到溶液E;
g、在70℃下,将步骤f制备的溶液E油浴搅拌8h,得到反应液F;
h、将反应液F离心分离,所得产物转入冷冻干燥机中冷冻干燥24小时后取出,获得MMT-Gd-DTPA复合物。
经扫描电子显微镜对样品进行表征(ZEISS MERLIN Compact),可知本实施例所获得的MMT-Gd-DTPA复合物直径约为9.7μm。本实施例所制备的MMT-Gd-DTPA复合物体外细胞毒性试验结果良好,生物安全性良好。本实施例所制备的MMT-Gd-DTPA复合物在模拟的胃肠道溶液中基本上没有出现钆离子的析出。本实施例所制备的MMT-Gd-DTPA复合物的体外纵向弛豫率r1达到5.4mM-1S-1。
实施例4
本实施例按如下步骤进行MMT-Gd-DTPA复合物的制备:
a、称取2g的MMT粉末于烧杯中,加入30mL的去离子水,分散均匀,得到溶液A;
b、向溶液A中加入溶液加入2g的GdCl3分散均匀,得到溶液B;
c、将溶液B转入高温反应釜后放入烘箱,在170℃下放置24小时,得到反应液C;
d、将反应液C离心分离,所得产物转入冷冻干燥机中冷冻干燥24小时后取出,获得MMT-Gd复合物;
e、称取1.5g的MMT-Gd复合物于烧杯中,加入30mL的去离子水,分散均匀,得到溶液D;
f、将1.5g的DTPA加入到溶液D中,经搅拌超声分散均匀后,得到溶液E;
g、在70℃下,将步骤f制备的溶液E油浴搅拌7h,得到反应液F;
h、将反应液F离心分离,所得产物转入冷冻干燥机中冷冻干燥24小时后取出,获得MMT-Gd-DTPA复合物。
经扫描电子显微镜对样品进行表征(ZEISS MERLIN Compact),可知本实施例所选用的MMT-Gd-DTPA复合物直径约为9.2μm。本实施例所制备的MMT-Gd-DTPA复合物体外细胞毒性试验结果良好,生物安全性良好。本实施例所制备的MMT-Gd-DTPA复合物在模拟的胃肠道溶液中基本上没有出现钆离子的析出。本实施例所制备的MMT-Gd-DTPA复合物的体外纵向弛豫率r1达到5.1mM-1S-1。
实施例5
本实施例按如下步骤进行MMT-Gd-DTPA复合物的制备:
a、称取2.5g的MMT粉末于烧杯中,加入30mL的去离子水,分散均匀,得到溶液A;
b、向溶液A中加入2.5g的GdCl3分散均匀,得到溶液B;
c、将所述溶液B转入高温反应釜后放入烘箱,在170℃下放置24小时,得到反应液C;
d、将反应液C离心分离,所得产物转入冷冻干燥机中冷冻干燥24小时后取出,获得MMT-Gd复合物;
e、称取2g的MMT-Gd复合物于烧杯中,加入30mL的去离子水,分散均匀,得到溶液D;
f、将2g的DTPA加入到溶液D中,经搅拌超声分散均匀后,得到溶液E;
g、在70℃下,将步骤f制备的溶液E油浴搅拌7h,得到反应液F;
h、将反应液F离心分离,所得产物转入冷冻干燥机中冷冻干燥24小时后取出,获得MMT-Gd-DTPA复合物
经扫描电子显微镜对样品进行表征(ZEISS MERLIN Compact),本实施例所获得的MMT-Gd-DTPA复合物直径约为9.1μm。本实施例所制备的MMT-Gd-DTPA复合物体外细胞毒性试验结果良好,生物安全性良好。本实施例所制备的MMT-Gd-DTPA复合物在模拟的胃肠道溶液中基本上没有出现钆离子的析出。本实施例所制备的MMT-Gd-DTPA复合物的体外纵向弛豫率r1达到5.33mM-1S-1。
以上所述仅为本发明的示例性实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!