一种糖脂聚合物修饰纳米结构脂质载体及制备方法与应用与流程
本发明属聚合物修饰纳米结构脂质载体制备与应用,具体为包封疏水性药物a-317491的糖脂聚合物修饰纳米结构脂质载体及制备方法。
背景技术:
疼痛是子宫内膜异位症的主要临床表现症状,主要采用激素和手术治疗。激素疗法副作用大,疗效不确切,手术治疗易复发,因此,探索药物治疗的新方法是内异疼痛新疗法发展的重要方向。atp及其p2x3受体可能在内异症疼痛敏化及信息传递中发挥了重要作用,
a-317491是p2x3选择性受体拮抗剂,可抑制atp激活p2x3受体引起的ca2+内流,抑制动作电位产生,抑制疼痛。a-317491(5-[(3-phenoxyphenyl)methyl-[(1s)-1,2,3,4-tetrahydronaphthalen-1-yl]carbamoyl]benzene-1,2,4-tricarboxylicacid)作用于p2x3受体高表达的内异病灶,一般情况下,药物很难分布到该作用位点,药物疗效差。因此,采用包封a-317491的药物传递系统显得尤为重要。a-317491的结构式如下:
壳聚糖-硬脂酸嫁接物通过硬脂酸的羧基与壳聚糖上活性氨基的化学嫁接,合成的“糖脂结构”两亲性阳离子嫁接物,能在水性介质中自聚集形成胶束,并具有负载亲、疏水性化疗药物和生物大分子药物的能力。但其存在载药能力有限的潜在局限性。
纳米结构脂质载体,由固体脂质和液体脂质组成,具有包封难溶性药物的特有优势。纳米结构脂质载体可实现a-317491的有效包封,但存在针对内异病灶p2x3高表达部位的有效分布问题。本课题组前期研究显示,糖脂聚合物胶束在大鼠异位内膜组织有较好分布。因此,采用糖脂聚合物修饰纳米结构脂质载体给药,有可能实现a-317491的内异疼痛有效治疗。
技术实现要素:
本发明的一个目的是提供一种糖脂聚合物修饰纳米结构脂质载体,由壳聚糖-硬脂酸嫁接物、单硬脂酸甘油酯、油酸和疏水性药物a-317491组成,其组成的重量百分比为:50.0~90.9wt%的壳聚糖-硬脂酸嫁接物,7.27~40.0wt%的单硬脂酸甘油酯,1.82~10.0wt%的油酸,0或3.23wt%的a-317491。
本发明所使用的壳聚糖脂肪酸嫁接物已为国家发明专利“荧光标记疏水改性壳聚糖聚合物及制备方法和应用”(专利号:zl2005100507981);和“表面修饰疏水改性壳寡糖聚合物给药胶团及其制备方法”(专利号:zl200610051601.0)所涵盖。
本发明的另一个目的是提供所述的糖脂聚合物修饰纳米结构脂质载体的制备方法,通过以下步骤实现:
(1)首先采用专利号:zl200610051601.0的方法合成壳聚糖-硬脂酸嫁接物:取硬脂酸0.13g,碳二亚胺(edc)0.54g,精密称定,溶于10ml无水乙醇,60℃活化50min。另取壳聚糖0.3g,精密称定,溶于20ml去离子水,加热至60℃。将上述乙醇溶液缓慢滴加至壳聚糖水溶液,60℃磁力搅拌反应12h。将终反应液置于透析袋中,去离子水透析48h。透析液冷冻干燥,冻干粉末分散于20ml无水乙醇,水浴超声,加热、趁热0.45μm微孔滤膜过滤,除去未反应的硬脂酸,重复3次。滤饼复溶于水,冷冻干燥,得壳聚糖-硬脂酸嫁接物;
(2)分别取单硬脂酸甘油酯、油酸和a-317491,质量比为8:2:0/1。溶于无水乙醇,50℃加热溶解,配成脂质浓度25mg/ml的溶液。取泊洛沙姆188,置于去离子水,50℃加热溶解,配成浓度为0.1wt%的溶液。400rpm磁力搅拌条件下,将溶有脂质的乙醇溶液注入水溶液,体积比为1:10,搅拌5min,得包封a-317491的纳米结构脂质载体分散液,脂质浓度约为2.5mg/ml,制备未包封/包封a-317491的纳米结构脂质载体溶液;
(3)取壳聚糖-硬脂酸嫁接物,加入去离子水溶解,配成5mg/ml的壳聚糖-硬脂酸溶液,加入0.2~2倍体积的浓度为2.5mg/ml的纳米结构脂质载体分散液,壳聚糖-硬脂酸与纳米结构脂质载体的质量比为1~10,室温20rpm的速度缓慢震荡10min,得糖脂聚合物修饰纳米结构脂质载体。5mg/ml的壳聚糖-硬脂酸溶液加入同体积的浓度为2.5mg/ml的包封a-317491的纳米结构脂质载体分散液,室温20rpm的速度缓慢震荡10min,得包封a-317491的糖脂聚合物修饰纳米结构脂质载体。
本发明的再一个目的是提供所述的糖脂聚合物修饰纳米结构脂质载体在制备抗内异疼痛药物中的应用。
本发明的有益之处是:a-317491为p2x3选择性受体拮抗剂,可有效抑制疼痛信号的传导,然而其水难溶,不利于临床用药,该发明利用纳米结构脂质载体实现对疏水药物a-317491的包封,增强其在水性介质中的溶解度。壳聚糖-硬脂酸嫁接物胶束修饰纳米结构脂质载体,吸附且分布于纳米结构脂质载体外周,可发挥异位子宫内膜靶向的作用,增强该纳米载体及药物在异位内膜组织的分布,利于药物分子在子宫内异部位的浓度增加,提高抗子宫内膜异位症疼痛的疗效。
附图说明
图1为糖脂聚合物修饰纳米结构脂质载体(a)、包封a-317491的糖脂聚合物修饰纳米结构脂质载体(b)的透射电镜照片。
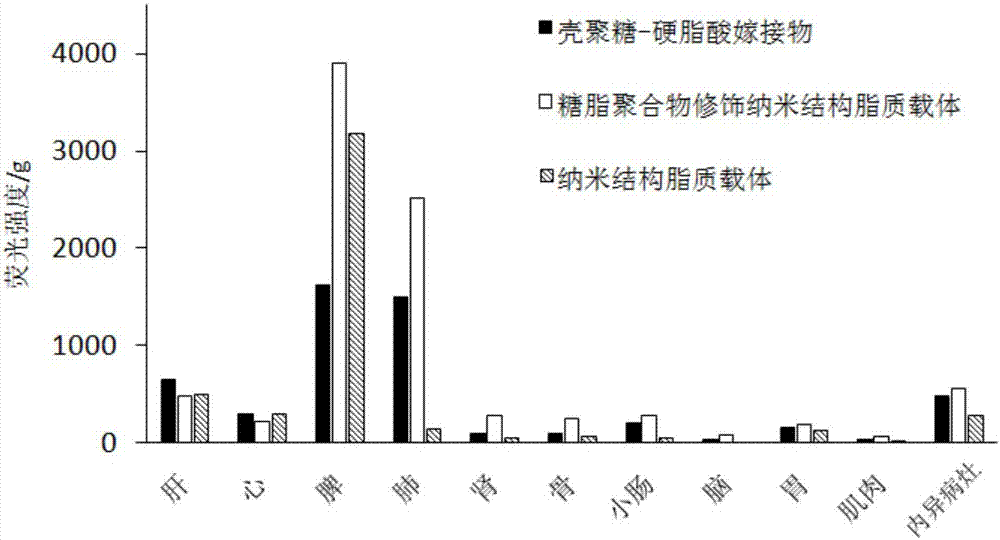
图2为糖脂聚合物修饰纳米结构脂质载体、纳米结构脂质载体、壳聚糖-硬脂酸嫁接物在子宫内膜异位症模型裸鼠体内不同组织器官的半定量分布图。
具体实施方式
本发明结合附图和实例作进一步的说明。
实施例1
(1)壳聚糖-硬脂酸嫁接物的合成
取硬脂酸0.13g,碳二亚胺(edc)0.54g,精密称定,溶于10ml无水乙醇,60℃活化50min。另取上述壳聚糖0.3g,精密称定,溶于20ml去离子水,加热至60℃。将上述乙醇溶液缓慢滴加至壳聚糖水溶液,60℃磁力搅拌反应12h。将终反应液置于透析袋中,去离子水透析48h。透析液冷冻干燥,冻干粉末分散于20ml无水乙醇,水浴超声,加热、趁热0.45μm微孔滤膜过滤,除去未反应的硬脂酸,重复3次。滤饼复溶于水,冷冻干燥,得壳聚糖-硬脂酸嫁接物。
(2)纳米结构脂质载体的制备
取24mg单硬脂酸甘油酯,6mg油酸,精密称定,溶于3.0ml无水乙醇,50℃水浴溶解。取30mg泊洛沙姆188,精密称定,置于30ml去离子水,加热至50℃。400rpm磁力搅拌条件下,将溶有脂质的乙醇溶液注入水溶液,搅拌5min,得纳米结构脂质载体分散液。
(3)糖脂聚合物修饰纳米结构脂质载体的制备
取25mg壳聚糖-硬脂酸嫁接物,加入5ml去离子水溶解,得5mg/ml的胶束溶液,加入10ml浓度为2.5mg/ml的纳米结构脂质载体分散液,室温缓慢震荡10min,得糖脂聚合物修饰纳米结构脂质载体。
经测定糖脂聚合物修饰纳米结构脂质载体的电位为25.4±0.2mv。
实施例2
(1)纳米结构脂质载体的制备
取24mg单硬脂酸甘油酯,6mg油酸,精密称定,溶于3.0ml无水乙醇,50℃水浴溶解。取30mg泊洛沙姆188,精密称定,置于30ml去离子水,加热至50℃。400rpm磁力搅拌条件下,将溶有脂质的乙醇溶液注入水溶液,搅拌5min,得纳米结构脂质载体分散液。
(2)糖脂聚合物修饰纳米结构脂质载体的制备
取25mg壳聚糖-硬脂酸嫁接物,加入5ml去离子水溶解,得5mg/ml的胶束溶液,加入5ml浓度为2.5mg/ml的纳米结构脂质载体分散液,室温缓慢震荡10min,得糖脂聚合物修饰纳米结构脂质载体。
经测定糖脂聚合物修饰纳米结构脂质载体的电位为27.0±0.9mv。
实施例3
(1)纳米结构脂质载体的制备
取24mg单硬脂酸甘油酯,6mg油酸,精密称定,溶于3.0ml无水乙醇,50℃水浴溶解。取30mg泊洛沙姆188,精密称定,置于30ml去离子水,加热至50℃。400rpm磁力搅拌条件下,将溶有脂质的乙醇溶液注入水溶液,搅拌5min,得纳米结构脂质载体分散液。
(2)糖脂聚合物修饰纳米结构脂质载体的制备
取25mg壳聚糖-硬脂酸嫁接物,加入5ml去离子水溶解,得5mg/ml的胶束溶液,加入2ml浓度为2.5mg/ml的纳米结构脂质载体分散液,室温缓慢震荡10min,得糖脂聚合物修饰纳米结构脂质载体。
经测定糖脂聚合物修饰纳米结构脂质载体的电位为23.8±0.6mv。
实施例4
(1)纳米结构脂质载体的制备
取24mg单硬脂酸甘油酯,6mg油酸,精密称定,溶于3.0ml无水乙醇,50℃水浴溶解。取30mg泊洛沙姆188,精密称定,置于30ml去离子水,加热至50℃。400rpm磁力搅拌条件下,将溶有脂质的乙醇溶液注入水溶液,搅拌5min,得纳米结构脂质载体分散液。
(2)糖脂聚合物修饰纳米结构脂质载体的制备
取25mg壳聚糖-硬脂酸嫁接物,加入5ml去离子水溶解,得5mg/ml的胶束溶液,加入1ml浓度为2.5mg/ml的纳米结构脂质载体分散液,室温缓慢震荡10min,得糖脂聚合物修饰纳米结构脂质载体。
经测定糖脂聚合物修饰纳米结构脂质载体的电位为20.9±0.6mv。
实施例5
(1)包封a-317491的纳米结构脂质载体的制备
取24mg单硬脂酸甘油酯,6mg油酸,3mga-317491,精密称定,溶于3.0ml无水乙醇,50℃水浴溶解。取30mg泊洛沙姆188,精密称定,置于30ml去离子水,加热至50℃。400rpm磁力搅拌条件下,将溶有脂质的乙醇溶液注入水溶液,搅拌5min,得包封a-317491的纳米结构脂质载体分散液。
(2)包封a-317491的糖脂聚合物修饰纳米结构脂质载体的制备
取25mg壳聚糖-硬脂酸嫁接物,加入5ml去离子水溶解,得5mg/ml的胶束溶液,加入5ml浓度为2.5mg/ml的a-317491纳米结构脂质载体分散液,室温缓慢震荡10min,得包封a-317491的糖脂聚合物修饰纳米结构脂质载体。
采用微粒粒度与表面电位分析仪,测定包封a-317491的糖脂聚合物修饰纳米结构脂质载体的粒径和表面电位。经测定包封a-317491的糖脂聚合物修饰纳米结构脂质载体的粒径为48.1±5.2nm,电位为28.3±0.4mv。包封药物前后糖脂修饰纳米结构脂质载体的外观形态见附图1,呈球形,粒径与微粒粒度与表面电位分析仪测定结果一致。
实施例6
(1)包封a-317491的纳米结构脂质载体的制备
取24mg单硬脂酸甘油酯,6mg油酸,3mga-317491,精密称定,溶于3.0ml无水乙醇,50℃水浴溶解。取30mg泊洛沙姆188,精密称定,置于30ml去离子水,加热至50℃。400rpm磁力搅拌条件下,将溶有脂质的乙醇溶液注入水溶液,搅拌5min,得包封a-317491的纳米结构脂质载体分散液。
(2)包封a-317491的糖脂聚合物修饰纳米结构脂质载体的制备
取25mg壳聚糖-硬脂酸嫁接物,加入5ml去离子水溶解,得5mg/ml的胶束溶液,加入5ml浓度为2.5mg/ml的包封a-317491纳米结构脂质载体分散液,室温缓慢震荡10min,得包封a-317491的糖脂聚合物修饰纳米结构脂质载体。
(3)包封a-317491的糖脂聚合物修饰纳米结构脂质载体载药量及包封率测定
采用高效液相色谱法,测定包封a-317491的糖脂聚合物修饰纳米结构脂质载体的载药量和包封率。色谱条件:c18反相色谱柱,流动相a:h2o(0.05%三氟乙酸),流动相b:乙腈(0.05%三氟乙酸),梯度洗脱(0.0min,70%a和30%b;8.0min,10%a和90%b;13.0min,10%a和90%b;13.1min,70%a和30%b;16min,70%a和30%b),流速:1.0ml/min,检测波长210nm,进样量:50μl,柱温30℃。包封a-317491的糖脂聚合物修饰纳米结构脂质载体的载药量为2.10±0.08%,包封率为64.4±2.57%,有效包封药物。
实施例7
糖脂聚合物修饰纳米结构脂质载体、纳米结构脂质载体、壳聚糖-硬脂酸嫁接物在内异模型裸鼠的体内分布。采用近红外染料dir标记,考察上述三种纳米载体的体内转运分布过程。
(1)取10mg壳聚糖-硬脂酸嫁接物,精密称定,溶于2ml去离子水,探头超声20次(400w,工作2s停3s),得5mg/ml的胶束溶液。按照1%投药量,逐滴加入dir/二甲基亚砜溶液,室温搅拌2h,移至透析袋(mwco3.5kda),避光去离子水透析12h。透析液定容,离心取上清,得dir标记的壳聚糖-硬脂酸嫁接物溶液。
(2)取24mg单硬脂酸甘油酯,6mg油酸,精密称定,溶于3.0ml无水乙醇,50℃水浴溶解。按1%投药量,向乙醇中加入dir/二甲基亚砜溶液。取30mg泊洛沙姆188,精密称定,置于30ml去离子水,加热至50℃。400rpm磁力搅拌条件下,将乙醇溶液注入水溶液,搅拌5min,得dir标记的纳米结构脂质载体。
(3)取25mg壳聚糖-硬脂酸嫁接物,加入5ml去离子水溶解,得5mg/ml的胶束溶液,加入5ml浓度为2.5mg/ml的dir标记的纳米结构脂质载体分散液,室温缓慢震荡10min,得dir标记的糖脂聚合物修饰纳米结构脂质载体。
(4)取3只内异裸鼠,尾静脉分别注射dir标记的壳聚糖-硬脂酸嫁接物溶液、dir标记的纳米结构脂质载体分散液和dir标记的糖脂聚合物修饰纳米结构脂质载体分散液各0.2ml。8、12、24、36、48h后,腹腔注射戊巴比妥钠麻醉,活体荧光成像观察三种载体的内异裸鼠体内分布,并拍摄荧光照片。激发波长设置为704nm,发射波长范围为740nm至950nm,滤光片为nir。48h裸鼠颈椎脱臼处死,取出病灶、心、肝、脾、肺、肾、大脑、胃、小肠、骨、肌肉,称重并拍摄纳米载体的分布照片。荧光半定量分析,计算不同组织的每克质量的荧光强度值,见附图2。糖脂聚合物修饰纳米结构脂质载体在内膜异位病灶的分布与纳米结构脂质载体相比,有明显增强。
- 还没有人留言评论。精彩留言会获得点赞!