在生物材料表面制备载肝素及Cu2+的介孔硅纳米颗粒涂层的方法与流程
本发明涉及生物材料的技术领域,具体涉及一种在生物材料表面制备载肝素及cu2+的介孔硅纳米颗粒涂层的方法。
背景技术:
血管内植入材料或器械(如,血管支架、人工血管等)表面的抗凝血性能及内皮修复性能仍然是其临床应用面临的主要问题,通过改变材料的表面性能来调控植入周围环境响应并进而提高植入材料的性能和功能对血管内植入材料或器械的临床应用具有非常重要的关键意义。迄今为止,诸多表面改性技术被用来提高材料的抗凝血性能及诱导内皮原位再生,但其效果仍不理想,特别是很难同时赋予材料以优异的抗凝血性能和快速内皮修复性能。通过在材料表面引入两种或两种以上的生物活性分子构建具有调控血液、血管组织及细胞行为的多功能生物活性层是赋予材料表面优异的抗凝血性能及内皮修复性能的常用手段。然而,目前的方法(如,共价接枝、静电吸附、固定生物分子复合物、层层自组装等)表面生物分子固定量、生物分子活性以及在血管流场环境中的持续作用能力等都还有待提高,如,共价固定的生物分子由于化学反应导致生物分子活性降低,而静电吸附以及层层自组装(lbl)引入的生物分子结合力较弱,在体内流场环境中生物分子的快速流失很难满足体内抗凝血及内皮原位快速再生的要求。
纳米技术可从细胞的粘附与生长以及细胞功能调控、生物活性因子的装载控释以及材料综合性能调控等不同角度调控生物材料的性能和功能,为血管内植入材料或器械的表面改性提供新的突破口。将装载了生物活性因子的纳米颗粒固定在材料表面可望用于血管内植入材料的表面修饰,进而通过活性因子的原位持续释放达到调控血液及内皮细胞行为的目的。
肝素具有优异的抗凝血性能,可以调控大量的生物及生理反应,并且表面固定肝素具有一定的促内皮细胞生长性能。目前常用的肝素化方法(如,离子键合、静电吸附、共价结合等)很难保证肝素的持续控释行为及其活性,并且表面肝素固定量也很难保证血管内植入材料长期持续作用的要求。将肝素装载在介孔硅纳米颗粒孔道内,不仅可以大大提高肝素分子的装载量,并且由于肝素的释放要经历介孔狭长的孔道可以实现肝素的可控持续释放,其装载量与释放行为也可以通过介孔参数和表面修饰进行调节。近年来的研究发现,cu2+可作为酶辅因子参与细胞信号通路及生物学应答调控,可以刺激血管内皮细胞增殖及增强血管发生,当与细胞生长因子联合使用时,效果更为显著。此外,cu2+还具有催化血液内no供体分解释放no的能力,而no则是调控血管内平衡及维持血运通畅的重要分子,因此,在装载肝素的介孔硅纳米颗粒孔道内进一步装载cu2+,可望实现抗凝血及促内皮细胞生长的协同作用。
技术实现要素:
本发明的目的在于:克服现有技术的不足,提供一种在生物材料表面制备载肝素及cu2+的介孔硅纳米颗粒涂层的方法,通过该方法对血管内植入材料或器械进行表面改性,可以有效控制材料表面肝素和cu2+的装载量和释放行为,赋予材料良好的血液相容性,并能显著促进血管内皮再生,从而有效提高材料的生物相容性和植入成功率;多巴胺是一种可以在几乎所有材料表面进行自聚合的化学分子,并形成牢固结合的涂层,涂层具有较强的与氨基反应的能力,因此,本发明所采用的方法几乎可以用于所有生物材料的表面改性,用于固定载肝素及cu2+的介孔硅纳米颗粒。
本发明所采取的技术方案是:
在生物材料表面制备载肝素及cu2+的介孔硅纳米颗粒涂层的方法,包括以下步骤:
1)首先对介孔硅纳米颗粒进行表面改性,从而获得氨基修饰的介孔硅纳米颗粒(msn-nh2);
2)进而在介孔孔道内装载肝素与cu2+;
3)然后用白蛋白对纳米颗粒表面进行修饰;
4)最后将纳米颗粒固定在多巴胺改性的生物材料表面,得到载肝素及cu2+的介孔硅纳米颗粒(msn-nh2@he/cu)的涂层。
本发明进一步改进方案是,所述步骤1)中,对介孔硅纳米颗粒(msn-nh2)进行表面改性方法为:
1.1)将介孔硅纳米颗粒与氨基硅烷分子溶液充分混合;
1.2)振荡反应24~48小时,离心收集纳米颗粒;
1.3)乙醇清洗三次;
1.4)在80摄氏度的条件下,真空干燥后得到msn-nh2。
本发明更进一步改进方案是,所述步骤1.1)中,所述氨基硅烷分子溶液为浓度在10~100mm范围内的3-氨丙基三甲氧基硅烷溶液或3-氨丙基三乙氧基硅烷溶液或3-氨丙基三甲氧基硅烷和3-氨丙基三乙氧基硅烷的混合溶液。
本发明更进一步改进方案是,所述步骤2)中,装载肝素与cu2+的方法为:
2.1)将步骤1)得到的msn-nh2加入到浓度在1~10mg/ml范围内的肝素溶液中;
2.2)在37摄氏度的条件下吸附4~12小时,离心得到载肝素的介孔硅纳米颗粒(msn-nh2@he);
2.3)继续将msn-nh2@he溶解到浓度在0.1~1mol/l范围内的cucl2溶液中;
2.4)在37摄氏度的条件下吸附4~12小时,离心干燥后得到msn-nh2@he/cu。
本发明更进一步改进方案是,所述步骤3)中,纳米颗粒表面修饰的方法为:
3.1)将步骤2)中得到的msn-nh2@he/cu浸没到白蛋白、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(edc)及n-羟基丁二酰亚胺(nhs)的混合溶液中;
3.2)在室温条件下充分反应4~12小时后,离心干燥后得到白蛋白修饰的msn-nh2@he/cu。
本发明更进一步改进方案是,所述步骤3.1)中,白蛋白、edc及nhs的混合溶液中的edc与nhs的摩尔比为3:1。
本发明更进一步改进方案是,所述步骤4)中,纳米颗粒固定的方法为:
4.1)将多巴胺修饰的生物材料浸没到步骤3)得到的白蛋白修饰的msn-nh2@he/cu的分散液中;
4.2)在室温条件下重复反应三次,每次均充分反应4~12小时,得到msn-nh2@he/cu的涂层。
本发明更进一步改进方案是,所述步骤4.1)中,生物材料的多巴胺修饰的方法为:
4.1.1)将生物材料浸没到浓度在0.1~1mg/ml范围内的弱碱性的多巴胺溶液中;
4.1.2)重复反应三次,每次均充分反应12~48小时。
本发明更进一步改进方案是,所述多巴胺溶液的ph值在8~8.5的范围内。
本发明的有益效果在于,与现有技术相比,本发明具备以下优势:
第一、本发明的在生物材料表面制备载肝素及cu2+的介孔硅纳米颗粒涂层的方法,通过该方法对血管内植入材料或器械进行表面改性,可以有效控制材料表面肝素和cu2+的装载量和释放行为,赋予材料良好的血液相容性,并能显著促进血管内皮再生,从而有效提高材料的生物相容性和植入成功率。
第二、本发明的在生物材料表面制备载肝素及cu2+的介孔硅纳米颗粒涂层的方法,多巴胺是一种可以在几乎所有材料表面进行自聚合的化学分子,并形成牢固结合的涂层,涂层具有较强的与氨基反应的能力,因此,本发明所采用的方法几乎可以用于所有生物材料的表面改性,用于固定载肝素及cu2+的介孔硅纳米颗粒。
附图说明:
图1为载肝素及cu2+的介孔硅纳米颗粒的制备步骤示意图;
图1中包括以下步骤:首先用氨基硅烷对介孔硅纳米颗粒进行表面修饰,然后依次在介孔孔道内吸附肝素和cu2+,最后用碳二亚胺将白蛋白固定在纳米颗粒表面。
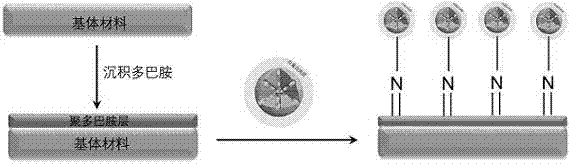
图2为生物材料表面固定纳米颗粒的制备步骤示意图;
图2中包括以下步骤:首先基体材料表面首先沉积聚多巴胺涂层,进而利用纳米颗粒表面白蛋白中氨基与多巴胺涂层的化学反应,将载肝素及cu2+的介孔硅纳米颗粒固定在材料表面,获得载肝素及cu2+的介孔硅纳米颗粒涂层。
图3为钛表面沉积多巴胺涂层及固定纳米颗粒后的表面血小板粘附的扫描电镜图。
图4为钛表面沉积多巴胺涂层及固定纳米颗粒后的表面内皮细胞粘附的荧光显微镜图。
具体实施方式:
为了进一步说明本发明,以下结合实施例对本发明提供的在生物材料表面制备载肝素及cu2+的介孔硅纳米颗粒涂层的方法。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
此外,应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
在生物材料表面制备载肝素及cu2+的介孔硅纳米颗粒涂层的方法,包括以下步骤:
1)首先对介孔硅纳米颗粒进行表面改性,从而获得msn-nh2;
2)进而在介孔孔道内装载肝素与cu2+;
3)然后用白蛋白对纳米颗粒表面进行修饰;
4)最后将纳米颗粒固定在多巴胺改性的生物材料表面,得到msn-nh2@he/cu的涂层。
所述步骤1)中,对介孔硅纳米颗粒进行表面改性方法为:
1.1)将介孔硅纳米颗粒与氨基硅烷分子溶液充分混合;
1.2)振荡反应30小时,离心收集纳米颗粒;
1.3)乙醇清洗三次;
1.4)在80摄氏度的条件下,真空干燥后得到msn-nh2。
所述步骤1.1)中,所述氨基硅烷分子溶液为浓度为40mm的3-氨丙基三甲氧基硅烷溶液。
所述步骤2)中,装载肝素与cu2+的方法为:
2.1)将步骤1)得到的msn-nh2加入到浓度为6mg/ml的肝素溶液中;
2.2)在37摄氏度的条件下吸附9小时,离心得到msn-nh2@he;
2.3)继续将msn-nh2@he溶解到浓度为0.7mol/l的cucl2溶液中;
2.4)在37摄氏度的条件下吸附8小时,离心干燥后得到msn-nh2@he/cu。
所述步骤3)中,纳米颗粒表面修饰的方法为:
3.1)将步骤2)中得到的msn-nh2@he/cu浸没到白蛋白、edc及nhs的混合溶液中;
3.2)在室温条件下充分反应10小时后,离心干燥后得到白蛋白修饰的msn-nh2@he/cu。
所述步骤3.1)中,白蛋白、edc及nhs的混合溶液中的edc与nhs的摩尔比为3:1。
所述步骤4)中,纳米颗粒固定的方法为:
4.1)将多巴胺修饰的生物材料浸没到步骤3)得到的白蛋白修饰的msn-nh2@he/cu的分散液中;
4.2)在室温条件下重复反应三次,每次均充分反应10小时,得到msn-nh2@he/cu的涂层。
所述步骤4.1)中,生物材料的多巴胺修饰的方法为:
4.1.1)将生物材料浸没到浓度为0.5mg/ml的弱碱性的多巴胺溶液中;
4.1.2)重复反应三次,每次均充分反应40小时。
所述多巴胺溶液的ph值为8.2。
实施例2
在生物材料表面制备载肝素及cu2+的介孔硅纳米颗粒涂层的方法,包括以下步骤:
1)首先对介孔硅纳米颗粒进行表面改性,从而获得msn-nh2;
2)进而在介孔孔道内装载肝素与cu2+;
3)然后用白蛋白对纳米颗粒表面进行修饰;
4)最后将纳米颗粒固定在多巴胺改性的生物材料表面,得到msn-nh2@he/cu的涂层。
所述步骤1)中,对介孔硅纳米颗粒进行表面改性方法为:
1.1)将介孔硅纳米颗粒与氨基硅烷分子溶液充分混合;
1.2)振荡反应30小时,离心收集纳米颗粒;
1.3)乙醇清洗三次;
1.4)在80摄氏度的条件下,真空干燥后得到msn-nh2。
所述步骤1.1)中,所述氨基硅烷分子溶液为浓度为60mm的3-氨丙基三乙氧基硅烷溶液。
所述步骤2)中,装载肝素与cu2+的方法为:
2.1)将步骤1)得到的msn-nh2加入到浓度为8mg/ml的肝素溶液中;
2.2)在37摄氏度的条件下吸附6小时,离心得到msn-nh2@he;
2.3)继续将载msn-nh2@he溶解到浓度为0.8mol/l的cucl2溶液中;
2.4)在37摄氏度的条件下吸附9小时,离心干燥后得到msn-nh2@he/cu。
所述步骤3)中,纳米颗粒表面修饰的方法为:
3.1)将步骤2)中得到的msn-nh2@he/cu浸没到白蛋白、edc及nhs的混合溶液中;
3.2)在室温条件下充分反应7小时后,离心干燥后得到白蛋白修饰的msn-nh2@he/cu。
所述步骤3.1)中,白蛋白、edc及nhs的混合溶液中的edc与nhs的摩尔比为3:1。
所述步骤4)中,纳米颗粒固定的方法为:
4.1)将多巴胺修饰的生物材料浸没到步骤3)得到的白蛋白修饰的msn-nh2@he/cu的分散液中;
4.2)在室温条件下重复反应三次,每次均充分反应9小时,得到msn-nh2@he/cu的涂层。
所述步骤4.1)中,生物材料的多巴胺修饰的方法为:
4.1.1)将生物材料浸没到浓度为0.6mg/ml的弱碱性的多巴胺溶液中;
4.1.2)重复反应三次,每次均充分反应36小时。
所述多巴胺溶液的ph值为8.1。
实施例3
在生物材料表面制备载肝素及cu2+的介孔硅纳米颗粒涂层的方法,包括以下步骤:
1)首先对介孔硅纳米颗粒进行表面改性,从而获得msn-nh2;
2)进而在介孔孔道内装载肝素与cu2+;
3)然后用白蛋白对纳米颗粒表面进行修饰;
4)最后将纳米颗粒固定在多巴胺改性的生物材料表面,得到msn-nh2@he/cu的涂层。
所述步骤1)中,对介孔硅纳米颗粒进行表面改性方法为:
1.1)将介孔硅纳米颗粒与氨基硅烷分子溶液充分混合;
1.2)振荡反应30小时,离心收集纳米颗粒;
1.3)乙醇清洗三次;
1.4)在80摄氏度的条件下,真空干燥后得到msn-nh2。
所述步骤1.1)中,所述氨基硅烷分子溶液为浓度为55mm的3-氨丙基三甲氧基硅烷和3-氨丙基三乙氧基硅烷的混合溶液。
所述步骤2)中,装载肝素与cu2+的方法为:
2.1)将步骤1)得到的msn-nh2加入到浓度为8mg/ml的肝素溶液中;
2.2)在37摄氏度的条件下吸附8小时,离心得到msn-nh2@he;
2.3)继续将载msn-nh2@he溶解到浓度为0.8mol/l的cucl2溶液中;
2.4)在37摄氏度的条件下吸附8小时,离心干燥后得到msn-nh2@he/cu。
所述步骤3)中,纳米颗粒表面修饰的方法为:
3.1)将步骤2)中得到的msn-nh2@he/cu浸没到白蛋白、edc及nhs的混合溶液中;
3.2)在室温条件下充分反应7小时后,离心干燥后得到白蛋白修饰的msn-nh2@he/cu。
所述步骤3.1)中,白蛋白、edc及nhs的混合溶液中的edc与nhs的摩尔比为3:1。
所述步骤4)中,纳米颗粒固定的方法为:
4.1)将多巴胺修饰的生物材料浸没到步骤3)得到的白蛋白修饰的msn-nh2@he/cu的分散液中;
4.2)在室温条件下重复反应三次,每次均充分反应8小时,得到msn-nh2@he/cu的涂层。
所述步骤4.1)中,生物材料的多巴胺修饰的方法为:
4.1.1)将生物材料浸没到浓度为0.6mg/ml的弱碱性的多巴胺溶液中;
4.1.2)重复反应三次,每次均充分反应32小时。
所述多巴胺溶液的ph值为8.4。
由图3可知,原始钛表面(a)及沉积多巴胺(b)的样品表面有大量的血小板粘附,并且粘附的血小板大量聚集和激活,而固定载肝素及cu2+介孔硅纳米颗粒后,血小板粘附数量大大减少,表明血液相容性得到提高。
由图4可知,原始钛表面(a)及沉积多巴胺(b)的样品表面内皮细胞粘附数量较少,并且其铺展状态较差,而固定纳米颗粒后(c),内皮细胞数量大大增加,表明载肝素及cu2+的纳米颗粒表面可以显著促进内皮细胞的粘附和生长。
- 还没有人留言评论。精彩留言会获得点赞!