一种肿瘤靶向双载药纳米载体及其制备方法与流程
本发明属于生物医学工程材料领域,具体的说,涉及一种肿瘤靶向双载药纳米载体及其制备方法。
背景技术:
据统计,恶性肿瘤是仅次于心脑血管疾病的第二大杀手,目前绝大多数的患者是通过手术切除、放射治疗和化学药物进行治疗。这些疗法对早期肿瘤患者可获得快速有效的治疗效果,但对晚期伴有局部扩散和转移的患者,并未能显著延长患者的生存期和改善患者的生存质量,且毒副作用较大。近年来,研究发现,癌症是一种基因病,是人体细胞在外环境因素的作用下,内在多种前癌基因被激活和抑癌基因失活的多阶段长期演变的过程。因此,将化学药物治疗与基因治疗结合,对提高肿瘤治疗效果有着重要意义。
基因治疗需要借助合适的载体将外源基因导入靶细胞中,使基因药物能够跨越体内环境的各种屏障,将其输送至靶细胞,实现药物的高效表达。其中,具有核-壳结构的聚合物自组装纳米体系,因其药物负载能力高、适用药物范围较广、粒径小且分布非常窄等优点,在基因药物输送体系中具有良好的应用前景。然而,现有的聚合物自组装纳米体系仍存在肿瘤特异性较低、细胞毒性较大、生物降解慢、无法控制药物释放等问题,限制了其应用。
技术实现要素:
为了克服现有技术的缺点与不足,本发明的首要目的是提供一种肿瘤靶向双载药纳米载体,其能够同时将化疗药物和基因药物靶向运送至肿瘤组织中,并具有药物包封率高、肿瘤靶向性强、细胞毒性低等优点。
本发明的另一目的是提供所述肿瘤靶向双载药纳米载体的制备方法。
本发明的目的通过下述技术方案实现:
一种肿瘤靶向双载药纳米载体,是由聚己内酯(pcl)、聚酰胺-胺型树枝状高分子(pamam)、聚乙二醇(peg)与多肽组装而成的阳离子型聚合物纳米载体。
本发明所述的肿瘤靶向双载药纳米载体,是以聚己内酯(pcl)为内核、以聚酰胺-胺型树枝状高分子(pamam)为外壳,经自组装聚合形成的聚合物纳米载体;疏水性的pcl内核能够包裹疏水性药物,pamam外壳能够通过静电作用携载基因药物,从而形成双载药载体,发挥药物协同效果。pamam外壳表面经peg和多肽修饰,能够显著降低高电荷密度的pamam所导致的细胞毒性;表面peg修饰还能阻止人体内皮网状系统对本纳米载体的捕获和清除作用,延长血液循环时间,提高药物作用效果;而表面多肽修饰则能提高肿瘤靶向性,并提高肿瘤细胞对本纳米载体的摄取量,提高肿瘤靶向治疗效果。本发明所述的肿瘤靶向双载药纳米载体,能够作为肿瘤靶向双载药递释系统,并具有水溶性好、生物相容性好、易降解,药物包封率高,肿瘤靶向性强,细胞毒性低等优点。
进一步地,所述的聚己内酯(pcl)为含有双硫键的聚己内酯。
细胞内环境的谷胱甘肽(gsh)浓度(2~10mm)远远高于细胞外环境的谷胱甘肽浓度(2~20μm),本发明采用含有双硫键的聚己内酯,其在细胞外环境能够稳定地负载药物,而进入细胞后在谷胱甘肽的还原作用下发生断裂,一方面能够实现药物的靶向释放,另一方面能够促进本纳米载体的体内降解,显著降低本纳米载体对细胞功能的不良影响。
进一步地,所述的聚酰胺-胺型树枝状高分子(pamam)是末端带有氨基、以乙二胺为核的1.0、2.0或3.0代的聚酰胺-胺型树枝状高分子(即pamam-g1、pamam-g2或pamam-g3)。
本发明采用pamam-g1、pamam-g2或pamam-g3,能够提高本纳米载体对基因药物的载药量,同时能够避免本纳米载体的分子结构过大而影响药物递送和细胞摄取效果,还能避免本纳米载体表面过高的电荷密度对细胞造成损害。
进一步地,所述的多肽为转铁蛋白受体特异性多肽。所述的转铁蛋白受体特异性多肽包括t7多肽。
本发明采用t7多肽等转铁蛋白受体特异性多肽,能够特异性结合肿瘤细胞表面高表达的转铁蛋白受体,能够显著提高本纳米载体的肿瘤靶向性和细胞摄取量,从而提高肿瘤的药物摄取效率和治疗效果。
本发明所述的肿瘤靶向双载药纳米载体的制备方法,包括以下操作步骤:
1)采用含有双硫键的胱胺引发ε-己内酯反应,制备具有双硫键的双羟基聚己内酯;
2)采用丙烯酰氯作封端处理,制备丙烯酸酯封端的双羟基聚己内酯;
3)采用丙烯酸酯封端的双羟基聚己内酯与聚酰胺-胺型树枝状高分子进行酰胺反应,制备聚己内酯-聚(酰胺-胺)聚合物;
4)将聚己内酯-聚(酰胺-胺)聚合物与双嵌段聚乙二醇及多肽进行反应,制备本发明所述的肿瘤靶向双载药纳米载体。
进一步地,本发明所述的肿瘤靶向双载药纳米载体的制备方法,具体包括以下操作步骤:
1)制备具有双硫键的双羟基聚己内酯:
将具有双硫键的胱胺和ε-己内酯溶解于干燥的甲苯中,在无水无氧条件下缓慢滴加入催化剂,滴加完后在氮气环境中冷凝回流反应,反应结束后除去未反应的甲苯,再用冷乙醚沉淀,干燥,得到具有双硫键的双羟基聚己内酯;
2)制备丙烯酸酯封端的双羟基聚己内酯:
将三乙胺、丙烯酰氯分别溶于干燥的甲苯中,将步骤1)制得的双羟基聚己内酯置于冰浴中,然后在避光、真空及氮气保护下依次缓慢滴加三乙胺和丙烯酰氯的甲苯溶液,滴加完后在氮气环境中冷凝回流反应,反应结束后过滤除去三乙胺盐酸盐结晶,滤液在过量的冷正己烷中沉淀,抽滤,干燥,得到丙烯酸酯封端的双羟基聚己内酯;
3)制备聚己内酯-聚(酰胺-胺)聚合物:
将聚酰胺-胺型树枝状高分子和步骤2)制得的双羟基聚己内酯分别溶于氯仿中,将双羟基聚己内酯的氯仿溶液滴加入聚酰胺-胺型树枝状高分子的氯仿溶液中,在真空及氮气保护下冷凝回流反应,反应结束后在三氯甲烷中进行透析处理,再用过量的冷石油醚沉淀,将所得到的白色沉淀用二氯甲烷溶解后缓慢滴加到去离子水中搅拌过夜,挥发有机溶剂后,冷冻干燥,得到聚己内酯-聚(酰胺-胺)聚合物;
4)制备所述的肿瘤靶向双载药纳米载体:
将步骤3)制得的聚己内酯-聚(酰胺-胺)聚合物溶于磷酸盐缓冲液中,调节ph值,加入双嵌段聚乙二醇,在室温下搅拌反应,制得聚己内酯-聚(酰胺-胺)-聚乙二醇聚合物;再次调节ph值,加入多肽的磷酸盐缓冲液,在室温下搅拌反应,反应结束后进行超滤处理,冷冻干燥,得到所述的肿瘤靶向双载药纳米载体。
本发明所述肿瘤靶向双载药纳米载体的制备方法,通过胱胺引发ε-己内酯进行开环聚合反应,形成带有双硫键的双羟基聚己内酯(ho-pcl-ss-pcl-oh),再通过迈克尔加成反应将丙烯酰化的双羟基聚己内酯接枝到聚酰胺-胺型树枝状高分子(pamam)的伯氨基上,然后可通过疏水端与亲水端的相互排斥作用,形成具有疏水性内核和亲水性外壳的纳米载体。本发明的制备方法,具有工艺简单、反应温和、副反应少、无需特殊处理等优点,可适用于规模化生产。
进一步地,在步骤1)中,所述的催化剂为异辛酸亚锡或氯化亚锡;所述的胱胺、ε-己内酯与催化剂的摩尔比为1:(100~200):(0.05~0.1);所述的胱胺在反应体系中的浓度为5~20mg/ml;所述的冷乙醚与反应体系溶液的体积比为(10~20):1。
进一步地,在步骤2)中,所述的双羟基聚己内酯与丙烯酰氯、三乙胺的摩尔比为1:(4.2~10):(4.2~10);所述的双羟基聚己内酯在反应体系中的浓度为10~50mg/ml;所述的冷正己烷与反应体系溶液的体积比为(5~10):1。
进一步地,在步骤3)中,所述的聚酰胺-胺型树枝状高分子与双羟基聚己内酯的摩尔比为(4~10):1;所述的双羟基聚己内酯在反应体系中的浓度为0.8~8mmol/l;所述透析处理的截留分子量为8000~14000;所述的冷乙醚与反应体系溶液的体积比为(2~10):1。
进一步地,在步骤4)中,所述的双嵌段聚乙二醇是末端基团为马来酰亚胺基(mal)和n-羟基丁二酰亚胺基(nhs)的双嵌段聚乙二醇;所述的ph值调节为7.8~8.2;所述的双嵌段聚乙二醇与步骤3)的双羟基聚己内酯的摩尔比为(1~10):1;所述的聚己内酯-聚(酰胺-胺)聚合物在反应体系中的浓度为8~80mmol/l;所述的多肽与聚己内酯-聚(酰胺-胺)-聚乙二醇聚合物的质量比为1:(1~5);所述的多肽在反应体系中的浓度为0.5~2.5mg/ml;所述的ph值再次调节为6.0~7.0。
附图说明
图1是实施例1制得的具有双硫键的双羟基聚己内酯的核磁氢谱图;
图2是实施例2制得的丙烯酸酯封端的双羟基聚己内酯的核磁氢谱图;
图3是实施例4制得的聚己内酯-聚(酰胺-胺)-聚乙二醇的核磁氢谱图;
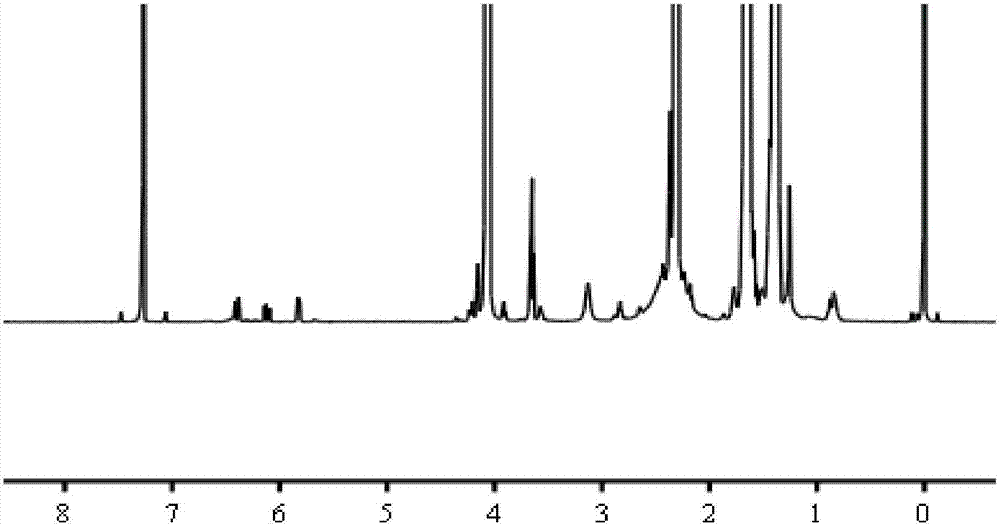
图4是实施例4制得的肿瘤靶向双载药纳米载体的核磁氢谱图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1:制备具有双硫键的双羟基聚己内酯(pcl)
将具有双硫键的胱胺和ε-己内酯溶解于干燥的甲苯中,在无水无氧条件下20min缓慢滴加入催化剂异辛酸亚锡,滴加完后在氮气环境中110℃下冷凝回流反应18h,反应过程中磁力搅拌,转速为300rpm;反应结束后40℃旋蒸除去甲苯溶剂,再用冷乙醚沉淀,然后40℃真空干燥12h,得到具有双硫键的双羟基聚己内酯(pcl)。
其中,胱胺的质量是200mg;甲苯的总体积是10ml;胱胺、ε-己内酯、异辛酸亚锡的摩尔比为1:132:0.05;冷乙醚与反应体系溶液的体积比为10:1。
将制得的具有双硫键的双羟基聚己内酯(pcl)溶解于氘代氯仿中进行核磁氢谱表征。如图1所示,化学位移在4.08、2.33、1.40、1.67ppm处的峰均为己内酯开环后五个亚甲基氢的特征峰,其中4.08ppm代表与氧相连的亚甲基氢的特征峰,2.33ppm代表与羰基相连的亚甲基氢的特征峰;3.55ppm处的峰为与胱胺相连的亚甲基的氢峰。图1核磁氢谱结果证明,本实施例制备得到了所述的具有双硫键的双羟基聚己内酯(pcl)。
实施例2:制备丙烯酸酯封端的双羟基聚己内酯(pcl-acrylate):
将三乙胺、丙烯酰氯分别溶于干燥的甲苯中,向实施例1制备得到的具有双硫键的双羟基聚己内酯(pcl)中先抽真空通氮气,再依次将三乙胺和丙烯酰氯的甲苯溶液在冰浴和避光的条件下30min缓慢滴加其中;80℃冷凝回流8h,反应过程中磁力搅拌,转速为300rpm,反应结束后,反应液过滤除去三乙胺盐酸盐结晶,滤液在过量的冷正己烷中沉淀,抽滤,收集白色粉末产物,最后40℃真空干燥24h,得到丙烯酸酯封端的双羟基聚己内酯(pcl-acrylate)。
其中,实施例1制得的具有双硫键的双羟基聚己内酯(pcl)的质量是200mg;具有双硫键的双羟基聚己内酯(pcl)与丙烯酰氯、三乙胺的摩尔比为1:10:10;甲苯的总体积为10ml;冷正己烷和反应体系溶液的体积比为10:1。
将制得的丙烯酸酯封端的双羟基聚己内酯(pcl-acrylate)溶解于氘代氯仿中进行核磁表征。如图2所示,化学位移在5.85ppm和6.40ppm处出现了亚甲基的两个β-h特征峰,化学位移在6.14ppm处出现的亚甲基的α-h特征峰。图2核磁氢谱结果证明,本实施例制备得到了所述的丙烯酸酯封端的双羟基聚己内酯(pcl-acrylate)。
实施例3:制备聚己内酯-聚(酰胺-胺)聚合物(pcl-pamam)
将聚酰胺-胺型树枝状高分子(pamam)和实施例2制得的丙烯酸酯封端的双羟基聚己内酯(pcl-acrylate)分别溶于氯仿中,聚酰胺-胺型树枝状高分子(pamam)在55℃和氮气环境下完全溶解,然后将丙烯酸酯封端的双羟基聚己内酯(pcl-acrylate)的氯仿溶液于30min内缓慢滴加入至聚酰胺-胺型树枝状高分子(pamam)的氯仿溶液中,抽真空,通氮气,55℃下冷凝回流反应24h,反应过程中磁力搅拌,转速为300rpm;反应结束后,在三氯甲烷中使用截留分子量为10000的透析袋透析1天,透析掉未反应的单体,再用过量的冷石油醚沉淀,得到白色沉淀,再用少量二氯甲烷溶解后,缓慢滴加到去离子水中,搅拌过夜,挥发有机溶剂后,冷冻干燥48h,得到所述的聚己内酯-聚(酰胺-胺)聚合物(pcl-pamam)。
其中,丙烯酸酯封端的双羟基聚己内酯(pcl-acrylate)的质量是71.6mg(0.0056mmol);聚酰胺-胺型树枝状高分子(pamam)与丙烯酸酯封端的双羟基聚己内酯(pcl-acrylate)的摩尔比为5:1;氯仿的总体积为7ml;冷石油醚与反应体系溶液的体积比为10:1;二氯甲烷的体积为1ml;去离子水的用量为二氯甲烷溶解液的质量的30倍。
实施例4:制备本发明所述的肿瘤靶向双载药纳米载体
将实施例3制得的聚己内酯-聚(酰胺-胺)聚合物(pcl-pamam)溶于适量ph=7.4的磷酸盐缓冲液中,调节ph=8,再加入双嵌段聚乙二醇(peg),室温下搅拌反应12h,得到聚己内酯-聚(酰胺-胺)-聚乙二醇(pcl-pamam-peg)。
其中,所述的双嵌段聚乙二醇是末端基团为马来酰亚胺基(mal)和n-羟基丁二酰亚胺基(nhs)的双嵌段聚乙二醇;聚己内酯-聚(酰胺-胺)聚合物(pcl-pamam)与双嵌段聚乙二醇(peg)的摩尔比为1:5;聚己内酯-聚(酰胺-胺)聚合物(pcl-pamam)在反应体系中的浓度是8mmol/l;磷酸盐缓冲液的体积为5ml。
将制得的聚己内酯-聚(酰胺-胺)-聚乙二醇(pcl-pamam-peg)的溶解于重水中进行核磁氢谱表征。如图3所示,化学位移在2.50ppm-2.86ppm处出现了亚甲基的h特征峰,为聚酰胺-胺型树枝状高分子(pamam)的特征峰,化学位移在3.67ppm处出现的亚甲基的h特征峰,为聚乙醇(peg)的特征峰。图3核磁氢谱结果证明,本实施例制备得到了聚己内酯-聚(酰胺-胺)-聚乙二醇(pcl-pamam-peg)。
将聚己内酯-聚(酰胺-胺)-聚乙二醇(pcl-pamam-peg)溶于适量磷酸盐缓冲液中,调节ph=6;将多肽t7溶于适量磷酸盐缓冲液中,加入到该聚己内酯-聚(酰胺-胺)-聚乙二醇(pcl-pamam-peg)磷酸盐缓冲液中,在常温下搅拌反应2h,然后转移到mwco10000超滤离心管中,以12000rpm超滤30min,去除未反应的聚合物和多肽,冷冻干燥24h后,制得本发明所述的肿瘤靶向双载药纳米载体(pcl-pamam-peg-t7)。
其中,多肽t7与聚己内酯-聚乙烯亚胺-聚乙二醇(pcl-pei-peg)的质量比为1:1;多肽在反应体系中的浓度为0.5mg/ml。
将本实施例制得的肿瘤靶向双载药纳米载体溶解于重水中进行核磁氢谱表征。如图4所示,图4a的化学位移在6.7ppm处出现了peg上的mal基团特征峰,但图4b中化学位移在6.7ppm处的mal基团特征峰消失了,而化学位移在3.5ppm处的存在尖锐的特征峰,证明聚乙二醇(peg)上的mal基团与t7上的巯基已成功连接。图4核磁氢谱结果证明,本实施例制备得到了所述的肿瘤靶向双载药纳米载体(pcl-pei-peg-t7)。
实施例5:本发明所述的肿瘤靶向双载药纳米载体的性能测试
1、细胞毒性测试
取实施例4制得的肿瘤靶向双载药纳米载体(pcl-pei-peg-t7),分别用pbs配制成0.01mg/ml、0.05mg/ml、0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml的载体溶液。在96孔培养板中分别接种1×104个hela细胞/孔,培养过夜,吸去培养基后用pbs洗涤2次,然后分别加入上述浓度的载体溶液,每孔100μl,并以未接种细胞的孔为空白孔,未加入载体溶液的细胞孔为对照孔,37℃、5%co2培养4小时。培养结束后,采用酶标仪测定各孔在450nm处的od值,计算细胞存活率。实验结果表明,各测试孔的细胞存活率均在80%以上,表明本发明制得的肿瘤靶向双载药纳米载体(pcl-pei-peg-t7)对细胞无毒性作用,生物相容性好。
2、谷胱甘肽还原敏感性测试
取实施例4制得的肿瘤靶向双载药纳米载体(pcl-pei-peg-t7),溶解于适量的水溶液中,平均分成六份,分别加入0.1mm、0.5mm、1mm、2mm、5mm、10mm的谷胱甘肽水溶液,在37℃水浴下搅拌反应15分钟,反应结束后分别测定各纳米载体溶液的粒径。实验结果表明,所加入谷胱甘肽水溶液的浓度大于1mm时,纳米载体的粒径发生明显变化,表明纳米载体中的聚己内酯二硫键被谷胱甘肽破坏,导致纳米载体的粒径发生变化。
3、肿瘤靶向性测试
将实施例4制得的肿瘤靶向双载药纳米载体(pcl-pei-peg-t7)与带有增强的绿色荧光蛋白(egfp)基因的质粒复溶于ph=7.4的磷酸盐缓冲液中,室温下涡旋60s,孵育,制得负载有绿色荧光蛋白(egfp)基因的纳米载体(pcl-pei-peg-t7/egfp)。另取未连接多肽t7的纳米载体(pcl-pei-peg),按照上述方法制备负载有绿色荧光蛋白(egfp)基因的纳米载体(pcl-pei-peg/egfp)作为对照。
在96孔培养板中分别接种1×104个hela细胞/孔,培养过夜,吸去培养基后用pbs洗涤2次,然后分别加入0.2mg/ml上述载体溶液,每孔100μl,并以未接种细胞的孔为空白孔,未加入载体溶液的细胞孔为对照孔,37℃、5%co2培养4小时。培养结束后,采用激光共聚焦显微镜观察。实验结果表明,与未连接多肽t7的纳米载体(pcl-pei-peg/egfp)相比,本发明的肿瘤靶向双载药纳米载体(pcl-pei-peg-t7)能够更好地转染进入细胞,细胞具有更强的绿色荧光信号表达。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!