一种用于运载膀胱癌症治疗药物的靶向纳米颗粒载体及其制备方法和应用与流程
本发明涉及纳米材料技术和生物医学材料
技术领域:
,具体涉及一种用于运载膀胱癌症治疗药物的磁性靶向中空普鲁士纳米颗粒载体(hpbmnps)的制备及其应用。
背景技术:
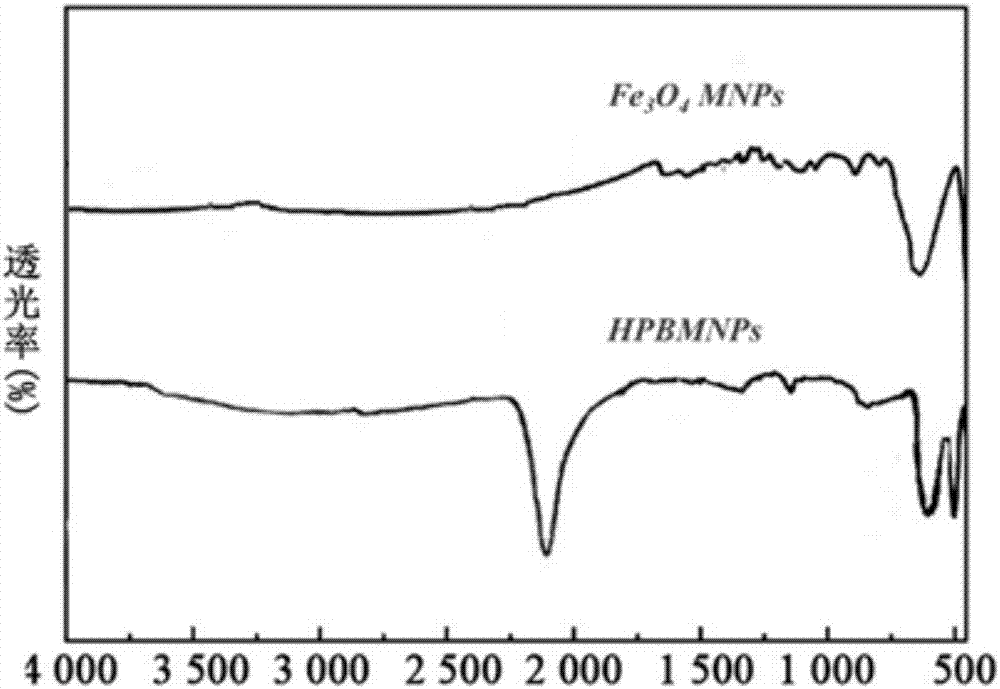
:癌症是各种恶性肿瘤的总称,是威胁人类健康的一项重大疾病。传统的治疗方法包括手术,放疗和化疗。传统手术用于切除早期的良性和未扩散的肿瘤,但缺点是未必能将肿瘤完全切除可能造成复发。放疗是采用高能射线杀死肿瘤来达到治疗肿瘤的目的,治疗早期还可以杀死大量肿瘤细胞,少数变异的肿瘤细胞继续存活并发生增殖,最终导致放疗失败。化疗是用化学药物杀死或抑制肿瘤细胞的生长和增殖。但是长期化疗,会使肿瘤细胞产生严重的耐药性,从而不能达到理想的效果。虽然放疗和化疗在一定程度上杀死了肿瘤细胞,但是也对人体的正常细胞产生伤害,使人体产生副作用。传统治疗癌症的药物,人体免疫系统中的吞噬细胞往往会将它们吞噬掉,使药物不能产生药效。而且传统的分子尺寸比较大,并不能到达细胞内部。而纳米级粒子因为尺寸较小、穿透性强、靶向性高、吸附性好的优点,可以通过静脉注射注入到人体体内,进入细胞内。随着纳米生物技术发展为国际前沿和热点问题,在生物医学领域有着广泛的应用,特别是纳米药物载体和成像技术。如药物输运系统(dds)的出现为药物的靶向输运和可控释放提供了新途径,对肿瘤的高效治疗和减少毒副作用有重要的作用。近年来,已经有无机纳米粒子广泛合成和用作药物载体,到目前为止,已经成功地生成了具有sio2,tio2和zro2组成的生物相容的中空纳米颗粒。除了提供药物的能力外,无机骨架的功能特征也在诊断和成像应用中显示出潜力。因此,开发新的中空壳层无机纳米粒子作为潜在的药物纳米载体在生物医学应用具有重要的意义。普鲁士蓝(pb)是一种历史悠久的蓝色染料,其制备简单且价格便宜。美国食品与药物管理局(fda)于2003年批准将其作为治疗铯和铊辐射中毒的临床用药,它在人体内的生物安全性和代谢途径非常可靠。因此,纳米型pb的高安全性使我们将其用作癌症化疗的细胞内药物载体。纳米磁性粒子在外磁场下可以进行定向移动,从而可以到达预期的目的地,而壳层中空可以作为药物的储存空间和释放空间。聚乙烯吡咯烷酮(pvp)是以n-乙烯基-2-吡咯烷酮为单体,通过聚合反应,形成的一种高分子聚合物,其具有很好的调控纳米粒径和可控侵蚀作用。经查阅专利和文献得出,现阶段所研究的纳米pb型载体粒子的靶向性太低,且载体载药数量不一。因此,能研究出一种靶向性强、低毒性且运载数量均等的运送癌症治疗药物的纳米pb型载体颗粒,将有良好的临床应用价值。技术实现要素:本发明的目的是克服普鲁士蓝纳米颗粒在应用于运送药物的过程中没有高特异性靶向性的缺点,提供一种用于运载膀胱癌症治疗药物的靶向纳米颗粒载体及其制备方法和应用,通过体外磁场,以实现载体装载的体内药物的磁性靶向分布。为实现上述目的,本发明采用的技术方案是:一种用于运载膀胱癌症治疗药物的靶向纳米颗粒载体,所述纳米颗粒载体以磁性四氧化三铁为核,其表面包裹有普鲁士蓝纳米壳,且其壳层有大小均等的中空孔隙。具体的,所述纳米颗粒载体为立方体结构,表面壳层含有中空孔隙,所述纳米颗粒载体的粒径为110nm,其壳层空腔的直径为90nm;其表面壳层的中空孔隙的直径小于2nm。研究表明,粒径介于20~150nm之间的纳米颗粒能够有效地避免被机体清楚机制所清除而更有效地到达靶组织,因此,制备的载体颗粒具有合适的尺寸,在进入机体内代谢过程中,更易在目标组织区域进行输送和吸收。优选的,纳米颗粒载体表面壳层的中空孔隙通过聚乙烯吡咯烷酮(pvp)可控侵蚀纳米粒子表面层形成,因为其可控制侵蚀的孔径大小和粒径大小,使药物可以均匀的装载与颗粒物上。一种用于运载膀胱癌症治疗药物的靶向纳米颗粒载体的制备方法,包括以下步骤:(1)配制fecl3·6h2o与h2o2的混合水溶液,记为溶液a;(2)配制k3fe(cn)6与h2o2的混合水溶液,记为溶液b;(3)配制fecl2·4h2o、fecl3·6h2o和hcl的混合铁盐溶液,氮气除氧,在n2条件下,将上述混合铁盐溶液逐滴加入到无氧氨水溶液中,室温剧烈搅拌;反应结束后,磁铁分离,用超纯水洗至中性,密封保存得到fe3o4mnps储备溶液,记为溶液c;(4)在常温搅拌状态下,将溶液a缓慢滴加到溶液b中,再加入溶液c,搅拌3h,得到含有磁性普鲁士蓝纳米粒子的溶液,取出胶体溶液,进行磁性分离和清洗,将分离产物置于真空干燥箱内烘干,得到粉末状磁性普鲁士蓝纳米粒子;(5)在磁力搅拌下,将聚乙烯吡咯烷酮水溶液加入到含有磁性普鲁士蓝纳米粒子溶液的聚四氟乙烯容器中,放置3h后,将聚四氟乙烯容器在140℃电炉中的不锈钢高压釜中放置4小时;反应结束后,进行离心分离,离心后,将沉淀物在蒸馏水中洗涤数次,冷冻干燥后得到所述纳米颗粒载体。所述溶液a中,fecl3·6h2o的浓度为0.04m;每ml溶液a中,含有质量浓度30%的h2o20.5μl;所述溶液b中,k3fe(cn)6的浓度为0.04m;每ml溶液a中,含有质量浓度30%的h2o20.5μl;所述步骤(3)的混合铁盐溶液中,fecl2·4h2o的浓度为2m,fecl3·6h2o的浓度为1m,hcl的浓度为2m;无氧氨水溶液的浓度为0.7m。所述步骤(4)中,溶液a、溶液b、溶液c的体积比为2:2:1。所述步骤(5)中,聚乙烯吡咯烷酮水溶液的浓度为5mg/ml,磁性普鲁士蓝纳米粒子溶液的浓度为1mg/ml。本发明的用于运载膀胱癌症治疗药物的靶向纳米颗粒载体在膀胱癌症治疗药物磁性靶向运载方面的应用。所述纳米颗粒载体的壳层的中空孔隙中装载抗肿瘤药物-顺铂粒子。有益效果:本发明的纳米颗粒载体(hpbmnps)在运送药物对膀胱癌t24细胞具有良好的靶向识别功能,有效的进入细胞内部;准确的杀死癌症细胞,同时具有无毒副作用,具有成为新一代高靶向运载抗癌药物对癌症细胞高准确杀伤的潜力。本发明的和纳米颗粒载体以前的药物载体相比具有高度的生物相容性,并且该纳米粒子装载药物后不仅可以被动的被细胞吞噬,还可以设置体外磁场,从而实现体内药物的磁性靶向分布,进而更精确的释放药物对癌细胞进行杀伤,且用药量大大减少,进而极大地降低了毒副作用。该类型纳米粒子在将来药物纳米载体发展中具有极大的潜力。附图说明图1表示固态的pbmnps和hpbmnps的sem和tem图,其中a为pbmnps的sem;b和c分别为hpbmnps的sem图和tem图;图2表示fe3o4mnps和hpbmnps的红外光谱图;图3表示cis@hpbmnps的吸附动力学(a)和释放的状况(b);图4表示hpbmnps和cis@hpbmnps的mtt测试的对比状况;图5表示膀胱癌t24细胞的共焦荧光图像,其中(a)为未添加物质,(b)为加入hpbmnps,(c)为加入cis@hpbmnps。具体实施方式下面结合附图对本发明做更进一步的解释。下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:实施例1配制含有2mfecl24h2o、1mfecl36h2o和2mhcl的混合铁盐溶液,氮气除氧10min。在n2条件下,将混合铁盐溶液逐滴加入到250ml、浓度为0.7m的无氧氨水溶液中,室温剧烈搅拌30min。磁铁分离,用超纯水洗至中性,定容250ml容量瓶中,密封保存得到fe3o4mnps储备溶液。实施例2配制含0.04mfecl3·6h2o与20μl质量分数为30%的h2o2混合水溶液40ml,记为溶液a;配制含0.04mk3fe(cn)6与20μl质量分数为30%的h2o2混合水溶液40ml,记为溶液b;在搅拌状态下,溶液a缓慢滴加到溶液b中,再加入20mlfe3o4mnps储备液,搅拌3h,含有磁性普鲁士蓝纳米粒子的溶液。取出胶体溶液,进行磁性分离、清洗,将分离产物置于真空干燥箱内烘干,得到粉末状pbmnps。实施例3在磁力搅拌下,将浓度为5mg/ml的聚乙烯吡咯烷酮(pvp)水溶液加入到含有浓度为1mg/ml的pbmnps溶液的聚四氟乙烯容器中,约3h后,将溶液在140℃电炉中的不锈钢高压釜中放置4小时。反应结束后,进行离心分离,离心后,将沉淀物在蒸馏水中洗涤数次。冷冻干燥后得到中空的纳米颗粒载体(hpbmnps)。使用扫描电子显微镜(sem)、透射电子显微镜(tem)对pbmnps和hpbmnps进行表征如图1所示,其中a为pbmnps的sem和;b和c分别为hpbmnps的sem和tem图。从中看出,合成的hpbmnps粒子粒径约为100nm左右,具有约为90nm的中空,而其中的微孔小于2nm,和膀胱癌治疗药物顺铂的粒径相近,非常适于运载。采用ft-ir(傅里叶变换红外光谱)及振动样品磁强计lh-3来表征fe3o4mnps和hpbmnps,其表征图分别图1和表1。从红外来看,合成的hpbmnps是符合要求的,而从磁性强度的测试,也得出合成的粒子具有超顺磁性,在一定的磁场范围内可以定向移动,这样就可以用于磁靶性运载。表1fe3o4mnps和pbmnps的磁性性质物质fe3o4mnpshpbmnps磁性性质超顺磁性超顺磁性实施例4为了充分利用hpbmnps在细胞内应用中的潜力,必须考虑的首要任务是安全/毒理学问题。通过t24细胞的mtt测定检查合成的hpbmnps的细胞毒性。即使hpbmnps的剂量高达1000mgml-1时,细胞活力约为70%,表明在体外具有优异的生物相容性。为了确保hpbmnps可用于不同的化疗方案,我们进一步研究了ph对hpbmnps稳定性的影响。hpbmnps溶液在ph值为2,5.4,7.4和8.6时保持其蓝色,分别代表胃、内体、血液和膀胱中的条件,表明hpbmnps纳米颗粒在较宽范围的ph条件下是稳定的。溶液的颜色在高ph值为11时变成浅橙色,表明hpbmnps中的配位结构的分解(浅橙色来自fe(oh)3)。然而,在体内从未发现如此高的ph条件。实施例5在黑暗中搅拌下,将5mg的hpbmnps纳米颗粒加入到3ml顺铂水溶液(2mg/ml)中。24小时后,通过离心机分离hpbmnps纳米颗粒。通过将上清液与邻苯二胺溶液的dmf溶液(1.2mg/ml)以1:1的体积比混合来测定上清液中的顺铂浓度。将混合物在100℃下加热10分钟,然后通过juscov-570uv/vis/nir分光光度计测量704nm处的吸光度,如图3(a)所示,表明其负载性很好。实施例6为了释放顺铂,在37℃下不加搅拌将装载有顺铂的hpbmnps纳米颗粒(5mg)加入到pbs缓冲液(ph7.4,5ml)中。通过uv/vis分光光度计测量顺铂从载铂的hpbmnps纳米颗粒的释放曲线,如图3(b)所示,顺铂释放率较低,但足够对t24细胞进行杀伤。利用元素分析仪对cis@hpbmnps进行表征,发现fe和pt都有对映的映射,且均匀分布,表明pt和fe均匀分布。实施例7将t24细胞系用含有10%胎牛血清的mccoy's5α培养基作为单层培养,在37℃的95%空气和5%co2的潮湿气氛的培养箱中。在这些条件下,电镀效率为90%,倍增时间为19小时。通过单层培养物的胰蛋白酶消化获得单细胞悬浮液。实施例8将t24细胞以1×105个细胞/孔接种在96孔培养板中。孵育过夜后,用不同浓度的hpbmnps纳米颗粒(0,50,100,150,200μg/ml)和负载顺铂的hpbmnps(0,50,100,150和200μg/ml)24小时。然后,用0.5mg/mlmtt处理细胞1小时,并将产生的甲腊晶体在100μldmso中匀浆。使用酶标仪(moleculardevices,usa)在570nm和690nm读取光密度(od)。在570nm记录吸光度,参考值为690nm。在单独的培养基中培养的细胞或0.01%的tritonx-100作为细胞活力的阴性对照或细胞死亡阳性对照。hpbmnps和负载顺铂的hpbmnps对细胞活力的影响通过与阴性对照标准化的活细胞的相对百分比进行评估,结果如图4所示。负载顺铂的hpbmnps随着其浓度的提高,对t24细胞的杀伤力增强,表明其与剂量有关,可对其增加人体可承受范围的剂量。实施例9在每个孔底部的lab-tek腔室盖玻片的4孔培养板中以1×105个细胞/孔的密度接种t-24细胞。孵育过夜后,连接到板上的t-24细胞,并将mem培养基用无血清的mem培养基(0.5ml/孔)中的不同浓度的药物负载纳米颗粒置换。然后用pbs溶液洗涤细胞镀覆层三次。然后加入dapipbs缓冲液(2.80e-5m,1ml)将细胞核染色30-60分钟。用pbs溶液洗涤后,使用具有63x油浸物镜的共焦荧光显微镜系统(leicatcssp5ii)检查dapi染色的覆盖层以检查颗粒的细胞定位,如图5所示,其中(a)无,(b)只有hpbmnps,(c)cis@hpbmnps,当用cis@hpbmnps处理细胞时,可以看出细胞膜被破坏,细胞的形态在形状上变化,显示了负载顺铂的hpbmnps具有较高的t24细胞杀伤能力。达到了我们预期的效果,在以后的癌症治疗方面具有明显的应用价值。最后有必要说明的是,以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法