含埃索美拉唑的复合胶囊及其制备方法与流程
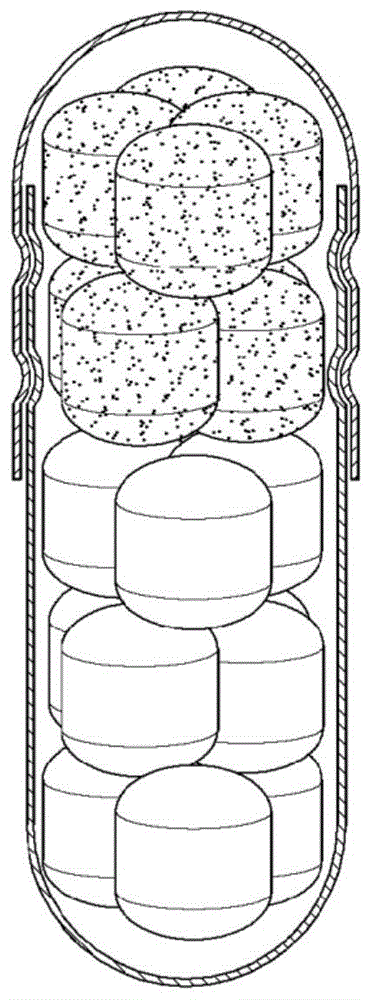
本公开涉及一种含埃索美拉唑的复合胶囊及其制备方法,并且更具体地,涉及一种含埃索美拉唑的复合胶囊,其是肠溶性的,因为其活性成分不溶于胃中并且在肠中表现出双重释放特性,从而能够在延长的时间段内释放活性成分并维持药物效果,并涉及一种制备所述含埃索美拉唑的复合胶囊的方法。
背景技术:
:埃索美拉唑((s)-5-甲氧基-2-[(4-甲氧基-3,5-二甲基吡啶-2-基)甲基亚磺酰基]-3h-苯并咪唑)是在奥美拉唑的两种光学异构体之中已知具有优异的安全性和功效的(s)-光学异构体,是一种质子泵抑制剂(ppi)。作为ppi,埃索美拉唑通过在酸分泌途径的最后阶段调节胃酸分泌而具有抑制哺乳动物(包括人)中胃酸分泌的作用。因此,众所周知,埃索美拉唑用于预防和治疗与胃酸分泌过多有关的疾病,诸如胃食管反流性疾病,包括反流性食管炎、胃炎、十二指肠炎、胃溃疡、十二指肠溃疡和消化性溃疡等。包括埃索美拉唑的ppi在酸性条件下容易降解或改性。因此,已经开发了肠溶性制剂,其可以通过引入肠溶包衣层来防止药物分解,所述肠溶包衣层防止暴露于胃中的胃酸,并且可以在肠中溶解和吸收。此外,已发现本领域的埃索美拉唑剂具有的问题在于:由于持续时间短,在服用一剂量埃索美拉唑剂12小时或更长时间后分泌胃酸,并且由于胃中的ph下降而观察到诸如胃灼热的症状。为了防止这种现象,可以增加药物的给药频率。然而,增加药物的给药频率可能由于患者的药物依从性降低而引起问题。技术实现要素:技术问题因此,需要开发具有耐酸性同时表现出更为持续的药物功效的含埃索美拉唑的口服剂型。提供一种含埃索美拉唑的复合胶囊,其对酸具有耐性,使得其不会在胃中降解,并且具有双重释放特性,从而导致持续的药物功效。提供一种制备含埃索美拉唑的复合胶囊的方法。技术方案本公开的一个方面提供了一种复合胶囊,包括:第一溶出部分,其包括:核心,所述核心包含作为活性成分的埃索美拉唑或其药学上可接受的盐;在所述核心上的内包衣层;和在所述内包衣层上的第一肠溶包衣层;以及第二溶出部分,其包括:核心,所述核心包含作为活性成分的埃索美拉唑或其药学上可接受的盐;在所述核心上的内包衣层;和在所述内包衣层上的第二肠溶包衣层,其中,所述第一肠溶包衣层包含作为包衣基材的甲基丙烯酸共聚物ld,甲基丙烯酸共聚物ld的量为在其上形成有所述内包衣层的所述核心的约5%(w/w)至约50%(w/w),并且所述第二肠溶包衣层包含作为包衣基材的含有比率为约1.5:1(w/w)至约3.5:1(w/w)的甲基丙烯酸共聚物s和甲基丙烯酸共聚物l的混合物,所述混合物的量为在其上形成有所述内包衣层的所述核心的约15%(w/w)至约40%(w/w)。本公开的另一方面提供了一种制备根据权利要求1至13中任一项所述的复合胶囊的方法,所述方法包括:制备包含埃索美拉唑或其药学上可接受的盐和药物添加剂的核心;用内包衣层包被所述核心;通过将第一肠溶包衣层包被在所述内包衣层上来获得第一溶出部分;单独地,通过将第二肠溶包衣层包被在所述内包衣层上来获得第二溶出部分;以及用所述第一溶出部分和所述第二溶出部分一起填充胶囊,其中所述第一肠溶包衣层包含作为包衣基材的甲基丙烯酸共聚物ld,甲基丙烯酸共聚物ld的量为在其上形成有所述内包衣层的所述核心的约5%(w/w)至约50%(w/w),并且所述第二肠溶包衣层包含作为包衣基材的含有比率为约1.5:1(w/w)至约3.5:1(w/w)的甲基丙烯酸共聚物s和甲基丙烯酸共聚物l的混合物,该混合物的量为在其上形成有所述内包衣层的所述核心的约15%(w/w)至约40%(w/w)。有益效果根据实施方式的含埃索美拉唑的复合胶囊具有耐酸性并且不易因暴露于胃液而降解,并且进一步地,通过包括第一溶出部分和第二溶出部分能够长时间表现出持续的药物功效,所述第一溶出部分能够在到达肠时立即释放,并且所述第二溶出部分能够延迟释放。因此,当每天施用一次时,含埃索美拉唑的复合胶囊可以表现出持续的药物功效,而不存在任何包括每天一次施用12小时后的胃灼热副作用。附图说明图1是根据实施方式的复合胶囊的示意图,其中第一溶出部分的核心(红色)和第二溶出部分的核心(蓝色)均是迷你片剂。图2和图3分别是示出实施例1至实施例3以及比较例1和比较例2的第一肠溶包衣层形成的迷你片剂的溶出试验结果的图线。图4和图5分别是示出实施例4至实施例7以及比较例3至比较例8的第二肠溶包衣层形成的迷你片剂的溶出试验结果的图线。图6是示出实施例8和实施例9以及比较例9的复合胶囊的溶出试验的测量结果的图线。具体实施方式在下文中,将详细描述本公开。除非另有说明,否则本发明中使用的所有技术术语与本领域普通技术人员所通常理解的相同。此外,在本说明书中描述了优选的方法或样品,但是类似或等同的方法或样品也包括在本发明的范围内。此外,本文所述的数值被认为包括“约”的含义,即使没有明确说明。本说明书中提及的所有出版物的内容均通过引用整体并入本文。根据一个实施方式,提供了一种复合胶囊,包括:第一溶出部分,包括:核心,所述核心包含作为活性成分的埃索美拉唑或其药学上可接受的盐;在所述核心上的内包衣层;和在所述内包衣层上的第一肠溶包衣层;以及第二溶出部分,包括:核心,所述核心包含作为活性成分的埃索美拉唑或其药学上可接受的盐;在所述核心上的内包衣层;和在所述内包衣层上的第二肠溶包衣层,其中所述第一肠溶包衣层可以包含作为包衣基材的甲基丙烯酸共聚物ld,甲基丙烯酸共聚物ld的量为在其上形成有所述内包衣层的所述核心的约5%(w/w)至约50%(w/w),并且所述第二肠溶包衣层可以包含作为包衣基材的含有比率为约1.5:1(w/w)至约3.5:1(w/w)的甲基丙烯酸共聚物s和甲基丙烯酸共聚物l的混合物,该混合物的量为在其上形成有所述内包衣层的所述核心的约15%(w/w)至约40%(w/w)。埃索美拉唑的药学上可接受的盐可以是本领域可获得的任何药学上可接受的盐,并且例如,可以是金属盐,诸如镁(mg)盐、锶(sr)盐、锂盐、钠盐、钾盐、钙盐等,或铵盐。然而,埃索美拉唑的药学上可接受的盐不限于此。在一个实施方式中,其药学上可接受的盐可以是埃索美拉唑的mg盐或埃索美拉唑的sr盐。此外,埃索美拉唑或其药学上可接受的盐可以以酸酐或水合物的形式使用。包含埃索美拉唑或其药学上可接受的盐的核心可以是可以包含在胶囊中的任何固体剂,并且例如,可以选自丸剂、迷你片剂、片剂及其组合。在一个实施方式中,核心可以包括迷你片剂,并且更具体地,可以具有接近球形的迷你片剂形式。因此,作为多单位球形片剂(must)的第一溶出部分和/或第二溶出部分可以填充在复合胶囊中。在一个实施方式中,第一溶出部分的核心和第二溶出部分的核心可以均呈迷你片剂形式,并且作为must,两个核心可以都填充在复合胶囊中(图1)。迷你片剂的直径可以为1mm至4mm,并且更具体地,直径为1.5mm至3mm。胶囊内部空间中的第一溶出部分和第二溶出部分可以分别以由至少4个,更具体地4至40个独立层分开的迷你片剂填充。可以根据本领域已知的方法制备迷你片剂。核心可以随同作为活性成分的埃索美拉唑或其药学上可接受的盐一起包含的本领域可用于制备核心的任何合适的药物添加剂。例如,核心可以另外包含一种或多种选自稀释剂、粘合剂、崩解剂、润滑剂、表面活性剂、抗氧化剂、防腐剂、稳定剂及其组合的添加剂。然而,添加剂不限于此。对于用作稀释剂,一种或多种稀释剂可以选自甘露醇、微晶纤维素、乳糖、纤维素及其衍生物、磷酸氢钙或磷酸三钙、赤藓糖醇、低取代羟丙基纤维素(hpc-l)、预胶化淀粉、山梨糖醇、木糖醇及其组合,但稀释剂不限于此。在一个实施方式中,对于用作稀释剂,可以使用甘露醇和/或微晶纤维素。对于用作粘合剂,一种或多种粘合剂可以选自羟丙基纤维素(hpc)、共聚维酮(乙烯基吡咯烷酮与其他乙烯基衍生物的共聚物)、羟丙基甲基纤维素(hpmc)、聚乙烯吡咯烷酮(聚维酮)、预胶化淀粉、hpc-l及其组合,但粘合剂不限于此。在一个实施方式中,对于用作粘合剂,可以使用hpc。对于用作崩解剂,一种或多种崩解剂可以是交联羧甲基纤维素钠、玉米淀粉、交聚维酮、hpc-l、预胶化淀粉及其组合,但崩解剂不限于此。在一个实施方式中,对于用作崩解剂,可以使用交联羧甲基纤维素钠。对于用作润滑剂,可以使用选自硬脂酰富马酸钠、硬脂酸镁、滑石、聚乙二醇、山嵛酸钙、硬脂酸钙、氢化蓖麻油及其组合中的一种或多种,但润滑剂不限于此。在一个实施方式中,对于用作润滑剂,可以使用硬脂酰富马酸钠。形成在核心上的内包衣层能够防止核心与肠溶包衣层之间的相互作用,并且可以包含作为包衣基材的亲水性聚合物,所述亲水性聚合物在施用复合胶囊后肠溶包衣层瓦解时不会抑制核心中活性成分的释放。内包衣层的包衣基材可以是,例如,选自hpmc、聚乙烯吡咯烷酮(pvp)、hpc-l、淀粉、明胶、乙基纤维素(ec)及其组合中的至少一种。在一个实施方式中,内包衣层可以包含hpmc作为包衣基材。在本说明书中,在其上形成有内包衣层的核心也称为经内部包衣的核心。内包衣层的量可以由本领域普通技术人员适当地选择,但是在一个实施方式中,内包衣层的量可以基于经内部包衣的核心在约3重量%至约5重量%的范围内。复合胶囊的第一溶出部分和第二溶出部分均包括肠溶包衣层,因此可以在胃中确保耐酸性。此外,在通过胃到达肠时,从第一溶出部分快速进行活性成分的第一次释放,并且在延迟的时间之后,从第二溶出部分继而进行活性成分的第二释放。因此,复合胶囊可以避免药物在胃中降解,并且由于药物在到达肠时快速溶出,所以可以表现出快速的药物功效,并且然后可以通过药物的双重释放而在长时间内持续药物功效。包含在第一溶出部分中的肠溶包衣层可以包含作为包衣基材的甲基丙烯酸共聚物ld。甲基丙烯酸共聚物ld是包含比率为约1:1的甲基丙烯酸和丙烯酸乙酯的阴离子共聚物,并且以溶液的形式存在。甲基丙烯酸共聚物ld可以商品名eudragitl30d-55商购获得,并且其iupac名称是聚(甲基丙烯酸-共-丙烯酸乙酯)1:1。包括在第一溶出部分中的肠溶包衣层可以包含作为包衣基材的含有比率为约1.5:1(w/w)至约3.5:1(w/w),例如约2:1(w/w)至约3:1(w/w)的甲基丙烯酸共聚物s和甲基丙烯酸共聚物l的混合物。甲基丙烯酸共聚物s是包含比率为约1:2的甲基丙烯酸和甲基丙烯酸甲酯的阴离子共聚物。甲基丙烯酸共聚物s可以商品名eudragits-100商购获得,并且其iupac名称是聚(甲基丙烯酸-共-甲基丙烯酸甲酯)1:2。甲基丙烯酸共聚物l是包含比率为约1:1的甲基丙烯酸和甲基丙烯酸甲酯的阴离子共聚物。甲基丙烯酸共聚物l可以商品名eudragitl-100商购获得,并且其iupac名称是聚(甲基丙烯酸-共-甲基丙烯酸甲酯)1:1。作为第一溶出部分的肠溶包衣层(也称为第一肠溶包衣层)的包衣基材的甲基丙烯酸共聚物ld是固体粉末,其相对于第一溶出部分的经内部包衣的核心的含量为约5%(w/w)至约50%(w/w),例如约8%(w/w)至约30%(w/w)。当这种固体粉末的量相对于经内部包衣的核心小于5%(w/w)时,尽管固体粉末快速溶解,但难以确保在0.1nhcl水溶液中的耐酸性。就这一点而言,当口服施用时,活性成分可能由于ppi的性质而降解,并且因此可能难以表现出医学功效。此外,当将甲基丙烯酸共聚物ld以相对于第一溶出部分的经内部包衣的核心大于50%(w/w)的量用作用于包衣的固体粉末时,可以确保在0.1nhcl水溶液中的足够耐酸性,但在通过胃后,活性成分的溶出在肠中过度缓慢,导致活体中药物吸收的延迟和医学功效的延迟。作为第二溶出部分的肠溶包衣层(也称为第二肠溶包衣层)的包衣基材的甲基丙烯酸共聚物s和甲基丙烯酸共聚物l可以以约1.5:1(w/w)至约3.5:1(w/w),并且例如约2:1(w/w)至约3:1(w/w)的比率混合。当包衣基材以低于上述比率的比率混合时,在相对低的ph下溶解的甲基丙烯酸共聚物l的比例变得相对高,并且因此,当通过胃到达肠时可能发生其快速释放,导致难以表现双重释放的特性。此外,当包衣基材以高于上述比率的比率混合时,作为相对不溶物质的甲基丙烯酸共聚物s的比例增加,导致药物的过度延迟释放。就这一点而言,包衣基材可能被排泄出而不会实现药物的完全释放,导致低的生物利用度。作为固体粉末,含有甲基丙烯酸共聚物s和甲基丙烯酸共聚物l的混合物可以以相对于经内部包衣的核心以15%(w/w)至40%(w/w),例如20%(w/w)至35%(w/w)的量使用。当混合物的含量低于上述量时,第二溶出部分可能不能够确保所需的溶出延迟,并且由于到达肠时的快速溶出,可能难以确保双重释放特性。此外,当混合物的含量大于上述量时,肠溶包衣层可能变得更厚,使得药物从溶出构件的第二次释放可能被过度延迟。因此,复合胶囊中的药物可能被排泄出而不会实现药物的完全释放,导致低的生物利用度。复合胶囊可以以适当的比率分别在第一溶出部分和第二溶出部分中包含活性成分,并且可以由本领域普通技术人员根据所需的溶出特性选择这种的适当比率。在一个实施方式中,作为游离碱,埃索美拉唑或其药学上可接受的盐可以以2:1至1:2的重量比包含在复合胶囊中的第一溶出部分与第二溶出部分之间。构成复合胶囊的胶囊可以是硬胶囊,并且可以使用本领域可获得的任何硬胶囊。硬胶囊的基材可以是,例如,选自明胶、羟丙甲纤维素、普鲁兰多糖(npcapstm等,capsugelcompany)、聚乙烯醇及其组合,但基材不限于此。对于用作硬胶囊,可以使用本领域可获得的任何常规尺寸的胶囊。根据胶囊的尺寸,使用各种胶囊尺寸。大尺寸的胶囊,例如尺寸00胶囊(胶囊帽的直径为8.5mm并且胶囊的长度为23.3mm)对于老年患者或体型较小的幼儿来说是不方便的,并且由于胶囊体积增加也可能具有差的便携性。在一个实施方式中,考虑到待填充在胶囊中的片剂或颗粒的质量限制,可以使用尺寸0、尺寸1、尺寸2、尺寸3或尺寸4,例如,尺寸1、尺寸2或尺寸3的复合胶囊。在复合胶囊中,活性成分在强酸性环境中几乎不释放。然而,活性成分的第一次释放在5.5或更低ph下在肠中从第一溶出部分中快速进行,并且活性成分的第二次释放在6.5至7.0ph在肠中从第二溶出部分中进行。关于对复合胶囊的溶出试验,将复合胶囊在0.1nhcl水溶液中放置2小时,并且然后将溶液转移到ph6.7至6.9的人工肠液中。在溶出试验中,在前两个小时期间几乎不发生释放,但是在人工肠液中开始释放。在溶出试验开始150分钟后,从第一溶出部分进行第一次释放,其中释放第一溶出部分的约90%(w/w)或更多的活性成分。从溶出试验开始经过180分钟的延迟时间后,从第二溶出部分开始活性成分的溶出,然后在360分钟时,实现完成溶出(约99%或更多)的第二次释放。在180分钟的延迟时间期间,可以实现第二溶出部分的5%活性成分,优选2%活性成分的脱出。在一个实施方式中,当在根据美国药典(usp)中描述的桨法ii、在37±0.5℃的温度下、在0.1nhcl水溶液中以100转/分钟(rpm)溶出120分钟后,在具有ph为6.7至6.9的人工肠液中连续进行溶出测试240分钟时,复合胶囊在0.1nhcl中在120分钟内具有耐酸性,在人工肠液中在60分钟内溶出约55%或更少的活性成分,并在人工肠液中在240分钟内溶出约95%或更多的活性成分(参见实验例4)。因此,考虑到复合胶囊可以通过使活性成分不在胃中溶出而是在肠中双重释放活性成分而能够具有足够的生物利用度和持续时间,可以在降低施用频率的同时有效地使用复合胶囊。复合胶囊可以包括作为活性成分的艾美拉唑或其药学上可接受的盐。已知这种活性成分是有效的,或者可以用于对将来新开发的药物行之有效的疾病的任何治疗或预防。因此,根据一个实施方式,复合胶囊可以用于预防或治疗与胃酸分泌过多有关的疾病,所述疾病选自胃食管反流性疾病、胃炎、十二指肠炎、胃溃疡、十二指肠溃疡和消化性溃疡。在一个实施方式中,复合胶囊可以每天施用一次。本公开的另一方面提供了一种制备根据权利要求1至13中任一项所述的复合胶囊的方法,所述方法包括:制备包含埃索美拉唑或其药学上可接受的盐和药物添加剂的核心;用内包衣层包被所述核心;通过将第一肠溶包衣层包被在所述内包衣层上来获得第一溶出部分;单独地,通过将第二肠溶包衣层包被在所述内包衣层上来获得第二溶出部分;以及用所述第一溶出部分和所述第二溶出部分一起填充胶囊,其中所述第一肠溶包衣层包含作为包衣基材的甲基丙烯酸共聚物ld,甲基丙烯酸共聚物ld的量为在其上形成有所述内包衣层的所述核心的约5%(w/w)至约50%(w/w),并且所述第二肠溶包衣层包含作为包衣基材的含有比率为约1.5:1(w/w)至约3.5:1(w/w)的甲基丙烯酸共聚物s和甲基丙烯酸共聚物l的混合物,该混合物的量为在其上形成有所述内包衣层的所述核心的约15%(w/w)至约40%(w/w)。根据一个实施方式制备口服固体制剂的方法的细节可以原样应用于根据本公开的上述方面的口服固体制剂,并且可以使用本领域已知的任何制备方法进行详述。当复合胶囊的第一溶出部分和第二溶出部分的核心是迷你片剂(must)或常规片剂时,可以根据直接压制或间接压制制备核心。对于直接压制,可以使用干燥颗粒或湿颗粒。在一个实施例中,核心的制备可包括以下步骤:(a)将稀释剂与埃索美拉唑或其药学上可接受的盐混合;(b)将步骤(a)的混合物与崩解剂、粘合剂和润滑剂混合;以及(c)对步骤(b)的混合物进行干法制粒,然后将所得产物压片,以获得迷你片剂或片剂。对于用内包衣层、第一肠溶包衣层和第二肠溶包衣层包衣迷你片剂或片剂,可以应用任何包衣迷你片剂或片剂的包衣方法。例如,可以使用流化床包衣机来进行包衣。在下文中,将参考以下实施例详细描述本发明。然而,以下实施例是实施方式的说明性实施例,并不意图在其他方面以任何方式限制实施方式的范围。[实施例]制备例1:含埃索美拉唑镁盐的核心和内包衣层的形成使用下表1中的组合物,将埃索美拉唑镁盐和甘露糖醇混合,并且使用30目圆筛筛分该混合物。将所得产物添加至具有微晶纤维素、交联羧甲基纤维素钠、羟丙基纤维素和硬脂酰富马酸钠的空共混机中,共混15分钟,从而制备最终混合物。将最终混合物放入辊压机中,然后进行干法制粒。将由此获得的颗粒使用20目圆筛进行筛分。接下来,使用直径为2.0mm的must冲头将10片迷你片剂压片,每次压片的压力程度为约1kp至约2kp并且重量为7.5mg,从而形成must。[表1]含埃索美拉唑镁盐的核心的组成在流化床包衣机中用具有下表2的组成的包衣流体对所制备的must进行包衣,从而获得经内部包衣的迷你片剂,每片的重量为7.88mg。[表2]内包衣层的组成制备例2:实施例1至实施例3以及比较例1和比较例2形成有第一肠溶包衣层的迷你片剂的制备在流化床制粒机中使用表3的组成,对经内部包衣的迷你片剂进行包衣,以根据实施例1至实施例3以及比较例1和比较例2制备形成有第一肠溶包衣层的迷你片剂。在实施例1至实施例3中,将作为第一肠溶包衣基材的eudragitl30d-55以相对于经内部包衣的迷你片剂的5%(w/w)至50%(w/w)的重量进行包衣。在比较例1和比较例2中,分别各自将eudragitl30d-55以4%(w/w)和51%(w/w)的重量进行包衣。[表3]第一肠溶包衣层的组成制备例3:实施例4至实施例7以及比较例3至比较例8形成有第二肠溶包衣层的迷你片剂的制备在流化床制粒机中使用下表4和表5的组成,对制备例1的经内部包衣的迷你片进行包衣,以制备实施例4至实施例7以及比较例3至比较例8的形成有第二肠溶包衣层的迷你片剂。在实施例4和实施例5中,将以2:1的比率混合的eudragits-100和eudragitl-100的混合物以相对于经内部包衣的迷你片剂的25%(w/w)至35%(w/w)的重量比进行包衣。在实施例6和实施例7中,将以3:1的比率混合的eudragits-100和eudragitl-100的混合物以相对于经内部包衣的迷你片剂的20%(w/w)至30%(w/w)的重量比进行包衣。[表4]实施例4至实施例7的第二肠溶包衣层的组成在比较例3和比较例4中,将以2:1的比率混合的eudragits-100和eudragitl-100的混合物分别以相对于经内部包衣的迷你片剂的10.15%(w/w)和40.61%(w/w)的重量进行包衣。在比较例5和比较例6中,将以3:1的比率混合的eudragits-100和eudragitl-100的混合物分别以相对于经内部包衣的迷你片剂的10.15%(w/w)和40.61%(w/w)的重量进行包衣。在比较例7和比较例8中,将以6:1的比率混合的eudragits-100和eudragitl-100的混合物分别以相对于经内部包衣的迷你片剂的10.15%(w/w)和20.30%(w/w)的重量进行包衣。[表5]比较例3至比较例8的第二肠溶包衣层的组成制备例4:实施例8和实施例9以及比较例9形成有第一肠溶包衣层的迷你片剂和形成有第二肠溶包衣层的迷你片剂的制备用10片实施例1的形成有第一肠溶包衣层的迷你片剂和10片实施例4的形成有第二肠溶包衣层的迷你片剂一起填充主要基材为明胶的2号明胶硬胶囊,以制备实施例8的复合胶囊(包括40mg埃索美拉唑)。以相同的方式,用实施例1和实施例7的迷你片剂填充胶囊,以制备实施例9的复合胶囊。此外,以相同的方式,用实施例1和比较例3的迷你片剂填充胶囊,以制备比较例9的复合胶囊。制备例5:根据胶囊类型的复合胶囊的制备以与制备例4相同的方式制备复合胶囊,不同之处在于用迷你片剂填充的羟丙甲纤维素胶囊是主要基材为羟丙甲纤维素的硬胶囊。此外,以与制备例4相同的方式制备复合胶囊,不同之处在于迷你片剂填充的普鲁兰多糖胶囊是主要基材为普鲁兰多糖的硬胶囊。实验例1:形成有第一肠溶包衣层的迷你片剂的溶出试验使用实施例1至实施例3以及比较例1和比较例2的形成有第一肠溶包衣层的迷你片剂,在下列条件下测量埃索美拉唑镁盐的时间依赖性溶出率:-溶出条件洗脱液:300ml0.01nhcl(2小时)→1,000ml人工肠液(ph6.8)装置:usp桨(法),100rpm温度:37℃测量溶出率的时间:60分钟、120分钟、125分钟、130分钟、135分钟、150分钟、165分钟和180分钟-分析条件使用的设备:hplc(hitachi5000系列,日本)检测器:紫外分光光度计(测量波长:302nm)柱:不锈钢管,其内径为约4.0mm并且长度为约10cm用于液相色谱的填充有硅胶的5μm柱流动相-磷酸钠缓冲液(ph7.3):乙腈:纯化水=50:35:15流速:1.0ml/min柱温:30℃实施例1至实施例3的形成有第一肠溶包衣层的迷你片剂的溶出率测量结果示于表6和图2中。[表6]如表6和图2中所示,实施例1至实施例3的迷你片剂在0.1nhcl中在最初2小时内具有耐酸性。然后,迷你片剂在人工肠液(ph6.8)中在30分钟内(即溶出试验开始后150分钟)显示出90%或更高的溶出率,这表明迷你片剂表现出立即释放。比较例1和比较例2的溶出率测量结果示于表7和图3中。[表7]如表7和图3中所示,其中将eudragitl30d-55以相对于经内部包衣的迷你片剂的4%(w/w)的重量作为第一肠溶包衣层使用的比较例1的迷你片剂由于与经内部包衣的迷你片剂相比涂布率低而难以具有足够的耐酸性,并且在0.1nhcl中在120分钟内显示出10%的释放。此外,由于在酸性环境中降解的埃索美拉唑的特性,比较例1的迷你片剂未显示出100%的最终溶出率。此外,其中将eudragitl30d-55以相对于经内部包衣的迷你片剂的51%(w/w)的重量作为第一肠溶衣层使用的比较例2的迷你片剂确保了足够的耐酸性,但在150分钟内显示出85%的溶出率。因此,埃索美拉唑的吸收减慢,并且因此医学功效的表达也可能延迟。实验例2:形成有第一肠溶包衣层的迷你片剂的耐酸性试验使用实施例1至实施例3以及比较例1和比较例2的形成有第一肠溶包衣层的迷你片剂,将迷你片剂在下述耐酸性条件下放置2小时,并且基于埃索美拉唑镁盐的量测量耐酸性。使用10片迷你片剂,并且结果示出在表8中。–耐酸性条件测试溶液:0.01nhcl装置:usp桨法,100rpm温度:37℃时间:放置2小时-分析条件使用的设备:hplc(hitachi5000系列,日本)检测器:紫外分光光度计(测量波长:302nm)柱:不锈钢管,其内径为约4.0mm并且长度为约10cm用于液相色谱的填充有硅胶的5μm柱流动相-磷酸钠缓冲液(ph7.3):乙腈:纯化水=50:35:15流速:1.0ml/min柱温:30℃[表8]耐酸性试验的结果试验前的量(%)试验后的量(%)实施例1100.9±1.3101.2±0.5实施例2101.3±2.5100.6±1.2实施例3100.6±0.9100.1±1.1比较例1100.6±1.690.4±2.4比较例2100.7±0.7101.3±1.7如表8中所示,作为实施例1至实施例3以及比较例1和比较例2在0.1nhcl中进行耐酸性试验的结果,包衣层比率低的比较例1在试验之前和之后在埃索美拉唑镁盐的用量上显示出约10.0%的差异。然而,发现除了比较例1之外的剩余样品在耐酸性试验后具有与原始活性成分的量相似的量。实验例3:形成有第二肠溶包衣层的迷你片剂的溶出试验使用实施例4至实施例7以及比较例3至比较例8的形成有第二肠溶包衣层的迷你片剂,在下列条件下测量埃索美拉唑镁盐的时间依赖性溶出率:-溶出条件洗脱液:300ml0.01nhcl→1,000ml人工肠液(ph6.8)装置:usp桨(法),100rpm温度:37℃测量溶出率的时间:60分钟、120分钟、150分钟、180分钟、210分钟、240分钟、300分钟和360分钟-分析条件使用的设备:hplc(hitachi5000系列,日本)检测器:紫外分光光度计(测量波长:302nm)柱:不锈钢管,其内径为约4.0mm并且长度为约10cm用于液相色谱的填充有硅胶的5μm柱流动相-磷酸钠缓冲液(ph7.3):乙腈:纯化水=50:35:15流速:1.0ml/min柱温:30℃实施例4至实施例7的形成有第二肠溶包衣层的迷你片剂的溶出率测量结果示于表9和图4中。[表9]参考表9和图4的结果,实施例4至实施例7的迷你片剂在0.1nhcl中在最初2小时内没有显示出任何溶出,使得确保了耐酸性。然后,在人工肠液(ph6.8)中药物的释放延迟60分钟或更长时间。然而,一旦药物开始释放,则释放迅速完成。尽管根据eudragits和eudragitl的比率而略有不同,但确保在0.1nhcl中的耐酸性120分钟后,埃索美拉唑镁盐在人工肠液中在60分钟内几乎不释放,而是在过去60分钟的时间时迅速释放。然后,在过去360分钟的时间时,确认了释放99%或更多的埃索美拉唑镁盐的优异释放特性。当由于制剂的性质而在360分钟的时间时未确保90%或更高的溶出率时,药物可能在不溶出的情况下被排泄出,并且就这一点而言,确认了在实施例4至实施例7中可以实现充分的释放。此外,比较例3至比较例8的形成有第二肠溶包衣层的迷你片剂的溶出率测量结果示于表10和图5中。[表10]参考表10和图5中所示的结果,在比较例3、比较例5和比较例7的迷你片剂的情况下,由于第二肠溶包衣层的重量比率低,所以难以在0.1nhcl中确保2小时的耐酸性。在比较例4、比较例6和比较例8的迷你片剂的情况下,由于第二肠溶衣层的重量比率高,不仅确保了耐酸性,而且药物的释放在人工肠液中也被过度延迟。在这些迷你片剂中,即使在经过6小时后也未实现超过90%的药物释放,因此,药物可能在药物的释放未充分完成的情况下被排泄出。实验例4:复合胶囊的溶出率试验使用实施例8和实施例9以及比较例9的复合胶囊,在下列条件下测量埃索美拉唑镁盐的时间依赖性溶出率:-溶出条件洗脱液:300ml0.1nhcl→1,000ml人工肠液(ph6.8)装置:usp桨(法),100rpm温度:37℃测量溶出率的时间:60分钟、120分钟、125分钟、130分钟、135分钟、150分钟、165分钟、180分钟、210分钟、240分钟、300分钟和360分钟-分析条件使用的设备:hplc(hitachi5000系列,日本)检测器:紫外分光光度计(测量波长:302nm)柱:不锈钢管,其内径为约4.0mm并且长度为约10cm用于液相色谱的填充有硅胶的5μm柱流动相-磷酸钠缓冲液(ph7.3):乙腈:纯化水=50:35:15流速:1.0ml/min柱温:30℃溶出率测量结果示于表11和图6中。[表11]埃索美拉唑镁盐的溶出率参考表11和图6的结果,通过将包括第一肠溶包衣层的迷你片剂和包括第二肠溶包衣层的迷你片剂以1:1的比率混合而制备的实施例8和实施例9的复合胶囊确保了在0.1nhcl中在前2小时内的耐酸性。然后,在人工肠液中第一次释放后,在第二次释放开始前将释放延迟了约45分钟。参考图6的图线,已经清楚地识别出这种双重释放特性。因此,实施例8和实施例9的复合胶囊由于在人工肠液中的双重释放特性而在溶出试验开始后显示出长达6小时的药物持续释放。在比较例9的迷你片剂中,在0.1nhcl中在2小时内确保了耐酸性。然而,在第一次释放后,药物的释放立即发生,而在第二次释放开始之前没有延迟释放。因此,在溶出试验3小时后,大多数药物(98%或更多)的释放完成。虽然已经参考其示例性实施方式具体地示出并且描述了本发明,但本领域的技术人员应理解,可以在不脱离由所附权利要求书所限定的实施方式的精神和范围的情况下,对本发明在形式和细节上做出各种改变。示例性实施方式应视为仅具有描述意义而不是用于限制目的。因此,实施方式的范围不是由实施方式的详细描述限定,而是由所附权利要求限定,并且范围内的所有差异将被解释为包括在本发明中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1