离子泵抑制剂抑制上皮间质转化及抗肿瘤转移中的用途的制作方法
本发明涉及医药技术领域,具体地说,涉及一种离子泵抑制剂抑制上皮间质转化及抗肿瘤转移中的用途。
背景技术:
随着全球经济科学人文的高速发展,人类将越来越多的关注眼光放在全球健康这个主题上。据2015年CBD对全球疾病负担进行统计分析,缺血性心脏病,脑血管病等多种疾病威胁人类健康,其中肺癌,肝癌,结肠癌,乳腺癌等多种癌症也高居榜单,成为人类头号杀手之一。从出现癌症的明确定义到如今,无论是政府机构,科研人员还是民间组织投入数十年,以期能揭开癌症神秘面纱攻克癌症,但到日前,伴随着经济发展,人口递增,癌症的发病率、致死率仍呈现居高不下的态势。据GLOBOCAN统计,2012年全球新增癌症病例1406.8万,820.2万人死于癌症,3245.5万人于五年中带瘤生存。仅中国,单2012年就有306.5万新增癌症病例,220万人死于癌症。因此研发针对癌症有效的治疗方法刻不容缓。
目前临床对于实体瘤的治疗仍是以外科切除为主,辅以放疗和化疗来杀死游离于血管,潜在转移病灶或原位灶残留的肿瘤细胞。放化疗作用机制是借助细胞毒化合物以及放射线来抑制肿瘤细胞增殖从而达到杀死肿瘤细胞的目的。放、化疗手法由于其作用机制,对细胞增殖时期的正常细胞也有杀伤作用,因此毒副作用较大。相较于放化疗的低特异性,分子靶向化合物的诞生则为高效精准靶向治疗肿瘤带来新生机。作为新一代的肿瘤化合物,分子靶向化合物能够特异性作用于肿瘤细胞中异常激活的信号通路或生物学进程,与传统放、化疗相比更高效、副作用更小。
肿瘤发病部位多种多样,恶性程度以及死亡率也各有不同,但肿瘤致死原因还是可归纳为如下四点:1.合并感染。肿瘤患者免疫力低下导致继发的严重感染甚至死亡;2.营养耗竭,代谢失常。肿瘤细胞相较于正常细胞不受衰老机制调节,增殖快速消耗大量营养物质,并因此代谢失常,代谢产物积累。3.异常出血;4.肿瘤转移。肿瘤转移至其它重要脏器,异位异常增殖从而破坏脏器正常生理结构,引起相关脏器功能损坏甚至衰竭,导致死亡。而在这几点致死原因当中,90%肿瘤死亡病例死于肿瘤转移。肿瘤转移是恶性肿瘤的主要生物学特性之一,肿瘤细胞脱离原发肿瘤灶,经由血管,淋巴管道或者体腔等途径,到达远端其它部位再次生长形成继发转移灶。
在实体瘤当中,肿瘤细胞呈现多态性,既有处于完全分化上皮状态的细胞也有分化程度较低的间质状态细胞,不同状态的细胞有各自不同的特性。上皮状态的细胞富有细胞极性,细胞间排列紧密连接在细胞外基底膜上,表达细胞粘附分子(比如钙粘蛋白E-cadherin),而间质状态的细胞则是没有细胞极性,不与细胞外基底膜连接,迁移、侵袭、细胞能动性高,细胞不表达或者是少量表达细胞粘附分子并大量表达波形蛋白Vimentin。在原位肿瘤中,大部分肿瘤细胞是以上皮状态的形式存在。如果肿瘤细胞需要侵袭,扩散至远端组织继而发展形成转移灶,肿瘤上皮细胞就需要转变进入更加间质表型的状态。这种转变需要一种复杂的细胞生物学进程参与,即上皮间质转化(Epithelial-Mesenchymal transition,EMT)。发生EMT时,上皮肿瘤细胞丢失细胞粘附,细胞记性以及缺少能动性的特性,获得能动性,侵袭能力以及干细胞样的间质特性。EMT是一个动态过程,生物体内还存在与之相对的MET进程,即间质上皮转化,细胞丢失间质表型特性转变成上皮表型特性,从而减少细胞侵袭出原位肿瘤的几率。基于EMT在肿瘤发生发展,以及恶性肿瘤转移过程中所扮演的重要角色,探索研发基于EMT或是MET的分子靶向化合物将能为肿瘤治疗带来新的契机。
离子泵抑制剂(proton pump inhibitors,简称PPIs)是一类主要用于长效持久减少胃酸分泌的药物,临床适应症主要是消化不良,消化性溃疡等为胃肠道疾病。离子泵抑制剂是全球销售最广泛的固态药物之一("WHO Model List of EssentialMedicines".World Health Organization.October 2013)。离子泵抑制剂包括:兰索拉唑(Lansoprazole)、奥美拉唑(Omeprazole)、右旋兰索拉唑(Dexlansoprazole)、埃索美拉唑(Esomeprazole)、泮托拉唑(Pantoprazole)、雷贝拉唑(Rabeprazole)、艾普拉唑(Ilaprazole)。
技术实现要素:
本发明要解决的技术问题是,针对现有技术不足,提供一种离子泵抑制剂抑制上皮间质转化及抗肿瘤转移中的用途。
为了实现从众多小分子化合物中筛选出基于EMT或是MET的分子靶向化合物,本发明利用了一种双化学发光报告系统作为基于上皮间质转化的生物学过程来筛选靶向EMT的化合物以实现攻克肿瘤转移,治疗肿瘤的临床应用价值。
该双化学发光报告系统是基于上皮间质转化中关键蛋白表达量的变化而设计。在已稳转该报告系统的细胞中,当细胞处于上皮表型表达钙粘蛋白Ecadherin时,细胞会表达萤火虫荧光素酶Luciferase;在细胞处于间质表型表达波形蛋白Vimentin时,细胞则会表达海肾荧光素酶Renilla;而处于上皮与间质的中间状态,即既有Ecadherin表达又有Vimentin表达时,细胞则同时表达荧火虫荧光素酶和海肾荧光素酶。这两种荧光素酶可作用于不同的底物并产生荧光信号由化学发光检测仪定量检测。根据报告系统的原理,在相同细胞数量的基础上,如加化合物的实验组luciferase读数升高,则发生MET;反之,当luciferase读数降低时,则发生EMT。通过一系列实验筛选,本发明从1200多种小分子化合物中筛选发现离子泵抑制剂能高效抑制细胞发生EMT的小分子。
本发明的目的是通过以下技术方案实现的:
本发明提供了一种离子泵抑制剂在抑制上皮间质转化及抗肿瘤转移中的用途。
优选地,所述离子泵抑制剂的结构通式如下:
优选地,所述离子泵抑制剂选自兰索拉唑、奥美拉唑、右旋兰索拉唑、埃索美拉唑、泮托拉唑、雷贝拉唑、艾普拉唑。结构式如下:
兰索拉唑(Lansoprazole)
奥美拉唑(Omeprazole)
右旋兰索拉唑(Dexlansoprazole)
埃索美拉唑(Esomeprazole)
泮托拉唑(Pantoprazole)
雷贝拉唑(Rabeprazole)
艾普拉唑(Ilaprazole)
优选地,所述离子泵抑制剂的有效浓度为20nM-10μM。
本发明还提供了一种离子泵抑制剂在制备抑制上皮间质转化及抗肿瘤转移药物组合物中的用途。
优选地,所述离子泵抑制剂选自兰索拉唑、奥美拉唑、右旋兰索拉唑、埃索美拉唑、泮托拉唑、雷贝拉唑、艾普拉唑。
优选地,所述药物组合物中,离子泵抑制剂的有效浓度为20nM-10μM。
优选地,所述药物组合物还包括药学上可接受的载体或赋形剂。
优选地,所述药物组合物还包括其他抗肿瘤药物。
优选地,所述其他抗肿瘤药物包括紫杉醇。
与现有技术相比,本发明具有如下的有益效果:
本发明利用高效动态的筛选方法,对多种小分子化合物进行是否是EMT靶点的筛选,获得了离子泵抑制剂能有效抑制上皮间质转化及肿瘤转移,为临床上用于治疗肿瘤转移的治疗靶点提供了新方法,可以带来巨大的社会经济利益。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1:双荧光与双化学发光报告系统质粒示意图;
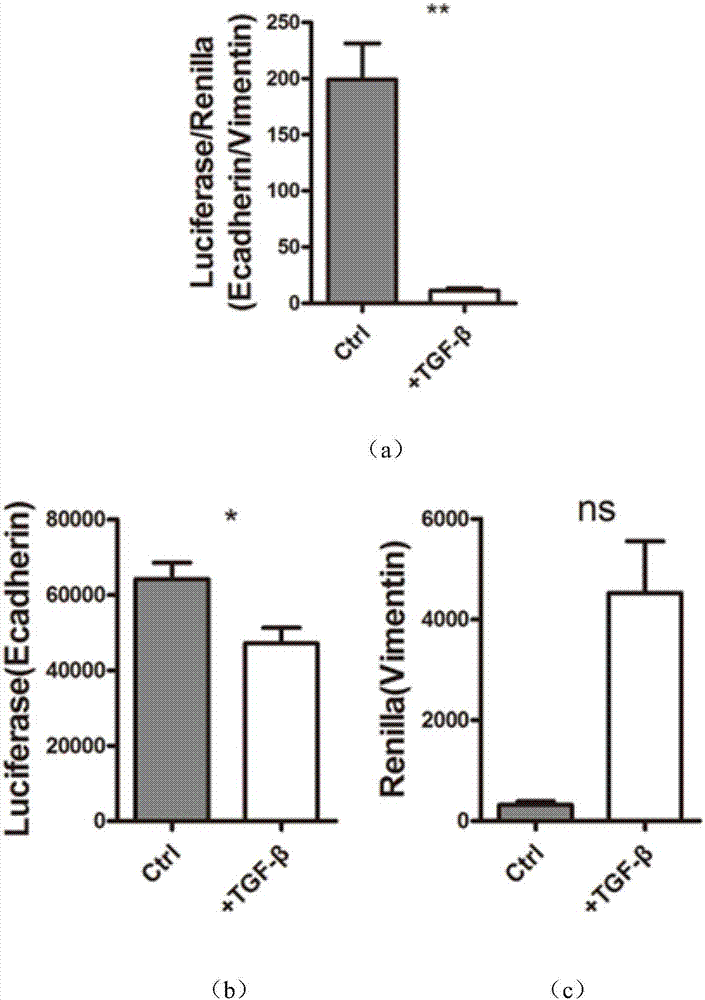
图2:利用TGF-β验证双化学发光报告系统有效性结果图;其中,图2a为添加TGF-β后luciferase(Ecadherin)与Renilla luciferase(Vimentin)的比值升高;图2b为添加TGF-β后luciferase(Ecadherin)读数升高;图2c为添加TGF-β后Renilla luciferase(Vimentin)读数降低;
图3:小分子化合物库筛选结果;
图4:小分子化合物浓度依赖结果;
图5:小分子化合物浓度依赖结果;
图6:离子泵抑制剂检测结果;
图7:兰索拉唑划痕实验结果;其中,图7a为对照组DMSO划痕0h时;图7b为对照组DMSO划痕24h时;图7c为对照组DMSO划痕40h时;图7d为实验组兰索拉唑划痕0h时;图7e为实验组兰索拉唑划痕24h时;图7f为实验组兰索拉唑划痕40h时;图7g为对照组实验组细胞迁移面积统计结果;
图8:兰索拉唑transwell实验结果;其中,图8a为对照组DMSO的细胞24h后在10倍物镜下细胞迁移情况;图8b为对照组DMSO的细胞24h后在20倍物镜下细胞迁移情况;图8c为实验组兰索拉唑的细胞24h后在10倍物镜下细胞迁移情况;图8d为实验组兰索拉唑的细胞24h后在20倍物镜下细胞迁移情况;图8e为对照组DMSO以及实验组兰索拉唑的细胞在24h后迁移细胞数量统计;
图9:兰索拉唑成球实验结果;其中,图9a为对照组DMSO在4倍物镜下成球效果;图9b为对照组DMSO在20倍物镜下成球效果;图9c为实验组兰索拉唑在4倍物镜下成球效果;图9d为实验组兰索拉唑在20倍物镜下成球效果;图9e为对照组实验组成球数量统计结果;
其中,***表示p<0.001,**表示p<0.01,*表示p<0.05,实验结果表示为平均值±S.E.M。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变化和改进。这些都属于本发明的保护范围。
实施例1
实验材料与设备:PC3细胞系(CRL-1435TM),(Cat no114-07),双化学发光报告系统(pLenti-EcadPm-mCherry-PA-Spacer-VimPm-eGFP-PA-hPKG-Puro),小分子化合物库(陶素)。
实验步骤:
1.转染双化学发光系统并验证工作效率
1.1将人前列腺癌细胞系PC3单细胞悬液均匀接种到六孔板中,待细胞生长至密度为80%左右时,用(Cat no114-07)转染试剂将双荧光报告系统pLenti-EcadPm-mCherry-PA-Spacer-VimPm-eGFP-PA-hPKG-Puro(图1)转染到PC3细胞中,具体转染方法参考转染试剂操作说明。
1.2转染72小时后,显微镜下观察细胞状态,细胞状态良好时在培养基中添加1ug/ml的嘌呤霉素进行细胞筛选。
1.3嘌呤霉素筛选48小时后,细胞状态稳定,待细胞生长至密度为90%时,用胰酶消化成单细胞悬液,并均匀接种至24孔板中。待细胞贴壁完全,向已转染双荧光与双化学发光系统的细胞中加100ng/ml TGF-β,使得细胞发生EMT,并在TGF-β处理72小时后进行化学发光检测luciferase与Renilla信号比值(图2),不经过TGFβ处理组为对照组Ctrl。
2.稳转细胞系筛选小分子化合物库
2.1采用稳转了双化学发光报告系统的PC3细胞系(即经步骤1.3中的嘌呤霉素筛选48小时后,细胞状态稳定),待细胞生长至密度为90%时,用胰酶消化成单细胞悬液,,按1000个细胞/孔的密度接种至化学发光检测特殊的96孔板(Fluidx,66-42049-L)中。小分子药物库中每种化合物单个设为一个实验组,每个实验组设立3个副孔,每块96孔板设立一个阴性对照组(添加溶剂DMSO),一个阳性对照组(添加100ng/ml TGF-β)。
2.2实验组化合物浓度为10μM,每三天换一次培养基,化合物处理7天后,检测并分析数据。
2.3CCK8检测每组细胞数量变化。每个孔板去除上清,用PBS洗一遍。弃去PBS后,添加100ul完全培养基,并按每100ul培养基10ul CCK8试剂的标准添加CCK8(同仁,cck8-kit,CK08)。37℃培养箱作用2小时,酶标仪在450nm波长检测吸收光强度。
2.4弃去cck8作用液,用PBS洗两遍,使得没有颜色干扰。弃掉PBS后,使用Promega ONE-GloTMluciferase assay system(E6110)进行化学发光的检测。具体转染方法参考Promega公司ONE-GloTMluciferase assay system检测试剂操作说明。检测仪器:Promega公司Discover System,软件程序为仪器自带的ONE-GloTMluciferase assay system检测体系。
2.5分析结果。用CCK8试剂盒检测到的吸光值代表每个组中细胞数量,luciferase读数代表每个组细胞的Ecadherin的表达水平。用吸光数值平均化每个孔之间细胞数量带来的luciferase读数差异,从而通过luciferase读数的高低来判断该化合物是否使细胞的Ecadherin的表达量发生变化。结果显示,TGF-β能促进细胞发生EMT,即使得luciferase/cck8的读数降低。结果如图3。
2.6挑选出使得luciferase/cck8读数升高的化合物后,设置更多的浓度梯度,检测化合物使得细胞发生MET是否是浓度依赖。具体实验操作同步骤1)-5),浓度梯度为10μM,1μM,100nM。结果如图4,luciferase/cck8的读数随着浓度的升高而升高。
2.7挑选出浓度依赖效果明显,luciferase/cck8比值升高明显的化合物,扩大浓度梯度,具体实验操作同步骤1)-5),浓度梯度为10μM,5μM,1μM,100nM,20nM。结果如图5,其中有三个化合物在扩大浓度梯度后浓度依赖的效果十分良好。且其中第六号化合物即是离子泵抑制剂之一兰索拉唑的luciferase/cck8的读数随着浓度的升高而升高。
2.8分析化合物类型,发现离子泵抑制剂兰索拉唑lansoprazole效果良好。购买其他剩余种类的离子泵抑制剂,采用双化学发光报告系统并用相同方法检测离子泵抑制剂是否能使得细胞发生MET。结果见图6,离子泵抑制剂能使得细胞luciferase/cck8的读数升高。
3.离子泵抑制剂生物学功能验证
挑选离子泵抑制剂中的兰索拉唑(Lansoprazole)进行生物学功能验证
3.1划痕实验Wound healing assay
将前述步骤1制备的PC3单细胞悬液按1*105密度均匀接种至六孔板中,待细胞生长至密为100%时,用不含血清的DMEM培养基培养过夜。24小时后,用200ul枪头划出直线,形成伤口。弃去含有漂浮细胞的培养液,添加含有10μM兰索拉唑的无血清DMEM培养基,在0小时,24小时,48小时拍照观察伤口愈合程度。图片用Image J进行未愈合面积计算。结果如图7,添加兰索拉唑化合物后,使得伤口愈合速度减慢,即细胞的迁移能力降低。
3.2 Transwell实验
将前述步骤1制备的PC3细胞饥饿处理24小时排除细胞增长的影响后,消化成单细胞,用不含血清的DMEM培养基重悬成密度为1*106的单细胞悬液。Transwell孔中添加500ul含10%FBS的DMEM培养基,并在每个transewell小室添加100ul PC3细胞悬液。37℃培养,24小时后取出小室,弃去小室中的培养基,放入4%多聚甲醛中固定15min。PBS涮洗数次,用棉签轻轻拭去小室内层可能残留的细胞,并将小室置于结晶紫中染色20min。PBS涮洗数次,用棉签轻轻擦去多余结晶紫染料及PBS。待小室晾干后,在显微镜下观察并记录细胞数量。结果如图8。添加兰索拉唑化合物后,迁移至小室下层的细胞数量减少,细胞的迁移能力降低。
3.3成球实验
将前述步骤1制备的PC3细胞消化成单细胞,细胞计数后,按1000个细胞/孔的密度与Matrigel(BD Growth Factor Reduced Matrigel,354230)1:1混合均匀,体积为200ul,沿孔板壁添加。放入培养箱中固定,2小时后添加培养基。3天换一次培养基,处理7天后拍照并统计成球数量。培养基为:DMEM/F12,2%B27,EGF,FGF。结果如图9。添加兰索拉唑化合物后,成球数量大小明显减少,细胞转变成上皮表型干细胞样特性减少。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变化或修改,这并不影响本发明的实质内容。在不冲突的情况下,本申请的实施例和实施例中的特征可以任意相互组合。
- 还没有人留言评论。精彩留言会获得点赞!