Nemo样蛋白激酶在制备治疗Ⅱ型糖尿病药物中的应用的制作方法
本发明属于基因的功能与应用领域,涉及以nemo样蛋白激酶(nemolikekinase,nlk)作为药物靶标在筛选治疗ⅱ型糖尿病药物中的应用,以及nlk的抑制剂在制备治疗ⅱ型糖尿病的药物中的应用。
背景技术:
糖尿病是一种由多病因引起的以慢性高血糖和高胰岛素为特征的终身性代谢性疾病。糖尿病会导致多种并发性疾病的发生,严重威胁患者的生命健康。目前糖尿病的死亡率仅次于心脑血管疾病和癌症,据世界卫生组织统计,糖尿病的并发症高达100多种,包括心血管疾病,中风,肾病等。因糖尿病截肢的患者是非糖尿病的10~20倍。临床数据显示,糖尿病发病后10年左右,将有30%~40%的患者至少会发生一种并发症,后期的药物治疗很难逆转,因此预防和及早治疗糖尿病是避免糖尿病并发症的发生最佳方法。
肝脏是调控糖、脂肪和蛋白质三大代谢的中心,三大能量代谢物质需要在肝脏中加工处理才能为机体利用。三大代谢紊乱,尤其是糖和脂肪代谢紊乱直接影响ii型糖尿病的发生发展。肝脏是调节血糖稳态平衡的重要场所,当血糖浓度升高时,肝脏摄取血液中的葡萄糖促进糖原合成和脂肪转换从而降低血糖;相反,当血糖浓度降低时,促进糖原分解和糖质新生,生成的葡萄糖运输到血液中,从而保持血糖稳态。
目前ii型糖尿病的病因和发病机制尚未研究清楚,因此缺乏针对病因的有效治疗手段。国际糖尿病联盟(idf)提出了糖尿病现代治疗的五个要点,分别是:饮食控制、运动疗法、血糖监测、药物治疗和糖尿病教育。口服降糖药在ii型糖尿病的药物治疗市场上占有很大比例。根据药物靶向性不同,临床使用的抗糖尿病药物主要分为两类,靶向外周器官(胰腺,肌肉,小肠等)和靶向肝脏组织药物,常用的药物有胰岛素、二甲双胍、及近来上市的噻唑烷二酮类药物、α-葡糖苷酶抑制剂等。这些药物虽然具有良好的疗效,但是长期服用会引发体重增加,肝脏毒性、心血管疾病、癌症等诸多副作用。
nemo样蛋白激酶(nemo-likekinase,nlk)是一个进化上非常保守的丝氨酸/苏氨酸蛋白激酶[1]。哺乳动物的nlk蛋白可以磷酸化多个转录因子密切相关(tcf/tef、foxo、notch1等),调节生物体早期胚胎发育过程[2-4]。近些年的研究表明nlk还与肿瘤的发生和发展[5],脂肪生成[6]及造血功能[7]等多种生命过程密切相关。近期,有研究表明nlk在tnfα诱导的nf-κb激活中发挥负调节作用,nlk通过与ikk复合物相互作用,抑制tak1招募ikkβ,从而抑制tnfα介导的炎症反应[8]。但nlk与ii型糖尿病之间的关系目前暂未见报道。
参考文献:
[1]t.ishitani,s.ishitani,nemo-likekinase,amultifacetedcellsignalingregulator,cellsignal,2013,25:190-197.
[2]s.ota,s.ishitani,n.shimizu,k.matsumoto,m.itoh,t.ishitani,nlkpositivelyregulateswnt/beta-cateninsignallingbyphosphorylatinglef1inneuralprogenitorcells,emboj,2012,31:1904-1915.
[3]h.kojima,t.sasaki,t.ishitani,s.iemura,h.zhao,s.kaneko,h.kunimoto,t.natsume,k.matsumoto,k.nakajima,stat3regulatesnemo-likekinasebymediatingitsinteractionwithil-6-stimulatedtgfbeta-activatedkinase1forstat3ser-727phosphorylation,procnatlacadsciusa,2005,102:4524-4529.
[4]t.ishitani,t.hirao,m.suzuki,m.isoda,s.ishitani,k.harigaya,m.kitagawa,k.matsumoto,m.itoh,nemo-likekinasesuppressesnotchsignallingbyinterferingwithformationofthenotchactivetranscriptionalcomplex,natcellbiol,2010,12:278-285.
[5]y.huang,y.yang,y.he,j.li,theemergingroleofnemo-likekinase(nlk)intheregulationofcancers,tumourbiol,2015,36:9147-9152.
[6]p.supakankul,s.mekchay,associationofnlkpolymorphismswithintramuscularfatcontentandfattyacidcompositiontraitsinpigs,meatsci,2016,118:61-65.
[7]m.kortenjann,m.nehls,a.j.smith,r.carsetti,j.schuler,g.kohler,t.boehm,abnormalbonemarrowstromainmicedeficientfornemo-likekinase,nlk,eurjimmunol,2001,31:3580-3587.
[8]s.z.li,h.h.zhang,j.b.liang,y.song,b.x.jin,n.n.xing,g.c.fan,r.l.du,x.d.zhang,nemo-likekinase(nlk)negativelyregulatesnf-kappabactivitythroughdisruptingtheinteractionoftak1withikkbeta,biochimbiophysacta,2014,1843:1365-1372.
技术实现要素:
为解决上述现有技术的缺陷和不足,本发明的目的在于研究nlk基因的表达与ⅱ型糖尿病之间的相关性,提供一个通过靶向nlk基因调控血糖的新策略,进而把nlk基因应用于ⅱ型糖尿病的治疗。
本发明的目的通过以下技术方案实现:
本发明首先以野生型c57小鼠为研究对象,发现nlk蛋白在高葡萄糖刺激下表达增强,表明nlk蛋白是葡萄糖响应蛋白。
同时,本发明以nlk基因肝脏特异性敲除小鼠(nlk-hko)和同窝阴性对照鼠为实验对象,通过检测腹腔葡萄糖耐受、肝脏糖元储存及胰岛素敏感性来研究nlk基因对血液葡萄糖的调控作用。结果发现与野生型wt小鼠对比,在生理状态下nlk基因敲除小鼠葡萄糖耐受能力显著增强,肝脏糖元储存增多,糖元合成被促进,胰岛素敏感性增加。因此,nlk可以作为ⅱ型糖尿病治疗的潜在靶标。
在此基础上,本发明第一方面,提供nemo样蛋白激酶作为药物靶标在筛选预防、缓解和/或治疗ⅱ型糖尿病的药物中的应用。
本发明第二方面,提供nemo样蛋白激酶的抑制剂在制备预防、缓解和/或治疗ⅱ型糖尿病的药物中的应用。
优选的,所述nemo样蛋白激酶的抑制剂是抑制nemo样蛋白激酶蛋白质活性或蛋白质水平的抑制剂、或者抑制nemo样蛋白激酶的mrna水平的抑制剂,其抑制活性是可逆的或不可逆的。
优选的,所述抑制nemo样蛋白激酶蛋白质活性或蛋白质水平的抑制剂包括nemo样蛋白激酶的抗体、抑制nemo样蛋白激酶蛋白质活性或蛋白质水平的蛋白质、多肽、酶、天然化合物、合成化合物、有机物、无机物;所述抑制nemo样蛋白激酶蛋白质活性或蛋白质水平的抑制剂是指可以结合nemo样蛋白激酶但在结合时不产生生物应答的物质,或者所述抑制剂可以阻断、抑制或减弱由激动剂介导的应答,并可与激动剂竞争结合nemo样蛋白激酶。
优选的,所述nemo样蛋白激酶的抗体包括但不限于单克隆抗体、合成抗体、多克隆抗体、多特异性抗体、人抗体、人源化抗体、嵌合抗体、单链fv(scfv)(包括双特异性scfv)、单链抗体、fab片段、f(ab')片段、二硫键连接的fv(sdfv)和任何上述的表位结合片段。特别地,用于本发明的抗体包括免疫球蛋白分子和免疫球蛋白分子的免疫活性部分。用于本发明的免疫球蛋白分子可以是免疫球蛋白分子的任何类型(例如,igg、ige、igm、igd、iga和igy)、类别(例如,igg1、igg2、igg3、igg4、iga1和iga2)或亚类。优选地,抗体是人或人源化单克隆抗体。
如本文所用,“人”抗体包括具有人免疫球蛋白的氨基酸序列的抗体,并且包括从人免疫球蛋白文库或从由人基因表达抗体的小鼠或其它动物分离的抗体。
优选的,抑制nemo样蛋白激酶的mrna水平的抑制剂可以是其反义核酸序列、sirna、mirna、shrna、dsrna,或者其它能够抑制nemo样蛋白激酶的mrna水平的蛋白质、多肽、酶、化合物。
本发明药物的剂型可以是口服剂的形式,例如片剂、胶囊、丸剂、粉剂、颗粒剂、悬浮剂、糖浆剂等;也可以是注射给药的剂型,例如注射液、粉针剂等,通过静脉内、腹膜内、皮下或肌肉内的途径。所有使用的剂型形式都是药学领域普通技术人员所熟知的。
本发明的药物可施用于会发生或已经发脂肪肝及相关疾病的任何动物。这些动物包括人类和非人类的动物,例如宠物或牲畜等。
本发明的药物可以本领域已知的途径施用于受试者,包括但不限于口服,胃肠外,皮下,肌内,静脉内,腹腔内,肝内,心肌内,肾内,阴道,直肠,颊,舌下,鼻内,透皮方式等。
施用的剂量将取决于接受者的年龄、健康和体重,联用药物的种类,治疗频率,给药途径等。药物可以单一日剂量施用,或者总日剂量以每天两次,三次或四次的分开剂量施用。剂量可以施用一次或多次,施药时间可以单日至几个月或更长时间。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明发现nlk的新功能,即nlk具有降糖的作用。
(2)基于nlk降糖过程中的功能,其为研制预防、缓解和/或治疗ⅱ型糖尿病的药物提供靶标。
(3)nlk的抑制剂可用于制备预防、缓解和/或治疗ⅱ型糖尿病的药物。
附图说明
图1是葡萄糖诱导后nlk蛋白表达结果图。
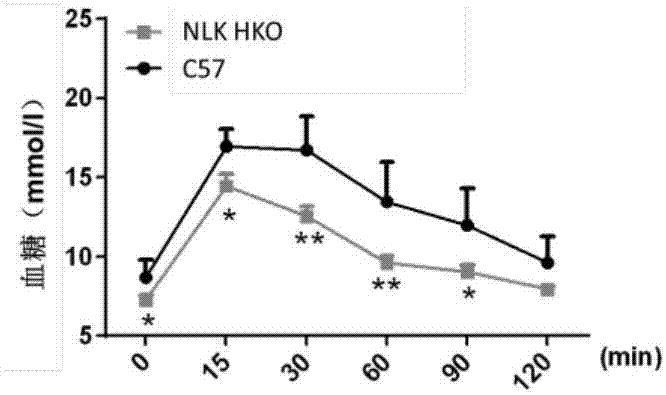
图2是wt和nlk-hko小鼠ipgtt检测结果(*:0.01≤p<0.05,**:p<0.01)。
图3是wt和nlk-hko小鼠ipgtt的auc统计结果(**:p<0.01)。
图4是wt和nlk-hko小鼠肝脏组织pas染色结果。
图5是胰岛素刺激wt和nlk-hko肝组织胰岛素信号通路激活检测结果。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
本发明中的试验所涉及的试剂在国内外市场购买,或按照说明书中的配方自行配制;未做特殊说明的实验方法都是采用本领域已知的常规方法。
实验用动物及饲养:
实验动物种属,性别,周龄及来源:c57bl/6(wt)小鼠和肝细胞特异性nlk基因敲除小鼠(nlk-hko),雄性,8周龄。c57bl/6小鼠购自北京华阜康生物科技有限公司;nlk-hko小鼠由nlk-flox/flox(由中国医学科学院基础医学研究所王琳芳院士实验室馈赠)与alb-cre工具鼠交配得到。
实验动物饲料配方:高糖饲料(购自南通特洛菲饲料科技有限公司):热量百分比:蛋白质(20%);碳水化合物(70%);脂肪(10%),总的热量质量比:3.85kcal/g。
动物饲养及环境条件:所有的实验小鼠均饲养在武汉大学心血管病研究所spf级动物房(许可证号:syxk(鄂):2009-0053)。每12小时交替照明,温度24±2℃,湿度40%-70%,小鼠自由饮水进食。
westernblot:
(1)组织蛋白提取
①向于干冰中预冷的ep管中放入3-4颗钢珠,并加入称重定量之后的组织样本。
②向裂解液中加入pmsf,混匀后加至样品中,迅速摇匀。
③于-80℃预冷研磨仪适配器中研磨样品,研磨参数设置为30hz/s,90s。
④研磨结束后,冰上放置10min,取出钢珠。
⑤超声裂解仪裂解样本(5khz/次,每次1s,间隔1s,重复10次),超声完成后冰上放置10min。
⑥样本放入4℃预冷的离心机中,12000rpm/min离心30min。
⑦吸取上清转移到新的ep管中,4℃,14000rpm/min离心10min。
⑧吸取上清转移到新的ep管中继续离心,4℃,14000rpm/min离心5min。
⑨准确吸取上清液并利用bcaproteinassaykit(pierectm,23225)进行蛋白定量。
(2)细胞中蛋白提取
细胞加入裂解液,裂解完成后离心取上清,运用bcaproteinassaykit定量收集蛋白样品。
(3)上样与电泳
根据目的蛋白大小选择需要的分离胶浓度,一般8%-10%的分离胶可满足大部分实验需求。配置好电泳凝胶,并在电泳槽内加入电泳液。把蛋白样品上样到sds-page胶加样孔内,点样完成后开始电泳。
(4)转膜
配制转膜液,提前预冷;pvdf膜使用前用甲醇浸泡1-2min;转膜,胶在负极侧,膜在正极侧,海绵、滤纸提前浸泡。转膜电压设为250v,电流设为0.2a,转移1.5h。
(5)封闭
把蛋白膜放置到预先准备好的tbst中,洗去膜上的转膜液。蛋白膜放入5%脱脂奶粉(intbst)中,在摇床上缓慢摇动,室温封闭1-4h。
(6)一抗孵育
封闭结束后用tbst洗涤蛋白膜3次,每次5min,加一抗,4℃孵育过夜。
(7)二抗孵育
一抗孵育后膜用tbst洗3遍,每次5min,加一定比例二抗(intbst)室温孵育1h。
(8)蛋白检测
孵育后用tbst洗涤3次,每次5min。利用bio-radchemidocxrs+凝胶成像系统检测目的条带。
【实施例1】葡萄糖激活nlk表达
实验动物分组:将c57bl/6小鼠从下午5:00至第二天早上9:00间禁食(不禁水),即禁食16h后开始实验操作。按操作分为三组,分别为fasted组(禁食16h);refeed组(禁食16h后,高糖饲料再喂养6h);i.p.glucose组(不禁食,按2g/kg量腹腔注射葡萄糖15min)。
肝脏组织取材:
(1)小鼠称重后,迅速脱颈处死。仰卧固定小鼠,用蒸馏水将小鼠胸部,腹部毛发润湿。
(2)用镊子钳夹小鼠腹部正中皮肤,沿腹部正中向头部剪开皮肤至剑突下,向尾端剪开皮肤,逐层暴露皮下筋膜,肌肉等,打开腹腔,充分暴露各脏器。
(3)迅速找到并取下小鼠的肝脏,将取下的肝脏标本置于灭菌纱布上,拭干肝脏表面上残留血液,将肝脏置于无菌培养皿中,剪碎,置于液氮中速冻。
nlk表达检测:取3组小鼠肝脏组织,westernblot检测肝脏组织中nlk蛋白含量。其中所用一抗信息为:(nlk(#94350,cst),gapdh(#2118,cst)),二抗为:peroxidaseaffinipuregoatanti-rabbit-igg(h+l)(#111-035-003)
检测结果如图1所示,refeed组与i.p.glucose组nlk蛋白表达量较fasted组显著增加,说明nlk蛋白在高葡萄糖刺激下表达增强,表明nlk蛋白是葡萄糖响应蛋白。
【实施例2】nlk基因敲除抑制ⅱ型糖尿病的发生发展
选用8周龄,雄性,wt小鼠和nlk-hko小鼠进行实验。实验小鼠分为2组,给以普通饮食饲养。在实验第9周,通过注射1.0g/kg体重的葡萄糖,进行葡萄糖耐量(intraperitonealglucosetolerancetest,ipgtt)实验,评价小鼠机体对糖耐受能力。在第10周,终末取材,取出小鼠肝脏,一部分置于甲醛溶液中固定作为病理分析用,另一部分速冻于液氮中,用于westernblot检测。
1、葡萄糖耐量实验(intraperitonealglucosetolerancetest,ipgtt)
将所有待实验的小鼠从下午5:00至第二天早上9:00间禁食(不禁水),即禁食16h后开始实验操作。
(1)在测血糖之前,先测量小鼠的空腹体重,根据10μl/g计算葡萄糖的注射体积。
(2)先检测葡萄糖注射前即0min时空腹血糖,在检测完毕后迅速经腹腔注射葡萄糖溶液。
(3)腹腔注射操作方法:a.固定小鼠;抓起小鼠,左手的小指和无名指抓小鼠的尾巴,另三手指抓住小鼠的颈部,使小鼠的头部向下,将小鼠腹部充分暴露。b.进针定位及注射:从腹部一侧进针右手持注射器,将尖端与小鼠腹部成45°的夹角,进针,回抽,注射时针头在腹部皮下穿行一小段距离,穿过腹中线后在腹部另一侧进入腹腔,注射完药物后,缓缓拔出针头,并轻微旋转针头,防止漏液。
(4)分别于腹腔注射后的15min、30min、60min、90min、120min时间点剪尾测小鼠血糖值,并记录血糖数值和检测时间。
2、小鼠血糖水平测定
(1)血糖仪准备:检查血糖仪(美国强生公司,onetouch)电池,按右侧开关,将试纸正确放入左侧插槽,屏幕显示与血糖试纸条相应代码的数字,随后显示滴血图案,提示血糖仪进入待测状态。
(2)固定小鼠:右手抓鼠尾,左手持一块毛巾,将毛巾对折,用拇指和食指捏住毛巾对折处,将鼠头部和身体包入手掌内的毛巾,拇指和食指在将鼠尾根部固定。
(3)剪尾:眼科剪迅速在距鼠尾末端0.1-0.2cm处剪下鼠尾,待血滴自行流出。
(4)血糖检测:将血糖仪试纸边缘轻触血滴,血液浸入试纸,血糖仪倒计时5秒显示读数。
3、肝脏中糖原含量测定(pas染色)
1)肝脏脱水,透明,浸蜡
切取10%中性福尔马林中固定好的部分肝叶组织于标记的包埋框内,在小流量流水冲洗30分钟以上。按照以下流程在机器上设置以下程序,①脱水:75%酒精(45分钟)→75%酒精(45分钟)→85%酒精(45分钟)→85%酒精(45分钟)→95%酒精(45分钟)→95%酒精(45分钟)→无水酒精(1小时)→无水酒精(1小时);②透明:二甲苯(1小时)→二甲苯(1小时);③浸腊(65℃):石蜡(1小时)→石蜡(1小时)。待组织冲洗完毕后,将包含组织的包埋框装进机器篮筐内,启动上述程序。上述程序完成后,取出组织包埋框送病理室包埋组织,同时清洗机器备用。
2)肝糖原pas染色
使用切片机切片(切片厚度5μm)→切片烘片60min→二甲苯脱蜡8min×3→水合100%、95%、70%酒精各5min→ddh2o洗,入0.5%过碘酸溶液5-10分钟→蒸馏水洗,70%酒精洗,入schiff试剂15-30分钟→流水洗10分钟→苏木素染色(淡染)2-3分钟→氨水返蓝30秒→自来水冲洗1分钟→70%放一下→95%放一下→100%酒精30s×3→二甲苯透明2min×3→封片→拍照。
4、胰岛素信号转导通路活性检测
wt及nlkhko小鼠正常饮食饲养10w,通过腹腔注射0.75u/kg胰岛素,完成后取肝脏组织,利用westernblot检测肝脏组织中胰岛素信号转导通路相关蛋白含量。其中所用一抗信息为:p-aktser473(#4060),p-aktthr308(#2965),akt(#4691),p-gsk3β(#9322),gsk3β(#9315),p-mtorser2448(#2971),mtor(#2983),β-actin(#4970),均购自cst。
二抗为:peroxidaseaffinipuregoatanti-rabbit-igg(h+l)(#111-035-003)以及goatanti-mouse-igg(h+l)(#115-035-003),购自jacksonlaboratory。
葡萄糖耐量实验检测结果如图2、3所示,在注射葡萄糖后,wt小鼠和nlk-hko小鼠的血糖水平在15min后剧增达到峰值,随着时间推移至注射后60min,两组小鼠血糖水平缓慢下降,但仍处于高于空腹血糖水平(0min时血糖),在120min时恢复至空腹血糖水平,且wt小鼠血糖水平从0min至120min一直处于高于nlk-hko小鼠的血糖水平(图2)。比较两组小鼠血糖曲线下面积(areaunderthecurve,auc),发现wt小鼠的auc显著高于nlk-hko小鼠(图3),表明nlk基因敲除增强小鼠葡萄糖耐受。
肝脏pas染色结果如图4所示,在nlk-hko小鼠切片中pas染色着色程度显著强于wt小鼠,表明nlk基因敲除小鼠肝组织中糖原累积显著增多,nlk基因对肝脏组织的糖元储存具有抑制作用。
胰岛素信号转导通路活性检测结果如图5所示,相比于wt组,nlk-hko小鼠akt及gsk3β的磷酸化水平显著增加,即nlk基因敲除后胰岛素信号转导通路活性增强,nlk基因具有抑制胰岛素信号通路的功能。
上述结果显示相比于wt小鼠,nlk-hko小鼠在高糖饮食下,葡萄糖耐受增强,肝脏糖元贮存量增加,胰岛素信号通路激活增强,及nlk基因敲除抑制了ⅱ型糖尿病的发生发展。本发明结果说明nlk基因在ⅱ型糖尿病疾病中有着重要的恶化作用,抑制nlk基因的表达及降低nlk蛋白含量可抑制ⅱ型糖尿病的发生。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!