脂质体组合物、其制备方法及其应用与流程
本发明涉及一种可用于药物传递的脂质体组合物、其制备方法及其应用。
技术背景
脂质体(liposome),由磷脂或其他类脂化合物形成的具有双分子层结构的封闭囊泡,是一种性质稳定、在血液循环中具有长效半衰期的非病毒载体。将抗肿瘤药物包封在脂质体中,不仅可以保护药物在进入病灶部位前免受机体酶的分解,延长药物循环时间,增加药物在病灶部位的浓度和作用时间,提高疗效,降低毒性;而且和其它传递系统相比,脂质体能够提供优越的生物相溶性、生物可降解性、低毒性、尺寸可控性及表面功能可修饰性。
硫酸长春新碱(vincristinesulfate,vcr)是夹竹桃科植物长春花生物碱类的细胞周期特异性抗肿瘤药物,抗肿瘤作用靶点是微管,主要抑制微管蛋白的聚合而影响纺锤体微管的形成,使有丝分裂停止于中期,虽然vcr抗肿瘤效果好,但vcr制剂体内代谢迅速、半衰期短、神经毒性大、胃肠道反应和骨髓抑制作用严重,vcr在临床上的应用受到限制。硫酸长春新碱的脂质体制剂传递药物的高效性,降低了硫酸长春新碱的毒副作用,增强了癌症的治疗效果,但脂质体制剂物理化学稳定性差,储存和应用过程中容易发生融合聚集,包封药物容易泄漏,难以抵抗体内的化学和生物的降解,因而也不适于制备尺寸较小的纳米颗粒。
因此,迫切需要改进脂质体制剂的稳定性,提高治疗效果。
技术实现要素:
本发明提供了一种脂质体组合物,其含有药物和脂质体,所述药物包裹在所述脂质体中,其中所述脂质体包括鞘磷脂、脂质体稳定剂、胆固醇类成分和聚阴离子化的有机化合物。
在本发明的优选的实施方式中,在所述脂质体组合物中,鞘磷脂与胆固醇的比可不同,但通常在75/25mol%/mol%鞘磷脂/胆固醇至30/50mol%/mol%鞘磷脂/胆固醇的范围内。在一个实施方式中,脂质体组合物包括约70/30mol%/mol%鞘磷脂/胆固醇至40/45mol%/mol%鞘磷脂/胆固醇。
在本发明的优选的实施方式中,在所述脂质体组合物中,所述鞘磷脂是神经鞘磷脂或鸡蛋鞘磷脂。
在本发明的优选的实施方式中,在所述脂质体组合物中,所述脂质体稳定剂选自n-(甲氧基-聚(乙二醇)-氧羰基)-二硬脂酰磷脂酰乙醇胺、二硬脂酰基磷脂酰乙醇胺-聚乙二醇、二肉豆蔻酰磷脂酰乙醇胺-聚乙二醇和磷脂酰乙醇胺-聚乙二醇中的一种或几种。
在本发明的优选的实施方式中,在所述脂质体组合物中,所述胆固醇类成分选自胆固醇及其衍生物、胆甾烷、胆酸和胆汁酸中的一种或几种。
在本发明的优选的实施方式中,在所述脂质体组合物中,所述聚阴离子化的有机化合物是聚阴离子化的多元醇或糖,该聚阴离子化的多元醇或糖是羟基基团被完全或部分修饰或被阴离子基团取代(阴离子化的)的多元醇或糖。因此,聚阴离子化的多元醇或聚阴离子化的糖包含多元醇部分或糖部分以及连接到其上的阴离子基团,优选的阴离子基团包括羧酸盐、碳酸盐、硫代碳酸盐、二硫代碳酸盐、磷酸盐、膦酸盐、硫酸盐、磺酸盐、硝酸盐和硼酸盐。优选地,聚阴离子化的糖或多元醇的至少一个阴离子基团是强阴离子基团,也就是说,当在含水介质中,在宽ph范围内,例如ph是3~12,优选ph是2~12,50%以上被离子化,或作为选择,解离常数的对数(pka)为3或更小,优选2或更小。
可以用本领域已知的各种化学方法对多元醇或糖进行聚阴离子化。例如,多元醇和/或糖与三氧化硫或氯磺酸在嘧啶或2-甲基吡啶中的反应导致一些或所有羟基基团被硫酸残基酯化(硫酸化),得到多硫酸化糖或多元醇。本发明优选的硫酸化糖是硫酸化的蔗糖,例如包括六硫酸蔗糖、五硫酸蔗糖和八硫酸蔗糖。
在本发明的优选的实施方式中,在所述脂质体组合物中,所述聚阴离子化的有机化合物是非聚合的聚阴离子化的有机羟基化的有机化合物,更优选是蔗糖八硫酸三乙胺。
在本发明的优选的实施方式中,在所述脂质体组合物中,所述药物是蒽环类抗生素化合物、喜树碱化合物、长春花碱、玫瑰树碱化合物、紫杉醇化合物、任何前述物质的衍生物、任何前述物质的前药和任何前述物质的类似物。
在本发明的优选的实施方式中,在所述脂质体组合物中,所述药物是硫酸长春新碱、长春碱、长春瑞滨、长春氟宁、长春西汀或长春酚胺。
本发明还提供了上述脂质体组合物的制备方法,包括:
a)将鞘磷脂、胆固醇类成分、磷脂稳定剂和聚阴离子化的有机化合物溶解在有机溶剂中制备空白脂质体;
b)使药物与所述空白脂质体混合,以制备包裹药物的脂质体组合物。
本发明的脂质体可以通过本领域已知或将会知道的任何方法制备。参见例如g.gregoriadis(编者),liposometechnology,vol.1-3,第1版,1983;第2版,1993,crc,press.bocaraton,fl。适宜制备本发明脂质体组合物的方法的例子包括挤出、反相蒸发、超声波、溶剂(例如乙醇)注射、微流化作用、洗涤剂透析、醚注射和脱水/再水合。
通过控制用于低压挤出的膜孔大小或用于微流化作用的压力或通过次数或任何其他适宜的方法可以控制脂质体的大小。例如在脂质体制备后,脂质体可参见us6,723,338的描述被设定尺寸以实现期望的颗粒尺寸范围。一般地,可用于本文的脂质体的尺寸范围为约0.05-0.5微米(50-500nm)、0.2-0.4微米(200-400nm)、约0.1-0.4微米(100-400nm)、约0.05-0.2(50-200nm)或约0.5(500nm)至约0.15微米(150nm)。在某些实施方式中,脂质体的颗粒尺寸的平均颗粒直径为约50nm、约60nm、约70nm、约80nm、约90nm、约100nm、约105nm、约110nm、约115nm、约120nm、约130nm、约140nm、约150nm、约160nm、170nm、约180nm、约190nm、或约200nm。在一个实施方式中,平均颗粒尺寸在90和125nm之间,而优选平均颗粒尺寸为约100nm,其中25%的颗粒尺寸分布不小于70nm并且其中90%的分布的颗粒尺寸不大于170nm。
在本发明的优选的实施方式中,在所述脂质体组合物中,所述脂质体的粒径为90~120nm。
在本发明的优选的实施方式中,本发明的脂质体组合物外部通常具有这样的ph,该ph适宜于或有助于在装载过程中维持期望实体的稳定性,以及高装载效率,例如90%以上的包载水平。例如,优选ph在ph5-9或ph5.5-8.5范围内。特别地,根据本发明,对于长春花碱衍生物,例如硫酸长春新碱、长春瑞滨、长春新碱、长春碱,最好在ph约6.0-8.0,更优选在ph约7.0下完成。
在本发明的优选的实施方式中,本发明的脂质体组合物可以作为药物组合物提供,例如含硫酸长春新碱的脂质体组合物,该脂质体组合物的稳定性显著提高,可以作为活性成分制备治疗和/或预防肿瘤的药物。优选的是,药物组合物含有本发明的脂质体组合物,和载体例如药学上可接受的载体。药学上可接受的载体的例子是生理盐水、等渗葡萄糖、等渗蔗糖、林格氏溶液和hanks'溶液。可以加入缓冲物质以提供获得保藏稳定性的最优ph。例如,约6.0至约7.5之间的ph。
附图说明
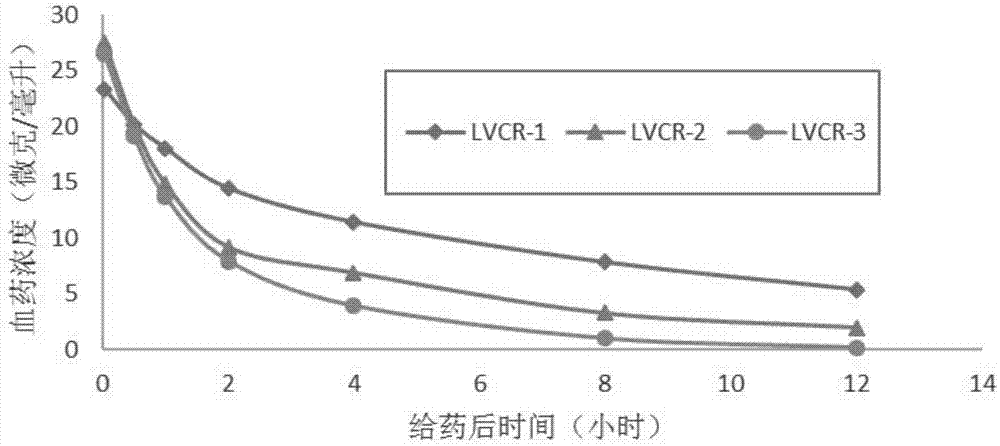
图1本发明硫酸长春新碱脂质体在大鼠体内的稳定性。
具体实施方式
实施例1
将神经鞘磷脂、胆固醇和n-(甲氧基-聚(乙二醇)-氧羰基)-二硬脂酰磷脂酰乙醇胺(peg-dspe)以55:45:0.02摩尔比共溶于氯仿,通过旋转蒸发去除氯仿,形成干燥脂膜。向其中加入浓度为0.8摩尔/升的蔗糖八硫酸三乙胺溶液,使磷脂的浓度为100mg/ml,60℃保温搅拌30分钟形成水化的磷脂溶液。该磷脂溶液在压力下反复被挤出通过孔径为100nm的聚碳酸酯膜至粒径100nm左右。通过超滤膜(
实施例2
将二硬脂酸磷脂酰胆碱脂、胆固醇和n-(甲氧基-聚(乙二醇)-氧羰基)-二硬脂酰磷脂酰乙醇胺(peg-dspe)以55:45:0.02摩尔比共溶于氯仿,通过旋转蒸发去除氯仿,形成干燥脂膜。向其中加入浓度为0.8摩尔/升的蔗糖八硫酸三乙胺溶液,使磷脂的浓度为100mg/ml,60℃保温搅拌30分钟形成水化的磷脂溶液。该磷脂溶液在压力下反复被挤出通过孔径为100nm的聚碳酸酯膜至粒径100nm左右。通过超滤膜(
实施例3
将神经鞘磷脂和胆固醇以55:45摩尔比共溶于氯仿,通过旋转蒸发去除氯仿,形成干燥脂膜。向其中加入浓度为0.3摩尔/升的枸橼酸/枸橼酸钠缓冲液(ph4.0),60℃保温搅拌30分钟形成水化的磷脂溶液。该磷脂溶液在压力下反复被挤出通过孔径为100nm的聚碳酸酯膜至粒径100nm左右,得到空白脂质体。以1mg硫酸长春新碱/20mg神经鞘磷脂的比例,将硫酸长春新碱溶液同空白脂质体混合,同时加入0.5摩尔/升磷酸二氢钠溶液调节ph至7.0-7.6,65℃温育30分钟得到包封后的硫酸长春新碱脂质体3(lvcr-3)。
实施例4
考察不同技术方案得到的样品体外稳定性,将实施例1、2、3得到的样品在15℃条件下存放,与不同时间点取出样品通过sepharosecl-4b(购自ge公司)凝胶柱分离脂质体包裹药物(dl)和游离药物(dc),hplc检测相应的药物浓度,计算包封率100*dl/(dl+dc),以考察样品的稳定性。如下表所示,本发明的硫酸长春新碱脂质体lvcr-1的稳定性大幅提升。
实施例5
脂质体在大鼠体内稳定性考察
将实施例1、2、3得到的硫酸长春新碱脂质体按照1mg/kg的剂量通过wistar大鼠尾静脉给药,分别于2min、30min、1h、2h、4h、8h和12h通过眼眶取血,分离血浆并提取血浆中的长春新碱,通过hplc检测血浆中硫酸长春新碱含量。结果如图1所示,半衰期分别为23.03h、17.85h和11.83h,auc分别为468.803、340.861和147.232mg/l*h,本发明的硫酸长春新碱脂质体lvcr-1的半衰期(t1/2)和曲线下面积(auc)均显著增加。
- 还没有人留言评论。精彩留言会获得点赞!