天然来源FFA4(GPR120)受体激动剂及其应用的制作方法
本发明属于医药技术领域,具体为gpr120激动剂领域,涉及天然植物中萘醌类化合物作用靶点的发现,具体上是萘醌类化合物中乙酰紫草素、黄钟花醌以及紫草素,以及含有乙酰紫草素和/或黄钟花醌和/或紫草素的紫草科植物提取物作用靶点的发现。所述的化合物为乙酰紫草素和/或黄钟花醌以及紫草素和/或者它们对应药学上可接受的盐、溶剂化物或多晶形物及药物组合物,以及含有乙酰紫草素和/或黄钟花醌和/或紫草素的紫草科植物提取物;所述的靶点为gpr120受体;所述的应用为非甾体消炎药诱发胃损伤、骨质酥松和克罗恩病等的治疗和预防。
技术背景
紫草科植物的干燥根有许多萘醌类化合物,且紫草萘醌类化合物为紫草的一类主要生物活性成分,具有抗炎、抗菌、抗癌,治疗肥胖、脂肪肝等多种作用,目前的关于紫草中此类化合物的研究多数集中在细胞水平或者动物水平,对于单一化合物在靶点水平研究机制的报道很少(詹志来,胡峻,刘谈,康利平,南铁贵,郭兰萍.紫草化学成分与药理活性研究进展[j].中国中药杂志,2015,40(21):4127-4135;suml,hey,liqs,etal.efficacyofacetylshikonininpreventingobesityandhepaticsteatosisindb/dbmice[j].molecules,2016,21(8):976;sum,huangw,zhub.acetylshikoninfromzicaopreventsobesityinratsonahigh-fatdietbyinhibitinglipidaccumulationandinducinglipolysis[j].plosone,2016,11(1):e0146884;cuil,yany,zhangm,etal.acetylshikoninsuppressesatherogenesisbyattenuatingvascularinflammationinapolipoproteine-deficientmice[j].internationaljournalofclinicalandexperimentalmedicine,2018,11(3):1882-1890.)
gpr120为一种g蛋白偶联受体,目前已经脱孤(属于脂肪酸类受体家族中的一员),也叫做游离脂肪酸受体4(ffa4)。其内源性配体为长链脂肪酸,如ala(α-亚麻酸)、epa(二十碳五烯酸)、dha(二十二碳六烯酸)等。gpr120受体在
脂肪、胰腺、肺以及结肠细胞中表达,其中人类结肠癌细胞ht29中高度表达该受体。研究表明gpr120受体与非甾体消炎药诱发胃损伤、骨质酥松和克罗恩病等疾病相关(kime,hany,kangjx,etal.omega-3polyunsaturatedfattyacidsprotectnsaid-inducedgastricinjurythroughgpr120dependentlipidraftpreservation[c]//journalofgastroenterologyandhepatology.111riverst,hoboken07030-5774,njusa:wiley-blackwell,2012,27:164-165;ahnsh,parksy,baekje,etal.freefattyacidreceptor4(gpr120)stimulatesboneformationandsuppressesboneresorptioninthepresenceofelevatedn-3fattyacidlevels[j].endocrinology,2016,157(7):2621-2635;tsukaharat,watanabek,hagiharay,etal.tu1689overexpressionofg-protein-coupledreceptors40and120intheilealmucosaofpatientswithcrohn'sdiseasecorrelateswithtnfalphaandincretinlevelsandclinicalparameters[j].gastroenterology,2013,144(5):s-822.)。目前文献报道的gpr120激动剂结构多样性较低,合成的激动剂主要有两大类,分别为含有羧基的母核结构以及含有磺酰亚胺的母核结构,而且已报道的天然来源的gpr120激动剂(除内源性配体)也很少。因此新型gpr120配体的发现不仅对于非甾体消炎药诱发胃损伤、骨质酥松和克罗恩病等疾病的治疗有潜在意义,而且还丰富了gpr120配体结构多样性,为今后新型高效gpr120配体研究提供参考。
目前关于紫草科萘醌类化合物乙酰紫草素、黄钟花醌以及紫草素,以及含有乙酰紫草素和/或黄钟花醌和/或紫草素的紫草科植物提取物作用于gpr120受体的内容尚未见报道。
技术实现要素:
本发明涉及一种ffa4(gpr120)受体激动剂及其应用,是关于一种来自天然植物萘醌类化合物作用靶点的发现,具体涉及乙酰紫草素、黄钟花醌以及紫草素的作用靶点的发现以及紫草提取物作用靶点的发现,涉及的作用靶点为一种g蛋白偶联受体gpr120,所述的gpr120受体涉及的药学上的应用可能为非甾体消炎药诱发胃损伤、骨质酥松和克罗恩病等疾病。
所述的gpr120,受体激动剂为萘醌类化合物和/或所述萘醌类化合物对应药学上可接受的盐、溶剂化物或多晶形物,和/或含有萘醌类化合物的紫草科植物提取物;
所述萘醌类化合物为乙酰紫草素、黄钟花醌、紫草素中的一种或两种以上。即所述的gpr120激动剂为乙酰紫草素、黄钟花醌以及紫草素和/或者它们对应药学上可接受的盐、溶剂化物或多晶形物。此外紫草提取物也显示出激动活性。
本发明所述的萘醌类化合物乙酰紫草素、黄钟花醌以及紫草素的化学结构如下,其中黄钟花醌的化学结构如式ⅰ,紫草素的化学结构如式ⅱ,乙酰紫草素的化学结构如式ⅲ:
所述的对应药学上可接受的盐是指对活生物体基本无毒的本发明化合物的盐,例如与盐酸、硫酸、磷酸等酸形成的盐,或者与氢氧化钠、氢氧化钾等碱形成的盐。
所述的溶剂化物是指通过溶剂化作用形成的本发明化合物与溶剂分子的组合,例如化合物与水的组合形成水合物。
所述的多晶形物是指以不同的晶格形式存在的本发明化合物。
一种药物组合物,包括上文所述的gpr120受体激动剂,其中还可添加药学上可接受的载体或赋形剂,对载体或赋形剂的选择不做限制,如:淀粉、氯化钠、微晶纤维素、山梨酸和/或甘露醇等。该组合物的给药方式可以是但不限于经静脉注射、口服、肌肉、皮下、皮肤表面、局部注射等方式给药,其剂型可以但不限于是注射液、冻干粉针剂、注射微球、脂质体、片剂、双层/多层片、口含片、舌下片、胶囊剂、水剂、散剂、糊剂、喷雾剂、颗粒剂、软胶囊、滴丸剂、凝胶剂、贴片、膏剂等,其中优选注射液、冻干粉针剂、片剂和胶囊剂。
所述的gpr120受体激动剂在制备预防和/或治疗非甾体消炎药诱发的胃损伤、骨质酥松和克罗恩病疾病的药物中的应用。
所述的gpr120受体激动剂中萘醌类化合物为紫草素和/或所述紫草素对应药学上可接受的盐、溶剂化物或多晶形物在制备预防和/或治疗非甾体消炎药诱发的胃损伤疾病药物中的应用。
所述的gpr120受体激动剂中萘醌类化合物为乙酰紫草素和/或黄钟花醌,和/或上述化合物对应药学上可接受的盐、溶剂化物或多晶形物在制备预防和/或治疗非甾体消炎药诱发胃损伤、骨质酥松和克罗恩病疾病药物中的应用。
所述的gpr120受体激动剂,还包括含有乙酰紫草素和/或黄钟花醌和/或紫草素的紫草科植物提取物和/或者含有上述的紫草科植物提取物对应药学上可接受的盐、溶剂化物或多晶形物。
所述的gpr120受体激动剂,还包括含有乙酰紫草素和/或黄钟花醌和/或紫草素的紫草科植物提取物对非甾体消炎药诱发胃损伤的预防或治疗作用,以及在制备非甾体消炎药诱发胃损伤药物中的应用。
本发明的技术方案为:利用无标记整合药理学技术epic测试所述物质的gpr120靶点活性。
本发明的有益效果:
体外细胞靶点测试实验表明,本发明的乙酰紫草素、黄钟花醌以及紫草及紫草提取物作用于gpr120受体,gpr120受体与非甾体消炎药诱发胃损伤、骨质酥松和克罗恩病等疾病相关,因此可以拓展此类物质在相关疾病的临床应用范围。
体外细胞靶点实验表明乙酰紫草素、黄钟花醌以及紫草素为gpr120的激动剂。体外细胞实验测试发现95%乙醇冷浸的紫草提取物进行也有gpr120激动活性。研究显示gpr120受体与非甾体消炎药诱发的胃损伤、骨质酥松和克罗恩病等疾病相关,因此所述的激动剂有着潜在的药用用途。而且据调研,所述的激动剂结构与目前文献发表的gpr120激动剂的母核结构完全不一样,因此还可为gpr120激动剂的设计提供新骨架,丰富结构多样性。
附图说明
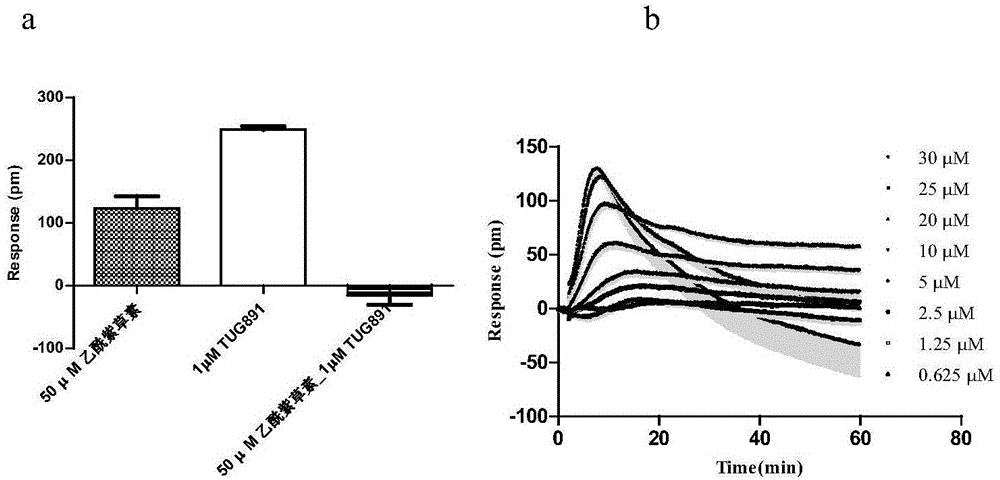
图1为实施例1乙酰紫草素在cho-gpr120细胞上的dmr响应;
其中,图1a为50μm乙酰紫草素、1μmtug891(一种商业的gpr120探针分子激动剂)、50μm乙酰紫草素预处理1h后1μmtug891在cho-gpr120上的60min内的最大dmr响应;图1b为不同浓度的乙酰紫草素在cho-gpr120细胞上的实时dmr响应曲线。
图2为实施例1中乙酰紫草素在cho-gpr120细胞上的dmr剂量响应曲线。
其中,图2a为乙酰紫草素、乙酰紫草素预处理1h后1μm的tug891在cho-gpr120细胞上的剂量响应曲线;图2b为不同浓的ah7614(种商业的gpr120探针分子拮抗剂剂)预处理1h后乙酰紫草素在cho-gpr120细胞上的dmr剂量响应曲线。
图3为实施例2乙酰紫草素在ht29细胞上的dmr响应;
其中,图3a为12.5μm乙酰紫草素、1μmtug891(一种商业的gpr120探针分子激动剂)、12.5μm乙酰紫草素预处理1h后1μmtug891在ht29上的60min内的最大dmr响应;图3b为不同浓度的乙酰紫草素在ht29细胞上的实时dmr响应曲线。
图4为实施例2中乙酰紫草素在ht29细胞上的dmr剂量响应曲线。
其中,图4a为乙酰紫草素、乙酰紫草素预处理1h后1μm的tug891在ht29细胞上的剂量响应曲线;图4b为不同浓的ah7614预处理1h后20μm乙酰紫草素在ht29细胞上的dmr剂量响应曲线。
图5为实施例3中新疆软紫草95%乙醇提取物在cho-gpr120细胞的dmr响应以(5a)及脱敏1μmtug891的dmr响应(5a)和被ah7614拮抗的dmr响应(5b)。
表1为乙酰紫草素、黄钟花醌以及紫草素在cho-grp120细胞上对于gpr120靶点的激动ec50列表。
具体实施方案
现结合实例(乙酰紫草素、黄钟花醌和紫草素以及紫草提取物),对本发明做进一步说明,实例仅限于说明本发明,而非对本发明的限定。
实施例1:在转染细胞cho-gpr120上,萘醌类化合物乙酰紫草素作用于gpr120靶点的发现。
转染细胞cho-gpr120的转染过程:首先将cho-k1细胞铺到10cm培养皿,5%co2和37℃培养18-24h,然后将进行gpr120瞬转,质粒和转染试剂lipo2000分别为8ug和24ul。瞬转24h后,换成含有600ug/mlzeocin的f12k+10%fbs培养基,每隔2-3天换液(液体为含有600ug/mlzeocin的f12k+10%fbs培养基),持续时间大概1个月。
探针分子激动剂tug891和拮抗剂ah7614购买于tocris公司。检测平台为康宁第三代epic成像仪,检测的信号为细胞动态质量重置(dmr)引起的波长位移。
将处于对数生长期的cho-gpr120细胞接种到epic配套的384微孔板中,每孔的细胞悬液体积为40μl,接种的密度为1.5×104个/孔,然后将接种好的384板置于细胞培养箱,在5%co2和37℃培养18-24h,当细胞融合度达到95%以上时,进行实验。
首先,分别实时监测50μm乙酰紫草素和1μmtug891在cho-gpr120细胞上引起的dmr信号,监测1h之后,然后在50μm乙酰紫草素对应的384孔中加入1μmtug891继续监测1h,以所检测的1h内最大响应的dmr信号作图,如图1a。tug891为已报道的高活性的gpr120激动剂,在此作为阳性对照比较乙酰紫草素的激动活性。结果表明,50μm乙酰紫草素在cho-gpr120引起的dmr响应为tug891(1μm)的49.5%,而细胞经过50μm乙酰紫草素预处理之后,再用1μmtug891处理,此时在cho-gpr120引起的信号为单独tug891处理时的-6.3%,说明tug891能使乙酰紫草素完全脱敏。综合表明乙酰紫草素和tug891可能作用于同一受体(gpr120受体),因此进一步对乙酰紫草素的激动活性进行了量效关系考察以及受体活性验证实验。
激动活性量效分析:将不同浓度的乙酰紫草素(30μm,25μm,20μm,10μm,5μm,2.5μm,1.25μm,0.625μm),加入接种cho-gpr120细胞的384板中,在epic仪器上监测1h,得到乙酰紫草素的实时dmr响应曲线(图1b)。结果表明乙酰紫草素引起的dmr响应呈剂量依赖关系,且dmr形状与tug891引起的dmr形状类似。乙酰紫草素的激动剂量曲线,取每个浓度(50μm,40μm,30μm,15μm,7.5μm,3.75μm,1.88μm)的乙酰紫草素在cho-gpr120细胞引起的最大响应值为纵坐标,浓度以10为底,取对数,拟合做出剂量曲线,其剂量响应曲线如图2a,得到它的ec50=10.50±3.91μm(表1)。另外两个化合物黄钟花醌和紫草素的激动剂量,操作过程同乙酰紫草素,所不同的是黄钟花醌的浓度为200μm,100μm,50μm,25μm,12.5μm,6.25μm,3.13μm,1.56μm,0.78μm,0.39μm,0.098μm,0.049μm,0.024μm,紫草素的浓度为200μm,66.67μm,22.22μm,7.41μm,2.47μm,0.82μm,0.27μm;由黄钟花醌和紫草素的激动剂量曲线,可得到它们的ec50值(表1)。
表1
受体活性验证实验:通过脱敏分析和拮抗分析,验证了乙酰紫草素对gpr120的激动活性。
脱敏分析:将不同浓度的乙酰紫草素加入(50μm,40μm,30μm,15μm,7.5μm,3.75μm,1.88μm),加入接种cho-gpr120细的384板中,在epic仪器上监测1h后,然后继续加入1μmtug891,再次监测1h,以乙酰紫草素浓度的对数剂量对1μmtug891的dmr响应作图,如图2a.从图可以看出,用乙酰紫草素单独处理时引起剂量依赖的dmr响应,当继续计入恒定浓度的tug891处理时,gpr120受体对tug891的敏感性降低,即呈现脱敏,而且乙酰紫草素浓度越高脱敏越明显,即有剂量依赖关系,其ic50=15.20±6.87μm,这表明乙酰紫草素和tug891作用与同一靶点(即gpr120)。
拮抗分析:目的为了进一步证明乙酰紫草素作用于gpr120靶点。将一组不同浓度的gpr120拮抗剂ah7614(20μm,6.67μm,2.22μm,0.74μm,0.25μm,0.082μm,0.027μm,0.0091μm,0.0030μm,0.0011μm,0.00034μm,0.00011μm,0.000038μm,0.000013μm)预处理cho-gpr120细胞,预处理1h,然后全部加入恒定浓度10μm乙酰紫草素继续监测1h,结果如图2b所示,用ah7614预处理后,ah7614能剂量依赖地降低乙酰紫草素的激动活性,其ic50=28.26±3.89nm。这进一步说明乙酰紫草素作用于gpr120靶点。
实施例2;除了转染细胞,还在内源表达gpr120的ht29细胞上进行乙酰紫草素gpr120靶点的验证实验。
ht29细胞购于中国科学院上海细胞库;探针分子激动剂拮抗剂,仍然使用tug891和ah7614,购买于tocris公司。检测平台为康宁第三代epic成像仪,检测的信号为细胞动态质量重置(dmr)引起的波长位移。
将处于对数生长期的ht29细胞接种到epic配套的384微孔板中,每孔的细胞悬液体积为40μl,接种的密度为3.2×104个/孔,然后将接种好的384板置于细胞培养箱,在5%co2和37℃培养18-24h,当细胞融合度达到95%以上时,进行实验。
首先,分别实时监测12.5μm乙酰紫草素和1μmtug891在ht29细胞上引起的dmr信号,监测1h之后,然后在12.5μm乙酰紫草素对应的384孔中加入1μmtug891继续监测1h,以所检测的1h内最大响应的dmr信号作图,如图3a。tug891为已报道的高活性的gpr120激动剂,在此作为阳性对照比较乙酰紫草素的激动活性。结果表明,12.5μm乙酰紫草素在ht29引起的dmr响应为tug891(1μm)的84.1%,而细胞经过12.5μm乙酰紫草素预处理之后,再用1μmtug891处理,此时在cho-gpr120引起的信号为单独tug891处理时的26.0%%,说明tug891能使乙酰紫草素脱敏。综合表明乙酰紫草素和tug891可能作用于同一受体(gpr120受体),因此也进一步对乙酰紫草素的激动活性进行了量效关系考察以及受体活性验证实验。
激动活性量效分析:将不同浓度的乙酰紫草素(12.5μm,6.25μm,3.125μm,1.5625μm,0.7813μm,0.3906μm),加入接种ht29细胞的384板中,在epic仪器上监测1h,得到乙酰紫草素的实时dmr响应曲线(图3b)。结果表明乙酰紫草素引起的dmr响应呈剂量依赖关系,其ec50=3.47±1.10μm
受体活性验证实验:通过脱敏分析和拮抗分析,验证了乙酰紫草素对gpr120的激动活性。
脱敏分析:将不同浓度的乙酰紫草素(50μm,3.13μm,1.56μm,0.78μm,0.39μm,0.19μm,0.10μm,0.048μm,0.024μm,0.012μm,0.0061μm),加入接种ht29细胞的384板中,在epic仪器上监测1h后,然后继续加入1μmtug891,再次监测1h,以乙酰紫草素浓度的对数剂量对1μmtug891的dmr响应作图,如图4a.从图可以看出,用乙酰紫草素单独处理时引起剂量依赖的dmr响应,当继续计入恒定浓度的tug891处理时,gpr120受体对tug891的敏感性降低,即呈现脱敏,而且乙酰紫草素浓度越高脱敏越明显,即有剂量依赖关系,其ic50=0.84±.11μm,这表明乙酰紫草素和tug891作用与同一靶点(即gpr120)。
拮抗分析:目的为了进一步证明乙酰紫草素作用于gpr120靶点。将一组不同浓度的gpr120拮抗剂ah7614(20μm,10μm,5μm,2.5μm,1.25μm,0.63μm,0.31μm,0.16μm,0.078μm,0.039μm,0.019μm,0.010μm,0.0049μm,0.0024μm)预处理ht29细胞,预处理1h,然后全部加入恒定浓度20μm乙酰紫草素继续监测1h,结果如图4b所示,用ah7614预处理后,ah7614能剂量依赖地降低乙酰紫草素的激动活性,其ic50=1.01±0.30μm为。这进一步说明乙酰紫草素作用于gpr120靶点。
实施例3;在转染细胞cho-gpr120上,95%乙醇提取的新疆软紫草提取物gpr120活性发现。
转染细胞cho-gpr120的转染过程:首先将cho-k1细胞铺到10cm培养皿,5%co2和37℃培养18-24h,然后将进行gpr120瞬转,质粒和转染试剂lipo2000分别为8ug和24ul。瞬转24h后,换成含有600ug/mlzeocin的f12k+10%fbs培养基,每隔2-3天换液(液体为含有600ug/mlzeocin的f12k+10%fbs培养基),持续时间大概1个月。
探针分子激动剂tug891购买于tocris公司。检测平台为康宁第三代epic成像仪,检测的信号为细胞动态质量重置(dmr)引起的波长位移。
将处于对数生长期的cho-gpr120细胞接种到epic配套的384微孔板中,每孔的细胞悬液体积为40μl,接种的密度为1.5×104个/孔,然后将接种好的384板置于细胞培养箱,在5%co2和37℃培养18-24h,当细胞融合度达到95%以上时,进行实验。
首先是激动和脱敏分析,分别实时监测100μm(提取物质量默认为500)的提取物在cho-gpr120细胞上引起的dmr信号,监测1h之后,然后在加过新疆紫草提取物的384孔中加入1μmtug891继续监测1h,以所检测的1h内最大响应的dmr信号作图,如图5a,新疆软紫草提取物在100μm在cho-gpr120细胞引起了动态质量变化,并且tug891能脱敏100μm新疆软紫草提取物的信号,表明新疆软紫草提取物可能有ffa4激动活性。然后是拮抗分析,先用ah7614预处理细胞1h,然后再加入12.5μm新疆软提取物,以所检测的1h内最大响应的dmr信号作图,如图5b,拮抗剂ah7614降低了100μm新疆软紫草提取物的dmr信号,表明该100μm新疆软紫草提取物的dmr信号来自于与ffa4受体的作用。
- 还没有人留言评论。精彩留言会获得点赞!