MSP纳米孔及其用途的制作方法
本申请要求2014年4月16日提交的美国临时申请第61/980,415号和2014年4月16日提交的美国临时申请第61/980,393号的权益,这两个临时申请据此通过引用整体并入本文。
政府权利声明
本发明受政府支持在美国国立卫生研究院颁发的授权编号r01hg005115下进行。政府具有本发明的某些权利。
背景
分析物的鉴定和表征常常涉及昂贵且费时的方法论。例如,当前技术需要昂贵的定制试剂和/或检测方法才能测定核酸序列。类似地,测定蛋白质序列的方法,例如,通过质谱技术的肽指纹图谱,可能费力且成本高。因此,有效的检测和分析核酸、蛋白质和其它分析物的方法是必需的。
概述
本文提供编码突变单链耻垢分枝杆菌孔蛋白(mycobacteriumsmegmatisporin,msp)的核酸序列。该核酸序列任选地包含第一和第二核苷酸序列,其中第一核苷酸序列编码第一msp单体序列并且第二核苷酸序列编码第二msp单体序列;和编码氨基酸接头序列的第三核苷酸序列。在本文提供的一些突变单链msp中,第一和第二msp单体序列中的至少一个是包含在位置97处的突变的突变msp单体序列。在本文提供的其它突变单链msp中,第一和第二msp单体序列中的至少一个是包含在以下任何氨基酸位置的一个或多个突变的突变msp单体序列:i68、s73、s116、p123或v128。
任选地,编码突变单链msp的核酸序列包含第一、第二、第三、第四、第五、第六、第七和第八核苷酸序列或其任何亚组,其中第一、第二、第三、第四、第五、第六、第七和第八核苷酸序列分别编码第一、第二、第三、第四、第五、第六、第七和第八msp单体序列。该核酸序列还包含编码任选地存在于多个位点(例如,介于msp单体序列之间)的氨基酸接头序列的第九核苷酸序列。第一msp单体序列可以是包含在以下任何氨基酸位置的一个或多个突变的突变msp单体序列:i68、s73、s116、p123或v128,或包含在位置97处的突变的突变msp单体序列。
本文还提供了编码突变msp单体的核酸。msp单体包含在以下一个或多个位置的突变:i68、s73、p97、s116、p123或v128。
还提供了包含本文描述的突变msp的多肽和由本文描述的核酸编码的多肽。本文还提供了一种包含本文描述的突变msp的系统,其中所述msp具有限定通道的前厅和缢缩区,其中所述通道位于第一导电液体介质和第二导电液体介质之间,其中至少一种导电液体介质包含分析物,并且其中当所述系统受到足以使分析物从一种导电液体介质转位到另一种的电场时,所述系统可操作以检测分析物。
还提供了检测分析物的存在的方法。该方法包括施加足以使分析物通过本文描述的突变msp从第一导电介质转位到液体连通的第二导电介质的电场并且测量离子电流,其中离子电流减小表明在第一介质中存在所述分析物。
附图说明
图1示出了对耻垢分枝杆菌的mspa、mspb、mspc和mspd单体的比对。每种蛋白质的编号从该序列成熟部分的第一个氨基酸开始。无信号/前导序列的mspa、mspb、mspc和mspd单体序列分别作为seqidno:1、seqidno:2、seqidno:3和seqidno:4提供。
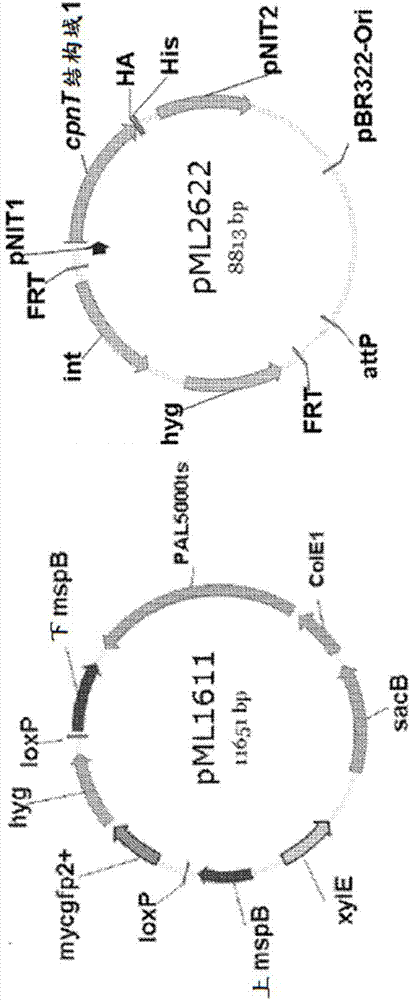
图2示出了用于构建ml712耻垢分枝杆菌的质粒的示意图。pml1611–mspb为缺失载体:mspbup、mspbdown-上游和下游与mspb染色体基因同源的区域;loxp-cre重组酶的重组位点,hyg-潮霉素抗性;sacb–果聚糖蔗糖酶;xyle-儿茶酚-2,3-双加氧酶;gfp2+-绿色荧光蛋白;tspal5000:分枝杆菌的热敏复制起点;cole1–大肠杆菌(e.coli)复制起点。pml2622–用于表达cpnt的n端通道形成结构域(d1)的整合型质粒。hyg:潮霉素抗性基因;pbr322-ori:大肠杆菌复制起点;对于cpnt的腈诱导型表达需要pnit1和pnit2,attp:噬菌体l5的染色体附着位点;int:l5整合酶;frt:flp重组位点。
图3为耻垢分枝杆菌菌株中的msp基因座的southern印迹。染色体dna分离自smr5(1)、ml16(2)和ml712(3)耻垢分枝杆菌菌株。在1%琼脂糖凝胶上分离dna片段,印迹到硝酸纤维素膜上,并且使用经地高辛(digoxigenin)标记的特异性探针检测。与探针杂交的dna片段的大小和预测值一致。预期片段大小:mspa基因座:1-1500bp,2,3-1250bp;mspb基因座:1,2-1140bp,3-1850bp;mspc基因座:1-1200bp,2,3-2100bp;mspd基因座:1-1730bp,2,3-1090bp。
图4为耻垢分枝杆菌孔蛋白基因缺失突变体中msp孔蛋白表达的western印迹。用0.5%辛基聚氧化乙烯萃取msp孔蛋白并且在每条泳道装载10μl。在8%sds-page上分离蛋白质并且使用mspa的多克隆抗体通过western印迹检测。泳道:1,smr5(野生型;mspa表达);2,ml16(三孔蛋白缺失突变体;mspb表达);3,ml712/pms2(四孔蛋白缺失突变体;空载体);4,ml712/pmn016(+mspa表达质粒);5,ml712/pml904(+m1mspa表达质粒)。
图5为编码单链m18-mspa的分枝杆菌表达质粒pml3213的示意图。该治疗包含以下:hyg,潮霉素抗性基因;orymyc,分枝杆菌复制起点;cole1ori,大肠杆菌复制起点;psmyc,分枝杆菌组成型启动子;m1-1、m1-2等,索引编号与单链基因构建体中的位置相对应的m1mspa基因。四分体a侧接在第一个m1-mspa起点的paci和在第四个m1-mspa末端的mlui;四分体b侧接在第五个m1-mspa起点的ecorv和在第八个m1-mspa末端的hindii。四分体内的单独m1-mspa基因侧接kpni、nsii、ndei、psti、scai、nhei。连接(ggggs)3(seqidno:5)的接头位于限制位点之间,但未示出。
图6为显示对耻垢分枝杆菌ml714中单链mspa表达的分析的western印迹。用0.5%辛基聚氧化乙烯萃取msp孔蛋白并且在每条泳道装载10μl。在10%sds-page上分离蛋白质,接着转移到pvdf膜上,并用αmspa单克隆抗体探测。泳道标记如下:m,蛋白梯带;1,表达野生型mspa(smr5);2,m12-mspa;3,m14-mspa;4,m18-mspa(单链m1-mspa)。通过定量图像分析测定mspa的量。
图7示出了单链m18-mspa的热稳定性。用0.5%正辛基聚氧化乙烯萃取单链m1mspa孔蛋白。在高于每条泳道的指示温度下在含2%sds的缓冲液中温育15μl样品15分钟。在8%sdspage中分离蛋白质,接着转移到pvdf膜上并用αmspa单克隆抗体探测。泳道标记如下:m,蛋白梯带;rt,室温;40、50等指示温育温度。向每条泳道装载等量的蛋白质样品。
图8a示出了用m18-mspa进行的脂质双层实验的结果。向双层腔室添加大约70ng蛋白质。在1mkcl中在-10mv的电势下,记录二植烷酰磷脂酰胆碱脂质双层中m1-8-mspa的电流轨迹。这导致通过脂质双层的电流逐步增加,表明m18-mspa通道插入膜中。
图8b为m18-mspa的电导直方图。分析了4张不同膜上的269个孔隙。单链m1-8-mspa在1.1ns下显示出主电导峰。
图9示出了电压门控实验的结果。将m18-mspa添加到二植烷酰磷脂酰胆碱膜的同侧。当约220个通道重构到膜中时,逐渐增加地向膜施加正(上部轨迹)和负(下部轨迹)电压。在施加的每个电压下记录膜电流。测定通道开始闭合时的临界电压(vc)作为脂质双层的电导在其初始最大值之后下降时的电压。m18-mspa的临界电压vc为+90mv。m18-mspa通道在施加的所有负电压下稳定。
图10a示出了在包含第一突变msp单体和第七突变msp单体的单链msp中产生的正斜坡的实例,第一突变msp单体包含在位置d56、i68、s73、d118、d134和e139处的突变并且第七突变msp单体包含在位置l88和i105处的突变。
图10b示出了在包含第一突变msp单体和第七突变msp单体的单链msp中产生的正斜坡的俯视图,第一突变msp单体包含在位置d56、i68、s73、d118、d134和e139处的突变并且第七突变msp单体包含在位置l88和i105处的突变。
图10c为单链msp的示意图。亚单位下的数字#1和#7表示正斜坡的位置。
图11为用于在大肠杆菌中表达单链m2-mspa的质粒pml3216的示意图。bla,氨苄青霉素抗性基因;pbr322-ori,大肠杆菌复制起点;laci,lac阻遏物蛋白;t7p,t7启动子;sd,夏因-达尔加诺序列(shine-dalgarnosequence);m2-1-m2-8,m2mspa密码子。
图12显示scm2-mspa可以在大肠杆菌中生成。在0.5的od600下用1.5mmiptg诱导大肠杆菌omp8细胞。在不同时间点,收集并裂解细胞。将等量的蛋白质样品装载到10%聚丙烯酰胺凝胶上。电泳后,凝胶经考马斯亮蓝(coomassie)染色并通过labworks软件(waltham,massachusetts)扫描定量。泳道:m,在左侧指出质量的分子量标记(kda);un,非诱导细胞;用iptg诱导2、4和6小时后。
图13示出了scmspam2再折叠的western印迹。将再折叠之前和之后的样品装载到8%聚丙烯酰胺凝胶上,接着隔夜转移到pvdf膜上。该膜经mspa特异性兔抗体染色。泳道:m,在左侧指出质量的分子量标记(kda);un,阴离子交换色谱法之后的未折叠样品;f,折叠的scmspam2。
图14(a-b)示出了scmspam2的通道形成性质。(a)平面脂质双层中scmspam2的电流轨迹记录。在添加如图3所示的再折叠scmspam2蛋白后,观察到电流逐步增加,表明通道插入。(b)单通道电导分布的直方图。分析了来自8张膜的总共392个通道。虚线表示数据分布的高斯拟合。scmspam2的主电导为2.3ns。
图15示出了scmspam2的电压依赖性通道闭合。将蛋白质添加到比色杯的同侧。插入大约200个控之后,按10mv增量增大正或负电压并且记录电流2分钟。平线表示开孔,而斜线表示孔闭合。scmspam2的临界电压经测定为约+80mv/-70mv。
图16示出了用于在大肠杆菌中表达单链scmspapn1(scmspapn1)的质粒pml3222的示意图。bla,氨苄青霉素抗性基因;pbr322-ori,大肠杆菌复制起点;laci,lac阻遏物蛋白;t7p,t7启动子;sd,夏因-达尔加诺序列;m2-97-1–m2-97-8,具有p97f突变的m2mspa的密码子优化基因。
图17显示scmspapn1可以在大肠杆菌中生成。在0.5的od600下用1.5mmiptg诱导大肠杆菌omp8细胞。在诱导2小时后,收集并裂解细胞。将等量的蛋白质样品装载到8%聚丙烯酰胺凝胶上。电泳后,凝胶经考马斯亮蓝染色并通过labworks软件(waltham,massachusetts)扫描定量。泳道:m,在左侧指出质量的分子量标记(kda);un,非诱导细胞;用iptg诱导2小时后。
图18示出了scmspapn1再折叠的western印迹。将样品装载到8%聚丙烯酰胺凝胶上,接着用考马斯亮蓝染色并通过labworks软件扫描定量。泳道:m,在左侧指出质量的分子量标记(kda);ib,从omp8大肠杆菌纯化的包涵体;ae,阴离子交换色谱法之后的样品;d,透析后的样品;r,折叠的scmspapn1蛋白。
图19显示scmspapn1插入脂质膜。dphpc脂质体装载30mm羧基荧光素染料。在517nm发射(492nm激发)下使用variancary荧光计(paloalto,ca)监测染料释放。符号:开口正方形-tritonx-100(0.1%v/v);闭合圆形-ldao(0.1%v/v);开口圆形-opoe(0.5%v/v);闭合三角形-wtmspa(60ng/ml);闭合正方形-scmspapn1(60ng/ml);开口三角形-scmspam2(120ng/ml)。当脂质体仅在pbs缓冲液中时未观察到显著的染料释放。
图20示出了孔隙重构到人工dphpc膜中的时间分布。比色杯装入指示浓度的kcl。向两侧添加最终100ng/ml的蛋白质样品。施加-10mv电势并且用testpoint软件记录数据。每个点表示第一次孔隙插入的时间。在1mkcl中scmspapn1的中值插入时间为399秒(分析了9张89%插入事件成功的膜)。在0.3mkcl中scmspapn1的中值插入时间为859秒(分析了8张50%插入事件成功的膜)。在1mkcl中scmspam2的中值插入时间为695秒(分析了10张40%插入事件成功的膜)。在0.3mkcl中scmspam2的插入时间为1270秒(8张膜,12%插入成功)。通过曼-惠特尼秩和检验(mann-whitneyranksumtest)测定*-p=0.028。
图21(a-d)示出了在1.0mkcl中scmspapn1和scmspam2的单通道电导。(a)平面脂质双层中scmspapn1的电流轨迹记录。在添加再折叠scmspapn1蛋白后,观察到电流逐步增加,表明通道插入。(b)单通道电导分布的直方图。分析了来自4张膜的总共137个通道。虚线表示数据分布的高斯拟合。scmspapn1的主电导为2.0ns。(c)平面脂质双层中scmspam2的电流轨迹记录。(d)单通道电导分布的直方图。分析了来自6张膜的总共238个通道。虚线表示数据分布的高斯拟合。scmspam2的主电导为1.3ns。
图22示出了在0.3mkcl和1.0mkcl中单链mspapn1的单通道电导及在0.3mkcl中scmspapn1在与膜接触之后通道插入膜中的增加。
具体实施方式
本文提供了突变耻垢分枝杆菌孔蛋白(msp)。突变msp可以是由两个或更多个msp单体组成的多聚体复合物,其中至少一个单体为突变msp单体。msp单体由耻垢分枝杆菌中的基因编码。耻垢分枝杆菌具有4个已鉴定的msp基因,表示为mspa、mspb、mspc和mspd。图1中示出了对耻垢分枝杆菌的mspa、mspb、mspc和mspd单体的野生型多肽序列的比对。每种蛋白质的编号从该序列成熟部分的第一个氨基酸开始,正如成熟氨基酸序列的第一个氨基酸上的数字“1”所示。无信号序列的mspa、mspb、mspc和mspd单体的氨基酸序列,即该序列的成熟部分分别作为seqidno:1、seqidno:2、seqidno:3和seqidno:4提供。具有信号/前导序列的mspa、mspb、mspc和mspd单体的氨基酸序列分别作为seqidno:6、seqidno:7、seqidno:8和seqidno:9提供。
进一步地,基因库(genbank)中公开了可修饰的野生型msp单体的序列,并且这些序列和其它序列通过引用整体并入本文,其中所含的单独子序列或片段也一样。例如,在基因库登录号aj001442和cab56052下可以分别找到野生型mspa单体的核苷酸和氨基酸序列。例如在基因库登录号nc_008596.1(核苷酸600086到600370)和yp884932.1下可以分别找到野生型mspb单体的核苷酸和氨基酸序列。例如在基因库登录号aj299735和cac82509下可以分别找到野生型mspc单体的核苷酸和氨基酸序列。例如在基因库登录号aj300774和cac83628下可以分别找到野生型mspd单体的核苷酸和氨基酸序列。
突变msp单体可以是由mspa、mspb、mspc或mspd编码的核酸,例如mrna或编码mspa、mspb、mspc或mspd的基因组序列编码的全长单体或其功能片段,其中该单体包含一个或多个修饰。
任选地,突变msp是突变单链msp或几个单链msp的多聚体,其中该多聚体包含至少一个突变单链msp。突变msp也可以是几个msp单体的多聚体,其中至少一个msp单体为突变msp单体。
单链msp可以,例如包含由两个或更多个msp单体(例如,8个单体)通过一个或多个氨基酸接头肽连接形成的多聚体。部分单链msp是指二聚、三聚等等形成孔蛋白的单链多聚体复合物。全长单链msp孔蛋白是指形成孔蛋白,无需二聚、三聚等等就能形成孔蛋白的单链多聚体复合物。换句话说,与必须和其它部分单链msp或单体msp单体缔合才能形成孔蛋白的孔蛋白相比,单链折叠形成孔蛋白,但是所有组分都在一条氨基酸链上。
突变单链msp和编码突变单链msp的核酸
本文提供了编码突变单链msp的核酸序列。例如,编码突变单链msp的核酸序列包含:(a)第一和第二核苷酸序列,其中第一核苷酸序列编码第一msp单体序列并且第二核苷酸序列编码第二msp单体序列;和(b)编码氨基酸接头序列的第三核苷酸序列,其中第一和第二msp单体序列中的至少一个是在位置p97处具有突变的突变msp单体序列。任选地,突变msp单体序列可包含在位置p97处的突变,其中该突变不是p97s突变或p97c突变。任选地,突变msp单体序列可包含p97f突变。如实施例中所示,位于scmspa的环6(氨基酸91-103)中的附加疏水性残基,例如苯丙氨酸促进孔隙更快且更有效地插入脂质双层。对于mspa的环6及其中所含残基的描述,参见huffe等,j.biol.chem.284:10223-10231(2009),其据此通过引用整体并入。因此,本文提供了在msp的环6(氨基酸91-103)中包含一个或多个疏水性取代的单链msp。
例如,本文提供了一种编码突变单链耻垢分枝杆菌孔蛋白(msp)的核酸序列,其中该核酸序列包含:(a)第一和第二核苷酸序列,其中第一核苷酸序列编码第一msp单体序列并且第二核苷酸序列编码第二msp单体序列;和(b)编码氨基酸接头序列的第三核苷酸序列,其中第一和第二msp单体序列中的至少一个是包含在以下任何氨基酸位置处的一个或多个突变的突变msp单体序列:d91、g92、d93、i94、t95、a96、p97、p98、f99、g100、l101、n102或s103,其中d91、g92、d93、i94、t95、a96、p97、p98、f99、g100、l101、n102或s103中的一个或多个经疏水性氨基酸取代。例如,疏水性氨基酸可选自由以下组成的组:丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、酪氨酸、色氨酸、脯氨酸和甘氨酸。以举例而非限制的方式,突变msp单体序列可包含(i)d90n、d91n和d93n突变;和(ii)g92f、t95f、a96f、p97f、p98f、g100f、l101f、n102f或s103f突变中的一个或多个。如上所述,位置g92、t95、a96、p97、p98、g100、l101、n102或s103处的取代不限于苯丙氨酸,因为这些氨基酸中的一个或多个可经另一个疏水性残基置换,例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、甲硫氨酸、酪氨酸、色氨酸、脯氨酸和甘氨酸。g92、t95、a96、p97、p98、g100、l101、n102或s103中的一个或多个可经相同的疏水性氨基酸或不同的疏水性氨基酸取代。
如通篇所用,在特定氨基酸处的突变用位置上氨基酸的单字母代码,接着是msp多肽序列中氨基酸位置的编号(例如,在seqidno:1中的氨基酸位置)和该位置上氨基酸取代的单字母代码指示。因此,应了解p97突变是在seqidno:1的氨基酸97处的脯氨酸取代为苯丙氨酸。类似地,d90n突变是在seqidno:1的氨基酸90处的天冬氨酸取代为精氨酸,d91n突变是在seqidno:1的氨基酸91处的天冬氨酸取代为精氨酸,等等。还应了解对应seqidno:1中的位置的氨基酸本文也提供(参见图1)。例如,而非限制,本领域的技术人员将理解,mspb(seqidno:2)、mspc(seqidno:3)和mspd(seqidno:4)中对于seqidno:1的e139的对应氨基酸分别为a139、a139和k138。
任选地,本文描述的任何突变msp单体序列还可包含在氨基酸位置d118处的突变、在位置d134处的突变或在位置e139处的突变。任选地,在位置e139处的突变可为e取代为r(精氨酸)或e取代为k(赖氨酸)。任选地,在位置d118处的突变可为d取代为r或d取代为k。任选地,在位置d134处的突变可为d取代为r或d取代为k。例如,本文描述的任何突变msp单体序列可包含选自由以下组成的组的一个或多个突变:d118r突变、d134r突变和e139k突变。任选地,本文描述的任何突变msp单体序列还可包含以下的至少一个:(i)在位置93处的突变和(ii)在位置d90、位置d91或位置d90和d91两处的突变。任选地,在位置90、91或93处的氨基酸经精氨酸、赖氨酸、组氨酸、谷氨酰胺、甲硫氨酸、苏氨酸、苯丙氨酸、酪氨酸或色氨酸取代。任选地,本文描述的任何突变msp单体序列还可包含d90n、d91n和d93n突变。
例如,包含在位置97处的突变的突变msp单体序列还可包含(i)在氨基酸位置d118、d134和/或e139处的突变,(ii)在位置d93处的突变,和/或(iii)在位置d90、位置d91或位置d90和d91两处的突变。例如,突变mspa单体序列可包含d90n突变、d91n突变、d93n突变、p97f突变、d118r突变、d134r突变和e139k突变。突变mspa单体序列也可包含d90n突变、d91n突变、d93n突变、p97f突变、d118r突变、d134r突变和e139k突变。
本文还提供了一种编码突变单链msp的核酸序列,其包含(a)第一和第二核苷酸序列,其中第一核苷酸序列编码第一msp单体序列并且第二核苷酸序列编码第二msp单体序列;和(b)编码氨基酸接头序列的第三核苷酸序列,其中第一和第二msp单体序列中的至少一个是包含在以下任何氨基酸位置处的一个或多个突变的突变msp单体序列:i68、s73、s116、p123或v128。本文提供了一种编码突变单链msp的核酸序列,其中突变msp单体序列包含在i68、s73、s116、p123或v128中任一处的一个或多个突变;其中所述突变不是i68v突变或s73c突变。
本文提供了一种包含在i68、s73、s116、p123和/或v128处的一个或多个突变的突变msp单体序列,其还包含(i)在氨基酸位置d118处的突变,(ii)在位置d93处的突变,和/或(iii)在位置d90、位置d91或位置d90和d91两处的突变。例如,突变mspa单体序列可包含在氨基酸位置i68、s73、s116、p123或v128处的一个或多个突变,在d93处的突变、在d118处的突变、在d134处的突变和在e139处的突变或其任何亚组。在另一个实例中,突变mspa单体序列可包含在氨基酸位置i68、s73、s116、p123或v128处的一个或多个突变,在d118处的突变、在d134处的突变、d90n突变和/或d91n突变。再一个实施例中,突变mspa单体序列可包含在氨基酸位置i68、s73、s116、p123或v128处的一个或多个突变,在d118处的突变、在d134处的突变和在e139处的突变、d90n突变、d91n突变和d93n突变。本文提供了一种编码突变单链msp的核酸,其中所述突变msp单体序列包含在i68、s73、s116、p123或v128中任一处的一个或多个突变,其中该突变不是i68v突变或s73c突变。在本文提供的任何突变单链msp中,突变msp单体序列可包含在i68、s73、s116、p123或v128中任一处的一个或多个突变,其中该突变不是i68v突变或s73c突变。
任选地,本文描述的任何突变msp单体序列还可包含在以下任何氨基酸位置的一个或多个突变:d13、a55、d56、e57、f58、e63、s136、g137或d172。任选地,在本文提供的突变msp单体序列中d13、a55、d56、e57、f58、e63、s136、g137或d172中的一个或多个可经赖氨酸或精氨酸取代。任选地,本文描述的包含在d13、a55、d56、e57、f58、e63、s136、g137或d172处的一个或多个突变的任何突变msp单体序列还可包含在以下位置的一个或多个突变:d118、d134或e139。任选地,本文描述的包含在d13、a55、d56、e57、f58、e63、s136、g137或d172处的一个或多个突变的任何突变msp单体序列还可包含在位置93处的突变和/或在位置90、位置91或位置90和91两处的突变。
因此,本文提供了一种编码突变单链耻垢分枝杆菌孔蛋白(msp)的核酸序列,其中该核酸序列包含(a)第一和第二核苷酸序列,其中第一核苷酸序列编码第一msp单体序列并且第二核苷酸序列编码第二msp单体序列;和(b)编码氨基酸接头序列的第三核苷酸序列,其中第一和第二msp单体序列中的至少一个是包含在以下任何氨基酸位置处的一个或多个突变的突变msp单体序列:d13、a55、d56、e57、f58、e63、s136、g137或d172。任选地,编码接头的第三核苷酸序列位于第一和第二核苷酸序列之间。
还提供了一种编码突变单链耻垢分枝杆菌孔蛋白(msp)的核酸序列,其中该核酸序列包含(a)第一和第二核苷酸序列,其中第一核苷酸序列编码第一msp单体序列并且第二核苷酸序列编码第二msp单体序列;和(b)编码氨基酸接头序列的第三核苷酸序列,其中第一和第二msp单体序列中的至少一个是包含以下突变的突变msp单体序列(i)在位置93处的突变,和/或(ii)在位置90、位置91或位置90和91两处的突变和(iii)在以下任何氨基酸位置处的一个或多个突变:d13、a55、d56、e57、f58、e63、s136、g137或d172。
还提供了一种编码突变msp单体的核酸,其中msp单体包含在以下一个或多个氨基酸位置处的突变:d13、a55、d56、e57、f58、e63、s136、g137或d172。任选地,包含在d13、a55、d56、e57、f58、e63、s136、g137或d172处的一个或多个突变的突变msp单体序列还可包含在位置93处的突变和/或在位置90、位置91或位置90和91两处的突变。任选地,包含在位置d13、a55、d56、e57、f58、e63、s136、g137或d172处的一个或多个突变的突变msp单体序列还可包含d90n、d91n和d93n突变。
在本文提供的突变单链突变msp中,第一单体序列可以是本文描述的任何突变单体序列。例如,突变单体序列可以是突变mspa序列。第二单体可选自由以下组成的组:野生型msp单体、第二突变msp单体、野生型msp旁系同源或同源单体及突变msp旁系同源或同源单体。应了解第二突变msp单体可与第一突变msp单体相同或不同。这些包括但不限于mspa/msmeg0965、mspb/msmeg0520、mspc/msmeg5483、mspd/msmeg6057、mppa、porm1、porm2、porm1、mmcs4296、mmcs4297、mmcs3857、mmcs4382、mmcs4383、mjls3843、mjls3857、mjls3931mjls4674、mjls4675、mjls4677、map3123c、mav3943、mvan1836、mvan4117、mvan4839、mvan4840、mvan5016、mvan5017、mvan5768、mul_2391、mflv1734、mflv1735、mflv2295、mflv1891、mch4691c、mch4689c、mch4690c、mab1080、mab1081、mab2800、rha1ro08561、rha1ro04074和rha1ro03127。野生型mspa旁系同源或同源单体可为野生型mspb单体。野生型mspa旁系同源和同源单体在本领域公知。表1提供了此类旁系同源物和同源物的非限制性列表。
表1.野生型mspa和野生型mspa旁系同源和同源单体
仅包括在蛋白质全长上具有显著氨基酸相似性的蛋白质。数据通过psi-blast算法(blosum62矩阵)使用万维网ncbi.nlm.nih.gov/blast/blast.cgi.上的nih基因库数据库获得。
n.d.:“未测定”
*stahl等,mol.microbial.40:451(2001)
**domer等,biochim.biophys.acta.1667:47-55(2004)
如本文中所用,突变单链msp是包含通过一个或多个氨基酸接头肽连接的至少两个msp单体或其功能片段的多肽,其中至少一个msp单体为突变msp单体。例如,突变单链msp可包含通过一个或多个氨基酸接头肽连接的两个、三个、四个、五个、六个、七个、八个、九个、十个、十一个、十二个或更多个msp单体,其中至少一个msp单体为突变msp单体。如上所述,单链突变msp可以例如通过折叠形成孔蛋白,无需二聚、三聚等等就能形成孔蛋白。可选地,突变单链msp可为部分单链突变msp,其包含通过一个或多个氨基酸连接肽连接的可以二聚、三聚等等形成孔蛋白的至少两个msp单体或其片段。
任选地,包含突变单链msp的msp孔蛋白可以,例如包含两个或更多个单链msp孔蛋白二聚体、两个或更多个单链msp孔蛋白三聚体、两个或更多个单链msp孔蛋白四聚体、两个或更多个单链msp孔蛋白五聚体、一个或多个单链msp孔蛋白六聚体、一个或多个单链msp孔蛋白七聚体、一个或多个单链msp孔蛋白八聚体或其组合。例如,msp孔蛋白可包含一个单链msp孔蛋白二聚体和两个单链msp孔蛋白三聚体。再举例而言,msp孔蛋白可包含一个单链msp孔蛋白四聚体和两个单链msp孔蛋白二聚体。
本文描述了氨基酸接头序列。在本文描述的任何单链msp中,接头序列可以,例如包含10至20个氨基酸。例如,氨基酸接头序列包含15个氨基酸。任选地,氨基酸接头序列包含(ggggs)3(seqidno:5)肽序列。可以在编码两个以上msp单体的核酸序列间提供编码接头序列的相同或不同核酸。任选地,可以在编码本文提供的单链msp中的msp单体的所有或一些核酸序列间提供接头序列。
还提供了一种编码突变单链msp的核酸序列,其中该核酸序列包含(a)第一、第二、第三、第四、第五、第六、第七和第八核苷酸序列或其任何亚组,其中所述第一、第二、第三、第四、第五、第六、第七和第八核苷酸序列分别编码第一、第二、第三、第四、第五、第六、第七和第八msp单体序列;和(b)编码氨基酸接头序列的第九核苷酸序列,其中所述第一msp单体序列是包含在位置p97处的突变的突变msp单体序列。
突变msp单体序列可包含在p97处的突变,其中该突变不是p97s突变或p97c突变。突变msp单体序列可包含p97f突变。如上所述,本文描述的任何突变msp单体序列还可包含在氨基酸位置d118处的突变、在位置d134处的突变或在位置e139处的突变。例如,本文描述的任何突变msp单体序列可包含d118r突变、d134r突变和/或e139k突变。本文描述的任何突变msp单体序列还可包含(i)在位置93处的突变,和/或(ii)在位置d90、位置d91或位置d90和d91两处的突变。任选地,在位置90、91或93处的氨基酸经精氨酸、赖氨酸、组氨酸、谷氨酰胺、甲硫氨酸、苏氨酸、苯丙氨酸、酪氨酸或色氨酸取代。本文描述的任何突变msp单体序列还可包含d90n、d91n和d93n突变。例如,本文提供了一种编码突变单链msp的核酸序列,其中该核酸序列包含(a)第一、第二、第三、第四、第五、第六、第七和第八核苷酸序列或其任何亚组,其中所述第一、第二、第三、第四、第五、第六、第七和第八核苷酸序列分别编码第一、第二、第三、第四、第五、第六、第七和第八msp单体序列;和(b)编码氨基酸接头序列的第九核苷酸序列,其中所述第一msp单体序列是包含在位置p97处的突变的突变msp单体序列,其还可包含(i)在氨基酸位置d118、d134或e139处的突变,(ii)在位置d93处的突变,和/或(iii)在位置d90、位置d91或位置d90和d91两处的突变。例如,第一msp单体序列可以是包含d90n突变、d91n突变、d93n突变、p97f突变、d118r突变、d134r突变和e139k突变的突变msp单体序列。
还提供了一种编码突变单链msp的核酸序列,其中该核酸序列包含(a)第一、第二、第三、第四、第五、第六、第七和第八核苷酸序列或其任何亚组,其中所述第一、第二、第三、第四、第五、第六、第七和第八核苷酸序列分别编码第一、第二、第三、第四、第五、第六、第七和第八msp单体序列;和(b)编码氨基酸接头序列的第九核苷酸序列,其中所述第一msp单体序列是包含在以下任何氨基酸位置的一个或多个突变的突变msp单体序列:i68、s73、s116、p123或v128。
第一msp单体序列也可以是包含在以下任何氨基酸位置的一个或多个突变:i68、s73、s116、p123或v128并且还包含在氨基酸位置d118处的突变的突变msp单体序列,其任选地具有(i)在位置93处的突变,和/或(ii)在位置d90、位置d91或位置d90和d91两处的突变。在本文描述的任何突变msp单体序列中,位置91处的氨基酸或位置90处的氨基酸可被精氨酸、赖氨酸、组氨酸、谷氨酰胺、甲硫氨酸、苏氨酸、苯丙氨酸、酪氨酸或色氨酸取代。突变msp单体序列还可包含d90n、d91n和d93n突变。包含在氨基酸i68、s73、s116、p123或v128处的一个或多个突变的突变msp单体还可包含在位置d13、a55、d56、e57、f58、e63、s136、d134、g137、e139或d172的一个或多个氨基酸中的突变。在本文描述的突变msp单体序列中,d13、a55、d56、e57、f58、e63、s136、d134、g137、e139或d172可以被赖氨酸或精氨酸取代。因此,包含在氨基酸i68、s73、s116、p123或v128处的一个或多个突变的突变msp单体,例如还可包含(i)在氨基酸位置d118处的突变,(ii)在位置d93处的突变,(iii)在位置d90、位置d91或位置d90和d91两处的突变,(iv)d90n、d91n和d93n突变和/或(v)在位置d13、a55、d56、e57、f58、e63、s136、d134、g137、e139或d172的一个或多个氨基酸中的突变。
例如,而非限制,第一突变msp单体可以是包含在位置d56、i68、s73、d118、d134和e139处的突变的突变msp单体。任选地,突变msp单体还可包含d90n、d91n和d93n突变。任选地,选自由d56、i68、s73、d118、d134和e139组成的组的一个或多个氨基酸可以被赖氨酸或精氨酸取代。
还提供了一种编码突变单链msp的核酸序列,其中该核酸序列包含(a)第一、第二、第三、第四、第五、第六、第七和第八核苷酸序列或其任何亚组,其中所述第一、第二、第三、第四、第五、第六、第七和第八核苷酸序列分别编码第一、第二、第三、第四、第五、第六、第七和第八msp单体序列;和(b)编码氨基酸接头序列的第九核苷酸序列,其中所述第一msp单体序列是包含在以下任何氨基酸位置的一个或多个突变的突变msp单体序列:i68、s73、s116、p123或v128,并且其中第一、第二、第三、第四、第五、第六、第七和第八核苷酸序列中的一个或多个编码包含在以下一个或多个位置的突变的突变msp单体序列:t83、n86、l88、i105、d90、d91、g92、d93或a96。例如,而非限制,第七核苷酸可以编码包含在以下一个或多个位置的突变的突变msp单体序列:t83、n86、l88、i105、d90、d91、g92、d93或a96。
应了解,第一核苷酸序列和第七核苷酸序列可以排列,但不一定按照包含第一、第二、第三、第四、第五、第六、第七和第八核苷酸序列的核酸序列中第一核苷酸序列和第七核苷酸序列所呈的顺序排列。在这种情况下,第一核苷酸序列是编码单链msp的第一或起始单体的核苷酸序列,并且可以是单链msp的第一、第二、第三、第四、第五、第六、第七或第八核苷酸序列。起始核苷酸序列无论出现在单链msp中的何处均被称为第一核苷酸序列。例如,如果单链msp的起始亚单位为第一msp单体(第一核苷酸序列),则第七msp单体(第七核苷酸序列)包含在以下一个或多个位置的突变:t83、n86、l88、i105、d90、d91、g92、d93或a96。在另一个实例中,如果单链msp的起始亚单位为第二msp单体(第一核苷酸序列),则第八msp单体(第七核苷酸序列)包含在以下一个或多个位置的突变:t83、n86、l88、i105、d90、d91、g92、d93或a96。在另一个实例中,如果单链msp的起始亚单位为第三msp单体(第一核苷酸序列),则第一msp单体(第七核苷酸序列)包含在以下一个或多个位置的突变:t83、n86、l88、i105、d90、d91、g92、d93或a96。在另一个实例中,如果单链msp的起始亚单位为第四msp单体(第一核苷酸序列),则第二msp单体(第七核苷酸序列)包含在以下一个或多个位置的突变:t83、n86、l88、i105、d90、d91、g92、d93或a96。在另一个实例中,如果单链msp的起始亚单位为第五msp单体(第一核苷酸序列),则第三msp单体(第七核苷酸序列)包含在以下一个或多个位置的突变:t83、n86、l88、i105、d90、d91、g92、d93或a96。在另一个实例中,如果单链msp的起始亚单位为第六msp单体(第一核苷酸序列),则第四msp单体(第七核苷酸序列)包含在以下一个或多个位置的突变:t83、n86、l88、i105、d90、d91、g92、d93或a96。在另一个实例中,如果单链msp的起始亚单位为第七msp单体(第一核苷酸序列),则第五msp单体(第七核苷酸序列)包含在以下一个或多个位置的突变:t83、n86、l88、i105、d90、d91、g92、d93或a96。在另一个实例中,如果单链msp的起始亚单位为第八msp单体(第一核苷酸序列),则第六msp单体(第七核苷酸序列)包含在以下一个或多个位置的突变:t83、n86、l88、i105、d90、d91、g92、d93或a96。
例如,而非限制,第一msp单体可以是包含在位置d56、i68、s73、d118、d134和e139处的突变的突变msp单体并且第七单体可以是包含在位置l88和i105处的突变的突变msp单体。任选地,在第一突变msp单体的位置d56、i68、s73、d118、d134和e139处的每个氨基酸均可被赖氨酸或精氨酸取代。任选地,在第一突变msp单体的位置d56、i68、s73、d118、d134和e139处的每个氨基酸均可被苯丙氨酸、色氨酸、组氨酸或酪氨酸取代。任选地,在第七突变msp单体的位置l88和i105处的每个氨基酸位置均可被赖氨酸或精氨酸取代。任选地,在第七突变msp单体的位置l88和i105处的每个氨基酸位置均可被苯丙氨酸、色氨酸、组氨酸或酪氨酸取代。d56、i68、s73、d118、d134、e139、l88和/或i105经芳香族氨基酸如苯丙氨酸、色氨酸、组氨酸或酪氨酸取代可以促进与分析物,例如核苷酸的p-堆积相互作用(p-stackinginteraction),以降低转位速度。任选地,第一、第二、第三、第四、第五、第六、第七和第八msp单体序列或其亚组可包含d90n、d91n和d93n突变。
图10a和10b示出了在包含第一突变msp单体和第七突变msp单体的单链msp中产生的正斜坡的非限制性实例,第一突变msp单体包含在位置d56、i68、s73、d118、d134和e139处的突变并且第七突变msp单体包含在位置l88和i105处的突变。mspa前厅内部这种带正电的斜坡引导单链核酸,例如dna通过msp。核酸和斜坡间的静电相互作用使得dna能够受控转位穿过孔隙。这降低了核酸的布朗运动(brownianmotion)和转位率。这还增加了精确度及核酸碱基和缢缩区内氨基酸之间的相互作用。图10c为单链msp的示意图。亚单位下的数字#1和#7表示正斜坡的位置。
在本文所述任何突变单链msp中,缢缩区可经修饰以增强mspa的核碱基、蛋白质或分析物识别性质。对缢缩区的修饰可以产生增强例如碱基特异性相互作用的读头。读头可通过引入具有较长侧链伸入dna或另一种分析物路径中的氨基酸来产生。例如,而非限制,为了产生一个或多个读头,在本文描述的单链msp的任何突变msp单体中的位置90和/或91处的氨基酸可经精氨酸、赖氨酸、组氨酸、谷氨酰胺、甲硫氨酸、苏氨酸、苯丙氨酸、酪氨酸、色氨酸或非天然氨基酸取代。也可产生定位头以增加一个或多个读头的效率。例如,可以在读头对面引入具有较长侧链,优选疏水性或带负电的氨基酸,以便降低缢缩区内dna或另一种分析物的逃逸运动。合适的氨基酸包括但不限于天冬氨酸、谷氨酰胺、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、酪氨酸、色氨酸和非天然氨基酸。为了进一步降低转位率,可通过使位置83、86、88和105处的一个或多个氨基酸突变来产生堆积侧。例如,而非限制,位置83、86、88和105处的一个或多个氨基酸可经色氨酸、酪氨酸或苯丙氨酸取代。任选地,堆积侧定位为使其位于正斜坡的附近。
第一、第二、第三、第四、第五、第六、第七和第八msp单体序列中的一个或多个或其任何亚组可独立地选自由以下组成的组:野生型mspa单体、突变mspa单体、野生型mspa旁系同源或同源单体及突变mspa旁系同源或同源单体。应了解,当第二、第三、第四、第五、第六、第七和/或第八msp单体序列为突变mspa单体序列时,突变mspa单体序列可与第一突变mspa单体序列相同或不同。任选地,第二、第三、第四、第五、第六、第七和第八msp单体序列或其任何亚组为野生型mspa旁系同源或同源单体。这些包括但不限于mspa/msmeg0965、mspb/msmeg0520、mspc/msmeg5483、mspd/msmeg6057、mppa、porm1、porm2、porm1、mmcs4296、mmcs4297、mmcs3857、mmcs4382、mmcs4383、mjls3843、mjls3857、mjls3931mjls4674、mjls4675、mjls4677、map3123c、mav3943、mvan1836、mvan4117、mvan4839、mvan4840、mvan5016、mvan5017、mvan5768、mul_2391、mflv1734、mflv1735、mflv2295、mflv1891、mch4691c、mch4689c、mch4690c、mab1080、mab1081、mab2800、rha1ro08561、rha1ro04074和rha1ro03127。野生型mspa旁系同源或同源单体可为野生型mspb单体。
突变msp单体和编码突变msp单体的核酸
还提供了编码突变msp单体的核酸,其中msp单体包含在位置97处的突变。任选地,突变msp单体可包含在p97处的突变,其中该突变不是p97s突变或p97c突变。任选地,突变msp单体可包含p97f突变。任选地,突变msp单体还可包含在氨基酸位置d118处的突变、在位置d134处的突变或在位置e139处的突变。例如,包含在位置97处的突变的突变msp单体还可包含d118r突变、d134r突变和/或e139k突变。任选地,包含在位置97处的突变的突变msp单体还可包含(i)在位置93处的突变,和/或(ii)在位置d90、位置d91或位置d90和d91两处的突变。任选地,位置90或91处的氨基酸被精氨酸、赖氨酸、组氨酸、谷氨酰胺、甲硫氨酸、苏氨酸、苯丙氨酸、酪氨酸或色氨酸取代。任选地,突变msp单体还可包含d90n、d91n和d93n突变。例如,而非限制,突变mspa单体序列可包含d90n突变、d91n突变、d93n突变、p97f突变、d118r突变、d134r突变和e139k突变。
还提供了编码突变msp单体的核酸,其中msp单体包含在以下一个或多个位置的突变:i68、s73、s116、p123或v128。任选地,突变单体还包含在氨基酸位置d118处的突变。任选地,msp单体还包含在位置d90、位置d91或位置d90和d91两处的突变。任选地,在位置91处的氨基酸或在位置90处的氨基酸可经精氨酸、赖氨酸、组氨酸、谷氨酰胺、甲硫氨酸、苏氨酸、苯丙氨酸、酪氨酸或色氨酸取代。任选地,突变msp单体序列还可包含d90n、d91n和d93n突变。任选地,突变msp单体序列还可包含在位置d13、a55、d56、e57、f58、e63、s136、d134、g137、e139或d172的一个或多个氨基酸中的突变。任选地,d13、a55、d56、e57、f58、e63、s136、d134、g137、e139或d172中的一个或多个可经赖氨酸或精氨酸取代。
还提供了编码突变msp单体的核酸,其中msp单体包含在以下一个或多个位置的突变:t83、n86、g92或a96。任选地,突变msp单体序列还包含在位置l88或i105处的突变。任选地,突变单体还包含在氨基酸位置d118处的突变。任选地,msp单体还包含在位置d90、位置d91或位置d90和d91两处的突变。任选地,在位置91处的氨基酸或在位置90处的氨基酸可经精氨酸、赖氨酸、组氨酸、谷氨酰胺、甲硫氨酸、苏氨酸、苯丙氨酸、酪氨酸或色氨酸取代。任选地,突变msp单体序列还可包含d90n、d91n和d93n突变。
如本文中所用,突变msp单体是指与野生型msp单体相比,具有至少或至多70、75、80、85、90、95、98或99%或更高同一性,或其中可推论的任何范围,但低于100%同一性,并且与一个或多个其它msp单体(野生型或突变)缔合时保持通道形成能力的msp单体。因此,除本文描述的突变以外,本文提供的任何突变msp还可包含另外的修饰,如取代、插入、缺失和/或添加,只要突变msp单体与野生型msp单体具有至少或至多70、75、80、85、90、95、98或99%或更高同一性,或其中可推论的任何范围,但低于100%,并且与一个或多个其它msp单体缔合时保持通道形成能力。
本文描述的任何突变msp均可包含2-15个相同或不同的msp单体,其中至少一个msp单体为突变msp单体。任选地,突变msp包含7-9个相同或不同的msp单体。任选地,至少第二单体选自由以下组成的组:野生型msp单体、第二突变msp单体、野生型msp旁系同源或同源单体及突变msp旁系同源或同源单体,其中第二突变msp单体可与第一突变msp单体相同或不同。例如,本文描述的任何突变msp均可包含2-15个msp单体,其中至少一个msp单体为突变mspa单体。任选地,至少第二单体选自由以下组成的组:野生型mspa单体、第二突变mspa单体、野生型mspa旁系同源或同源单体及突变mspa旁系同源或同源单体,其中第二突变mspa单体可与第一突变mspa单体相同或不同。任选地,第二单体为野生型mspa旁系同源或同源单体。
例如,突变msp可包含一个或多个包含在位置97处的突变的msp单体。在另一个实例中,突变msp可包含一个或多个包含在i68、s73、s116、p123或v128中的一处或多处的突变的msp单体及一个或多个包含在以下一个或多个位置的突变的msp单体:t83、n86、l88、i105、d90、d91、g92、d93或a96。在另一个实例中,突变msp可包含一个或多个在位置d56、i68、s73、d118、d134和e139处具有突变的msp单体及一个或多个在位置l88和i105处具有突变的msp单体。
氨基酸序列上的修饰可作为等位变异(例如,由于遗传多态性)产生,可由于环境影响(例如,由于暴露于紫外线辐射)或其它人为干预(例如,通过克隆dna序列的诱变),如诱导点、缺失、插入和取代突变而产生。这些修饰可导致氨基酸序列变化,提供沉默突变,修饰限制位点或提供其它特定突变。氨基酸序列修饰通常属于三个类别中的一个或多个:取代、插入或缺失修饰。插入包括氨基和/或末端融合以及序列内插入单个或多个氨基酸残基。插入一般会是比氨基或羧基末端融合的那些更小的插入,例如在1至4个残基的数量级。缺失的特征在于从蛋白质序列去除了一个或多个氨基酸残基。通常,在蛋白质分子内的任何一个位点缺失不超过约2至约6个残基。氨基酸取代通常是单个残基,但是可以一次在许多不同位置发生;插入通常会在约1至约10个氨基酸残基的数量级;并且缺失范围将为约1至约30个残基。缺失或插入优选在相邻对中产生,即缺失2个残基或插入2个残基。取代、缺失、插入或其任何组合可合并以得到最终构建体。突变可能或可能不将序列置于阅读框外并且可能或可能不产生可以产生mrna二级结构的互补区。取代修饰是其中已经去除至少一个残基并且在其位置插入不同残基的修饰。
修饰,包括本文公开的特定氨基酸取代,可通过已知方法产生。举例而言,通过定点诱变编码蛋白质的dna中的核苷酸来产生修饰,从而产生编码该修饰的dna,之后使该dna在重组细胞培养中表达以产生msp单体或单链多聚体。在具有已知序列的dna中的预定位点产生取代突变的技术是公知的,例如m13引物诱变和pcr诱变。
本文描述的msp蛋白中的氨基酸可为20种自然存在的氨基酸、自然存在的氨基酸的d-立体异构体、非天然氨基酸和经化学修饰的氨基酸中的任一种。非天然氨基酸(即,并非自然存在于蛋白质中的那些)在本领域中也已知,正如例如williams等,mol.cell.biol.9:2574(1989);evans等,j.amer.chem.soc.112:4011-4030(1990);pu等,j.amer.chem.soc.56:1280-1283(1991);williams等,j.amer.chem.soc.113:9276-9286(1991)中;及其中引用的所有参考文献所述。β和γ氨基酸在本领域已知并且也作为非天然氨基酸在本文中被考虑到。
如本文中所用,经化学修饰的氨基酸是指侧链已经化学修饰的氨基酸。例如,侧链可修饰为包含信号部分,如荧光团或放射性标记。侧链也可修饰为包含新官能团,如硫醇、羧酸或氨基基团。经翻译后修饰的氨基酸也包括在经化学修饰的氨基酸的定义内。
还考虑到保守性氨基酸取代。举例而言,可以在本文提供的任何msp单体的一个或多个氨基酸残基中产生保守性氨基酸取代。本领域的技术人员将了解,保守性取代是一个氨基酸残基被另一个在生物学和/或化学上相似的氨基酸置换。以下8组各自含相互为保守性取代的氨基酸:
1)丙氨酸(a)、甘氨酸(g);
2)天冬氨酸(d)、谷氨酰胺(e);
3)天冬酰胺(n)、谷氨酰胺(q);
4)精氨酸(r)、赖氨酸(k);
5)异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、缬氨酸(v);
6)苯丙氨酸(f)、酪氨酸(y)、色氨酸(w);
7)丝氨酸(s)、苏氨酸(t);和
8)半胱氨酸(c)、甲硫氨酸(m)
还考虑到非保守性取代,例如甘氨酸取代脯氨酸。
本领域的技术人员容易理解如何测定两个多肽或核酸的同一性。例如,可以在比对两个序列之后计算同一性,使得同一性处于其最高水平。另一种计算同一性的方式可以通过公开算法进行。可以使用smith和waterman,adv.appl.math.2:482(1981)的算法;通过needleman和wunsch,j.mol.biol.48:443(1970)的比对算法;通过pearson和lipman,proc.natl.acad.sci.u.s.a.85:2444(1988)的相似性搜索方法;通过计算机实现这些算法(wisconsin遗传学软件包中的gap、bestfit、fasta和tfasta,geneticscomputergroup,575sciencedr.,madison,wi;可从国家生物技术信息中心获得的tatusova和maddenfemsmicrobiol.lett.174:247-250(1999)的blast算法(http://www.ncbi.nlm.nih.gov/blast/bl2seq/bl2.html);或通过观察进行用于比较的序列的最佳比对。
对于核酸而言,例如用通过这样至少对关于核酸比对的材料的引用并入本文的zuker,science244:48-52,1989;jaeger等proc.natl.acad.sci.usa86:7706-7710,1989;jaeger等methodsenzymol.183:281-306,1989中公开的算法可以获得相同类型的同一性。应理解,通常可以使用任何方法并且,在某些情况下,这些不同方法的结果可以不同,但是技术人员理解如果用这些方法中的至少一种找到同一性,则序列将被称为具有规定的同一性。
例如,如本文中所用,叙述为与另一序列具有特定百分比同一性的序列是指通过以上描述的一种或多种计算方法计算,具有所叙述的同一性的序列。例如,如果使用zuker计算方法计算第一序列与第二序列具有80%同一性,即使通过任何其它计算方法计算第一序列与第二序列不具有80%同一性,如本文所定义,第一序列与第二序列也具有80%同一性。作为再一个实例,如果使用每种计算方法计算第一序列与第二序列具有80%同一性(虽然实际上,不同计算方法往往会产生不同的计算同一性百分比),则如本文所定义,第一序列与第二序列具有80%同一性。
进一步地,任何msp或msp单体也可经化学或生物学修饰。例如,正如本领域的技术人员所知,可以用化学药品修饰msp或msp单体以产生二硫桥。
msp可包含核苷酸结合位点。如本文中所用,核苷酸结合位点是指在msp中核苷酸接触或留在氨基酸上一段时间的位点,归因于扩散运动这段时间较长,如大于1皮秒或1纳秒。可采用分子动力学计算来评估这些暂时休息时间。
还提供了本文描述的核酸编码的多肽。因此提供了包含突变msp单体或其功能片段的多肽。突变msp单体的非限制性实例包括但不限于包含含有本文描述的任何突变的seqidno:1、seqidno:2、seqidno:3和seqidno:4的多肽。还提供了包含的氨基酸序列与包含seqidno:1、seqidno:2、seqidno:3和seqidno:4的多肽具有至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%同一性或之间的任何百分比的msp单体,其中所述多肽包含本文描述的任何突变。还提供了包含突变单链msp或其功能片段的多肽。还提供了包含突变单链msp或其片段的多肽,突变单链msp包含本文描述的任何突变msp单体。
表2中提供了包含本文所述突变的突变msp单体的非限制性实例。每个示例性突变msp单体包含对于每个单体列出的所有突变。例如,d90n/d91n/d93n/p97f指四种突变全部存在。本文还提供了包含表2中提供的任何示例性突变msp单体序列的单链msp。应理解括号内列出的氨基酸是作为该位置用于取代的替代物列出。例如,p97(a/v/l/if/m/y/w或g)意为p97可经a、v、l、i、f、m、yw或g取代。
表2
通道形成蛋白
确定蛋白质是否是通道形成蛋白的方法在本领域中公知。可以通过确定蛋白质是否插入双层中来确定msp是否形成通道,例如美国专利公布第20120055792号的实施例2中所述,其通过引用整体并入本文。美国专利公布第20120055792号中描述的所有制备和使用孔蛋白的方法均可用于制备和使用本文描述的msp孔蛋白。如果蛋白质插入双层中,则孔蛋白为通道形成蛋白。通常,通过观察导电性的离散变化来检测通道形成。参见,美国专利公布第20120055792号,和niederweis等,mol.microbiol.33:933(1999),二者通过引用并入本文。
本文描述了双层。msp通常将能够插入各自在本领域中公知的脂质双层或其它薄膜中。在美国专利公布第20120055792号中提供了将突变mspa插入脂质双层的实例;这种技术也可适用于其它msp蛋白。另外,通过引用并入本文的美国专利第6,746,594号描述了多种脂质双层和薄膜,包括就本文讨论的msp而言可以采用的无机材料。通过引用并入本文的美国专利第6,267,872号中描述的方法、装置和技术就本文讨论的msp而言也可采用。而且,在脂质双层中可以包含一种以上的msp。例如,在脂质双层中可以包含2、3、4、5、10、20、200、2000或更多种。任选地,在本文描述的方法中可以采用从2至1010任意数量的msp。这样多种的msp可以呈msp集群的形式。集群可以随机组装或者可以采用一种模式。如本文中所用,集群是指集中在一起并且作为一个单元移动,但是未相互共价结合的分子。
任选地,msp不自发门控。如本文中所用,门控是指通过蛋白质通道的电导通常暂时的自发变化(例如,持续少至1-10毫秒或达1秒)。长期持续的门控事件常常可以通过改变极性而逆转。在大多数情况下,门控概率随着施加更高的电压而增加。门控和通过通道的电导变化的程度在msp间,根据例如前厅和缢缩区的构成以及浸没蛋白质的液体介质的性质高度可变。通常,蛋白质在门控期间导电性变低,并且电导可因此永久性停止(即,通道可永久性关闭),使得该过程不可逆。任选地,门控是指通过蛋白质通道的电导自发变成低于其开口状态电流的75%。
各种条件如光和液体介质,包括其ph、缓冲液组成、去垢剂组成和温度,可以影响msp的行为,特别是就其通过通道的电导以及分析物相对于通道暂时性或永久性的运动而言。
如通篇所用,通道是指由前厅和缢缩区限定的,气体、液体、离子或分析物可以通过其中的msp的中心、空部分。如本文中所用,“顺(cis)”是指分析物通过其进入通道或分析物移动跨越其表面的msp通道侧面。如本文中所用,“反(trans)”是指分析物(或其片段)通过其离开通道或分析物未移动跨越其表面的msp通道侧面。
本文描述的任何突变msp,例如突变mspa,可包含限定通道的前厅和缢缩区。进一步地,突变msp或突变msp旁系同源物或同源物的直径可小于相应野生型msp或野生型msp旁系同源物或同源物的缢缩区的直径。突变msp或突变msp旁系同源物或同源物可在前厅或缢缩区内具有突变,其容许分析物通过电泳或以其它方式转位穿过突变msp或突变msp旁系同源物或同源物的通道,转位速度或平均转位速度低于分析物转位穿过野生型msp或野生型msp旁系同源物或同源物的通道的转位速度或平均转位速度。同样,本文描述的任何突变msp可包含长度为约2至约6nm且直径为约2至约6nm的前厅,和长度为约0.3至约3nm且直径为约0.3至约3nm的缢缩区5,其中所述前厅和缢缩区一起限定通道。应理解,可以在本文描述的任何msp的前厅或缢缩区中产生一个或多个突变以便增加或降低通过msp通道的电导。例如,本文描述的任何突变msp还可包含在前厅和/或缢缩区内的氨基酸缺失、取代或插入以改变电导。
如通篇所用,前厅是指msp内部直径通常沿着中轴线从一端到另一端减小的锥形部分,其中前厅最窄的部分与缢缩区连接。前厅也可称为高脚杯区。前厅和缢缩区一起限定msp的通道。提到前厅的直径时,应理解因为前厅形状上似锥形,所以直径沿着中轴线的路径变化,其中直径在一端比对端大。直径范围可为约2nm至约6nm。任选地,直径为约、至少约或至多约2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9或6.0nm,或其中可推论的任何范围。中轴线的长度范围可为约2nm至约6nm。任选地,长度为约、至少约或至多约2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9或6.0nm,或其中可推论的任何范围。本文提到直径时,可以通过测量中心到中心的距离或原子表面到表面的距离来测定直径。
如通篇所用,缢缩区是指msp通道在直径方面最狭窄的部分,其与前厅连接。缢缩区的长度范围可为约0.3nm至约2nm。任选地,长度为约、至多约或至少约0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2或3nm,或其中可推论的任何范围。缢缩区的直径范围可为约0.3nm至约2nm。任选地,直径为约、至多约或至少约0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2或3nm,或其中可推论的任何范围。
本文讨论的任何msp均可包含在脂质双层中。任选地,分析物通过电泳或以其它方式从同侧转位通过通道到达反侧。任选地,分析物通过电泳或以其它方式从反侧转位穿过通道到达同侧。任选地,通过电泳或以其它方式驱使分析物从同侧或反侧进入通道并且留在通道中或之后分别退回到同侧或反侧。应理解分析物可以在电场存在或缺乏时转位穿过通道。
单链msp在各种不同的电解液浓度下起作用,例如约0.3-1mkcl(参见图22)。为优化通道活性,在msp插入膜或脂质双层之前可以进行脂质缔合。在非限制性实例中,图22显示在ph8.0的仅含0.3mkcl的缓冲液中未观察到通道活性。然而,使膜破裂且随后复涂该膜导致在ph8.0的含0.3mkcl的电解液中scmspapn1的通道活性增强。因此,在本文所述的任何方法中,可用一种或多种脂质接触或预温育msp以优化通道活性。
载体和细胞
还提供了包含编码本文描述的多肽的核酸的载体。载体还可包含启动子序列,例如组成型启动子或诱导型启动子。组成型启动子的实例包括但不限于psmyc启动子和phsp60。诱导型启动子的实例包括但不限于乙酰胺诱导型启动子和四环素诱导型启动子。
还提供了经本文描述的任何载体转染的培养细胞,或其子代,其中该细胞能够表达msp(作为单链msp、包含msp单体的msp或msp单体)。还提供了包含本文描述的任何载体的耻垢分枝杆菌菌株。无内源性孔蛋白的耻垢分枝杆菌菌株也被考虑到并且还可包含本文描述的任何载体。用“无”意指在使用适当的msp-特异性抗血清时在免疫印迹中不能检测出内源性孔蛋白,或包含少于1%的内源性孔蛋白。
本文公开的任何msp单体或单链msp可通过以下产生:用包含与编码msp单体或单链msp孔蛋白的核酸序列可操作地连接的诱导型启动子的载体转化包含野生型mspa、野生型mspb、野生型mspc、野生型mspd的缺失的突变细菌菌株;并且纯化msp单体或单链msp孔蛋白(参见,例如通过引用并入本文的美国专利第6,746,594号)。任选地,突变细菌菌株包含reca基因的缺失。任选地,载体包含编码本文描述的msp单体或单链msp的任何核酸。细菌菌株还可包含耻垢分枝杆菌菌株ml16、ml714或ml712。
系统和使用方法
还提供了一种系统,其包含本文描述的具有限定通道的前厅和缢缩区的突变msp,其中所述通道位于第一液体介质和第二液体介质之间,其中至少一种液体介质包含分析物,并且其中所述系统可操作以检测分析物的性质。系统可操作以检测任何分析物的性质,包括使msp受到电场,使得分析物与msp相互作用。系统可操作以检测分析物的性质,包括使msp受到电场,使得分析物通过电泳转位穿过msp的通道。还提供了一种系统,其包含具有限定通道的前厅和缢缩区的msp,其中所述通道位于第一液体介质和第二液体介质之间的脂质双层中,并且第一和第二液体介质之间唯一的液体连通点出现在通道中。而且,本文描述的任何系统均可包含本文描述的任何突变msp。
第一和第二液体介质可以相同或不同,并且任一种或两种可包含一种或多种盐、去垢剂或缓冲剂。事实上,本文描述的任何液体介质均可包含盐、去垢剂或缓冲剂中的一种或多种。任选地,至少一种液体介质导电。任选地,至少一种液体介质不导电。本文描述的任何液体介质均可包含粘度改变物质或速度改变物质。液体介质可包含本文描述的任何分析物。
分析的性质可为电、化学或物理性质。msp可包含在系统或本文描述的任何其它实施方案中的脂质双层中。系统可包含多种msp。系统可包含本文描述的任何msp,如单链突变mspa或包含至少2-15个单体的突变msp,其中至少一个单体为突变mspa单体。系统中包含的突变msp可包含长度为约2至约6nm且直径为约2至约6nm的前厅,和长度为约0.3至约3nm且直径为约0.3至约3nm的缢缩区,其中所述前厅和缢缩区一起限定通道。
本文描述的任何msp,包括系统中包含的msp,还可包含分子发动机。系统中的分子发动机能够使分析物移入或穿过通道,转位速度或平均转位速度低于在没有分子发动机时分析物转位入或穿过通道的转位速度或平均转位速度。分子发动机可以是,例如酶,如聚合酶、外切核酸酶或解螺旋酶(如dnab)或噬菌体核酸包装发动机(参见,例如serwerviruses3(7):1249-80(2011))。本文描述的任何系统还可包含膜片钳放大器或数据获取装置。系统还可包含一个或多个与第一液体介质、第二液体介质或两者连通的温度调节装置。本文描述的任何系统可操作以通过电泳或以其它方式转位分析物穿过msp通道。
突变mspa可以在前厅或缢缩区内具有突变,其容许分析物,例如通过电泳,转位穿过通道,平均转位速度低于0.5nm/μs或低于0.05nm/μs。分析物可选自由以下组成的组:核苷酸、核酸、氨基酸、肽、蛋白质、聚合物、药物、离子、生物战剂、污染物、纳米级物体或其组合或集群。任选地,可将分析物进一步定义为核酸。核酸可通过电泳或以其它方式转位穿过通道,平均转位速度低于1个核苷酸/μs或低于0.1个核苷酸/μs。可将核酸进一步定义为ssdna、dsdna、rna或其组合。
如本文中所用,通过电泳转位分析物是指向接触一种或多种溶液(例如,浸入溶液中)的msp孔蛋白施加电场,使得电流流过msp通道。电场使分析物移动,使其与通道相互作用。如本文中所用,“相互作用”意指分析物移入和任选地,穿过通道,其中“穿过msp通道”(或“转位”)意为进入通道一侧并且移向且移出通道的另一侧。特别考虑到,在本文讨论的任何实施方案中,本文讨论的任何分析物均可通过电泳或以其它方式转位穿过msp通道。就这一点而言,特别考虑到除非特别指出,否则本文中包含转位的任何实施方案可以指电泳转位或非电泳转位。任选地,考虑到了不采用电泳转位的方法。
如通篇所用,液体介质包括含水介质、有机含水介质和有机仅液体的介质。有机介质包括,例如甲醇、乙醇、二甲亚砜及其混合物。本文描述的方法中可采用的液体在本领域中公知。在例如通过引用整体并入本文的美国专利第7,189,503号中提供了此类介质,包括导电液体介质的描述和实例。可向此类介质中添加盐、去垢剂或缓冲剂。此类试剂可用于改变液体介质的ph或离子强度。在液体介质中可包括粘度改变物质,如甘油或各种聚合物(例如,聚乙烯吡咯烷酮、聚乙二醇、聚乙烯醇、纤维素聚合物)及其混合物均。测量粘度的方法在本领域中公知。
可向液体介质添加的任何试剂也可改变正在研究的分析物的速度。这样,速度改变剂可为盐、去垢剂、缓冲剂、粘度改变物质或添加到液体介质中增加或降低分析物速度的任何其它试剂。通常,本文采用的分析物在接触本文描述的msp的至少一种液体介质中可溶或部分可溶。
如本文中所用,核酸是指呈单链或双链形式的脱氧核糖核苷酸或核糖核苷酸聚合物,并且除非另有限制,否则涵盖以类似于自然存在的核苷酸的方式与核酸杂交的天然核酸已知类似物,如肽核酸(pna)和硫代磷酸酯dna。除非另外指出,否则特定核酸序列包括其互补序列。核苷酸包括但不限于atp、datp、ctp、dctp、gtp、dgtp、utp、ttp、dutp、5-甲基-ctp、5-甲基dctp、itp、ditp、2-氨基-腺苷-tp、2-氨基-脱氧腺苷-tp、2-硫代胸苷三磷酸、吡咯-嘧啶三磷酸和2-硫代胞苷,以及以上所有的α硫代三磷酸盐,和以上所有碱基的2'-0-甲基-核糖核苷三磷酸。经修饰的碱基包括但不限于5-br-utp、5-brdutp、5-f-utp、5-f-dutp、5-丙炔基dctp和5-丙炔基-dutp。
如本文中所用,药物是指可以改变受试者的生物学过程的任何物质。药物可以设计或用于受试者疾病、病症、综合征或其它健康困扰的诊断、治疗或预防。药物在本质上可以是供休养的,即,仅用于改变生物学过程而不用于受试者疾病、病症、综合征或其它健康困扰的诊断、治疗或预防。生物制剂,指通过牵涉重组dna技术的生物机制生成的物质,也被术语药物所涵盖。药物包括,例如抗菌剂、抗炎药、抗凝剂、抗病毒剂、抗高血压药、抗忧郁药、抗微生物剂、止痛药、麻醉剂、β-阻断剂、二磷酸盐、化疗剂、造影剂、生育药物、致幻剂、激素、毒品、鸦片剂、镇静剂、他汀类(statin)、类固醇和血管舒张剂。在merckindex:anencyclopediaofchemicals,drugs,andbiologicals,第15版newjersey:merck,2013中也可以找到药物的非限制性实例。用于治疗结核的抗菌药物例如包括异烟肼、利福平、吡嗪酰胺和乙胺丁醇。采用药物作为分析物的方法还可包括药物筛选。例如,可以使用msp,通过观察离子电流阻塞来研究药物向细胞或生物体内的摄取。可构建具有不同大小、静电性质和化学性质的特定msp孔蛋白缢缩区和/或前厅以精密模仿药物进行或离开细胞或生物体所需的途径。这些方法可以大大加速药物筛选以及药物设计(参见,例如pagel等,j.bacteriology189:8593(2007))。
如本文中所用,生物战剂是指能够在植物或动物(包括人类)中引起死亡或疾病或食物降解或供水或环境退化的任何生物体或任何此类生物体的任何自然存在的、生物工程化或合成的组分。非限制性实例包括埃博拉病毒(ebolavirus)、马尔堡病毒(marburgvirus)、炭疽杆菌(bacillusanthracis)和肉毒梭状芽胞杆菌(clostridiumbotulinum)、重型天花(variolamajor)、轻型天花(variolaminor)、炭疽(anthrax)和篦麻毒素(ricin)。
如本文中所用,污染物是指污染空气、水或土壤的物质。污染物的非限制性实例包括肥料、杀虫剂、杀昆虫剂、去垢剂、石油烃、烟和含重金属的物质,如含锌、铜或汞(例如,甲基汞)的那些。
本文可以使用任何分析物,包括例如核苷酸、核酸、氨基酸、肽、蛋白质、聚合物、药物、离子、生物战剂、污染物、纳米级物体或包含这些分析物之一或其组合的任何其它分子。分析物可以是分亚组群(例如2-10个核苷酸或氨基酸),因为将作为一个整体的集群视为分析物。通常,分析物的大小不会如此大以致其不能进入msp的通道。换言之,典型分析物将在大小上比msp的通道开口小。然而,可以采用大小比通道开口大的分析物,并且可以确定分析物的大小太大而不能进入通道。任选地,分析物的分子量小于1,000,000da。任选地,分析物的分子量为约、至多约或至少约1,000,000、950,000、900,000、850,000、800,000、750,000、700,000、650,000、600,000、550,000、500,000、450,000、400,000、350,000、300,000、250,000、200,000、150,000、100,000、75,000、50,000、25,000、20,000、15,000、10,000、7,500、5,000、2,500、2,000、1,500、1,000或500da或更小,或其中可推论的任何范围。
分析物也可以是纳米级物体,即是在其两个维度上小于100nm的物体。如本文中所用,分析物还可包含磁珠。可将磁珠进一步定义为链霉亲和素包被磁珠。分析物还可包含光珠。本文描述的任何分析物均可为离子或可为中性。分析物可包含生物素。
可以采用的珠粒包括磁珠和光珠。例如,可以使用链霉亲和素包被磁珠向牵引dna通过msp通道的静电力施加反作用力。在这后一种技术中,磁珠附着于生物素化dna,并且将使用强磁场梯度施加与静电推动力(-10pn)同等的力。参见gosse和croquette,biophys.j.82:3314(2002)。这样,阻塞电流读出将不受影响,但可以独立控制dna上的力。然后可以关联并集合每个dna数十个或数百个的完整独立读数以重构准确的dna序列。
用“光镊”操纵的光珠在本领域中也已知,并且此类方法可适用于本文描述的msp。光镊是用于对纳米级物体施加力的常用工具。分析物附着于珠粒一端,而另一端可插入孔蛋白的通道中。用光镊控制并测量珠粒的位置和力。此类方法控制分析物进入通道的通道并且允许对分析物的读数,例如聚合物单元的读数的更多控制。对于此类方法在人工纳米孔情况下的描述,参见例如trepagnier等,nanolett.7:2824(2007)。通过引用并入本文的美国专利第5,795,782号也讨论了光镊的用途。
荧光共振能量转移(fret),一种公知技术,可以用于本文描述的分析方法中。例如,荧光fret受体或fret供体分子可并入msp中。然后用匹配的fret供体或fret受体标记分析物。当匹配的fret供体在fret受体的forster距离之内时,将很可能发生能量转移。所产生的信号可用于分析目的,代替或补充如本文所述使用离子电流的方法。因此,检测、鉴定或测序方法可包括fret技术。可以采用的其它光学方法包括向msp内部(例如前厅或缢缩区)引入光学活性分子。将施加外部光以影响蛋白质的内部。此类方法可用于影响分析物的转位速度或可允许分析物进入或离开通道,提供了分析物的受控通道。可选地,聚焦在孔隙上的光脉冲可用于加热孔隙以影响其如何与分析物相互作用。此类控制可以非常快,因为来自小体积焦点的热量将迅速消散。因此控制分析物转位速度的方法可以采用此类光学活性分子或光脉冲。转位速度的操纵也可以通过使物体附着于分析物的一端来实现,并且然后分析物的另一端与msp相互作用。所述物体可以是珠粒(例如聚苯乙烯珠粒)、细胞、大分子(如链霉亲和素、中性抗生物素蛋白(neutravidin)、dna等)或纳米级物体。然后该物体可受到流体流或可以受到被动粘性阻力。
分子发动机在本领域中公知并且是指与分析物,如聚合物(例如,15多聚核苷酸)物理性相互作用,并且能够相对于固定位置,如msp的前厅、缢缩区或通道物理性移动分析物的分子(例如,酶)。虽然不想要受理论约束,但分子发动机利用化学能产生机械力。分子发动机可与聚合物的每个单元(或“聚体(mer)”)按顺序方式相互作用。分子发动机的非限制性实例包括dna聚合酶、rna聚合酶、解螺旋酶、核糖体和外切核酸酶。非酶发动机也已知,如包裹dna的病毒发动机。参见smith等,nature413:748(2001)。在美国专利第7,238,485号中描述了各种分子发动机和此类发动机的期望性质,该专利通过引用整体并入本文。
分子发动机可置于msp孔蛋白的同侧或反侧并且可任选地固定,如'485专利所述。将分子发动机并入msp中的方法可以使用'485专利中描述的方法进行。就本文描述的msp而言也可以采用'485专利中描述的系统和装置。实际上,如本文所述,使用msp,可以采用'485专利中讨论的任何实施方案。在例如cockroft等,j.amer.chem.soc.130:818(2008);benner等,naturenanotech.2:718(2007);和gyarfas等,acsnano3:1457(2009)中也讨论了分子发动机。
分子发动机通常用于调节分析物与msp相互作用的速率或转位速度。本文描述的任何msp均可包含分子发动机。任选地,分子发动机用于降低分析物进入msp孔蛋白通道的速率或降低分析物转位穿过msp通道的转位速度。任选地,转位速度或平均转位速度低于0.5nm/μs。任选地,转位速度或平均转位速度低于0.05nm/μs。任选地,转位速度或平均转位速度低于1个核苷酸/μs。任选地,转位速度或平均转位速度低于0.1个核苷酸/μs。
任选地,分析物的移动速率范围从大于0hz到2000hz。这里,速率是指在1秒内(hz)规则聚合物前进的亚单位(或“聚体(mer)”)的数量。任选地,范围介于约50-1500hz、100-1500hz或350-1500hz之间。任选地,移动速率为约、至多约或至少约25、75、100、150、200、250、300、15350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1050、1100、1150、1200、1250、1300、1350、1400、1450、1500、1550、1600、1650、1700、1750、1800、1850、1900、1950或2000hz,或其中可推论的任何范围。在表征期间的至少一部分时间,通过使用以基本上恒定的速率移动分析物的分子发动机来控制速率。另外,移动速率的范围可取决于分子发动机。例如,对于rna聚合酶而言,范围可为350-1500hz;对于dna聚合酶而言,范围可为75-1500hz;并且对于核糖体、解螺旋酶和外切核酸酶而言,范围可为50-1500hz。
在本文描述的方法中可以采用记录和检测技术。另外,通过引用整体并入本文的美国专利第5,795,782和7,189,503号也描述了就msp而言可以采用的记录方法和仪器,以及优化电导读数的方法。通过引用整体并入本文的美国专利第6,746,594号描述了用于含纳米孔的薄膜的支撑物及使用就本文描述的msp而言可以采用的此类支撑物的方法。
制备单链msp的方法
msp孔隙,例如mspa是目前用于核酸纳米孔测序的最佳可用通道蛋白。然而,其8个亚单位的组成使得不可能在孔隙中引入可以优化msp对于核酸测序的性质的不对称变化。为了克服这种困难,本文提供了制备单链msp的方法。这些方法可用于生成完全或部分单链msp。通常,该方法包括转化突变细菌菌株。突变菌株包含野生型mspa、野生型mspb、野生型mspc、野生型mspd的缺失,和任选地reca基因的缺失。用包含编码单链msp孔蛋白的核酸的载体转化突变菌株。然后从细菌中纯化单链msp孔蛋白。任选地,单链msp孔蛋白包含单链mspa孔蛋白。任选地,该载体包含本文描述的任何核酸。
如实施例中所述,为了组合mspa的优良测序能力与增强的使前厅和收缩性质适于dna测序的能力,构建了单链mspa孔蛋白八聚体,其允许前厅和缢缩区对于dna测序的最佳性质。在mspa孔蛋白蛋白中mspa链端靠在一起并且通过短肽接头连接。(ggggs)3(seqidno:3)肽,例如,用于连接前一个mspa单体(或多聚体)的羧基端与下一个缺乏信号肽的mspa单体(或多聚体)的氨基端。为产生包含mspa孔蛋白序列的载体,每个mspa单体序列侧接独特限制位点,其允许使任何单独单体突变的能力。为了产生mspa孔蛋白序列,可以利用独特限制位点逐步组装每个mspa序列以形成二聚体、四聚体和八聚体单链mspa。为了在产生单链mspa多聚体中避免重组问题,以不同的密码子使用合成7个mspa基因,即所述基因编码完全相同的氨基酸序列,然而dna序列已经由天然mspa核苷酸序列(seqidno:10)改变。为了产生mspa孔蛋白序列,编码第一msp单体的核苷酸序列可任选地含有编码前导序列(例如,seqidno:6的氨基酸1-27)的核酸序列。在第一msp单体序列之后的7个msp单体中的每一个均可包含seqidno:1或具有本文描述的一个或多个突变的seqidno:1。包含mspa孔蛋白序列的载体转化到四孔蛋白突变细菌菌株中,如实施例中所述。任选地,可纯化单链msp并且经受再折叠过程。例如,在8m脲存在下的阴离子交换色谱法可用于获得单链msp的纯净成分,该纯净成分经缓冲液透析以去除脲。透析之后,向样品中添加包含再折叠剂(例如l-精氨酸)和去垢剂的再折叠缓冲液并且纯化,获得再折叠单链msp。再折叠剂为本领域技术人员已知。这些包括但不限于精氨酸、盐酸精氨酸、精氨酰胺、甘氨酰胺、脯氨酸、甘油和环糊精(参见例如,yamaguchi等biomolecules4:235-251(2014);并且可通过western印迹或本领域技术人员已知的其它免疫组织化学技术检查mspa孔蛋白的表达水平和寡聚状态。可通过脂质双层实验测定mspa孔蛋白的通道活性,如实施例中所述并且如本领域技术人员所知。
单链m18-mspa孔隙插入脂质双层比相似量的八聚体m1-mspa频繁得多。八聚体mspa的插入是冗长的过程。因此,单链msp,如本文描述的那些,利于使用msp检测和鉴定分析物,例如用于核酸测序的系统和方法的设置。
增加脂质双层中msp插入的方法
本文提供了一种增加脂质双层中msp插入数量的方法,其包括使本文描述的任何msp与脂质接触以形成脂质缔合msp并且将该步骤的脂质缔合msp插入脂质双层中。任选地,接触步骤包括在脂质双层中插入msp并且破坏脂质双层以形成脂质缔合msp。例如,可以在脂质双层中插入msp,随后破坏脂质双层。破坏的脂质双层包含msp。因此,msp与脂质缔合。然后可以使脂质缔合msp与其它脂质接触以形成另一包含脂质缔合msp的脂质双层。如本文中所用,脂质双层是包含可用于插入本文提供的任何msp的脂质分子,例如磷脂的薄膜。因此,在本文提供的方法中,可以使msp与作为脂质双层的一部分或不是其一部分的磷脂接触,以便形成脂质缔合msp。
如上所述,本领域的技术人员可以使用诸如通过引用整体并入本文的美国专利第20120055792号的实施例2中描述的技术确定msp是否插入双层中。美国专利第20120055792号中描述的所有制备和使用孔蛋白的方法可用于制备和使用本文描述的msp孔蛋白。如果蛋白质插入双层中,则孔蛋白为通道形成蛋白。通常,通过观察导电性的离散变化来检测通道形成。参见,美国专利公布第20120055792号,和niederweis等,mol.microbiol.33:933(1999),二者通过引用并入本文。msp插入的增加可为约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、200%、300%、400%或更多的增加。
检测方法
还提供了一种检测分析物的存在的方法,其包括:(a)施加足以使分析物通过本文描述的任何突变msp从第一导电介质转位到液体连通的第二导电介质的电场;并且(b)测量离子电流,其中离子电流减小表明在第一介质中存在所述分析物。任选地,第一和第二液体导电介质相同。任选地,第一和第二液体导电介质不同。突变msp孔蛋白可以是本文讨论的任何突变msp孔蛋白。例如,msp孔蛋白可以是突变单链msp、包含2-15个单体的突变msp或其组合。如上所述,在本文描述的方法中也可使用多种msp。
在本文公开的方法中,msp还可包含分子发动机。分子发动机能够使分析物移入或穿过通道,转位速度或平均转位速度低于在没有分子发动机时所述分析物通过电泳转位入或穿过该通道的转位速度或平均转位速度。因此,在本文包括施加电场的任何实施方案中,电场可足以使分析物通过电泳转位穿过通道。本文讨论的任何液体介质,如导电液体介质,可包含分析物。在包括测量离子电流的方法中,分析物与msp孔蛋白通道相互作用以提供电流模式,其中电流模式中阻塞的出现表明存在所述分析物。
本文公开的方法还可包括鉴定分析物。例如,此类方法可包括将关于未知分析物获得的电流模式与使用已知分析物在相同条件下获得的已知电流模式做比较。在另一个实例中,而非限制,鉴定分析物可包括(a)测量离子电流以提供电流模式,其中电流的减小定义了电流模式中的阻塞,并且(b)将该电流模式中的一个或多个阻塞与(i)该电流模式中的一个或多个阻塞,或(ii)使用已知分析物获得的已知电流模式中的一个或多个阻塞做比较。
分析物可以是本文描述的任何分析物。例如,分析物可为核苷酸、核酸、氨基酸、肽、蛋白质、聚合物、药物、离子、污染物、纳米级物体或生物战剂。在本文提供的方法中,任选地,第一或第二导电液体介质中的至少一种包含多种不同的分析物。
在分析物为聚合物,例如蛋白质、肽或核酸的方法中,所述方法还可包括鉴定聚合物的一个或多个单元。例如,鉴定聚合物的一个或多个单元可包括测量离子电流以提供对于每个聚合物单元而言包含阻塞的电流模式,并且将该电流模式中的一个或多个阻塞与(i)该电流模式中的一个或多个其它阻塞或(ii)使用具有已知单元的聚合物获得的电流模式中的一个或多个阻塞做比较。这些方法可包括鉴定聚合物的顺序单元,例如而非限制,核酸中的顺序或连续核苷酸。在另一个实例中,可以使用本文描述的方法鉴定多肽中的顺序或连续氨基酸。
本文提供的方法可包括将聚合物内的至少第一单元与该聚合物内的至少第二单元区别开。区别可包括测量在第一和第二单元单独转位穿过通道时产生的离子电流以分别产生第一和第二电流模式,其中第一和第二电流模式相互不同。
本文提供的方法还可包括为聚合物测序。测序可包括测量聚合物的每个单元单独转位穿过通道时的离子电流或光信号以提供与每个单元相关的电流模式,并且将每个电流模式与在相同条件下获得的已知单元的电流模式做比较,以便为聚合物测序。
还提供了一种使用本文提供的任何突变msp为核酸或多肽测序的方法。所述方法包括产生包含第一和第二侧面的脂质双层,向脂质双层的第一侧面添加纯化msp,向脂质双层的第二侧面施加正电压,使实验核酸或多肽序列转位穿过msp孔蛋白,将实验阻塞电流与阻塞电流标准做比较,并确定实验序列。
本文提供的任何检测方法还可包括测定分析物的浓度、大小、分子量、形状或取向,或其任何组合。
如本文中所用,聚合物是指包含两个或更多个线性单元(也称为“聚体(mer)”)的分子,其中每个单元可相同或不同。聚合物的非限制性实例包括核酸、肽和蛋白质,以及多种烃类聚合物(例如聚乙烯、聚苯乙烯)和功能化烃类聚合物,其中聚合物的骨架包含碳链(例如,聚氯乙烯、聚甲基丙烯酸酯)。聚合物包括共聚物、嵌段共聚物和支化聚合物如星形聚合物和树状聚合物。
本文描述了使用msp为聚合物测序的方法。另外,测序方法可以在类似于通过引用整体并入本文的美国专利第7,189,503号中描述的那些的方法中进行。还参见美国专利第6,015,714号,其通过引用整体并入本文。在此类测序方法中可以进行一次以上读数以提高精确度。在'503专利中也讨论了分析聚合物的特征(例如,大小、长度、浓度、同一性)和鉴定聚合物的离散单元(或“聚体(mer)”)的方法,并且对于本msp可以采用。实际上,对于'503专利中讨论的任何方法均可采用msp。
目前,几种类型的可观测信号可以在纳米孔测序和分析物检测中用作读出机制。示例性读出方法依赖于离子阻塞电流或共同通过电流,其独特地通过核苷酸或占据孔隙中最窄收缩部分的其它分析物的同一性测定。这种方法被称为阻塞电流纳米孔测序或bcns。核酸的阻塞电流检测和表征已经在蛋白质孔隙a-溶血毒素(ahl)和固态纳米孔两者中得以证明。
已经证实阻塞电流检测和表征提供了许多关于在各种情况下穿过或留在纳米孔中的dna结构的信息。一般而言,阻塞由离子电流的变化证明,该变化由噪声波动清晰可辨并且通常与孔隙中心开口处分析物分子的存在相关。阻塞的强度将取决于存在的分析物的类型。更具体地,阻塞是指离子电流降低到未阻塞电流水平约5-100%阈值以下,保持至少1.0μs,并且自发恢复到未阻塞水平的间隔。例如,离子电流可降低到约、至少约或至多约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%或其中可推论的任何范围的阈值以下。如果就在其之前或之后的未阻塞信号的平均电流偏离典型未阻塞水平,未阻塞信号的平方根噪声值(rmsnoise)两倍以上,则拒绝阻塞。将深度阻塞鉴定为离子电流降低到<未阻塞水平的50%的间隔。将电流保持在未阻塞水平的80%和50%之间的间隔鉴定为部分阻塞。
公开了可用于公开的方法和组合物,可连同其使用,可用于其制备或为其产物的材料、组合物和组分。本文公开了这些和其它材料,并且应理解当公开这些材料的组合、亚组、相互作用、分组等时,虽然可能未明确公开对每种不同的单独和集体的组合和排列的特指,但是每一种都被特别考虑到并且在本文中有描述。例如,如果公开并讨论一种方法并且讨论了可以对该方法中所包括的许多组合物进行的许多修改,则除非明确指出相反,否则特别考虑到了该方法的每种组合和排列及可能的修改。同样,还特别考虑到且公开了这些的任何亚组或组合。这种概念适用于本公开的所有方面,包括但不限于方法中的步骤。因此,如果存在多个可以进行的附加步骤,则应理解这些附加步骤中的每一步均可用公开方法的任何特定方法步骤或方法步骤的组合进行,并且每个此类组合或组合的亚组都被特别考虑到并且应视为公开的。还考虑到,本说明书中讨论的任何实施方案对于本文描述的任何方法、化合物、蛋白质、孔蛋白、肽、多肽、多聚体、单体、核酸、载体、菌株、培养细胞、系统或组合等均可实现,并且反之亦然。
本文引用的出版物及其引用的材料据此明确地通过引用整体并入。
已经描述了许多实施方案。然而,应理解可做各种修改。因此,其它实施方案是在以下权利要求书的范围之内。
实施例
构建单链mspa,其由8个共价连接的单体组成。如本文所示,编码单链m1-mspa的表达质粒在野生型耻垢分枝杆菌中不稳定,但是在缺乏同源重组所需的reca基因的耻垢分枝杆菌中可以增殖。reca基因在缺乏4种已知msp孔蛋白的四孔蛋白突变耻垢分枝杆菌ml712中缺失。该菌株使得单链m1-mspa的表达成为可能。单链m1-mspa产生的通道具有与八聚体m1-mspa通道相似的电导,但是对电压门控的耐受性极大提高。单链mspa这种不可预见的优势对于核酸,例如dna的纳米孔测序非常重要。
耻垢分枝杆菌的msp四缺失突变体的构建
为了分离突变mspa孔蛋白,使用三孔蛋白缺失突变耻垢分枝杆菌ml16菌株(δmspa::frt、δmspc::frt、δmspd::frt)(参见stephan等人,mol.microbiol.58:714-730(2005))。然而,在这种菌株中用mspa特异性兔抗血清在免疫印迹中仍然检测到低水平的mspb。mspb的存在可有助于在单通道实验中观察到的异质性并且使数据分析变得复杂。为了克服这个问题并且改进mspa制备,构建了缺乏全部4个msp基因的耻垢分枝杆菌菌株。
因为耻垢分枝杆菌4个msp基因全部缺失是致死性的,所以第一步是将cpnt(1)的n端通道形成结构域的表达盒整合到耻垢分枝杆菌孔蛋白三突变体ml16中。为此,构建质粒pml2622,其携带在腈诱导型启动子的控制下经his6和ha标记的cpnt的n端结构域(图2)。cpnt的n端结构域在平面双层实验中形成通道并且在甘油吸收实验中补充孔蛋白突变耻垢分枝杆菌ml16菌株。将救援质粒pml2622整合到孔蛋白三突变耻垢分枝杆菌ml16染色体中的分枝杆菌噬菌体l5-位点中。用与l5基因组区域互补的引物集通过pcr确认整合。这个菌株命名为耻垢分枝杆菌ml709。pml2622整合后,用如stephan等(gene343:181-190(2004))描述的flp重组酶从染色体上切除质粒骨架以去除编码潮霉素磷酸转移酶和l5整合酶的基因。这个菌株命名为耻垢分枝杆菌ml709-234。
为使耻垢分枝杆菌ml711中的剩余mspb基因缺失,构建mspb缺失载体pml1611,其含有两个作为整合和等位置换标志的报告基因gfp和xyle(图2)。mspb缺失载体pml1611携带mspb的863bp和946bp长的上游和下游区域并且用于通过等位交换使耻垢分枝杆菌ml709-234中的mspb基因缺失。这种msp孔蛋白四突变体命名为耻垢分枝杆菌ml711。使用含cre重组酶的质粒pcresacb从染色体上切除侧接loxp位点的gfp和hyg基因。用染色体dna使用特异性引物集通过pcr并且用染色体dna使用特异性探针通过southern印迹确认4个msp基因全部缺失(图3)。这种未标记的msp孔蛋白四突变体命名为耻垢分枝杆菌ml712(相关基因型:δmspa::frt、δmspb::loxp、δmspc::frt、δmspd::frt、attbl5::frt-pnit-cpntd1-frt)。菌株ml712在middlebrook7h10琼脂板上的生长于野生型和ml16菌株相比受损。接下来,如heinz等(anal.biochem.285:113-120(2000))所述,通过使用去垢剂辛基聚氧化乙烯提取耻垢分枝杆菌细胞来评估ml712菌株中msp基因的表达。在middlebrook7h9培养基中生长的msp四孔蛋白缺失突变耻垢分枝杆菌ml712与孔蛋白三突变体ml16相反未产生任何msp蛋白(图4)。这证明在耻垢分枝杆菌ml712中实现全部msp基因的缺失。当在ml712中分别使用质粒pmn016和pml904表达野生型mspa或m1mspa时,mspa的表达水平与野生型耻垢分枝杆菌的表达水平相似。
单链m1-mspa的构建
先前构建了m12-mspa亚基二聚体(pavlenok等plosone7(6):e38726)。作为针对单链mspa的下一步骤,使4个mspa-m1基因融合以编码m14-mspa亚基四聚体。将所得质粒pml2647转化到耻垢分枝杆菌ml712的四孔蛋白缺失菌株中以生成和纯化蛋白质。然而,四聚体mspa质粒不稳定。为了避免重组,使reca基因在四孔蛋白突变体ml712中缺失并且产生菌株耻垢分枝杆菌ml714。
然后,将编码其中有8个m1-mspa亚基连接的单链mspa(m18-mspa)的基因克隆到大肠杆菌中。每个亚基均具有d90n突变、d91n突变和d93n突变。这通过使用pml2647作为模板使编码四聚体m1mspa的两个基因融合在一起(m14-mspa)来实现。单独的mspa亚基被(ggggs)3接头隔开。在所得质粒pml3213中,两个四聚体m1-mspa构建体侧接独特限制位点(四分体a:paci、mlui;四分体b:ecorv、hindiii)(图5)。除四分体的第一个和最后一个基因外,四聚体内的基因侧接相同限制位点。
所得m18-mspa基因处于组成型psmyc启动子的控制之下(图5)。将质粒pml3213转化到耻垢分枝杆菌ml714(reca缺失的四孔蛋白突变体)以生成和纯化蛋白质。western印迹实验显示,在耻垢分枝杆菌ml714中单链m18-mspa的表达水平与m12-mspa相比更低并且降低到野生型mspa水平的大约7%(图6)。
单链m1-mspa的稳定性
mspa孔隙对热和化学变性有极高耐受性(heinz等j.biol.chem.278:8678-8685(2003))。为测试单链mspa的热稳定性,使m18-mspa蛋白在2%sds的存在下经受越来越高的温度15分钟(图7)。即使在将蛋白质加热到100℃之后,显著量的m18-mspa也稳定(图7)。这个结果显示,m18-mspa至少对热变性与野生型mspa蛋白一样稳定。
单链m1-mspa的通道性质
为检查m18-mspa是否形成功能通道,进行了体外脂质双层实验。当仅向脂质双层添加正辛基-poe缓冲液时未记录到插入。添加大约70ng的m18-mspa蛋白导致通过脂质双层的电流逐步增加,表面m18-mspa通道插入膜中(图8a)。对m18-mspa的电流记录的分析显示出1.1ns的主峰(图8b)。该通道电导类似于由m1-mspa二聚体(1.3ns)和m1mspa单体(1.4ns)产生的孔隙的那些(参见pavlenok等)。
电压门控
将电压门控定义为在某一电压阈值下的自发性通道闭合并且是细菌β-桶状通道蛋白的固有性质(bainbridge等febslett431(3):305-308(1998))。因为使用高达+180mv的电压使ssdna转位穿过mspa孔隙,所以对电压门控的耐受性对于纳米孔测序实验而言极其重要(manrao等nat.biotechnol.30(4):349-353(2012);derrington等proc.natl.acad.sci.usa107(37):16060-16065(2010);butler等proc.natl.acad.sci.usa105(52):20647-20652(2008))。因此,分析在脂质双层实验中m18-mspa的电压门控。插入大约220个m18-mspa孔隙之后,通过脂质双层的电压按10mv增量依次增加,并且测量通过孔隙的离子电流3分钟。将临界电压vc定义为孔隙开始闭合时的电压,并且在这些实验中当离子电流降低时测量。
m18-mspa通道在+90mv下开始闭合并且在施加的所有负电压下完全稳定(图9)。在用经凝胶纯化的m18-mspa蛋白进行的第二次实验中,未观察到高达±100mv电压的电压门控。因此,m18-mspa的临界电压vc是比m1-mspa或m12-mspa(对于两种蛋白质而言vcrit+40mv、-50mv)高两倍。这些结果显示,将8个亚基全部连接到单个多肽中明显增加了单链mspa对电压门控的耐受性。单链mspa这种不可预见的优势对于核酸,例如dna的纳米孔测序非常重要。
突变单链mspa(scmspam2)的构建
如本文所述,mspa中的突变对改善其与dna的相互作用,其碱基识别性质及其与膜和辅助蛋白,例如phi29dna聚合酶的相互作用有用。使用以上对单链m1mspa描述的方法,构建突变单链mspa(mspam2),其中8个突变mspa单体连接在一起。使用mspa抗体通过western印迹证实单链m1mspa和单链mspam2两种构建体在耻垢分枝杆菌ml712中的表达,证明在耻垢分枝杆菌中scmspa的生成是可行的。如本文所示,单链msp可以在大肠杆菌中表达。产生按mg量计的单链m2mspa(scmspam2)蛋白,但是未折叠。已经开发了允许分离活性scmspam2的折叠方案。
一种单链m2-mspa(scm2-mspa),其中8个m2-mspa基因(如butler等(pnas105:20647-20652(2008)所述含有突变d90n/d91n/d93n/d118r/d134r/e139k)通过编码(ggggs)3多肽接头的dna片段连接。另外,每个基因侧接独特限制位点以使每个mspa亚基的特异性修饰成为可能。该序列中的基因从atg起始密码子开始被命名为m2-1至m2-8(图11和表3)。对于大肠杆菌细胞中单链mspam2蛋白的蛋白质生成和纯化,去除了mspa的信号肽。scm2-mspa序列经密码子优化以在大肠杆菌中最佳表达并且由genscript合成。所得scm2-mspa基因侧接ecori和hindiii并且在来自genscript的puc57质粒中获得。接下来,切除整个scm2-mspa并且克隆到pet-21(a)+载体中。scm2-mspa基因受所得质粒pml3216中的t7启动子控制(图11)。
对于scmspam2蛋白质生成和纯化,将质粒pml3216转化到缺乏3种主要孔蛋白的大肠杆菌bl21(de3)omp8菌株中(参见prilipov等femsmicrobiol.lett163:65-72(1998))。选择bl21(de3)omp8菌株以免scmspam2受大肠杆菌的内源性孔蛋白污染。用1.5mmiptg诱导scm2-mspa表达之后,使细胞在37℃下在补充了氨苄青霉素的lb培养基中生长。在诱导2小时后观察到靶蛋白的最大限度表达,占细胞裂解产物中总蛋白的大约4%(图12)。对应于scmspam2的蛋白质条带具有170kda的表观质量,这与其165.6kda的预测分子质量一致(图12)。接下来,分离并纯化来自包涵体的scmspam2,如sambrook等(cshprotocols2006)所述。主要含scmspam2蛋白的包涵体溶于8m脲中。之后使用hitrapqff柱(gehealthcare,unitedkingdom)在8m脲的存在下使该样品经受阴离子交换色谱法。scmspam2蛋白的洗脱曲线与先前公布的野生型mspa的洗脱曲线非常相似(heinz等,2003)。这种蛋白质很可能未折叠并且没有通道活性。
然后,纯化scmspam2并且进行再折叠程序。阴离子交换色谱法之后,将浓度为50μg/ml的scmspam2纯净成分按10倍稀释于含有10mmnacl、25mmhepes、0.6ml-精氨酸、0.1%(v/v)ldao,ph8.0的缓冲液中以产生1ml的最终体积。在室温下(大约21℃)在旋转混合器上温育混合物过夜。然后,将样品转移到具有3.5kdamwco的透析管中并且在室温下用2l含有10mmnacl、25mmhepes(ph8.0)、0.023%(v/v)ldao的缓冲液透析过夜。将透析过的蛋白质转移到微型管中并且在室温下再温育一天。接下来,使用mspa特异性兔抗血清通过western印迹分析评估再折叠效率。再折叠程序后,与mspa多克隆抗体反应的条带从170kda迁移到大约130kda,表明已经发生scmspam2折叠成电泳淌度增加的更紧凑形式(图13)。先前已经对大肠杆菌的外膜蛋白观察到折叠后的此类电泳迁移率改变。然而,不清楚mspa是否会显示类似现象。
为了检查在再折叠程序后scmspam2是否在体外形成功能通道,进行了脂质双层实验。向平面双层仅添加0.023%ldao-缓冲液时,未观察到通道活性。相反,在再折叠步骤后添加scmspam2蛋白导致电流逐步增加,表明通道插入脂质双层中(图14)。对电流轨迹的分析显示2.3ns的平均电导(图14)。感兴趣的是,对由单体产生的mspam2的分析显示在1.2ns和2.4ns的两个峰,表明两种不同的蛋白质构象。另外,用scmspam2进行的多通道实验显示提高的电压门控耐受性,临界电压为+80mv/-70mv(图15)。增强的电压耐受性例如有利于在相对较高电压下进行的ssdna实验。
突变单链mspa(mspapn1)的构建
一种单链mspapn1(scmspapn1)基因,其中8个mspa基因(如butler等(pnas105:20647-20652(2008)所述含有p97f突变和突变d90n/d91n/d93n/d118r/d134r/e139k)通过编码(ggggs)3多肽接头的dna片段连接。另外,每个基因侧接独特限制位点以使每个mspa亚基的特异性修饰成为可能。该序列中的基因从atg起始密码子开始被命名为m2-97-1至m2-97-8(图16和表3)。对于大肠杆菌细胞中单链mspapn1蛋白的蛋白质生成和纯化,去除了mspa的信号肽。scmspapn1序列经密码子优化以在大肠杆菌中最佳表达并且由genscript合成。所得scmspapn1基因侧接ecori和hindiii并且在来自genscript的puc57质粒中获得。接下来,切除整个scmspapn1并且克隆到pet-21(a)+载体中。scmspapn1基因受所得质粒pml3216中的t7启动子控制(图16)。
对于scmspapn1蛋白质生成和纯化,将质粒pml3216转化到缺乏3种主要孔蛋白的大肠杆菌bl21(de3)omp8菌株中(参见prilipov等femsmicrobiol.lett163:65-72(1998))。选择bl21(de3)omp8菌株以免scmspapn1受大肠杆菌的内源性孔蛋白污染。用1.5mmiptg诱导scmspapn1表达之后,使细胞在37℃下在补充了氨苄青霉素的lb培养基中生长。在诱导2小时后观察到靶蛋白的最大限度表达,占细胞裂解产物中总蛋白的大约5%(图17)。对应于scmspapn1的蛋白质条带具有170kda的表观质量,这与其165.6kda的预测分子质量一致(图17)。接下来,分离并纯化来自包涵体的scmspapn1,如sambrook等(cshprotocols2006)所述。主要含scmspapn1蛋白的包涵体溶于8m脲中。之后使用hitrapqff柱(gehealthcare,unitedkingdom)在8m脲的存在下使该样品经受阴离子交换色谱法。scmspapn1蛋白的洗脱曲线与先前公布的野生型mspa的洗脱曲线非常相似(heinz等,2003)。这种蛋白质很可能未折叠并且没有通道活性。
然后,纯化scmspapn1并且进行再折叠程序。阴离子交换色谱法之后,将scmspapn1纯净成分用2l含有140mmnacl、10mmk2hpo4/kh2po4、2mmkcl(ph7.5)的缓冲液透析以去除脲。在室温下(大约21℃)温育混合物过夜。透析后,向样品中添加l-精氨酸和ldao以分别产生0.6m和0.1%(v/v)的最终体积。在定轨振荡器上温育再折叠缓冲液(140mmnacl、10mmk2hpo4/kh2po4、2mmkcl、0.6ml-精氨酸、0.1%(v/v)ldao,ph7.5)中的蛋白质样品过夜(图18)。通过在280nm下的吸光度测定,计算纯化样品的浓度为1.37mg/ml。蛋白质产率为每1l细菌培养物0.45mg。
为了测试在位置97处的苯丙氨酸对单链mspa并入人工脂质膜的影响,如所述通过监测荧光羧基荧光素染料从脂质体的释放来测量不同mspa构建体的插入活性(参见schwarz等,biophys.j.58(3):577-83(1990);schwarz等,biochim.biophys.acta1239(1):51-7(1995))。简单地说,通过在30mm羧基荧光素的存在下挤出而制备dphpc脂质体。羧基荧光素当其被封入脂质囊泡中时自我猝灭。mspa孔隙插入染料负载脂质体之后,扩散介导的染料流出导致反应混合物中的荧光增加。图19示出了这些羧基荧光素释放实验的结果。添加含有ldao(0.1%v/v)或opoe(0.5%v/v)的缓冲液仅导致染料从脂质体最小限度的释放,与用作阳性对照的tritonx-100(1%v/v)缓冲液相反。重要的是,添加scmspapn1(60ng/ml,最终)导致羧基荧光素的释放比添加scmspam2(120ng/ml,最终)更快且更大量。有趣的是,野生型mspa(60ng/ml,最终)导致从脂质体的染料扩散比scmspapn1更慢(图19)。这些数据表明位于scmspa的环6中的附加苯丙氨酸促进孔隙更快且更有效地插入脂质双层。
接下来,在双层装置中测量第一孔隙插入dphpc膜的时间。假设插入能力增强的孔隙插入脂质膜中需要更少时间。为检查环6中苯丙氨酸对scmspa的膜插入时间的影响,将scmspapn1与scmspam2做比较。简单地说,为双层比色杯装入电解液,施加-10mv电势,并且使用testpoint软件获取和记录数据。在这些实验中一直使用相同比色杯。按100ng/ml的最终浓度向两侧添加蛋白质。重要的是,在对于scmspapn1的89%实验中,但仅在对于scmspam2的40%实验中观察到成功插入事件。这与羧基荧光素释放实验的结果一致。虽然scmspapn1的中值插入时间为399秒,与scmspam2的695秒完全不同,但是这种差异不显著。令人惊讶地,在0.3mkcl溶液中分析scmspapn1时,插入速率降低(中值时间:859秒,50%)。然而,用scmspapn1一半的实验产生成功插入,而用scmspam2在0.3mkcl中仅观察到一次成功插入,时间为1270秒(分析了8张膜,12%成功插入)(图20)。该结果显示了环6中苯丙氨酸对单链mspa插入膜的有利影响。
为了检查在再折叠程序后scmspapn1是否在体外形成功能通道,进行了脂质双层实验。向平面双层仅添加0.1%ldao-缓冲液时,未观察到通道活性。相反,在再折叠步骤后添加scmspapn1蛋白导致电流逐步增加,表明通道插入脂质双层中(图21)。对电流轨迹的分析显示2.0ns的平均电导(图21)。这可转化为每个核苷酸更大的剩余电流和dna测序实验中更佳的信号。
脂质对单链mspapn1通道活性的影响
scmspapn1在室温下按1μg/mg和0.2μg/ml量储存一个月以上。将scmspapn1稀释于0.1%ldao、140mmnacl、10mmk2hpo4/kh2po4(ph7.5)、2mmkcl中。制备用于通道实验的水平双层的方法在本领域中已知。参见,例如butler等(2008)和akeson等biophysicaljournal;77:3227-3233(1999),二者整体并入本文。对于通道实验而言,使用2%于氯仿中的二植烷酰磷脂酰胆碱(diphpc)以形成基本上如butler等和akeson等描述的用于插入mspa的膜双层。mspa插入双层之后,使膜破裂并且使用1%于正癸烷中的diphpc重新涂覆该膜。这些实验中使用的电解液为0.3或1mkcl、10mmhepes,分别为ph8.0或ph7.0。
如图22所示,单链mspa在各种不同的电解液浓度下起作用,例如约0.3-1mkcl。为优化通道活性,在mspa插入膜或脂质双层之前可以进行脂质缔合。因此,在本文所述的任何方法中,可用一种或多种脂质接触或预温育mspa以优化通道活性。在非限制性实例中,图22显示在ph8.0的仅含0.3mkcl的缓冲液中未观察到通道活性。然而,使膜破裂且随后复涂该膜导致在ph8.0的含0.3mkcl的电解液中scmspapn1的通道活性增强。
- 还没有人留言评论。精彩留言会获得点赞!