核酸合成技术的制作方法
本发明通常涉及核酸合成领域,更具体地,涉及用于合成核酸的方法和系统以及此类合成的质量控制。
重组核酸技术已经促进了分离的基因在多种生物体中的研究。例如,此类技术已经允许研究人员在宿主生物体(例如,细菌)中表达特定基因(例如,小鼠基因)以不仅研究基因本身的作用,而且研究其表达产物。虽然此类技术已被用于研究天然存在的核酸,但研究人员还对研究核酸序列的特定突变或变化的影响感兴趣。例如,可以将靶向突变引入核酸序列,继而导致表达的蛋白序列的变化。然后,研究人员可以研究此类突变对感兴趣的蛋白相互作用的影响。此类突变可以通过基于PCR的技术引入,并且所得的序列可以在宿主细胞中表达。然而,这些技术可涉及劳动密集型分析和耗时的宿主细胞繁殖以确定特定宿主细胞是否已经掺入感兴趣的序列。而且,虽然重组技术可能适合于简单地产生已有核酸序列的突变(例如点突变、缺失或置换),但此类技术不能很好地适于产生完全合成的不依赖于模板的核酸分子。
一些核酸合成技术为基于化学的技术或酶技术,例如,化学固相合成,其涉及将单独的核苷酸以期望的顺序彼此添加以形成多核苷酸链,如有限长度的PCR引物(例如,30-50个核苷酸)。然而,适合于形成相对短的序列的核酸合成技术当用于合成长的多核苷酸链时(例如,大于50个核苷酸)可能较慢和/或易于出错。例如,出错率为1/500个核苷酸的技术可通常产生少于50个核苷酸的无误短序列,但当用于合成500-2000个核苷酸的序列时,可引入若干错误。
简述
本文提供的是具有改善的效率和准确性的合成核酸的技术。所公开的技术可以在一个或多个合成阶段掺入质量反馈以促进从通过疑似产生错误的合成过程产生的一组合成分子中选择具有期望质量水平(例如,核苷酸序列中没有错误或具有限定错误范围的错误)的核酸分子。在某些实施方案中,核酸合成技术可以掺入多个经设计、分别合成、然后被组装的核酸片段。在具体实施中,质量反馈可以基于单独的片段和/或由单独的片段形成的组装核酸分子获得的测序数据。例如,可以合成多个单独的片段并进行测序,其中仅收集具有正确序列的片段用于稍后组装为核酸分子。在多个拷贝的各个片段分别合成的情况下,可以收集正确的拷贝,而避免或者甚至丢弃不正确的拷贝。也可以对组装的分子进行测序以选择具有期望的序列错误特性的分子。此外,可以仅收获具有期望序列的组装核酸分子。
在另一实施方案中,可以合成并组装片段,而无需在组装前对单独的片段进行测序。此处,可以经由组装分子的测序信息提供质量控制。然而,即使在这样的实施方案中,可以实施其它质量控制步骤。例如,各个单独的片段合成过程可以具有不同的产率,这取决于片段大小和/或序列。通过合并大约相等浓度的片段,例如,通过稀释某些片段或通过使较低产率片段进行另外的扩增步骤,片段合并步骤可以导致不同的产率。以此方式,片段合成步骤可以掺入扩增信息作为质量反馈的一部分。而且,来自片段和/或组装分子的产率和/或测序信息可以提供为设计阶段的反馈。在一个实施方案中,特定的片段设计集可以在片段和/或组装分子水平具有差的产率或差的错误率。可以将此类信息提供回设计阶段并且作为将来片段设计的质量控制实施。
为便于分析,公开的技术可以在单个平台(或多个连接平台)中掺入核酸合成(例如,“写”)以及测序(例如,“读”)。因此,本文提供用于读写核酸的设备和方法。因此,公开的技术可以与某些测序平台联合使用。在一个实施方案中,使用可以以模板依赖方式进行的技术的某些测序平台可以掺入早期合成步骤以在平台上原位产生模板。然后,可以对该合成模板(对应于期望片段序列)进行扩增和测序以提供关于错误、质量、设计等的反馈。因此,与某些PCR或重组核酸合成技术相比,公开的技术可以用经由电脑模拟设计的期望合成序列以最初无模板的方式实施。
在一个实施方案中,提供用于合成核酸的方法。所述方法可以包括以下步骤:(a)提供具有重叠序列的多个核酸片段,其中所述多个核酸片段具有与所述多个核酸片段的至少一个其它片段的互补序列,其中所述多个核酸片段的第一片段具有第一可切割衔接子序列和所述第一可切割衔接子序列下游的靶序列的5’端,并且其中所述多个核酸片段的最后一个片段具有第二可切割衔接子序列上游的靶序列的3’端;(b)用与所述第一可切割衔接子序列互补的第一固定化引物使所述第一片段固定在基底上;(c)将所述多个核酸片段经由互补序列的杂交而组装成组装的多核苷酸分子,其中组装的多核苷酸分子经由所述第一固定化引物被固定在所述基底上;(d)对在所述基底上的组装多核苷酸分子进行扩增以产生扩增簇,所述扩增簇含有在基底上的组装的多核苷酸分子的扩增子;以及(e)对所述扩增簇进行测序。
还提供用于合成核酸片段的方法,其包括以下步骤:(a)经由多个与寡核苷酸的5’端互补的第一固定化引物的杂交提供多个固定在基底上的寡核苷酸,其中各个寡核苷酸在5’端包含第一衔接子序列;(b)延伸所述寡核苷酸以产生对应于片段序列的延伸的多核苷酸,其中所述延伸包括将多个单独的核苷酸或核酸掺入至所述多个寡核苷酸的各个寡核苷酸的3’端以产生所述具有片段序列的延伸的多核苷酸;(c)在所述具有片段序列的延伸的多核苷酸的3’端连接第二衔接子序列;(d)经由多个与所述延伸的多核苷酸的3’端互补的第二固定化引物使所述延伸的多核苷酸的3’端与所述基底退火以形成桥;(e)对所述桥进行扩增以形成多个扩增簇;(f)对所述多个扩增簇进行测序以确定所述多个扩增簇中的一个或多个是否包含所述核酸片段的序列;(g)如果所述多个扩增簇中的一个或多个的序列包含所述核酸片段的序列或与所述核酸片段的序列互补,则收获所述多个扩增簇中的一个或多个以产生具有所述片段序列的收获的扩增簇;以及(h)将具有所述片段序列的收获的扩增簇与第二多个扩增簇合并,其中所述第二多个扩增簇中的至少一部分包含仅与所述片段序列的一部分互补的序列。
在一些实施方案中,用于合成核酸的方法可以包括以下步骤:(a)基于所述核酸的序列提供多个靶序列,其中所述多个靶序列的组合形成所述核酸的序列;(b)提供多个固定在基底上的引物寡核苷酸;(c)在第一聚合酶的存在下,基于所述多个靶序列以单链方式延伸所述引物寡核苷酸以产生多个片段多核苷酸;(d)在第二聚合酶的存在下向所述多个片段多核苷酸提供第一测序试剂,其中所述第一测序试剂具有一种或多种核苷酸单体,并且其中所述一种或多种核苷酸单体形成多个与所述多个片段多核苷酸的至少一部分互补的多核苷酸;(e)向所述多个片段多核苷酸提供第二测序试剂,其中所述第二测序试剂包含至少一种核苷酸单体,其中所述第二测序试剂的至少一种核苷酸单体包含可逆终止部分,并且其中所述第二测序试剂在提供所述第一测序试剂之后提供,由此获得所述多个片段多核苷酸的每个的序列;(f)基于所述多个片段多核苷酸各自的序列与所述相应靶序列的比较收获所述多个片段多核苷酸;以及(g)对所述多个片段多核苷酸进行组装以产生组装的多核苷酸。
本公开提供用于合成核酸的系统。所述系统可以包括(a)基底,其具有多个流道,所述多个流道中的每个包含多个固定化引物寡核苷酸;(b)基于处理器的装置,其存储可执行指令并与所述基底连接,其中所述可执行指令被配置为:(i)接收指示存在第一聚合酶基于多个靶序列之一产生相应的多个单链片段多核苷酸的各个流道的一个或多个合成信号;(ii)基于所述一个或多个合成信号,控制第一测序试剂、第二测序试剂和第二聚合酶进入所述流道,其中所述第一测序试剂包含一种或多种核苷酸单体,其中所述一种或多种核苷酸单体形成多个与所述多个片段多核苷酸的至少一部分互补的多核苷酸,其中所述第二测序试剂包含至少一种核苷酸单体,并且其中所述第二测序试剂中的至少一种核苷酸单体具有可逆终止部分;(iii)接收指示在存在第二聚合酶下所述第一测序试剂和所述第二测序试剂存在的各个流道的一个或多个测序信号;(iv)基于所述一个或多个测序信号确定所述多个片段多核苷酸各自的序列;以及(v)提供关于所述多个片段多核苷酸各自的序列与所述相应靶序列的比较的指示;以及(c)组装单元,其被配置成从所述多个流道的每个聚集所述多个片段多核苷酸的每个并且组装所述多个片段多核苷酸的每个以产生组装的多核苷酸。
进一步提供了用于合成核酸的方法,其包括以下步骤:(a)提供包含靶序列的起始多核苷酸序列;(b)基于所述靶序列接收或获取代表多个重叠核酸片段的序列的信息,其中设计所述片段使得所述包含所述靶序列的片段在5’至3’方向上包含不连续,并且其中当所述核酸片段在与所述靶序列的互补链上杂交时,核酸片段之间出现所述不连续;(c)接收来自扩增簇的测序信息,其中所述扩增簇从桥扩增,所述桥由具有所述多个核酸片段的序列的合成片段产生;以及(d)基于所述测序信息确定所述多个扩增簇中的一个或多个的质量。
附图
当参照附图阅读以下详述时,本发明的这些和其它特征、方面和优势将变得更好理解,其中在整个附图中,同样的字符代表同样的部件,其中:
图1为根据本公开的实施方案产生合成的多核苷酸分子的技术的示意概述,在某些实施方案中,所述合成的多核苷酸分子可以继而用于产生其它核酸(例如,经由转录)和/或蛋白(例如,经由翻译);
图2为可以与图1的技术结合使用的系统的框图;
图3为根据本公开的实施方案随着测序反馈产生合成的多核苷酸分子的模板非依赖性单链多核苷酸片段的片段合成技术;
图4为根据本公开的实施方案随着片段和组装的合成多核苷酸的测序反馈组装合成的多核苷酸分子的多个多核苷酸片段的片段合成和组装技术;
图5为根据本公开的实施方案随着测序反馈进行的多核苷酸片段组装技术;
图6为根据本公开的实施方案平行合成不同多核苷酸片段序列,用于稍后组装成合成的多核苷酸分子的流动池;
图7为根据本公开的实施方案合成的多核苷酸分子的单一平台合成、扩增和测序的微流体读写盒的实施方案;
图8为根据本公开的实施方案随着测序反馈产生合成的多核苷酸分子的模板非依赖性多核苷酸片段的技术的流程图;
图9为根据本公开的实施方案随着测序反馈产生组装的合成多核苷酸分子的技术的流程图;以及
图10为根据本公开的实施方案基于来自组装的合成多核苷酸的测序反馈的合成多核苷酸设计的质量反馈技术的流程图。
详述
1.定义
如本文所用,单数形式“一个/一种(a)”、“和”以及“该/所述(the)”包括复数指代物,除非上下文另有明确规定。因此,例如,提及“一种细胞”包括多个此类细胞,诸如此类。除非另有明确表明,否则本文所使用的所有技术和科学术语与本发明所属领域的普通技术人员通常理解的含义相同。
如本文所用,“扩增”和/或其语法变体是指使用含有核苷酸序列的模板核酸序列或其互补物增加所述核苷酸序列的拷贝数的任何方法。可以例如用聚合酶或连接酶进行扩增。该方法可以在体外,例如在流动池或其它流体容器中进行。在一些实施方案中,核酸扩增导致核苷酸掺入DNA和/或RNA分子或引物中,从而形成与靶核酸互补的新分子。形成的核酸分子、其互补物或两者可以用作合成另外核酸分子的模板。如本文所用,一个扩增反应可以由至少一轮或多轮复制组成。核酸的扩增反应包括,例如,聚合酶链式反应(PCR)、随机引物扩增、桥式扩增、滚环扩增(RCA)、连接酶链式反应和本领域已知的其它方法。有用的扩增方法的实例描述于美国专利申请公开第2005/0037393 A1号中,所述专利申请通过引用并入本文。一个PCR反应可以由5至100个“循环”的DNA分子的变性和合成组成。
扩增可以在溶液中或在固相上进行。桥式扩增为特别有用的固相扩增方法。桥式扩增的实例描述在Bentley等人,Nature 456:53-59(2008);美国专利第5,641,658号或7,115,400号;或美国专利公开第2002/0055100 A1号、2004/0096853 A1号、2004/0002090 A1号、2007/0128624 A1号或2008/0009420 A1号中,将其各自通过引用整体并入本文。可以在溶液中或在固相上进行的其它方法包括,例如,PCR、RCA、MDA以及本文示出的或本领域已知的其它扩增方法。RCA的实例描述在Lizardi等人,Nat.Genet.19:225-232(1998)或美国专利公开第2007/0099208A1号中,将其各自通过引用整体并入本文。同样有用的是多重置换扩增(MDA),例如,使用RCA的产物(即RCA扩增子)作为模板。MDA的示例性方法描述在美国专利第6,124,120号;5,871,921号;或EP 0,868,530 B1中,将其各自通过引用整体并入本文。
如本文所用,“互补的”或“互补性”和/或其语法变体是指核酸之间的碱基配对或杂交的程度。例如,如本领域技术人员已知的,腺嘌呤(A)能够与胸腺嘧啶(T)或尿嘧啶(U)形成氢键或碱基对,并且鸟嘌呤(G)能够与胞嘧啶(C)形成氢键或碱基对。因此,A与T或U互补,,以及G与C互补。这些为存在于体内绝大多数DNA和RNA杂交物中的标准“Watson-Crick”碱基对。当用于提及核酸的双链区时,互补性可以为完全的,这时双链区中的所有碱基是碱基配对的。可选地,互补性可以为“部分的”,其中双链区中的仅一些碱基根据碱基配对原则匹配。核酸链之间的互补性程度对核酸链之间的杂交效率和强度具有影响。“互补”序列也可以包括以下或完全由以下形成:非-Watson-Crick碱基对和/或由非天然和修饰的核苷酸形成的碱基对,只要能满足上述关于其杂交能力的需求。
如本文所用,“错误率”和/或其语法变体是指与靶多核苷酸序列中的核苷酸数目相比,多核苷酸序列中的错误的核苷酸的相对数目。错误的核苷酸是指当将多核苷酸序列和靶多核苷酸序列进行比对时,与靶多核苷酸序列中的相应核苷酸不同的多核苷酸序列中的核苷酸。错误率可以以多种形式呈现,所述形式包括但不限于序列中错误的核苷酸数目与特定序列中总核苷酸数目的比率或分数。例如,当靶多核苷酸具有序列AAAAA,并且基于所述靶多核苷酸的合成多核苷酸具有序列AAAAG时,错误率为1/5或20%。
如本文所用,“杂交”和/或其语法变体是指当互补(包括部分互补的)多核苷酸链彼此反向平行排列时,所述链通过在互补的核苷酸之间形成氢键的物理相互作用。杂交和杂交强度(例如,多核苷酸之间的缔合强度)受本领域众所周知的许多因素的影响,所述因素包括多核苷酸之间的互补性程度和涉及的条件的严格性,其受诸如以下条件的影响:盐浓度、存在其它组分(例如,存在或不存在聚乙二醇)、杂交链的摩尔浓度以及多核苷酸链的G+C含量,这些均导致形成的杂交物的特征性解链温度(Tm)。术语“杂交(hybridization/hybridize)”和“结合”,当用于提及核酸时,可以互换使用并且可以指核酸序列的单链通过互补核苷酸之间的氢键合形成双螺旋区段的过程。“杂交物”、“双链体”和“复合物”,当用于提及核酸时,也可以在本文互换使用,指通过杂交形成的双链核酸分子(例如,DNA-DNA、DNA-RNA和RNA-RNA种类)。
如本文所用,“核酸”和/或其语法变体包括单链或双链形式的脱氧核糖核苷酸或核糖核苷酸的聚合物。术语可以包括由含有糖、磷酸和嘌呤或嘧啶碱基的单体(核苷酸)组成的此类聚合物。除非特别限定,否则该术语涵盖含有天然核苷酸的类似物的核酸,所述天然核苷酸的类似物具有与参考核酸和/或具有非天然骨架的核酸(如蛋白质核酸)相似的结合特性。在具体实施方案中,核苷酸类似物也以与天然存在的核苷酸类似的方式代谢。提及具体的核酸序列可隐含地指其互补序列以及明确表明的参考序列。例如,与扩增核酸序列相关的教导应被理解为包括产生一个或多个拷贝的序列、其互补物或两者的实施方案,除非有明确相反的说明。
如本文所用,“核苷酸”和/或其语法变体是指碱基-糖-磷酸的组合。核苷酸为核酸序列(DNA和RNA)的单体单元。术语核苷酸包括核糖核苷三磷酸ATP、UTP、CTP、GTP和脱氧核糖核苷三磷酸,如dATP、dCTP、dITP、dUTP、dGTP、dTTP或它们的衍生物。本文使用的“核苷酸”也指双脱氧核糖核苷三磷酸(ddNTP)以及它们的衍生物,包括但不限于ddATP、ddCTP、ddGTP、ddITP和ddTTP。在本公开的一个实施方案中,“核苷酸”可以为未标记的或为通过众所周知的技术可检测标记的。可检测的标记包括但不限于放射性同位素、荧光标记、化学发光标记、生物发光标记和酶标记。
如本文所用,“核酸片段”和/或其语法变体是指比参考核酸短的包含共价连接的核苷酸序列的合成或天然分子。核苷酸可以通过在一个核苷酸的脱氧核糖或核糖的3’位与相邻核苷酸的脱氧核糖或核糖的5’位之间的磷酸二酯键而连接。核酸片段可以包括天然碱基(例如,A、G、C、T或U)或修饰的碱基(例如,7-脱氮鸟苷、肌苷)。此外,核酸片段中的碱基可以通过除了磷酸二酯键之外的键合进行连接,只要其不干扰核酸片段的杂交。因此,核酸片段可以为肽核酸,其中构成碱基中的一个或多个通过肽键而非磷酸二酯键进行连接。核酸片段可以为单链或双链的。尽管核酸片段可以由较长的参考核酸产生,但应理解,术语“片段”意指两个核酸的比较长度并且不一定指产生两个核酸之一的起点或方法。通常,核酸片段具有与参考核酸的一部分相同或完全互补的序列。然而,在一些实施方案中,片段可以少于与参考序列的一部分完全同源或互补的序列,例如,与参考序列的一部分至少80%、85%、90%、95%、99%或99.9%同源或互补。
如本文所用,“引物”和/或其语法变体是指在核酸分子的扩增或聚合期间通过核苷酸单体的共价键合延伸的单链寡核苷酸。引物可以是天然存在的,如在纯化的限制性消化物中,或者合成产生的。引物通常能够充当依赖样品的核酸合成的起始点。引物可以为单链或双链的,并且,在具体实施方案中,其必须足够长以在选定聚合酶的存在下准备好期望延伸产物的合成。引物的精确长度将取决于许多因素,其包括杂交和聚合温度、引物来源以及使用的方法。例如,引物可以包含约至少15-75个核苷酸,尽管其可以含有较少或更多的核苷酸。基于本文示出的教导,在确定用于具体应用的引物的适当长度中涉及的因素对于本领域普通技术人员而言将容易了解或确定。
本文使用的术语“固定化”意欲涵盖经由共价或非共价键合与固体支持物的直接或间接连接。在某些实施方案中,可以使用共价连接,但通常,所需要的是在意欲使用支持物的条件下,例如在需要核酸扩增和/或测序的应用中,分子(例如,核酸)保持与支持物结合或连接。通常,使待被用作捕获寡核苷酸或扩增寡核苷酸的寡核苷酸固定,以使3’端可用于酶促延伸,并且至少一部分序列能够与互补序列杂交。固定可以经由与表面连接的寡核苷酸的杂交发生,在该情况下,固定化的寡核苷酸或多核苷酸可以为3’-5’方向。可选地,固定可以通过除碱基配对杂交之外的手段发生,所述手段如上文所示的共价连接。在一些实施方案中,核酸分子可以如,例如,美国专利申请序列号13/784,368和美国专利申请公开第2011/0059865A1号中所描述的经由凝胶层连接至固体支持物或其它表面,将其各自通过引用整体并入本文。
如本文所用,“固体支持物”、“固相”、“支持物”和“基底”和/或它们的语法变体是指提供基本上刚性结构或保持其形状而非呈现放置其的器皿形状的结构的任何材料。材料可以具有能够连接另一材料的表面,所述另一材料包括但不限于光滑支持物(例如,金属、玻璃、塑料、硅和陶瓷表面)以及有织纹的材料和多孔材料。基底材料包括但不限于丙烯酸类、碳(例如,石墨、碳纤维)、纤维素(例如,醋酸纤维素)、陶瓷、可控孔度玻璃、交联多糖(例如,琼脂糖或)、凝胶、玻璃(例如,改良的玻璃或功能化玻璃)、金(例如,原子级平滑的Au(111))、石墨、无机玻璃、无机聚合物、乳胶、金属氧化物(例如,SiO2、TiO2、不锈钢)、准金属、金属(例如,原子级平滑的Au(111))、云母、硫化钼、纳米材料(例如,高定向热解石墨(HOPG)纳米片)、硝酸纤维素、光纤束、有机聚合物、纸、塑料、聚丙烯酰吗啉(polacryloylmorpholide)、聚(4-甲基丁烯)、聚(对苯二甲酸亚乙酯)、聚(乙烯基丁酸酯)、聚丁烯、聚二甲硅氧烷(PDMS)、聚乙烯、聚甲醛、聚甲基丙烯酸酯、聚丙烯、多糖、聚苯乙烯、聚氨酯、聚偏二氟乙烯(PVDF)、石英、人造丝、树脂、橡胶、半导体材料、二氧化硅、硅(例如,表面被氧化的硅)、硫化物和
基底可以具有平坦表面,但不一定是平的,并且可以包括任何类型的形状,其包括球形(例如,珠)、多孔形(例如凝胶)或圆柱形(例如,纤维)。连接至固体支持物的材料可以与固体支持物的任何部分连接(例如,可以与多孔固体支持物材料的内部部分连接)。
基底可以为有图案的,其中将图案(例如,斑点、垫、井孔(well)、柱状物、条纹、旋涡、线、三角形、长方形、圆圈、弧、格、格子、斜纹、箭头、正方形或交叉线)蚀刻、印刷、处理、素描、切割、雕刻、镌刻、压印、固定、加盖、涂覆、浮雕、嵌入或分层堆积在基底之上。图案可以包含在基底上的一个或多个切割区或改性区。
当生物材料通过稳定的化学或物理相互作用与固体基底缔合或结合时,其被“连接”至基底。在一些优选实施方案中,通过共价键连接。然而,连接不一定是共价的或永久的。在一个实施方案中,材料通过“间隔分子”或“接头基团”连接基底。此类间隔分子为具有第一部分和第二部分的分子,所述第一部分连接生物材料,所述第二部分连接基底。因此,当连接基底时,间隔分子干预基底和生物材料,但与两者连接。将生物材料(例如,核酸、亲和配体受体、酶、化学羟基自由基发生器)与基底连接的方法为本领域众所周知的,并且包括但不限于化学偶联。
如本文所用,“测序试剂”及其语法等同物是指这样的组合物,如溶液,其包含一种或多种反应物、催化剂或标记或参与反应以确定聚合物(例如核酸)中单体(例如核苷酸)顺序的其它分析物。在一些实施方案中,如合成测序的实施方案中,测序试剂包含一种或多种具有标记部分、终止部分或两者的核苷酸单体。此类部分为化学基团,其通常不是天然存在的核酸部分,通过合成手段被引入以改变核苷酸单体的关于在特定条件下的可检测性或在特定条件下的酶反应性的自然特性。可选地,测序试剂包含一种或多种缺少非天然标记部分和/或非天然终止部分的核苷酸单体。在一些实施方案中,测序试剂由不多于一种核苷酸单体类型、两种不同的核苷酸单体类型、三种不同的核苷酸单体类型或四种不同的核苷酸单体类型组成,或者包含不多于一种核苷酸单体类型、两种不同的核苷酸单体类型、三种不同的核苷酸单体类型或四种不同的核苷酸单体类型。“不同的”核苷酸单体类型为具有彼此不同的碱基部分的核苷酸单体。两种或更多种核苷酸单体类型可以具有其它部分,如上文所示的那些部分,其彼此相同或彼此不同。
为了便于说明,本文描述关于多种核苷酸单体的各种方法和组合物。应理解,这些方法或组合物中的多种核苷酸单体可以为相同或不同的类型,除非另外明确地指明。应理解,当向靶核酸提供包含多种核苷酸单体的测序试剂时,核苷酸单体不一定必须同时提供。然而,在本文所述方法的优选实施方案中,向靶核酸一起(同时)提供多种核苷酸单体。不考虑是否向靶核酸分别地或同时提供多种核苷酸单体,结果可以为测序试剂(包含其中含有的核苷酸单体)与靶核酸同时存在。例如,可以向靶核酸同时或分别递送两种核苷酸单体。在此类实施方案中,将向靶核酸提供包含两种核苷酸单体的测序试剂。可选地,可以在包含递送和去除各个核苷酸类型的循环中依序递送不同的核苷酸类型,使得不同的核苷酸类型不与靶核酸同时存在。在一些实施方案中,将0种、1种或2种核苷酸单体掺入与靶核酸互补的多核苷酸中。在一些实施方案中,测序试剂可以包含可以被掺入聚合物的寡核苷酸。寡核苷酸可以包含终止部分和/或标记部分。
如本文所用,“测序运行”和/或其语法变体是指为获得指示聚合物中单体顺序的信号而进行的物理或化学步骤的重复过程。信号可以指示在单个单体分辨率或较低分辨率下的单体的顺序。在具体实施方案中,步骤可以在核酸靶标上开始并且进行以获得指示核酸靶标中碱基顺序的信号。过程可以进行至其通常的完成,这通常通过这样的点来限定,在该点处,来自该过程的信号不再能够区分具有合理确定性水平的靶标的碱基。如果需要,完成可以较早发生,例如,一旦已经获得期望量的序列信息。在一些实施方案中,测序运行由若干循环组成,其中各个循环包括一系列的两个或更多个步骤,并且在各个循环中重复所述系列的步骤。例如,可以进行10个循环的合成测序运行以鉴定10个核苷酸的序列。10个循环可以各自包括以下步骤:聚合酶催化的引物延伸以添加具有阻断性部分和标记部分的核苷酸类似物;检测延伸的引物上的标记部分;以及从延伸的引物去除标记部分和阻断性部分。
测序运行可以在单个靶核酸分子上进行或者同时在具有相同序列的靶核酸分子群体上进行,或者同时在具有不同序列的靶核酸群体上进行。在一些实施方案中,当不再从起始信号采集的一个或多个靶核酸分子获得信号时,终止测序运行。例如,测序运行可以从存在于固相基底上的一个或多个靶核酸分子起始,并且基于从所述基底去除一个或多个靶核酸分子而终止。当起始测序运行时,测序可以通过在其他方面停止存在于基底上的靶核酸的检测而终止。测序可以使用任何合适的测序技术进行,所述测序技术如美国专利申请公开第2012/0122737A1号中所述的那些,将其通过引用并入本文。
如本文所用,术语“表面”和/或其语法变体是指易于和试剂、珠或分析物接触的支持物结构(例如,基底)的一部分。该表面可以为基本上平坦的或平面的。可选地,该表面可以为圆形的或波状外形的。可以包括于表面的示例性轮廓为井状、凹槽、柱状物、脊状、通道等。可以被用作支持物结构的示例性材料包括但不限于丙烯酸类、碳(例如,石墨、碳纤维)、纤维素(例如,醋酸纤维素)、陶瓷、可控孔度玻璃、交联多糖(例如,琼脂糖或)、凝胶、玻璃(例如,改性玻璃或功能化玻璃)、金(例如,原子级平滑的Au(111))、石墨、无机玻璃、无机聚合物、乳胶、金属氧化物(例如,SiO2、TiO2、不锈钢)、准金属、金属(例如,原子级平滑的Au(111))、云母、硫化钼、纳米材料(例如,高定向热解石墨(HOPG)纳米片)、硝酸纤维素、光纤束、有机聚合物、纸、塑料、聚丙烯酰吗啉、聚(4-甲基丁烯)、聚对苯二甲酸亚乙酯、聚(乙烯基丁酸酯)、聚丁烯、聚二甲硅氧烷(PDMS)、聚乙烯、聚甲醛、聚甲基丙烯酸酯、聚丙烯、多糖、聚苯乙烯、聚氨酯、聚偏二氟乙烯(PVDF)、石英、人造丝、树脂、橡胶、半导体材料、二氧化硅、硅(例如,表面被氧化的硅)、硫化物和单一材料或若干不同材料的混合物可以形成可用于本文实施方案中的表面。术语“表面”和“基底”在本文互换使用。
2.本公开的通用技术
本公开提供用于核酸合成的改善的技术。该技术可以将核酸测序掺入一个或多个质量控制的合成步骤中。测序可以促进收获选自或收获自合成分子区域的无误合成核酸。此外,技术可以允许合成和测序(读写)在单一设备上发生,使得对于单独的合成分子而言,可以控制和量化合成的错误率。在一些情况下,读写可同时发生或者快速连续发生。因此,本公开描述用于研发合成和测序装置(读写装置)的系统和方法以将合成生物学引至日常生物工作中。
此外,本文示出的技术可以以模板非依赖性方式进行。更具体地,核酸可以例如,通过在不存在核酸片段与模板核酸的相互作用的情况下组装所述核酸片段从头合成。在不使用模板的情况下,可以合成片段本身,例如,使用化学合成技术或使用模板非依赖性酶。但是应理解,可以使用模板依赖性合成方法产生片段或组装期望的片段以适合一些实施方案。
现转向附图,首先参照图1,根据本公开的实施方案示出用于产生合成的多核苷酸分子的技术的示意概述,在某些实施方案中,所述合成多核苷酸分子可以继而用于产生其它核酸(例如,经由转录)和/或蛋白(例如,经由翻译)。可以从片段设计阶段10开始核酸的合成。所述片段设计阶段10可以包括使用关于靶核酸序列12的信息来设计一个或多个核酸片段(例如,片段14a、14b、14c、14d)的序列。虽然图1中示出四个核酸片段(例如,片段14a、14b、14c、14d),但应理解,基于靶核酸序列12可以设计任何数目(例如,至少1、2、3、4、5、6、7、8、9、10个或更多个)的核酸片段的序列。
如所示出的,各个核酸片段14a、14b、14c、14d包含至少一个其它核酸片段14a、14b、14c、14d互补的序列。例如,核酸片段14a具有核酸片段14b的序列(例如,序列16b)的互补序列(例如,序列16a),如通过重叠区域示出的。核酸片段14b具有核酸片段14c的序列(例如,序列18b)的互补序列(例如,序列18a)。核酸片段14c具有核酸片段14d的序列(例如,序列20b)的互补序列(例如,序列20a)。在某些实施方案中,互补序列仅与另一片段的一部分互补。即,互补序列16a仅代表片段14a的一部分。而且,互补序列16b和18b仅代表片段14b的一部分。在具体实施方案中,互补序列部分存在于片段末端。
在一些实施方案中,基于靶核酸序列12可以设计核酸片段14a、14b、14c、14d的序列,使得核酸片段序列14a、14b、14c、14d具有与靶核酸序列12相同或互补的组合序列(具有计数一次的重叠序列)。例如,整体序列(包含核酸片段14a的序列,不含序列16b、18a的核酸片段14b的序列,核酸片段14c的序列以及不含序列20b的核酸片段14d的序列)与靶核酸序列12相同或互补。在该实施方案中,与靶核酸序列相比,在片段的组合序列中不存在空位。如下文详细示出的,在替代实施方案中,与靶核酸序列相比,空位可以存在于核酸片段的组合序列中(例如片段的序列之间)。
靶核酸序列12通常具有至少两个核苷酸。例如,靶核酸序列12可以为至少约10、25、50、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950个碱基,以及约1、2、3、4、5、6、7、8、9或10kb,以及约11、12、13、14、15、16、17、18、19或20kb,以及约25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100kb,以及约200、300、400、500、600、700、800、900或1,000kb和在其中的全部增量。可选地或另外地,靶核酸序列12可以为不超过约100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950个碱基,以及约1、2、3、4、5、6、7、8、9或10kb,以及约11、12、13、14、15、16、17、18、19或20kb,以及约25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100kb,以及约200、300、400、500、600、700、800、900或1,000kb。
核酸片段14a、14b、14c、14d的序列通常具有至少两个核苷酸。例如,核酸片段14a、14b、14c、14d可以为至少约10、25、50、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950个碱基和在其中的全部增量。可选地或另外地,核酸片段14a、14b、14c、14d可以为不超过约10、25、50、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900或950个碱基。
核酸片段14a、14b、14c、14d的重叠互补序列(例如,序列16a、16b、18a、18b、20a、20b)通常具有至少一个核苷酸。例如,核酸片段14a、14b、14c、14d的重叠序列可以多于或少于2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950个碱基和在其中的全部增量。在具体实施方案中,核酸片段14a、14b、14c、14d的重叠序列的长度可以为1至50个碱基,如5至45个碱基、10至40个碱基、15至35个碱基、20至30个碱基。在具体实施方案中,重叠或互补序列可短于片段14的大小,它们是片段14的一部分。对于具有两个互补重叠的片段,互补序列各自小于总片段大小的一半。
然后,片段设计阶段10之后是片段合成阶段22。在一个实施方案中,在基底24上合成一个或多个核酸片段14a、14b、14c、14d。核酸片段14a、14b、14c、14d的合成可以通过以下进行:随着向游离3’羟基相继添加核苷酸而在基底24上延伸固定化引物,导致靶向核酸片段14a、14b、14c、14d的多核苷酸以5’至3’方向合成。在特定实施方案中,片段合成可以在聚合酶,如末端脱氧核苷酸转移酶(TdT)的存在下进行。
图1中例示的合成可以在不存在模板的情况下进行,因为TdT可以在没有模板的情况下添加核苷酸。在具体实施方案中,在TdT的存在下,用不同类型的核苷酸类似物依序处理被固定在基底24上的引物。核苷酸类型的不同在于核苷酸上存在哪种碱基。被递送至引物的核苷酸类似物类型的顺序将决定所产生片段的序列。此外,核苷酸类似物可以包括可逆阻断性部分以阻止每个循环向引物添加多于一个核苷酸。在这种情况下,循环可以包括(1)在TdT的存在下,将适当类型的可逆阻断性核苷酸类似物递送至表面-固定化引物,由此将单个核苷酸类似物添加至引物的3’端以产生延伸引物;(2)从基底24洗掉未反应的核苷酸类似物(以及任选地TdT);以及(3)从延伸引物的3’端处的核苷酸类似物移除阻断性部分。具体实施方案可以使用TdT种类或TdT种类的工程化变体,所述TdT种类的工程化变体对于含有特定阻断基团的核苷酸而言具有所需活性。使用已知的诱变技术,以及在已知的聚合酶分析中利用特定的核苷酸种类对聚合酶活性进行筛选可以产生此种TdT。
可选地,核酸片段14a、14b、14c、14d的合成可以通过相继添加核苷酸经由以3’至5’方向延伸基底24上的固定化引物进行。例如,化学合成可以以组装核苷酸链的众所周知的循环过程进行。通过化学反应循环逐一添加核苷酸,其中将特定分子(例如,核苷酸)添加至增长的DNA分子(例如,增长的DNA链),有时候经由催化作用进行,直至期望链为完整的。通常,化学反应的各个循环包括脱三苯甲基化、偶联、加帽和氧化的步骤。在脱三苯甲基化或“脱保护”的步骤期间,从增长的DNA链的最后一个核苷酸移除二甲氧基三苯甲基(DMT)基团以允许下一个核苷酸的添加。可以监测从各个循环释放的DMT的量以确定偶联效率。DMT的释放是明显的,因为释放DMT时,发射出亮橙色。可以使用的示例性化学合成方法示于美国专利第7,914,739号或美国专利申请公开第2004/0219063A1号,为了所有目的将其各自通过引用整体并入本文。
另一有用的合成方法是通过依序添加三核苷酸(即寡核苷酸3mer)来产生核酸片段。在具体实施方案中,可以例如使用诸如上文示出的那些化学合成方法合成64个三核苷酸。在该实例中,64个三核苷酸对应于20个天然存在的氨基酸的密码子。可以使用circligase(Epicentre,WI)将三核苷酸连接在一起。连接可以以5’至3’方向或者可选地以3’至5’方向进行。不管怎样,所得片段将编码对应于连接在一起的三核苷酸数目的氨基酸数目。而且,氨基酸的顺序将对应于用于合成核酸片段的三核苷酸添加的顺序。
在基于连接的合成的具体实施方案中,使用在5’或3’端具有可逆阻断性部分的三核苷酸是有用的。例如,当以5’至3’方向合成核酸片段时,使用在3’位被阻断的三核苷酸是有帮助的。在该情况下,可以通过在circligase的存在下将第一密码子的三核苷酸溶液递送至新生片段进行各添加循环。片段可以经由5’端连接至固体支持物,或者5’端可以在其他方面阻断以阻止连接。因此,期望连接事件将导致新生片段的3’端与进来的三核苷酸的5’端之间的连接。每个循环中多于一个三核苷酸的添加被阻止,因为一旦通过添加单个三核苷酸进行延伸,新生片段将立刻具有阻止进一步延伸的3’阻断基团。过量的三核苷酸可以例如通过洗涤移除,然后可以移除或修饰3’阻断基团以在延伸的新生片段上产生未阻断的3’端。然后,再一次,在circligase的存在下可以通过将第二密码子的三核苷酸溶液递送至先前延伸并去阻断的新生片段来进行第二循环。
三核苷酸连接也可以以3’至5’方向进行。三核苷酸可以在5’位任选地被阻断,以及新生片段可以经由3’端任选地被阻断或者连接至表面。可以通过在circligase的存在下将第一密码子的三核苷酸溶液递送至新生片段进行各个添加循环,从而由于新生片段的5’端与进来的三核苷酸的3’端之间的连接而延伸新生片段。过量的三核苷酸可以例如通过洗涤移除,然后可以移除或修饰5’阻断基团以在延伸的新生片段上产生未阻断的5’端。然后,可以通过在circligase的存在下将第二密码子的三核苷酸溶液递送至先前延伸并去阻断的新生片段来进行第二循环。应理解,尽管示例了三核苷酸,但可以使用4mer寡核苷酸、5mer寡核苷酸、6mer寡核苷酸或较大寡核苷酸进行连接至新生片段的相似连接合成。
如所示出的,可以在基底24上合成分别靶向核酸片段14a、14b、14c、14d的序列的多核苷酸26a、26b、26c、26d。此外,合成的多核苷酸26a、26b、26c、26d的扩增可以在基底24上进行以产生多核苷酸26a、26b、26c、26d的簇。基底24上的扩增可以使用桥式扩增、固相PCR、滚环扩增(RCA)或上文所指出的任何其它合适的方法进行。在一些实施方案中,合成的多核苷酸26a、26b、26c、26d的扩增为任选的。
片段合成阶段22之后可以是合成质量控制阶段28,在该合成质量控制阶段28中,对合成的多核苷酸26a、26b、26c、26d进行测序,并且将合成的多核苷酸26a、26b、26c、26d的序列与它们相应的核酸片段14a、14b、14c、14d的序列进行比较。可以对合成的多核苷酸26a、26b、26c、26d或它们的扩增簇相继或平行进行测序运行。测序运行可以如美国专利申请公开第2010/0279882A1号或者美国专利第8,637,242号所述进行,将所述专利通过引用并入本文。如所示出的,测序运行可以包括利用包含一个或多个具有标记部分、终止部分或两者的核苷酸的测序试剂30。
在进行测序运行之后,可以获得各个合成的多核苷酸26a、26b、26c、26d或它们的扩增簇的序列。然后,通过将各个合成的多核苷酸26a、26b、26c、26d的序列和/或其互补序列(在扩增簇的情况下)与它们相应的核酸片段14a、14b、14c、14d的序列相比较,可以测定合成错误率。在一些实施方案中,还可以测定各个合成的多核苷酸26a、26b、26c、26d或它们的扩增簇的相应序列准确性分数(例如,通过从1中减去错误率)。通常,基底24将包括各个期望片段的位点的冗余。例如,各个片段可以在基底上冗余地合成至少2、4、5、10、25、50、100个或更多个位点。可以基于正使用的合成程序的预期错误率测定冗余位点的数目以产生期望数目的准确位点。因此,尽管一些位点可以含有序列中具有错误的片段,但可以鉴定具有准确序列的其它位点,并且从下文进一步详述中示出的那些位点收获片段。
通过将测序掺入合成质量控制阶段28,测序数据可以用于核酸合成质量控制。例如,通过测序测定的合成错误率可以用于确定片段设计的如何。进一步举例来说,各个合成的多核苷酸26a、26b、26c、26d或它们的扩增簇的较低合成错误率可以代表它们相应的核酸片段14a、14b、14c、14d的片段设计较好。相反地,各个合成的多核苷酸26a、26b、26c、26d或它们的扩增簇的较高合成错误率可以代表它们相应的核酸片段14a、14b、14c、14d的片段设计较差。因此,可以设置合成错误率的预定阈值并且将其用于与通过测序测定的各个合成的多核苷酸26a、26b、26c、26d或它们的扩增簇的合成错误率进行比较以确定它们相应的设计片段是否是期望的。例如,预定的阈值错误率可以为至多约0.00%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.10%、0.15%、0.20%、0.25%、0.30%、0.35%、0.40%、0.45%、0.50%、0.55%、0.60%、0.65%、0.70%、0.75%、0.80%、0.85%、0.90%、0.95%、1.00%、1.10%、1.20%、1.30%、1.40%、1.50%、1.60%、1.70%、1.80%、1.90%、2.00%、2.10%、2.20%、2.30%、2.40%、2.50%、2.60%、2.70%、2.80%、2.90%、3.00%、4.00%、5.00%、6.00%、7.00%、8.00%、9.00%、10.00%、15.00%、20.00%、25.00%、30.00%、35.00%、40.00%、45.00%、50.00%、55.00%、60.00%、65.00%、70.00%、75.00%、80.00%、85.00%、90.00%、95.00%、100%。该信息可以用于设计不同集合的片段序列。合成和QC程序可以重复若干次以允许序列质量的迭代改善。
此外,在合成质量控制阶段28中通过测序测定的合成错误率可以用于决定如何收获合成的多核苷酸26a、26b、26c、26d或它们的扩增簇。例如,当合成的多核苷酸26a、26b、26c、26d或它们的扩增簇各自的错误率等于、小于或大于预定的阈值错误率时,可以选择性收获合成的多核苷酸26a、26b、26c、26d或它们的扩增簇。预定的阈值错误率可以为至多约0.00%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.10%、0.15%、0.20%、0.25%、0.30%、0.35%、0.40%、0.45%、0.50%、0.55%、0.60%、0.65%、0.70%、0.75%、0.80%、0.85%、0.90%、0.95%、1.00%、1.10%、1.20%、1.30%、1.40%、1.50%、1.60%、1.70%、1.80%、1.90%、2.00%、2.10%、2.20%、2.30%、2.40%、2.50%、2.60%、2.70%、2.80%、2.90%、3.00%、4.00%、5.00%、6.00%、7.00%、8.00%、9.00%、10.00%、15.00%、20.00%、25.00%、30.00%、35.00%、40.00%、45.00%、50.00%、55.00%、60.00%、65.00%、70.00%、75.00%、80.00%、85.00%、90.00%、95.00%、100%。在一些实施方案中,可以比较合成的多核苷酸26a、26b、26c、26d或它们的扩增簇的错误率,并且可以选择性收获那些具有最低、最高或等于、小于或大于预定的阈值错误率的那些合成的多核苷酸。
因为可以通过测序获得各个合成的多核苷酸26a、26b、26c、26d或它们的扩增簇的序列,所以也可以测定核酸片段14a、14b、14c、14d之一的预定合成序列的产率。例如,核酸片段14a的预定合成序列可以为无误序列(例如,合成错误率为约0.0%),如果合成的多核苷酸26a的全部序列(例如,在扩增簇中的单拷贝或多拷贝)被确定为无误序列,则来自合成的核酸片段14a的无误序列的产率为100%。在一些实施方案中,核酸片段14a、14b、14c、14d之一的具有预定错误率(不考虑实际序列)的合成序列的产率可以由测序确定。例如,在被测序的扩增簇中的全部100个合成的多核苷酸26a中,存在90个具有约0.05%的合成错误率的多核苷酸26a(例如,具有或没有相同序列)。因此,具有约0.05%的合成错误率的合成的多核苷酸26a的产率为90%。
因此,除了合成错误率之外,或者可选地,预定的合成序列和/或具有预定错误率的合成序列的产率可以用于合成质量控制阶段28中的核酸合成质量控制。与合成错误率类似,此类产率可以用于确定片段设计的如何和/或确定如何收获合成的多核苷酸26a、26b、26c、26d或它们的扩增簇。
如上文所示出,在测序之前,可以在表面上扩增片段。可以进行扩增以产生群体(也被称为“簇”)拷贝,从而在表面形成特征。可以在表面上合成并扩增多个片段以产生阵列特征。可能的是,扩增过程可能引入错误以产生含有一些拷贝的最初合成片段和含有错误的其它拷贝的混合簇。在簇或特征中扩增错误的存在可以通过在簇或特征中获得的序列数据的一个或多个核苷酸位置的混合信号的存在识别。因此,质量控制可以包括例如基于以下测定扩增错误:簇中混合信号的存在或不存在、关于簇获得的序列数据中的一个或多个位置处观察到的统计变异的阈值、关于簇获得的序列数据中的一个或多个位置处观察到的信噪比的阈值、特征中信噪比的衰减率等。此外,该质量控制数据可以用于确定片段设计的如何和/或确定如何收获合成的多核苷酸26a、26b、26c、26d或它们的扩增簇。
继续参照图1的示例性实施方案,在从基底24收获一些或全部的合成多核苷酸26a、26b、26c、26d或它们的扩增簇之后,接着是片段组装阶段32。在片段组装阶段32中,合成的多核苷酸被组装以产生一个或多个靶向靶核酸序列12的组装的多核苷酸。在示出的实施方案中,从基底24收获合成的多核苷酸26b、26c、26d,而合成的多核苷酸26a保留于基底24上。在片段组装阶段32期间,合成多核苷酸26b、26c、26d被组装至合成的多核苷酸26a以产生组装的多核苷酸34。如下文详细讨论的,组装可以在一种或多种用于片段组装和空位修复的酶的存在下进行,所述酶包括但不限于DNA重组酶、β蛋白、DNA聚合酶、DNA连接酶、circligase或它们的任何组合。
片段组装阶段32之后可以是组装质量控制阶段36,在组装质量控制阶段36中,对组装的多核苷酸34进行测序,并且将组装的多核苷酸34的序列与靶核酸序列12进行比较。在一些实施方案中,组装的多核苷酸34的扩增可以在测序之前进行,并且可以对扩增簇进行测序运行。在其它实施方案中,组装的多核苷酸34的扩增为任选的。组装质量控制阶段36中的测序运行可以与合成质量控制阶段28中的测序运行类似地进行。如所示出的,测序运行可以包括利用与测序试剂30相似的测序试剂38。可以使用上文关于核酸片段示出的技术对组装的多核苷酸进行质量控制步骤。
在进行测序运行之后,可以获得组装的多核苷酸34或它们的扩增簇的序列。然后,通过将组装的多核苷酸34的序列和/或它们的互补序列(在扩增簇的情况下)与靶核酸序列12的序列进行比较,可以测定合成错误率。在一些实施方案中,还可以测定相应序列的准确性分数(例如,通过从1中减去错误率)。
与合成质量控制阶段28类似,组装质量控制阶段36可以使用核酸合成质量控制的合成错误率。例如,在组装质量控制阶段36中通过测序测定的合成错误率可以用于确定片段设计的如何。进一步举例来说,组装的多核苷酸34或它们的扩增簇的较低合成错误率可以代表核酸片段14a、14b、14c、14d的片段设计较好。相反地,组装的多核苷酸34或它们的扩增簇的较高合成错误率可以代表核酸片段14a、14b、14c、14d的片段设计较差。因此,可以设置合成错误率的预定阈值,并且将其用于与通过测序测定的组装的多核苷酸34或它们的扩增簇的合成错误率进行比较以确定设计片段是否是期望的。例如,预定的阈值错误率可以为至多约0.00%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.10%、0.15%、0.20%、0.25%、0.30%、0.35%、0.40%、0.45%、0.50%、0.55%、0.60%、0.65%、0.70%、0.75%、0.80%、0.85%、0.90%、0.95%、1.00%、1.10%、1.20%、1.30%、1.40%、1.50%、1.60%、1.70%、1.80%、1.90%、2.00%、2.10%、2.20%、2.30%、2.40%、2.50%、2.60%、2.70%、2.80%、2.90%、3.00%、4.00%、5.00%、6.00%、7.00%、8.00%、9.00%、10.00%、15.00%、20.00%、25.00%、30.00%、35.00%、40.00%、45.00%、50.00%、55.00%、60.00%、65.00%、70.00%、75.00%、80.00%、85.00%、90.00%、95.00%、100%。该信息可以用于设计不同集合的片段序列或不同的组装多核苷酸。合成和QC程序可以重复若干次以允许序列质量的迭代改善。
此外,在组装质量控制阶段36通过测序测定的合成错误率可以用于确定组装的多核苷酸34或它们的扩增簇的选择性收获。例如,当错误率等于、小于或大于预定的阈值错误率时,可以选择性收获组装的多核苷酸34或它们的扩增簇。预定的阈值错误率可以为至多约0.00%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.10%、0.15%、0.20%、0.25%、0.30%、0.35%、0.40%、0.45%、0.50%、0.55%、0.60%、0.65%、0.70%、0.75%、0.80%、0.85%、0.90%、0.95%、1.00%、1.10%、1.20%、1.30%、1.40%、1.50%、1.60%、1.70%、1.80%、1.90%、2.00%、2.10%、2.20%、2.30%、2.40%、2.50%、2.60%、2.70%、2.80%、2.90%、3.00%、4.00%、5.00%、6.00%、7.00%、8.00%、9.00%、10.00%、15.00%、20.00%、25.00%、30.00%、35.00%、40.00%、45.00%、50.00%、55.00%、60.00%、65.00%、70.00%、75.00%、80.00%、85.00%、90.00%、95.00%、100%。在一些实施方案中,可以比较组装的多核苷酸34或它们的扩增簇的错误率,并且可以选择性收获那些具有最低、最高或等于、小于或大于预定的阈值错误率的组装的多核苷酸。可以经由光学、化学、磁力、电力、电磁或它们的任何组合从基底24收获组装的多核苷酸34。
在一些实施方案中,组装的多核苷酸34可以例如经由转录阶段40继而用于产生其它核酸。例如,组装的多核苷酸34可以为DNA 42,其可以用作合成mRNA 44的模板。DNA可以为单链的或双链的以适应具体用途。在某些实施方案中,转录阶段40之后可以是翻译阶段46。例如,合成mRNA 44可以用作合成蛋白48的模板。转录和翻译可以使用本领域已知的方法进行,所述方法如Sambrook,等人,Molecular Cloning:A Laboratory Manual(第3版,2001);Sambrook,等人,Molecular Cloning:A Laboratory Manual(第2版,1989);Maniatis等人,Molecular Cloning:A Laboratory Manual(1982);和Ausubel等人,Current Protocols in Molecular Biology(John Wiley和Sons,2008年7月更新)所述的那些,将其各自通过引用并入本文。
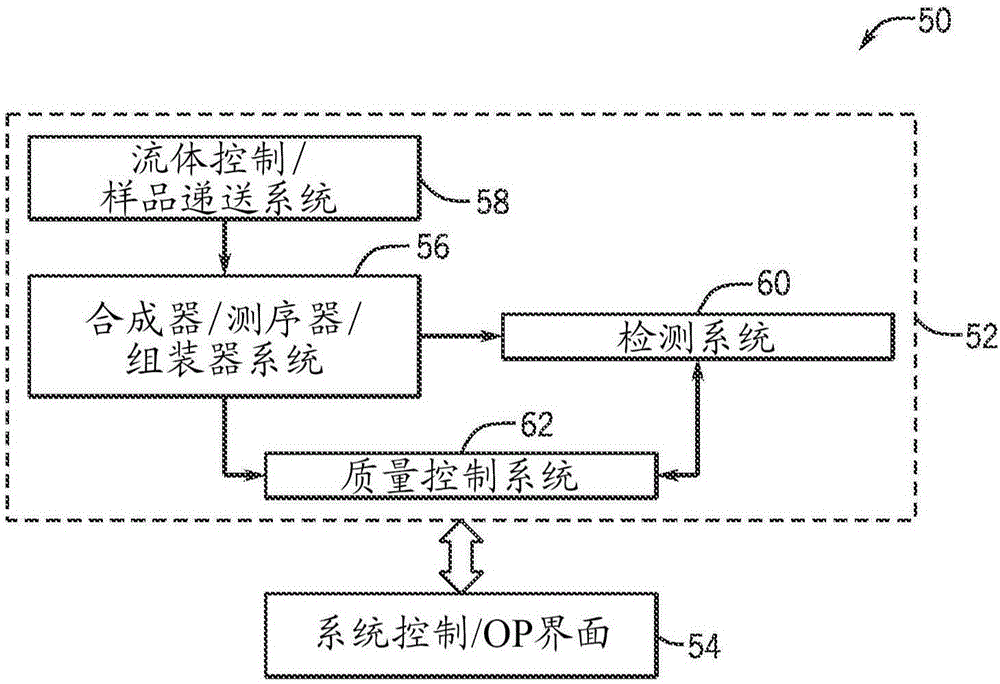
图2为合成系统50的框图,其可以与图1的技术或本文示出的其它方法联合使用。合成系统50包括被设计以合成核酸的合成仪52。合成仪52与系统控制/操作界面54通信。系统控制/操作界面54可以用于基于靶核酸序列12的片段设计。例如,系统控制/操作界面54可以执行在本地或远程存储的程序以促进如上文所指出的基于靶核酸序列12的一个或多个核酸片段的设计。可选地或另外地,用户可以将一个或多个设计的核酸片段序列输入系统控制/操作界面54。
系统控制/操作界面54可以包括被设计以监测过程参数、采集数据、系统设置等的通用或专用计算机。系统控制/操作界面54可以包括一个或多个处理器和存储可通过一个或多个处理器执行的指令的一个或多个存储装置。操作界面可以通过在本地执行的程序或者通过合成仪52上存储的和/或合成仪52内执行的程序来产生以提供合成仪52的系统或子系统的健康、采集数据的质量等的目测指示。
系统控制/操作界面54也可以允许用户与系统交互以调控操作、开始和中断合成、评价质量控制信息以及用系统硬件或软件可能期望的任何其它交互。例如,系统控制/操作界面54可以自动地采取和/或修改待在合成程序中进行的步骤,而无需用户输入。可选地或另外地,系统控制/操作界面54可以产生关于待在合成程序中进行的步骤的推荐,并且向用户显示这些推荐。在采取和/或修改测序程序中的步骤之前,该模式将允许人类操作员进行输入。此外,系统控制/操作界面54可以为用户提供选项,允许用户选择待通过合成仪52自动进行的合成程序中的某些步骤,同时在采取和/或修改其它步骤之前需要用户进行输入。在任何情况下,允许自动化和用户交互模式可以在进行合成程序中提供增加的灵活性。此外,自动化和人控交互的组合可以进一步允许合成系统50能够基于用户和/或合成仪52的子系统收集的输入通过适应机器学习而产生和修改新的测序程序和算法。
系统控制/操作界面54可以包括后处理系统,其可以包括一台或多台已编程的计算机,所述计算机接收可以是像素化图像数据形式的所检测的信息并且从该图像数据推导出序列数据。后处理系统可以包括图像识别算法,其在测序过程期间区分被连接至结合在单独位点处的核苷酸的染料的颜色(例如,通过分析编码特定颜色或强度的图像数据),并且记录在单独位点位置处的核苷酸的序列。渐进地,然后,后处理系统可以构建样品阵列的单独位点的序列表,其可以通过各种生物信息算法被进一步加工以建立延伸的材料长度的遗传信息。
合成仪52包含被配置成进行图1中示出的各个步骤的技术的合成器/测序器/组装器系统56,所述步骤包括片段合成阶段22、合成质量控制阶段28和组装质量控制阶段36期间的核酸测序以及片段组装阶段32。在某些实施方案中,合成器/测序器/组装器系统56被配置成进行图1示出的转录阶段40和/或翻译阶段46。这些阶段为例示性的,并且应理解,所述系统可以被配置成进行另外的或替代性阶段。如下文详细讨论的,一个或多个支持系统(例如,基底24)可以用于图1中示出的片段合成阶段22、合成质量控制阶段28、片段组装阶段32和/或组装质量控制阶段36,所述支持系统包括但不限于珠、磁珠、载玻片、微芯片、纳米微滴、电润湿盒或它们的任何组合。该支持系统可以用作与合成器/测序器/组装器系统56联合的反应容器或载体。视情况而定,合成器/测序器/组装器系统56可以为单一平台或基底,或者可以包括多个平台或基底。例如,片段合成可以发生在第一基底上,而组装可以发生在第二基底上。而且,片段合成和片段组装可以涉及具有不同分辨率(例如,不同的分子密度分辨率)的基底。在具体实施方案中,对于多平台的合成器/测序器/组装器而言,平台之间的移动可以为自动的,或者可以包括某些操作员介入的步骤。
合成仪52还包含流体控制/递送系统58和检测系统60。流体控制/递送系统58可以接收多个过程流体用于递送至合成器/测序器/组装器系统56中。如本领域技术人员所理解的,过程流体可以根据核酸合成的具体阶段以及根据使用的合成方案而变化。例如,在片段合成阶段22中,过程流体可以包含聚合酶(例如,TdT)和四种常见DNA类型的核苷酸。在合成质量控制阶段28和组装质量控制阶段36的测序(例如,合成测序或SBS)中,过程流体可以包含聚合酶和四种常见DNA类型的标记核苷酸。测序阶段使用的核苷酸通过引入诸如独特荧光标签的标记可不同于合成阶段使用的核苷酸。荧光标签允许检测系统60检测哪些核苷酸是最后添加至与在基底24的单独位点的模板核酸杂交的探针中。在合成和测序阶段之一或两者中使用的核苷酸可以包含可逆阻断性部分。该可逆阻断性部分分别阻止每个合成或测序循环中多于一个核苷酸的添加。在其它测序方法中,如通过连接进行的测序,过程流体可以包含具有连接独特荧光标签的查询寡核苷酸探针。类似地,查询探针将以这样的构型结合各个位点处的模板,该构型允许查询探针连接锚定引物,并且可以通过检测系统60进行检测,用于对各位点处的模板进行测序。
在一些实施方案中,流体控制/递送系统58可以在不同时间向合成器/测序器/组装器系统56递送多个过程流体。例如,在测序期间,流体控制/递送系统58可以在递送包含聚合酶和天然存在的四种常见DNA类型的标记核苷酸的过程流体之后递送这样的过程流体,所述过程流体包含用于从核苷酸移除可逆阻断性部分、切割核苷酸接头、或者用于从连接的寡核苷酸移除碱基以释放新的可延长探针末端的试剂。可以用于本文示出的方法和装置中的示例性流体和检测配置描述在WO 07/123744;美国专利申请公开第2012/0270305A1号;第2013/0023422A1号;和第2013/0260372A1号;以及美国专利第5,528,050号;第5,719,391号;第8,158,926号和第8,241,573号中,将其各自通过引用并入本文。在具体实施方案中,除了测序(即“读”)功能之外,可以修改商购的测序平台以进行核酸的“写”功能,如本文示出的。示例性平台包括但不限于和NextSeqTM平台(Illumina,Inc.San Diego,CA)、和Ion平台(Thermo Fisher,Waltham,MA);焦磷酸测序平台(Roche,Basel Switzerland)和纳米孔平台(Oxford Nanopore,Oxford England)。如本文提供的,流体控制/递送系统58可以基于系统50是否确定合成阶段完成(例如,经由核苷酸掺入产生的和通过合成器/测序器/组装器系统56检测的信号)或者系统50是否确定合成阶段已经产生足够优质的产物来控制测序试剂的递送。可选地,流体控制/递送系统58可以重新开始全部或部分合成方案,用于产生新的核酸片段和/或新的组装的多核苷酸。
如上文所指出的,在一些实施方案中,合成的多核苷酸(例如,合成的多核苷酸26a、26b、26c、26d和组装的多核苷酸34)可以在测序之前于基底24上进行扩增。该过程可以包括在支持物上扩增DNA或RNA片段以产生大量DNA或RNA片段的位点,所述片段的序列通过测序过程测定。用于产生适合于测序的扩增核酸的位点的示例性方法包括但不限于滚环扩增(RCA)(Lizardi等人,Nat.Genet.19:225-232(1998))、桥式扩增(Adams和Kron,Method for Performing Amplification of Nucleic Acid with Two Primers Bound to a Single Solid Support,Mosaic Technologies,Inc.(Winter Hill,MA);Whitehead Institute for Biomedical Research,Cambridge,MA,(1997);Adessi等人,Nucl.Acids Res.28:E87(2000);Pemov等人,Nucl.Acids Res.33:e11(2005);或US 5,641,658),polony生成(Mitra等人,Proc.Natl.Acad.Sci.USA 100:5926-5931(2003);Mitra等人,Anal.Biochem.320:55-65(2003))或使用乳剂于珠上的克隆扩增(Dressman等人,Proc.Natl.Acad.Sci.USA 100:8817-8822(2003))或与基于珠的衔接子库的连接(Brenner等人,Nat.Biotechnol.18:630-634(2000);Brenner等人,Proc.Natl.Acad.Sci.USA 97:1665-1670(2000));Reinartz,等人,Brief Funct.Genomic Proteomic 1:95-104(2002))。
合成仪52还包含质量控制系统62。可以通过质量控制系统26评估和/或控制样品(例如,合成的多核苷酸26a、26b、26c、26d和组装的多核苷酸34)的质量、通过合成系统50推导出的数据的质量以及用于处理样品(例如,测序)的各种参数。例如,如上文所指出的,质量控制系统可以接收测序信息并且可以测定预定合成序列的合成错误率和/或产率和/或具有预定错误率的合成序列的产率,这继而可以被质量控制系统62用于确定片段设计的如何和/或决定合成和/或组装的多核苷酸的收获(例如,收获哪一簇)。在某些实施方案中,质量控制系统62可以与系统控制/操作界面54通信以提供针对片段设计阶段10的反馈,使得可以自动地或由用户进行适合的片段设计。质量控制系统62可以包括一个或多个程序化处理器、或者通用或专用计算机,其与流体控制/样品递送系统58、合成器/测序器/组装器系统56和检测系统62内的传感器和其它处理系统通信。
图3示出根据本公开的实施方案随着测序反馈产生合成多核苷酸分子的模板非依赖性单链多核苷酸片段的片段合成技术70。应注意,虽然图3中示出单链多核苷酸,但在本文所述的片段合成技术70中也考虑了双链多核苷酸。片段合成技术70从基底72(例如,图1的基底24)开始(阶段74)。
可以修饰基底72使得多个引物(例如,P5引物76、P7引物78)被固定在基底72的表面上(阶段79)。P5和P7引物描述在美国专利第8,563,477号和Bentley等人,Nature 456:53-59(2008)中,将其各自通过引用并入本文。虽然图3中示出一个拷贝的P5引物76和一个拷贝的P7引物78,但应注意,多个拷贝的的P5引物76和P7引物78,或者多个拷贝的其它合适引物可以被固定在基底72上。如下文详细讨论的,可以控制基底72上的引物的密度。
核酸合成可以在P5引物的3’端进行。单链多核苷酸片段的核酸合成基于靶核酸的片段的序列。因此,一系列单独的核苷酸可以在基底72上依序流动,使得单独的核苷酸相继掺入P5引物76的3’端以产生延伸的多核苷酸80(阶段82)。单独的核苷酸类型的递送顺序基于靶核酸片段的序列(例如,从5’端至3’端)或其互补物。因为延伸的多核苷酸80在无模板链的情况下合成,所以该合成可以被称为模板非依赖性合成。如上文所指出的,延伸的多核苷酸80的合成可以在诸如TdT的聚合酶的存在下进行。此外,核苷酸可以为具有可逆阻断性部分的类似物以阻止每个循环向引物掺入多于一个核苷酸。在该情况下,循环可以包括从延伸的引物移除阻断性部分的步骤以重新产生能够在随后循环中掺入新的核苷酸类似物的3’氧。
在一些实施方案中,单链多核苷酸片段的合成可以在可切割的衔接子的3’端而非P5引物76上进行。例如,可切割的衔接子可以包含P5引物76的互补序列(例如,P5’衔接子),使得可切割的衔接子可以与固定化P5引物76杂交。因此,可切割的衔接子也被固定在基底72上。与上文示出的合成关于P5引物76的3’端的延伸类似,合成可以在可切割的衔接子的3’端进行以产生延伸的多核苷酸80。如本文先前例示的,可以使用其它核酸合成方法来产生核酸片段,所述方法包括但不限于已知的化学合成方法。
在延伸的多核苷酸80在基底72上合成之后,可以进行质量控制阶段(例如,图1中的合成质量控制阶段28)。如上文所指出的,在某些实施方案中,延伸的多核苷酸80可以在质量控制阶段之前进行扩增。此类扩增的一个实例84用虚线框示于图3中,代表一个任选阶段。其它阶段对于一些实施方案而言可以为任选的。
如所示出的,延伸的多核苷酸80的扩增82可以为通过桥式扩增。例如,P7’衔接子86可以被连接至延伸的多核苷酸80的3’端(阶段88)。P7’衔接子86包含与P7引物78的序列互补的序列。单链延伸的多核苷酸80可以被桥连,使得P7’衔接子86可以与固定在基底72上的P7引物78杂交(阶段90)。从P7引物78的3’端延伸的第二链92可以使用延伸的多核苷酸80和P7’衔接子86作为模板进行合成(阶段98)。因此,形成包含延伸的多核苷酸80和互补的第二链92的双链的核酸96。第二链92的3’端可以包含与P5引物76互补的P5’衔接子94。然后,可以使双链核酸96变性,使得可以形成两条单链多核苷酸(例如,延伸的多核苷酸80和第二链92),其中两条单链多核苷酸中的每个的一端连接于基底72(阶段100)。可以重复扩增步骤,并且可以在基底72上形成延伸的多核苷酸80的扩增簇102(阶段104)。
不管是否进行延伸的多核苷酸80的扩增84,可以对延伸的多核苷酸80进行测序(阶段106)。在示出的实施方案中,测序可以为合成测序或SBS技术,在该技术中四种常见DNA/RNA类型的标记的核苷酸108可以在基底上流动。各个标记的核苷酸108可以具有独特的荧光标签和与其连接的可逆阻断性部分。该荧光标签允许检测系统(例如,图2的检测系统60)检测哪些核苷酸是最后添加至与在基底72上的单独位点处的模板核酸(例如,延伸的多核苷酸80)杂交的探针中。可逆阻断性部分阻止每个循环在各个位点添加多于一个核苷酸。如下文详细讨论的,可以用任何其它合适的方法进行延伸的多核苷酸80的测序,所述方法包括通过连接进行的测序、焦磷酸测序、经由氢离子检测的测序、纳米孔测序等。
可以通过向特征的阵列提供不同的核苷酸(或寡核苷酸)对通过本文示出的方法制得的核酸进行测序,各个特征具有合成的核酸以便在各个特征产生不同的信号,各个信号对应于已经添加至该特征中的特定核苷酸(或寡核苷酸)种类。例如,在使用四种不同标记的情况下,可以获得对应于四种不同核苷酸(或寡核苷酸)种类的单独图像,其中各个图像捕获四种可能颜色(或信号类型)之中的单一颜色(或其它信号类型)。在该实例中,四种不同图像中的每一种的信号颜色是不同的,从而产生四种颜色图像的循环,其对应于在核酸的特定位置上存在的四种可能的核苷酸。在某些方面,此类方法还可以包括向分子的阵列提供另外标记的核苷酸(或寡核苷酸),从而产生颜色图像的多个循环。下文进一步详细示出一些示例性测序技术,其由多个循环产生图像,并且通常为每个循环多个图像。
SBS技术通常涉及通过向模板链迭代添加核苷酸而产生的新生核酸链的酶延伸。在常规的SBS方法中,在每个递送步骤中,在聚合酶的存在下,可以向靶核酸提供单一核苷酸单体。然而,在本文所述的方法中,在每个递送步骤中,在聚合酶的存在下,可以向靶核酸提供多于一种类型的核苷酸单体。
SBS可以利用具有终止部分的核苷酸单体或没有任何终止部分的核苷酸单体。利用没有终止的核苷酸单体的方法包括,例如,焦磷酸测序和使用γ-磷酸标记的核苷酸的测序,如下文进一步详细示出的。在使用没有终止的核苷酸单体的方法中,在每个循环中通过聚合酶被添加至新生核酸链中的核苷酸的数目通常为可变的并且取决于模板序列和核苷酸递送模式。对于利用具有终止部分的核苷酸单体的SBS技术,在所使用的测序条件下,终止子可为有效不可逆的,如同于利用双脱氧核苷酸的常规Sanger测序的情况;或者终止子可以为可逆的,如同于商购自Illumina,Inc.(San Diego,CA)或描述于Bentley等人,Nature 456:53-59(2008),WO 04/018497;WO 91/06678;WO 07/123744;美国专利第7,057,026号;7,329,492号;7,211,414号;7,315,019号或7,405,281号以及美国专利申请公开第2008/0108082 A1号中的测序方法的情况,将其各自通过引用并入本文。
可选地或另外地,对于终止部分的使用,SBS技术可以利用具有标记部分的核苷酸单体或者没有标记部分的核苷酸单体。因此,掺入事件可以基于以下进行检测:标记的特性,如标记的荧光;核苷酸单体的特性,如分子量或电荷;核苷酸掺入的副产物,如氢或焦磷酸的释放;等等。在两种或更多种不同的核苷酸同时存在于测序试剂或延伸核酸的实施方案中,不同的核苷酸可以彼此区分。例如,在测序试剂或延伸产物中存在的不同核苷酸可以具有不同的标记并且可以使用适当的光学器件对它们进行区分,所述适当的光学器件如通过商购自Illumina,Inc.(San Diego,CA)或描述在美国专利申请公开第2012/0270305 A1号;2013/0023422 A1号;和2013/0260372 A1号;以及美国专利第5,528,050号;5,719,391号;8,158,926号和8,241,573号(将其各自通过引用并入本文)中的测序平台所例示的。
优选地,在基于可逆终止的测序实施方案中,在SBS反应条件下,标记基本上不会抑制延伸。然而,检测标记可以例如,通过切割或降解移除。可以在将标记掺入合成核酸(例如核酸片段或组装的核酸)的排列特征之后捕获图像。在具体实施方案中,各个循环涉及向阵列同时递送四种不同的核苷酸类型,并且各个核苷酸类型具有光谱特性不同的标记。然后,可以获得四种图像,每种使用对于四种不同标记之一具有选择性的检测通道。可选地,可以依序添加不同的核苷酸类型,并且可以在各个另外步骤之间获得阵列的图像。在任一实施方案中,各个图像将显示具有掺入的具体类型的核苷酸的核酸特征。由于各个特征的不同序列内容,不同的图像中将存在或不存在不同的特征。然而,特征的相对位置将在图像中保持不变。可以如本文所示存储、加工和分析从此类可逆终止-SBS方法获得的图像。在图像捕获步骤之后,可以移除标记并且可以移除可逆终止部分用于后续核苷酸添加和检测的循环。在具体循环中已经检测到标记之后且在后续循环之前移除标记可以提供减少背景信号和循环之间串扰的优势。
可以与本文所述的方法和系统一起利用的另外示例性SBS系统和方法描述于美国专利申请公开第2007/0166705号、美国专利申请公开第2006/0188901号、美国专利第7,057,026号、美国专利申请公开第2006/0240439号、美国专利申请公开第2006/0281109号、PCT公开号WO 05/065814、美国专利申请公开第2005/0100900号、PCT公开号WO 06/064199和PCT公开号WO 07/010,251中,将其公开内容通过引用并入本文。
具体的测序实施方案可以利用焦磷酸测序技术。焦磷酸测序检测无机焦磷酸(PPi)的释放,因为具体的核苷酸被掺入至新生链中(Ronaghi等人(1996)Analytical Biochemistry 242(1),84-9;Ronaghi,M.(2001)Genome Res.11(1),3-11;Ronaghi等人(1998)Science 281(5375),363;美国专利第6,210,891号;美国专利第6,258,568号和美国专利第6,274,320号,将其公开内容通过引用并入本文)。在焦磷酸测序中,释放的Ppi能够通过被ATP硫酸化酶转化成三磷酸腺苷(ATP)而被检测到,并且产生的ATP的水平可以经由荧光素酶产生的光子检测到。合成的核酸(例如片段或组装的核酸)可以被连接在阵列的各特征中,并且可以使阵列成像以捕获由于在阵列特征中掺入核苷酸而产生的化学发光信号。在用特定核苷酸类型(例如A、T、C或G)处理阵列之后,可以获得图像。在添加各个核苷酸类型之后获得的图像将根据检测到的阵列中何种特征而不同。图像中的这些差异反映阵列上的特征的不同序列内容。然而,与其它SBS方法一样,各个特征的相对位置将在图像中保持不变。可以使用本文示出的系统和方法分析图像。例如,在用各个不同核苷酸类型处理阵列之后获得的图像可以以与本文例示的基于可逆终止的测序方法获得的图像的相同的方式处理。
焦磷酸检测可以被用于实时监测核酸的合成。例如,基于TdT的合成方法可以被用于合成核酸片段,如上文所示出的。当添加各个核苷酸时,焦磷酸将被释放。可以检测和定量各个合成循环中释放的焦磷酸的量以测定合成的产率和效率。这样,可以类似于化学合成中如何评价DMT来评价焦磷酸检测。
一些实施方案涉及通过连接技术进行的测序。此类技术利用DNA连接酶以掺入寡核苷酸,然后可以鉴定掺入的寡核苷酸。寡核苷酸通常具有不同的标记,其与寡核苷酸所杂交的序列中的特定核苷酸的身份有关。与其它SBS方法一样,可以使用核酸片段或组装的核酸所连接的特征阵列,并且可以在用标记的测序试剂处理阵列之后获得图像。各个图像将显示具有掺入的特定类型标记的核酸特征。由于各个特征的不同序列内容,不同的图像中将存在或不存在不同的特征,但特征的相对位置将在图像中保持不变。可以如本文所示存储、加工和分析从基于连接的测序方法获得的图像。通过可以与本文所述的方法和系统一起利用的连接系统和方法的示例性测序描述在美国专利第6,969,488号、美国专利第6,172,218号和美国专利第6,306,597号,将其公开内容通过引用并入本文。
应理解,可以将任何上述测序方法掺入本文所述的方法和/或系统中。此外,应理解,可以容易地修改其它已知测序过程,用于与本文所述的方法和/或系统一起使用。在对延伸的多核苷酸80进行测序之后,评价延伸的多核苷酸80的序列。当将延伸的多核苷酸80的序列与靶核酸的序列比较时,如上文所阐述的,可以获得合成错误率。也如上文所阐述的,可以获得预定的合成序列(例如,无误序列)的产率和/或具有预定错误率的合成序列(例如,当存在延伸的多核苷酸80的扩增簇时)的产率。此类产率和/或合成错误率可以用于核酸合成的质量控制(例如,图1的合成质量控制阶段28),例如,以确定片段设计的如何和/或确定如何收获延伸的多核苷酸80。例如,基于错误率和/或产率,可以从基底72切割或者可以不从基底72切割延伸的多核苷酸80。在示出的实施方案中,从P5引物76切割延伸的多核苷酸80(阶段110)。
图4示出根据本公开的实施方案随着片段和组装的合成多核苷酸的测序反馈组装合成多核苷酸分子的多个多核苷酸片段的片段合成和组装技术120。片段合成和组装技术120可以从片段设计阶段122(例如,图1中示出的片段设计阶段10)开始。片段设计阶段122可以包括使用靶核酸124设计一个或多个核酸片段(例如,片段126a、126b、126c、126d)的序列。虽然图4中示出四个核酸片段(例如,片段126a、126b、126c、126d),但应理解,可以基于靶核酸序列124设计任何数目(例如,1、2、3、4、5、6、7、8、9、10个或更多个)的核酸片段序列。可以以与图1的片段设计阶段10示出的相同或相似过程设计核酸片段126a、126b、126c、126d。此外,对于单独的单链核酸片段,各个核酸片段126a、126b、126c、126d可以经历与图3中示出合成和测序过程相同或相似的合成和测序过程。
基于各个核酸片段126a、126b、126c、126d的序列,可以在基底130上合成相应的多核苷酸128a、128b、128c、128d(阶段132)。合成的多核苷酸128a、128b、128c、128d分别对应于核酸片段126a、126b、126c、126d。合成的多核苷酸128a、128b、128c、128d的合成可以与图3的延伸的多核苷酸80的合成相同或相似。在一些实施方案中,可以对合成的多核苷酸128a、128b、128c、128d进行扩增以在基底130上产生相应的扩增簇134a、134b、134c、134d(阶段136)。在某些实施方案中,此类扩增为任选的。虽然例示了扩增簇134a、134b、134c、134d,但可以在合成的多核苷酸128a、128b、128c、128d上进行下述阶段。
在一种或多种测序试剂139的存在下,可以平行或依序对扩增簇134a、134b、134c、134d进行测序(阶段138)。如上文讨论的,可以从测序获得关于扩增簇134a、134b、134c、134d的合成错误率和/或产率(或扩增错误率和/或产率)。在一些实施方案中,合成(或扩增)错误率和/或产率可以用于向片段设计阶段122提供反馈以确定片段设计的如何。在某些实施方案中,可以提供多个循环的此类反馈,以便可以自动地或者由用户进行适合的片段设计路线。
当片段设计被确定为期望的时,可以从基底130收获扩增簇134a、134b、134c、134d中的一个或多个。在一些实施方案中,不从基底130收获第一扩增簇(例如,扩增簇134a),而收获其它扩增簇(例如,扩增簇134b、134c、134d)(阶段140)。在此种情况下,扩增簇134a、134b、134c、134d可以在基底130上组装以产生组装的多核苷酸150(阶段142)。在其它实施方案中,扩增簇134a、134b、134c、134d全部都从基底130收获(阶段144)。在此种情况下,扩增簇134a、134b、134c、134d可以在不同的基底146或相同的基底130上组装以产生组装的多核苷酸152(阶段148)。
如上文讨论的,关于扩增簇134a、134b、134c、134d的合成(或扩增)错误率和/或产率可以用于确定如何收获扩增簇134a、134b、134c、134d。例如,基于合成错误率和/或产率,可以收获各个扩增簇134a、134b、134c、134d中的全部或部分。
不考虑可以如何收获和组装扩增簇134a、134b、134c、134d,可以对组装的多核苷酸150或152进行空位修复以产生连接于基底130或146上的组装的多核苷酸簇154(阶段156)。组装质量控制阶段158可以在片段组装之后发生。如所示出的,然后,在组装质量控制阶段158期间,在一种或多种测序试剂157的存在下,可以对组装的多核苷酸簇154进行测序。类似地,可以从测序获得关于组装的多核苷酸簇154的合成(或扩增)错误率和/或产率。在一些实施方案中,合成(或扩增)错误率和/或产率可以用于向片段设计阶段122提供反馈以确定片段设计的如何。在某些实施方案中,可以提供多个循环的此类反馈,以便可以自动地或者由用户进行适合的片段设计路线。
当确定片段设计是期望的,可以从基底130或146收获全部或部分组装的多核苷酸簇154(阶段160)。收获可以基于关于组装的多核苷酸簇154的合成(或扩增)错误率和/或产率。
图5示出根据本公开的实施方案随着测序反馈进行的多核苷酸片段组装技术170。多核苷酸片段组装技术170可以从片段设计阶段172(例如,图1中示出的片段设计阶段10)开始。片段设计阶段172可以包括使用靶核酸174设计一个或多个核酸片段(例如,片段176a、176b、176c、176d)。虽然图5中示出四个核酸片段(例如,片段176a、176b、176c、176d),但应理解,可以基于靶核酸序列174设计任何数目(例如,至少1、2、3、4、5、6、7、8、9、10个或更多个)的核酸片段。可以以与图1的片段设计阶段10示出的相同或相似过程设计核酸片段176a、176b、176c、176d。
基于设计的四个核酸片段176a、176b、176c、176d,可以合成相应的核酸片段179a、179b、179c、179d。例如,合成的核酸片段179a、179b、179c、179d分别靶向设计的核酸片段176a、176b、176c、176d。核酸片段179a、179b、179c、179d的合成可以以任何合适的方式进行,所述方式包括关于图4所述的方法。此外,第一核酸片段179a和最后核酸片段179d可以被进一步修饰(阶段178)。如所示出的,可切割的衔接子180可以与第一核酸片段179a的5’端连接,并且可切割的衔接子182可以与最后一个核酸片段179d的3’端连接。可切割的衔接子180、182可以为具有引物的互补序列的任何合适的衔接子,所述引物可以被固定至基底184。例如,如上文所指出的,P5引物186和P7引物188可以被固定至基底184。因此,可切割的衔接子180可以具有与P5引物186的序列互补的P5’的序列,以及可切割的衔接子182可以具有与P7引物188的序列互补的P7’的序列。
然后,合成的核酸片段179a、179b、179c、179d可以在基底184上平行或依序流动(阶段192)。因为核酸片段179a的5’端的可切割衔接子180与被固定在基底184上的P5引物186互补,所以核酸片段179a可以与P5引物186杂交,使得核酸片段179a连接于基底184。然后,其它核酸片段179b、179c、179d可以被组装至核酸片段179a(阶段194)。核酸片段179a、179b、179c、179d的组装可以在任何合适的酶的存在下进行,所述酶包括但不限于DNA重组酶、β蛋白或它们的任何组合。
在片段组装阶段194之后,可以修复组装的核酸片段179a、179b、179c、179d以产生双链多核苷酸196(阶段198)。例如,各个单链200或202上的核酸片段之间的空位可以使用其它单链202或200作为模板进行填补。片段修复阶段198可以在任何合适的酶的存在下进行,所述酶包括但不限于DNA聚合酶、DNA连接酶、circligase或它们的任何组合。
然后,可以使双链多核苷酸196变性(阶段204)。因为链200与被固定至基底184的其它链202杂交,所以一经变性,链200可以从基底184洗掉,并且链202保留在基底184上。然后,可以扩增链202。例如,如所示出的,链202可以进行桥式扩增,在该桥式扩增中,可切割的衔接子182与P7引物188杂交(阶段206),然后第二链可以使用链202作为模板进行合成以产生双链多核苷酸(例如,与图3中示出的阶段98相似)。链202的扩增也可以使用如上文所指出的滚环扩增(RCA)或任何其它合适的固相扩增方法进行。由于扩增,可以在基底184上形成链202的扩增簇208,包括链202及其互补序列的拷贝(阶段210)。在一些实施方案中,此类扩增阶段(例如,阶段206、210)为任选的。
然后,在组装质量控制阶段214期间,在一种或多种测序试剂212的存在下,可以对扩增簇208进行测序。与以上类似地,可以从测序获得关于扩增簇208的合成(或扩增)错误率和/或产率。在一些实施方案中,合成(或扩增)错误率和/或产率可以用于向片段设计阶段172提供反馈以确定片段设计的如何。在某些实施方案中,可以提供多个循环的此类反馈,以便可以自动地或者由用户进行适合的片段设计路线。
当确定片段设计是期望的时,可以从基底184收获全部或部分扩增簇208(阶段216)。收获可以基于关于组装的多核苷酸簇154的合成错误率和/或产率。如所示出的,可以从基底184上的P5和P5引物切割扩增簇208。
图6示出根据本公开的实施方案平行合成不同的多核苷酸片段序列用于稍后组装成合成的多核苷酸分子的流动池220。流动池220包括基底221和一个或多个流道(例如,流道222a、222b、222c、222d),在所述流道中,可以引入各种载体流体、试剂等。虽然图6中示出四个流道,但应理解,流动池220可以包括任何数目的流道(例如,1、2、3、4、5、6、7、8、9、10个或更多个)。
各个流道222a、222b、222c、222d可以包括在基底221上的一个或多个反应位点,在所述反应位点,可以发生如上文讨论的核酸的合成、扩增和/或测序。例如,各个流道222a、222b、222c、222d包括如所示出的三个反应位点224。可以设想反应位点的许多不同的布局,其包括规则的、重复的和非规则的图案。例如,反应位点的布局可以包括直线(即,矩形)布局、三角形布局、六角形布局等。具体布局可以遵循于2011年10月6日提交的美国专利第7,813,013号和/或美国专利申请第13/267,565号的教导,将所述专利据此通过引用并入。应注意,图案化基底也可以用于控制能够询问的特征的密度(例如,通过成像)。
引物(例如,P5、P7引物)可以流入各个流道222a、222b、222c、222d,使得引物沉积并连接于各个流道222a、222b、222c、222d的反应位点224。在各个流道222a、222b、222c、222d的各个反应位点224,如上文所讨论,核酸片段226可以通过引物的延伸合成,或者被连接至引物(阶段228)。各个流道222a、222b、222c、222d通常包含不同的核酸片段226。例如,流道222a、222b、222c、222d可以包含图4的核酸片段128a、128b、128c、128d。在一些实施方案中,流道222a、222b、222c、222d中的任一个可以包含与其它流道222a、222b、222c、222d中的一个或多个的核酸片段相同的核酸片段。
可以在一种或多种测序试剂230的存在下,对在各个流道222a、222b、222c、222d的各个反应位点224处的核酸片段226进行测序(阶段232)。在一些实施方案中,在测序之前,可以在流道222a、222b、222c、222d中的一个或多个中,进行核酸片段226的扩增。与以上类似地,可以从测序获得关于核酸片段226的合成错误率和/或产率。在一些实施方案中,合成错误率和/或产率可以用于向片段设计提供反馈以确定片段设计的如何。在某些实施方案中,可以提供多个循环的此类反馈,以便可以自动地或者由用户进行适合的片段设计路线。
可以基于合成(或扩增)错误率和/或产率从基底221收获全部或部分核酸片段226(阶段234)。如所示出的,选择性收获一些核酸片段226(例如,核酸片段236),随后从流道222a、222b、222c、222d洗掉。其它核酸片段226(例如,核酸片段238)并不进行收获,并且保持连接于基底221的反应位点224中。收获可以基于关于核酸片段226的合成(或扩增)错误率和/或产率。将收获的核酸片段226从流道222a、222b、222c、222d洗掉,然后可以进行收集用于稍后组装成合成的多核苷酸分子。
图7示出根据本公开的实施方案的合成多核苷酸分子的单一平台合成、扩增和测序的微流体读写盒240的实施方案。盒240具有如所示出的大致圆形,然而,可以设想许多其它形状,包括正方形、矩形、三角形、六角形等。
盒240包括基底242和一个或多个流道244。流道244彼此相邻,并且放射状对中中心区246。可以将各种载体流体、试剂等引入(例如,沿着由参考248示出的朝向中心区246的方向)流道244,并且可以流出流道244(例如,以与方向248通常相反的方向)。虽然图7中示出十六个流道,但应理解,盒240可以包括任何数目的流道(例如,1、2、3、4、5、6、7、8、9、10个或更多个)。
中心区246可以被具有环250的流道244间隔。环250可以为打开的(例如,当安装时)或闭合的(例如,当移除时)以允许或阻断载体流体、试剂、反应物(例如,片段核酸)等从流道244流动至中心区246。在一些实施方案中,环250可以包括中心区246与各个流道244之间的门。门可以为打开的和闭合的以提供从任何流道244至中心区246的选择性流动。
各个流道244(与图6中示出的流道222a、222b、222c、222d相似)可以包括在基底242上的一个或多个反应位点252,在所述反应位点,可以发生如上文讨论的核酸的合成、扩增和/或测序。例如,各个流道224包括如所示出的三个反应位点252。反应位点252的布局与图6的反应位点224的布局相似。
核酸的合成、扩增和/或测序可以在与图6中所述的流道222a、222b、222c、222d相似的流道244中发生。然而,不同于图6的流动池220,盒240包括中心区246,其可以被用于组装和修复核酸片段,如图1的阶段32和图4的阶段142、148、156中所述的那些。此外,中心区246也可以用于组装质量控制,如图1的阶段36和图4的阶段158中所述的那样。此外,可以从中心区246收获组装的多核苷酸(例如,来自核酸片段)。
图8示出根据本公开的实施方案随着测序反馈产生合成的多核苷酸分子的模板非依赖性多核苷酸片段的技术260的流程图。技术260可以从提供被固定在基底上的引物开始(方框262)。可以通过延伸引物进行单链多核苷酸的合成(方框264)。单链多核苷酸的合成可以基于靶核酸序列。
在一些实施方案中,可以使用如上文讨论的任何合适的方法扩增合成的单链多核苷酸(方框266)。在其它实施方案中,此类扩增为任选的,因此,方框266用虚线框示出。
然后,可以对合成的单链多核苷酸进行测序(方框268)。可以将单链多核苷酸的序列与靶核酸序列进行比较(方框270),用于合成质量控制。如上文讨论的,合成(或扩增)错误率和/或产率可以用于质量控制。例如,合成(或扩增)错误率和/或产率可以用于向片段设计提供反馈以确定设计质量。然后,基于序列的比较(例如,合成错误率和/或产率),可以收获合成的单链多核苷酸(方框272)。
图9示出根据本公开的实施方案随着测序反馈产生组装的合成多核苷酸分子的技术280的流程图。技术280可以从提供被固定在基底上的引物开始(方框282)。基于靶核酸序列,可以设计多个核酸片段。根据图8中所述的技术260,可以合成、扩增、测序和/或收获各个设计的核酸片段。
基于设计的核酸片段的序列,可以通过延伸基底上的引物合成多个片段多核苷酸(方框284)。在一些实施方案中,可以使用如上文讨论的任何合适的方法扩增多个片段多核苷酸(方框286)。在其它实施方案中,此类扩增为任选的,因此,用虚线框示出方框286。
然后,可以对多个片段多核苷酸进行测序(方框288)。可以将多个片段多核苷酸各自的序列与其相应设计的核酸片段的序列进行比较(方框290),用于合成质量控制。如上文讨论的,合成(或扩增)错误率和/或产率可以用于质量控制。例如,合成(或扩增)错误率和/或产率可以用于向片段设计提供反馈以确定设计质量。
然后,基于序列比较(例如,合成(或扩增)错误率和/或产率),可以收获多个片段多核苷酸(方框292)。可以进一步组装和/或修复收获的多个片段多核苷酸以产生组装的多核苷酸(方框294)。此外,如上文讨论的,可以对组装的多核苷酸进行质量控制(例如,测序)。质量控制可以向片段设计提供反馈并且可以用于收获组装的多核苷酸。
图10示出根据本公开的实施方案的基于来自组装的合成多核苷酸的测序反馈的合成多核苷酸设计的质量反馈技术300的流程图。技术300可以从接收基于靶序列的多个重叠片段序列的系统(例如,系统50)开始(方框302)。设计的片段序列可以由操作员设计或者可以由系统根据基于规则的技术自动设计,所述技术可以根据如本文提供的接收的质量信息更新。例如,靶序列可包含与差的分段分数相关的核苷酸序列。即,其它靶序列的先前测序数据可以表明被设计以在该序列内断开的片段可能与具有高错误率(或者低的片段产率)的组装分子相关。而且,其它核苷酸序列可与高的分段分数相关。在此类实施方案中,相对于靶序列的较低分段分数区,自动的基于规则的系统可以优选产生在较高分段分数区内断开的片段。
基于设计的片段序列,可以合成多个片段多核苷酸(方框303)。多个片段多核苷酸中的每个可以用任何合适的方法合成,所述方法包括图8中所述的方法。第一和最后一个片段多核苷酸可以用衔接子进一步修饰(方框304)。例如,一个衔接子可以连接于第一多核苷酸的5’端,以及另一衔接子可以连接于最后一个多核苷酸的3’端。
与衔接子互补的引物可以被固定在基底上(方框306)。因此,可以通过基底上的引物捕获第一片段多核苷酸(方框308)。其它片段多核苷酸可以在基底上流动,使得其它片段多核苷酸沿着第一片段多核苷酸组装,并且进一步修复组装的多核苷酸(方框310)。
在一些实施方案中,可以使用如上文讨论的任何合适的方法扩增组装的多核苷酸(方框312)。在其它实施方案中,此类扩增为任选的,因此,用虚线框示出方框312。
然后,可以对组装的多核苷酸进行测序(方框314)。可以将组装的多核苷酸的序列与靶序列进行比较(方框316),用于合成质量控制。如上文讨论的,合成错误率和/或产率可以用于质量控制。例如,合成错误率和/或产率可以用于向片段设计提供反馈(方框302提供)以确定片段设计质量和/或合成的核酸分子的整体质量。然后,基于序列比较(例如,合成(或扩增)错误率和/或产率),可以收获组装的多核苷酸(方框318)。
虽然本文仅示出和描述了所考虑的实施方案的某些特征,但本领域技术人员将进行许多修改和改变。而且,应理解,公开的实施方案的某些元素可以彼此组合或交换。因此,应理解,所附权利要求旨在涵盖落在本公开的真正精神内的全部此类修改和改变。
- 还没有人留言评论。精彩留言会获得点赞!