木霉属组合物和使用方法与流程
相关申请的交叉引用
本申请按照35u.s.c.§119(e)要求2014年9月18日提交的美国临时申请no.62/052,209的优先权,并且该临时申请通过引用并入本文。
本发明涉及通过真菌寄生真菌(mycoparasiticfungi)形成微菌核繁殖体以及这些微菌核用于植物病害防控的用途。
背景技术:
木霉(trichoderma)属是一种众所周知的全球土壤真菌,已经被广泛地探索作为许多植物致病性真菌的拮抗剂(howellcr,2003.mechanismsemployedbytrichodermaspeciesinthebiologicalcontrolofplantdiseases:thehistoryandevolutionofcurrentconcepts.plantdisease87:4-10;harmange,2006.overviewofmechanismsandusesoftrichodermaspp.phytopathology96:190–194)。由于直接对抗病原体活性和/或诱导宿主抗性反应,木霉属物种的分离株可以成功防控植物病害(harmange,2000.mythsanddogmasofbiocontrol:changesinperceptionsderivedfromresearchontrichodermaharzianumt-22.plantdisease84:377–393)。此外,已经报道了,对于一些菌株来说,在作为非严格植物共生体形成之后,木霉通过定植根际来起到植物生长促进剂的功能(harmange,howellcr,viterboa,cheti,loritom,2004.trichodermaspecies-opportunistic,avirulentplantsymbionts.naturereviewsmicrobiology2:43-56;harmange,kubicekpk,1998.trichodermaandgliocladiumvol2.enzymes,biologicalcontrolandcommercialapplications.taylorandfrancis,london1-393)。描述了用作生物防控剂的木霉菌株的不同作用方式:a)通过定植土壤和/或植物的部分或通过竞争营养物质的根际能力;b)通过产生针对病原体的各种细胞壁降解酶的微寄生作用;c)通过生产能够杀死病原体的抗微生物化合物(挥发性和非挥发性物质)的抗生现象;d)通过改善植物发育来促进生长,以及e)在植物中诱导系统性防御反应(harmanandkubicek,1998,ibid;harman,2006,ibid)。
目前,生物除害剂市场中的大多数木霉产品是基于固体底物产生的气生分生孢子。木霉的气生分生孢子是在湿谷物上使用固体底物发酵生产的,这个工艺需要数周的时间来进行生产和干燥,从而提高了生产成本(pandeya,fernandesm,larrochec,2008.currentdevelopmentsinsolid-statefermentation.springernewyork,us,517p.doi:10.1007/978-0-387-75213-6;ramanujamb,prasadrd,rangeswaranr,2010.massproduction,formulation,qualitycontrolanddeliveryoftrichodermaforplantdiseasemanagement.thejournalofplantprotectionsciences2(2):1–8)。在湿谷物上生产真菌分生孢子受到诸多限制,包括劳动力成本高、质量控制差、发酵时间长、工人对环境的担忧以及规模上的困难。已经对液体培养生产方法进行了研究,并集中于木霉的浸没式分生孢子和衣原体的生产(lewisja,papavizasgc,1983.productionofchlamydosporesandconidiabytrichodermaspp.inliquidandsolidgrowthmedia.soilbiologyandbiochemistry15:351–357;papavizasgc,dunnmt,lewisja,beagle-ristainoj,1984.liquidfermentationtechnologyforexperimentalproductionofbiocontrolfungi.phytopathology74(10):1171–1175;tabachnikm,1989.methodofgrowingtrichoderma.patentus4,837,155a;harmange,jinx,staszte,peruzzottig,leopoldac,taylorag,1991.productionofconidialbiomassoftrichodermaharzianumforbiologicalcontrol.biologicalcontrol1:23-28;jinx,taylorag,harmange,1996.developmentofmediaandautomatedliquidfermentationmethodstoproducedesiccation-tolerantpropagulesoftrichodermaharzianum.biologicalcontrol7:267–274;srirams,roopakp,savithamj,2011.extendedshelf-lifeofliquidfermentationderivedtalcformulationsoftrichodermaharzianumwiththeadditionofglycerolintheproductionmedium.cropprotection30:1334–13339)。制品研究集中于木霉生物质、气生分生孢子和衣原体的稳定工艺,其提供足够的储存稳定性(lewisja,papavizasgc,1985.characteristicsofalginatepelletsformulatedwithtrichodermaandgliocladiumandtheireffectontheproliferationofthefungiinsoil.plantpathology34(4):571–577;jinx,custisd,2010.microencapsulingaerialconidiaoftrichodermaharzianumthroughspraydryingatelevatedtemperatures.biologicalcontrol56:202-208;yonselys,batumms,2010.trichodermagranuleproduction.patentep20080866322;srirametal.,2011,ibid)。尽管在液体培养中尝试生产木霉,但是产量低、发酵时间长、耐干燥性差和储存稳定性差等因素已经妨碍了工业上大规模采用该生产方法。
为了满足生物除害剂市场预期并促进木霉作为杀真菌剂的用途或促进植物健康,必须开发有效和可行的液体培养生产技术,来构思高质量的基于木霉的产品。优选地,木霉将在土壤和腐烂的植物材料中持续存在。为此,许多植物病原真菌产生菌核;即,对干燥具有高度抗性的黑色化、致密的菌丝聚集体。这些繁殖体通常用作真菌的越冬结构(cooke,1983,morphogenesisofsclerotia.in“fungaldifferentiation:acontemporarysynthesis”smith,j.e,ed.pp397-418.marceldekker,inc.,newyork,ny,u.s.a.;coley-smithandcooke,1971,survivalandgerminationoffungalsclerotia.in“annualreviewofphytopathology”,horsfall,j.g.,baker,k.f.,zentmyer,g.a.,eds.pp65-92.annualreviewsinc.,paloalto,ca,u.s.a.)。已经在浸没式液体培养发酵中以高浓度生产诸如colletotrichumtruncatum和mycoleptodiscusterrestris的真菌植物病原体的微菌核(小的菌核颗粒,200-600μm)(jacksonandschisler,1995,mycologicalresearch,99:879-884;shearerandjackson,2003,u.s.patentno.6,569,807)。杂草植物的这些病原体的微菌核已经在土壤和水生环境中显示出作为持续繁殖体的价值(shearerandjackson,2006,biologicalcontrol.38:298-306;boyetteetal.,2007,biocontrol52:413-426)。然而,到目前为止,还没有对任何木霉属物种的微菌核的报道。
技术实现要素:
本文中公开了真菌的经分离的微菌核,该组合物包含木霉属物种的微菌核。在本发明的一个实施方式中,经分离的微菌核来自哈茨木霉(trichodermaharzianum)。在本发明的另一个实施方式中,经分离的微菌核来自木素木霉(trichodermalignorum)。在本发明的又另一个实施方式中,经分离的微菌核来自绿色木霉(trichodermaviridae)。在本发明的一个实施方式中,经分离的微菌核来自哈茨木霉(trichodermaharzianum)。在本发明的另一个实施方式中,经分离的微菌核来自里氏木霉(trichodermareesei)。在本发明的又另一个实施方式中,经分离的微菌核来自康氏木霉(trichodermakoningii)。在本发明的一个实施方式中,经分离的微菌核来自拟康氏木霉(trichodermapseudokoningii)。在本发明的又另一个实施方式中,经分离的微菌核来自多孢木霉(trichodermapolysporum)。在本发明的又另一个实施方式中,经分离的微菌核来自棘孢木霉(trichodermaasperellum)、钩状木霉(trichodermahamatum)、盖姆斯木霉(trichodermagamsii)、绿粘帚霉(gliocladiumvirens)和链孢粘帚霉(gliocladiumcatenulatum)。
本文公开了一种包含真菌的微菌核的组合物,该组合物包含木霉属物种的微菌核和农学上可接受的载体,其中在再水合后,所述微菌核在再水合后发芽出菌丝或孢子,以产生分生孢子。在本发明的一个实施方式中,微菌核以防控植物病害的有效量存在。在本发明的另一个实施方式中,微菌核以促进植物生长的有效量存在。在本发明的另一个实施方式中,微菌核是通过液体培养发酵产生的,并且在回收的生物质中以至少1×105个微菌核每克所述生物质的浓度存在。
本文还公开了一种用于以高浓度耐干燥真菌微菌核产生真菌的方法。所述方法包括如下步骤:用包含木霉属物种的菌丝或孢子的生物防控真菌的真菌繁殖体接种包含碳源和氮源的液体培养基,所述有机氮源的浓度在8克/升和40克/升之间,并且所述碳源的浓度大于40克/升;使所述繁殖体孵育足够的时间以允许产生微菌核;并且收集所获得的包含生物质的微菌核。在一个实施方式中,所获得的微菌核在干燥后是储存稳定的。在另一个实施方式中,所获得的微菌核在施用于种子后是储存稳定的。在另一个实施方式中,所获得的微菌核在再水合后产生分生孢子。
本文还公开了一种用于以高浓度耐干燥真菌微菌核和浸没式分生孢子产生真菌的方法。该方法包括如下步骤:用包含木霉属物种的菌丝或孢子的真菌的真菌繁殖体接种包含碳源和氮源的液体培养基,所述有机氮源的浓度在8克/升和40克/升之间,并且所述碳源的浓度大于40克/升;在生物反应器中使繁殖体孵育足够的时间以允许产生微菌核和浸没式分生孢子;使生物反应器曝气于空气流并提供至少0.1v空气/v培养基,该空气流保持溶解氧水平接近或大于零;并且收集所获得的微菌核和浸没式分生孢子。在本发明的一个实施方式中,从所公开的方法收集到约10.8×106个微菌核/升和约1.9×1012个浸没式分生孢子/升。
附图简要说明
本发明以及所公开的实施方式可以从以下附图的详细描述中得到最好的理解,其中:
图1是描绘在空气干燥和在冷藏条件(4℃)下长时间储存后c:n比(36g碳l-1)对由用5%硅藻土配制的哈茨木霉t-22的干燥的微菌核(ms)颗粒产生分生孢子的影响的图。将ms颗粒在25℃下在水琼脂上孵育7天后,评估分生孢子产量。在时间“0”处的平均值(±se)表示耐干燥性,并且不同的字母表示显著差异(p≤0.05)。
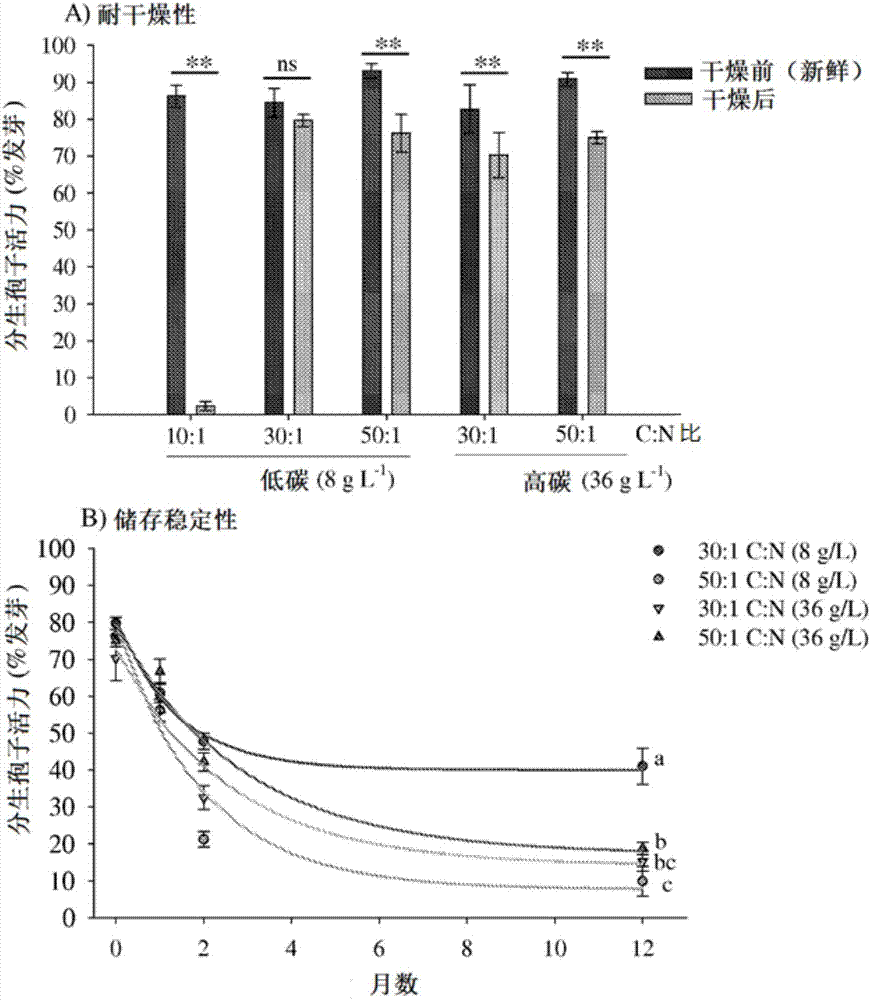
图2a和2b是描绘在各种培养基中产生的哈茨木霉t-22浸没式分生孢子的耐干燥性和储存稳定性的图。将经干燥的浸没式分生孢子真空包装并在4℃下储存。在25℃下孵育16小时后,在水琼脂上评估经干燥的浸没式分生孢子的分生孢子发芽。在图2a中,空气干燥前后的存活率(平均值±se)之间的成对比较;配对t-student检验,p≤0.05(*)、p≤0.01(**)或不显著(ns)。在图2b中,圆圈表示平均值(±se),而线是通过指数衰减模型拟合的数据:y=40+40.3exp(-0.72×时间)(r2=0.75)[30:1c:n,8gl-1],y=7.7+71.6exp(-0.5×时间)(r2=0.80)[50:1c:n,8gl-1],y=14.1+58.7exp(-0.39×时间)(r2=0.79)[30:1c:n,36gl-1]和y=17.2±61.9exp(-0.35×时间)(r2=0.81)[50:1c:n,36gl-1]。通过平方和减数(sum-of-squaresreduction)测试比较存活率衰减曲线,不同字母表示曲线之间的显著差异,p≤0.05。
图3是描绘使用棉籽粉作为氮源的各种液体培养基中产生的哈茨木霉t-22微菌核(ms)颗粒的储存稳定性的图。在旋转摇荡器培养箱中在28℃和350rpm下生长4天后收获培养物。将含有微菌核的培养物与硅藻土混合,脱水,并空气干燥至小于4%的水分并在4℃或25℃下储存真空包装。
图4是描绘在生长室生物测定中在土壤中播种的甜瓜(cv.‘halesbest’)来说露头的刚出芽的幼苗在出芽后幼苗腐烂(damping-off)中存活的可能性的图,该土壤被使用哈茨木霉t-22(0.4gms颗粒/1000cm3)处理或未用哈茨木霉t-22处理的以两种速率(0.625和1.5g/1000cm3)施用的立枯丝核菌(rhizoctoniasolani)侵染。检查出芽后幼苗腐烂的发生时间高达播种后15天。值是三次独立实验的平均值(±se)。根据对数秩检验(log-rank),后面有不同字母的存活曲线具有统计学意义(p≤0.05)。对照(哈茨木霉)和哈茨木霉+立枯丝核菌0.625g/1000cm3的曲线重叠,彼此没有显著差异。
具体实施方式
本文公开了由木霉形成微菌核繁殖体以及这些微菌核的用途。
定义
在本发明的说明书和权利要求书中使用时,单数形式“一”、“一个”、“一种”和“该”以及不使用量词的情形也旨在包括复数形式,除非上下文另有明确指出。例如,术语“一个细胞”包括多个细胞,包括其混合物。
本文中使用时,“微菌核”指的是真菌的一些静止状态的小型菌核体。微菌核是稳定的、有活力的、有时黑色的、紧密的真菌菌丝集合体。微菌核本身不具有感染性,但是当被再水合(例如通过暴露于土壤中的水分或树皮中的裂缝内的水分进行)时,微菌核发芽出菌丝或者孢子以产生分生孢子,这两种都对目标真菌植物病原体具有感染性。微菌核具有极强的耐干燥性,能够以长孢子的方式和植物生长方式发芽,并且还保留其天然形式或正常形式(即相同真菌的菌丝体、芽生孢子和/或分生孢子)的杀真菌能力。在形态学上,微菌核可以作为聚集的细胞群存在。
本文中使用时,术语“分生孢子”指的是真菌的无性孢子或非运动性孢子。“气生”分生孢子是由生长固体基质的真菌菌丝形成的,或者能够直接由菌核体(包括微菌核)形成。在含水环境(例如液体发酵肉汤)中形成的分生孢子被称为“浸没式”分生孢子。
本文中使用时,术语“杀真菌剂”指的是诱导死亡、破坏或阻碍生长并防止目标真菌扩散的材料或材料的混合物。杀真菌剂也用于对抗真菌感染。杀真菌剂可以是接触式的或系统性的。接触式杀真菌剂在喷洒于表面时会杀死真菌。系统性杀真菌剂必须被真菌吸收后才使真菌死亡。本文中公开的杀真菌方法包括防治性、保护性、预防性和根除性处理。
本文中描述的本发明对于从来自木霉属的任何物种、菌株或种类的真菌寄生真菌产生微菌核是有效的,尽管也可以设想本发明可用于从来自胶枝霉(gliocladium)属的物种产生微菌核。本文中使用的优选物种包括但不限于哈茨木霉(trichodermaharzianum)、木素木霉(trichodermalignorum)、绿色木霉(trichodermaviridae)、里氏木霉(trichodermareesei)、康氏木霉(trichodermakoningii)、拟康氏木霉(trichodermapseudokoningii)、多孢木霉(trichodermapolysporum)、棘孢木霉(trichodermaasperellum)、钩状木霉(trichodermahamatum)和盖姆斯木霉(trichodermagamsii)。
本发明的微菌核的制备优选地在液体培养基中进行,并且优选地通过深槽液体培养发酵进行大规模生产。也可以设想使用固体培养基。用于制备黑色化的微菌核的液体培养基是关键的,因为它们的形成和产量是中等依赖性的。为了在本文中使用,培养基优选地包含浓度为8克氮源/升和小于40克氮源/升之间的浓度的氮源和浓度大于18克碳水化合物/升的碳源,优选地大于40克碳水化合物/升。合适的氮源包括但不限于水解酪蛋白、酵母提取物、水解大豆蛋白、水解棉籽蛋白、玉米浆粉和水解玉米面筋蛋白。合适的碳源包括但不限于碳水化合物,包括葡萄糖、果糖和蔗糖,以及甘油。本文使用的优选的液体培养基由jackson描述(u.s.专利5,968,808,其内容通过引用并入本文)。当在jackson培养基上的浸没式培养物中生长时,来自木霉属的真菌产生微菌核。迄今为止,尚未公开有从这些真菌获得这些微菌核。发酵可以使用常规的需氧液体培养技术采用搅拌和曝气来进行。搅拌优选地抑制窗口壁上的菌丝体生长。合适的温度可以在约15℃至约32℃的范围内,并且ph可以在约4至约8的范围内。用于发酵的优选温度范围为约25℃至约30℃。一旦获得足够重的真菌生长,通常在约2-4天,微菌核开始形成,然后继续发酵直到获得足够高浓度的微菌核。不限于此,在一个优选的实施方式中,继续发酵,直到培养物中大部分活菌(即大于30重量%)被分化,更优选地直到培养物中主要比例的活菌(即大于50重量%)被分化,以形成微菌核。在一些生物反应器配置中发现的高纯度(sheer)发酵条件可能会导致微菌核被分解成较小的黑色化的菌丝聚集体或混合制品。这些菌丝聚集体或混合制品将繁殖传播分生孢子。发酵完成后,可以使用常规技术(例如通过过滤或离心)来回收微菌核。可以将微菌核干燥(例如通过空气干燥或通过施用于种子)至低的水分水平,并在室温或更低温度下储存。在优选的实施方式中,在干燥后从发酵回收的生物质将含有约1×105个或更高的微菌核/克生物质(基于生物质的干重),特别是至少1×106个微菌核/克生物质。
预期通过液体发酵的微生物的商业生产将通过在生物反应器中的发酵来实现。生物反应器中的条件将通过液体发酵形成微菌核和浸没式分生孢子二者的培养物。考虑到本文公开的培养基条件的教导,可以预期本领域普通技术人员将能够通过控制发酵罐中的溶解氧速率来控制微菌核和浸没式分生孢子的形成。
用作抗病原真菌的生物防控的商业制品可以由已经从本文所述的培养基中收获的微菌核制备得到。实际上,可以设想商业制品可直接从培养物中制备,从而避免了任何纯化步骤的需要。尽管可以直接使用液体培养物,例如在种子包衣、灌封混合物中,但是在优选的实施方式中,如上文所述,使用本领域中的常规技术,将水从培养物中除去至部分干燥或基本干燥,并将干燥的培养物破碎或研磨成适合通过常规造粒机应用的小颗粒。可以通过空气干燥(例如将收集的芽生孢子与干燥剂例如硅藻土混合)或喷雾干燥进行干燥。为了促进应用和随后的真菌生长和分生孢子受精,收获的微菌核可替代地配制在合适的农学上可接受的营养的或惰性的载体或载剂中,以用作可湿性粉末、粉尘、颗粒剂、钓饵(bait)、溶液、可乳化的浓缩物、乳液、悬浮浓缩物和喷雾剂(气溶胶)。例如,对于液体应用,微菌核可以被配制为悬浮液或乳液。在这样的实施方式中,优选的载体包括但不限于水、缓冲液或菜油或植物油。在一个特别适用于固体颗粒应用的替代的优选实施方式中,微菌核可以用固体惰性载体或稀释剂来配制,所述固体惰性载体或稀释剂例如硅藻土、滑石、粘土、蛭石、caco3、玉米芯砂粒、藻酸盐凝胶、淀粉基质或合成聚合物,或者它们可以并入传统的控释微粒或微胶囊中。本领域技术人员将认识到,真菌还可以与常规添加剂例如粘着剂或粘附剂、乳化剂、表面活性剂、泡沫材料、保湿剂或润湿剂、抗氧化剂、uv保护剂、营养添加剂、肥料或杀虫剂组合配制。为了应用于种子、树的树皮或树冠和植物上,微菌核也可以与吸湿或亲水的佐剂一起配制。制品可以具有较低的微菌核浓度,其中本领域普通技术人员将使用微菌核作为农用化学品、生物杀虫剂、杀虫剂、杀真菌剂、植物生长添加剂和生物刺激剂。
与未处理的对照相比,选择微菌核的绝对量及其在最终组合物中的浓度以提供病原真菌的有效减少。实际用量不是关键的,并且受实际考虑因素(例如载剂或载体的性质、目标病原真菌的密度、应用的方法和地点)的影响,并且可以通过常规测试容易地确定。对于包含木霉属物种的微菌核和农学上可接受的载体的组合物且其中所述微菌核在再水合后发芽出菌丝或者孢子以产生分生孢子来说,出于配制和应用的目的,“有效量”被定义为足以随后在目标栖息地中产生足够的分生孢子以相对于未处理的对照感染和杀死目标病原真菌的任何数量的微菌核。作为实例而不限于此,可以设想,合适的制品通常将含有从液体培养物回收的每克生物质中约1×105个或更高的微菌核(基于生物质的干重),优选地为每克生物质中至少1×106个微菌核。
在使用中,可以使用常规技术将本发明的微菌核施用于待保护的植物表面上或附近,例如施用于树皮上,或作为种子包衣。在一个优选的实施方式中,将微菌核以颗粒形式施用于土壤或无土壤灌封混合物,例如在温室中使用。根据目标真菌类害虫,微菌核可以被施用在农田、果园、温室、花园或草坪中,或者施用于观赏植物、树木或商业或住宅结构体上或其附近,作为对抗植物病原真菌的拮抗剂。
在本发明的另一个实施方式中,微菌核可以被施用于植物的表面上或附近,以促进植物生长和健康。
与未处理的对照相比,选择微菌核的绝对量及其在最终组合物中的浓度以提供病原真菌的有效减少或增加植物健康。实际用量不是关键的,并且受实际考虑因素(例如载剂或载体的性质、目标病原真菌的密度、应用的方法和地点)的影响,并且可以通过常规测试容易地确定。出于配制和应用的目的,“有效量”被定义为足以随后在目标栖息地中产生足够的菌丝生长或分生孢子以相对于未处理的对照抑制目标病原真菌的生长和感染的任何数量的微菌核。作为实例而不限于此,可以设想,合适的制品通常将含有从液体培养物回收的每克生物质中约1×105个或更高的微菌核(基于生物质的干重),优选地为每克生物质中至少1×106个微菌核。
本文中所描述的木霉属物种的微菌核产生有效防控植物病原体的菌丝和气生分生孢子。不限于此,可通过本发明的微菌核防控的植物病原体包括但不限于如下的各种物种:rhizoctonia、sclerotinia、sclerotiorum、fusarium、verticillium、phytophthora、castenea、armillaria、pythium和thielviopsis。
统计分析
用完全随机化的设计进行每个实验并重复至少三次。使用r(rcoreteam,2012.r:alanguageandenvironmentforstatisticalcomputing.rfoundationforstatisticalcomputing,vienna,austria)和lme4工具包(batesdm,maechlerm,bolkerb,2012.lme4:linearmixed-effectsmodelsusings4classes.rpackageversion0.999999-0。可从http://cran.stat.sfu.ca/web/packages/lme4/lme4.pdf获得)来进行对重复测量数据进行线性混合效应分析,以解决培养基和时间对生物质积累、浸没式分生孢子浓度、微菌核浓度、从干燥的微菌核生产分生孢子和分生孢子活力的影响。对于液体发酵研究,将处理(即培养基)、时间(即发酵日或储存期)及其相互作用项作为固定影响因素输入到模型中。作为随机影响因素,随着时间和实验重复对摇瓶(即受试物或重复物)进行重复观察,以解释说明在不同日期进行的实验中的任何变化。采用似然比卡方检验,通过比较嵌套模型估计其p值来解决固定影响因素及其在线性混合模型中的相互作用的意义(pinheirojc,batesdm,2000.mixed-effectsmodelsinsandsplus.newyork:springer.rcoreteam,2012.r:alanguageandenvironmentforstatisticalcomputing.rfoundationforstatisticalcomputing,vienna,austria)。必要时,通过log10(x+1)转化浸没式分生孢子和微菌核生产数据,以满足分析前的数据正态性和均一性假设。使用在multcomp包中的函数ghlt进行事后成对比较,以比较各处理,通过单步法校正用于多重比较的p值。通过配对t-student检验比较在空气干燥前后记录的浸没式分生孢子活力(%发芽率),以解释说明耐干燥性对在每个处理内浸没式分生孢子存活的影响。对于通过随着时间的分生孢子产量测量的微菌核储存稳定性的纵向数据集,处理(=培养基)和时间(月)被拟合为固定效应因素,而样品包(即受试物)被认为是线性混合模型的随机影响因素。然后使用对比矩阵比较储存稳定性曲线的斜率,以评估处理之间的差异。通过使用函数nls的指数衰减模型拟合浸没式分生孢子储存稳定性数据,并通过平方和减数测试进行非线性模型之间的比较(ratkowskyd,1990.handbookofnonlinearregressionmodels.newyorkandbasel:marceldekker)。
通过存活分析(kaplanel,meierp,1958.nonparametricestimationfromincompleteobservations.journaloftheamericanstatisticalassociation53(282):457-481),来评估土壤处理对由r.solani引起的出芽后幼苗腐烂杀死的瓜苗的比例的影响。考虑检查存活超过15天的幼苗。通过对数秩检验(存活包),采用由bonferroni调整的p值,评估对于处理的存活曲线之间的统计学显著差异。通过广义线性混合模型(glmer)分析在第15天记录的总的幼苗出芽比例和健康幼苗的比例数据,以处理作为固定影响因素,而批次(punnets,重复物)和生物测定(重复实验)被评为随机影响因素。
木霉分离株
在整个本研究中使用哈茨木霉rifai菌株t-22(atcc20847;
测试的其它木霉属物种是从美国农业部农业研究服务局(usda,agriculturalresearchservice),culturecollectioninpeoria,illinois获得的。即哈茨木霉(nrrl13879)、哈茨木霉(nrrl13019)、哈茨木霉(nrrla-24290)、木素木霉(nrrl1762)、绿色木霉(nrrla-23264)、里氏木霉(nrrl6156)、康氏木霉(nrrla-18871)、拟康氏木霉(nrrl22083)和多孢木霉(nrrl28981)。木霉属的每个菌株的库存培养物作为单孢子分离株在马铃薯葡萄糖琼脂(pda)上在室温下生长三周。将孢子化的板切成1mm2琼脂塞,并且将这些琼脂塞的库存培养物储存在-80℃下在10%甘油中。通过使用从冷冻库存培养物获得的分生孢子悬浮液接种pda平板并将这些培养物在室温(~22℃)下培养2-3周,来产生用于液体培养实验的分生孢子接种物。所有液体培养物以5×106个分生孢子ml-1培养物肉汤的初始浓度接种。
对于液体培养物研究,通过使用从冷冻库存培养物获得的分生孢子悬浮液接种在pda平板并将这些培养物在25±1℃下培养2-3周,来获得分生孢子接种物。通过用10ml含有0.04%聚氧乙烯脱水山梨糖醇单油酸酯(吐温80,
使用由葡萄糖
使用250ml带挡板的锥形瓶(bellcoglass,vineland,nj,usa)使所有培养物在100ml液体培养物中生长3天,在28℃和300rpm下在具有1.9cm水平行程的旋转振荡器培养箱(innova4000,newbrunswickscientific,edison,nj,usa)中孵育。在发酵期间,经常手动摇动烧瓶,以防止瓶壁上的菌丝生长。对于c:n比和碳浓度研究,用分生孢子悬浮液接种培养基,该分生孢子悬浮液是从被调整以在培养基中提供5×105分生孢子ml-1的最终浓度的2-3周龄的哈茨木霉孢子化琼脂板获得的。接种2、4、7天后,取3ml样品测定生物质、浸没式分生孢子和微菌核浓度。对于每个实验,在每个采样日期从每个烧瓶取出重复的样品,并在研究中对每个处理使用两个重复烧瓶。重复实验四次。
不同氮源
基于生物质和繁殖体形成,来评价用于在生长哈茨木霉培养物中使用的不同氮源。将氮源添加到具有葡萄糖的基础盐培养基中,以产生具有50:1c:n比且碳浓度为36gl-1的培养基,其对应于来自之前实验的培养基6(参见表1)。此外,测试含有具有约40%碳的粉末状糖蜜(biosevltd.,
为了完成氮源研究,用在培养物6中生长的哈茨木霉的3天龄预培养物接种含有棉籽粉作为氮源(30:1和10:1c:n比例,碳浓度为36gl-1)的基础盐培养基(表1)。使用前述方法用分生孢子孵育预培养物。重复实验三次。
表1–用于评估哈茨木霉t-22的生长、繁殖体形成和产量的基于碳浓度(gl-1)和碳-氮(c:n)比的培养基组成
生长和繁殖体形成
在生长期间,在不同时间取出3ml样品以测量生物量积累以及分生孢子和微菌核浓度。所有取样均采用宽孔1ml塑料移液器吸头(用剃刀刀片移除尖端,以产生更宽的开口)。对于生物质积累测量,从烧瓶中取出1ml全培养肉汤,并通过真空过滤将生物质从废培养基中分离到预称重的过滤盘上(2.4cm玻璃纤维g6,fisherscientific,pittsburgh,pa,usa)。通过在测量之前将生物质和过滤盘在60℃下干燥至重量恒定,来测定干重积累。使用血细胞计数器来显微测定浸没式分生孢子浓度。对于微菌核浓度测量,将100μl培养肉汤放置在载玻片上,并用大的24×50mm盖玻片(fisherscientific,usa)覆盖。显微计数盖玻片上的所有微菌核。只有直径大于50μm的离散的紧密的菌丝聚集体才算作微菌核。稀释培养肉汤,以适合便于计数微菌核。在培养肉汤取样和稀释期间,不断涡旋微菌核悬浮液,以确保均匀性。由于其大尺寸,血细胞计数器不能用于计数微菌核。所有显微镜分析使用具有nomarski光学的olympusbh-2显微镜进行。
表2–包含不同氮源、液体培养基6(36g碳l-1;50:1c:n比)的培养基评价
实施例1:哈茨木霉的配制、耐干燥性和储存稳定性
在培养基评价研究中,如上所述的哈茨木霉菌株t-22的培养物在第2天和第4天取样并在第7天收获。在第7天收获时,向每个烧瓶的真菌生物质添加硅藻土,每个烧瓶的真菌生物质以5gde100ml-1培养物肉汤的浓度包含微菌核和/或浸没式分生孢子。使用whatman1号滤纸将培养物生物质-de混合物在布氏漏斗中进行真空过滤。在搅拌器(mini
为了比较室温和冷藏温度下木霉微菌核的储存稳定性,将一百毫升的哈茨木霉t-22培养物在以棉籽粉作为氮源的10:1和30:1c:n比的培养基中生长,在第4天收获,用5%de(w/v)配制,并空气干燥至小于4%的水分。将空气干燥的微菌核制品真空包装在15×22cm镀铝的mylar袋(pakvf4,impakcorporation,losangeles,ca,usa)中,并保持在环境温度(25℃)或冷藏(4℃)条件下。
为了测试微菌核活力和浸没式分生孢子产生,采用来自jacksonma,jaronskist,2009.productionofmicrosclerotiaofthefungalentomopathogenmetarhiziumanisopliaeandtheirpotentialforuseasabiocontrolagentforsoil-inhabitinginsects.mycologicalresearch113:842–850的方法。简言之,在水琼脂(2%w/v)板上接种25mg的哈茨木霉的经干燥的微菌核-de制品,并在25℃下孵育。在再水合时,微菌核菌丝体萌芽地(芽管形成)和孢子分生地(分生孢子的产生)发芽。对每个处理重复物使用两个水琼脂板(子样品)。在25℃下孵育24小时后,用立体显微镜(olympus,型号szh10)检查每个板中100个微菌核-de颗粒,检查菌丝发芽,作为活力的量度。为了列举分生孢子产生,将水琼脂板保持在25℃下共7天。然后将每个板充满7ml的0.04%吐温80溶液,并且使用无菌环将分生孢子从微菌核-de颗粒中移出。分生孢子移出后,从每个板移取可用液体,并且测定液体体积。使用血细胞计数器显微测量移取的液体中的分生孢子浓度,并计算每个板的分生孢子总数。为了确定每克空气干燥的微菌核-de制品产生的哈茨木霉的分生孢子数,将每个板收获的分生孢子数除以加入到每个水琼脂板的干燥的微菌核-de制品的重量(0.025g)。
对于浸没式分生孢子活力测定,将0.01g每个干燥的浸没式分生孢子-de制品稀释在10ml的0.04%吐温80
在摇瓶培养条件下,在具有不同c:n比的液体培养基中,在7天发酵期间观察并监测了哈茨木霉t-22的浸没式分生孢子和微菌核的形成。无论所测试的c:n比,哈茨木霉的微菌核专有地在高碳培养基(36gl-1)中形成和发育。具有10:1c:n比的最富饶的培养基(#4)缺乏浸没式分生孢子的产生,但促进了微菌核的发育。哈茨木霉的全面形成的微菌核直径为90-600μm。根据考虑随着时间的推移的重复措施的线性混合效应模型,两种培养基(χ2(15)=264.84,p<0.0001)和发酵时间(χ2(12)=32.09,p=0.0013)影响哈茨木霉的微菌核产生。发酵时间和培养基之间的相互作用对微菌核产生的变化贡献很大(χ2(12)=20.78,p=0.023)(表3)。通常,在所有培养基(2.6–4.8×104ml-1)中,在第4天产生更多的微菌核,在第7天观察到较少的微菌核,可能是由于微菌核聚集。在48小时生长后,哈茨木霉的微菌核开始形成,微菌核在第4天变得更加明确和致密,并且在第7天变黑。虽然微菌核更紧致和黑色化,但是这些结构呈现出从其表面发出的短的菌丝延伸。第4天在培养基4和5中观察到微菌核聚集,而第2天在培养基6中存在较高数量的未成熟的微菌核。
除了仅产生微菌核的培养基4之外,所有测试的培养基支持浸没式分生孢子。这些浸没式分生孢子是通过在生长的早期阶段(第2天)附着于浸没式菌丝的分生孢子细胞(例如,花椒苷)产生来形成的,特别是当真菌在弱培养基(8g碳l-1)中生长时。在生长4天后,在具有高碳水平和较低氮浓度(50:1,30:1c:n比;表3)的那些培养物中以高浓度产生浸没式分生孢子。浸没式分生孢子的生产速率受培养基×发酵时间相互作用的影响(χ2(15)=904.97,p<0.0001)。在所有培养基中注意到浸没式分生孢子产量整体随着时间的推移显著增加(χ2(12)=980.8,p<0.0001),第7天达到较高的浸没式分生孢子数量。含有较低碳的浓度的培养基1、2和3在第4天(1.6-3.2×108分生孢子ml-1)达到最大浸没式分生孢子产量,而富碳培养基5和6在第7天达到最大产量(3.9-9.7×108分生孢子ml-1)。在富碳的培养基中观察到的较高的浸没式分生孢子浓度被预期为这些培养基中营养物质的较高可用性促进了更好的营养生长和随后的分化(χ2(15)=1028.2,p<0.0001)。在碳限制培养基(培养基1、2和3)中生长的哈茨木霉培养物在2天内产生大量的浸没式分生孢子(6.5-7.7×107分生孢子ml-1),而培养基6(c:n比50:1和36g碳l-1)产生明显更多的浸没式分生孢子(第7天为9.7×108分生孢子ml-1)。
表3–通过在旋转振荡器培养箱中在28℃和300rpm下在具有不同c:n比和不同碳浓度的培养基中生长的哈茨木霉t-22的培养物评价浸没式分生孢子、微菌核(ms)和生物质产量
生物质积累(mgml-1)遵循预测的模式,其中当与在具有36gl-1碳的培养基中生物的培养物相比时,碳限制培养基(8gl-1)中的真菌生长导致较少的生物质,无论何种c:n比(表3)。培养基与发酵时间的相互作用显著差异(χ2(10)=122.95,p<0.0001)。含有较高碳浓度的培养基4、5和6随时间推移增加生物质积累(χ2(12)=185.4,p<0.0001)。正如预期的那样,培养基4在所有评估日产生最多的生物质,具有最高的碳和氮浓度(c:n=10:1和36gl-1碳)(χ2(15)=247.14,p<0.0001)。真菌生物质与培养基1(碳和氮含量最低)的发酵天数呈线性关系降低。显微镜检查表明:菌丝生长随着时间的推移在富碳的培养基中增加,随后快速形成微菌核。
哈茨木霉t-22繁殖体的耐干燥性和储存稳定性
如上所述制备哈茨木霉t-22。经过7天生长后,将所有来自c:n比研究的哈茨木霉培养物空气干燥至0.8-3.8%的水分,相应的水活度(aw)测量范围为0.35-0.41,并真空包装以在4℃下储存。在再水合并孵育24小时后,100%的干燥的微菌核颗粒通过发芽出菌丝方式发芽,并且开始在菌丝延伸部分上和微菌核颗粒表面上产生气生分生孢子,如浅绿色着色所示。这些微菌核颗粒继续发芽出菌丝,从而产生分生孢子,其中培养基影响空气干燥的微菌核颗粒的分生孢子产生(χ2(2)=31.08,p<0.0001)。与从30:1和50:1c:n比的培养基收获的微菌核颗粒相比,从10:1c:n比的培养基获得的微菌核颗粒分别产生更多35%和52%的分生孢子(图1)。对于4℃下贮存的干燥微菌核颗粒来说,分生孢子的生产受到培养基(χ2(4)=98.4,p<0.0001)和储存期(χ2(3)=47.2,p<0.0001)二者的显著影响。由于这两个因素的相互作用也是显著的(χ2(2)=13.23,p=0.0013),储存稳定性曲线的斜率在统计学上是不同的,这表明在测试的培养基上,分生孢子产量与储存时间有很大差异。由于再水合的微菌核颗粒仅在培养基4(10:1c:n比)和培养基6(50:1c:n比)之间不同(p=0.0007),而培养基5(30:1c:n比)和其它培养基中发现的暂时分生孢子产生没有差异(p>0.05),测定12个月储存稳定性模式(图1)。通过从具有10:1c:n比和36克碳l-1的培养基(培养基4)收获的微菌核颗粒的分生孢子在超过储存12个月时保持高产量(1.13-2.03×1010分生孢子g-1),分生孢子产生在储存6个月后显著增加。来自30:1c:n比培养基的微菌核颗粒展现出第二高的分生孢子产量,而在培养基6(50:1c:n比)中产生的微菌核颗粒获得最低产量。无论来自不同培养基的微菌核颗粒的分生孢子产量的差异如何,每次处理的分生孢子产量不会随时间降低,这表明这些微菌核在冷藏下保持稳定性长达12个月。
在干燥之前和之后并然后在4℃下储存1、2和12个月后,评估在不同培养基中产生并在7天生长后收获的浸没式分生孢子的活力和稳定性。当与新鲜浸没式分生孢子相比,只有在培养基2(8g碳l-1,30:1c:n比)中产生的浸没式分生孢子在干燥后没有经受发芽的显著降低(配对t(5)=1.23,p=0.273),而从测试的其它培养基中获得的浸没式分生孢子展现出显著更低的耐干燥性(配对t检验:p<0.01)(图2)。来自培养基1(营养物有限)的新鲜浸没式分生孢子对新鲜的浸没式分生孢子具有最高的发芽率(84.3%活力),但是最差的耐干燥性(2.1%活力)(图2)。使用非线性指数衰减模型,以r2=0.75-0.81的置信度,来解释每次处理中储存时间和浸没式分生孢子活力之间的关系。根据随时间记录的我们的实验活力数据拟合的模型,分别从培养基2、3、5和6收获时,储存的浸没式分生孢子的半衰期估计为1.93、1.05、1.26和1.81个月。培养基2(低碳和30:1c:n比)和6(高碳,低氮50:1c:n比)在第2个月显示出最高的发芽速率,尽管在储存12个月后来自最可行(41%存活)的培养基3(低碳和50:1c:n比)的浸没式分生孢子的活力显著降低。存活曲线的比较显示,与其它培养基中产生的浸没式分生孢子相比,从培养基3中收获的浸没式分生孢子存活时间较长(p<0.01)。
实施例2:搅拌速度和氮源对哈茨木霉t-22液体发酵的影响
在有利于微菌核形成的营养物浓度下,用不同氮源的发酵研究表明,在测试的所有氮源中,微菌核形成以不同的程度发生(表4)。用糖蜜取代作为碳源的葡萄糖可以抑制微菌核的形成。除了仅产生浸没式分生孢子的糖蜜处理外,在50:1(c:n比)下测试的具有36克碳l-1的所有碳源和氮源导致了浸没式分生孢子和微核菌二者的产生。将搅拌速度从300rpm提高到350rpm不影响浸没式分生孢子的产生(χ2(1)=3.11,p=0.08)、微生物产量(χ2(1)=1.06,p=0.302)或生物量积累(χ2(1)=2.16,p=0.142)。因此,在300和350rpm下生长期间获得的实验数据被分组在一起用于分析。基于微菌核产量,与测试的其它氮化合物相比,以36g碳l-1和50:1c:n比率与葡萄糖组合的棉籽粉在第2至4天产生显著更高的微菌核数量(χ2(10)=137.56,p<0.0001,表4)。总体而言,无论使用何种氮源,微菌核形成随着发酵时间而增加(χ2(6)=34.14,p<0.0001)。培养基的相互作用×发酵天数对微菌核产生有显著影响(χ2(5)=13.17,p=0.022),表明了微菌核的生长速度根据培养基改变。
表4–通过在具有不同氮源、c:n比为50:1和碳浓度为36gl-1的液体培养基中生长的哈茨木霉t-22的培养物评价浸没式分生孢子、微菌核(ms)和生物质产量。培养物在旋转振荡器培养箱中在28℃和300rpm或350rpm下孵育。
培养基组合物对于哈茨木霉微菌核的形成和黑化具有显著的影响,特别是当使用不同的氮源时。例如,用棉籽粉
对于浸没式分生孢子,产量受培养基组成和发酵时间之间的相互作用显著影响(χ2(5)=406.3,p<0.0001)。除糖蜜+酸水解酪蛋白培养基以外,在所有测试培养基(χ2(6)=453.21,p<0.0001)中,浸没式分生孢子产量随时间增加。在葡萄糖+棉籽粉的培养基中生长的培养物在4天的发酵中产生最高的浸没式分生孢子产量(χ2(10)=472.6,p<0.0001)。培养基组成和发酵时间独立地起作用,且对生物质积累没有影响(χ2(5)=7.92,p=0.161)。比用葡萄糖+酵母提取物、葡萄糖+酸水解酪蛋白或者葡萄糖+玉米浆修饰的培养基中生长的培养物相比,在含有糖蜜+酸性水解酪蛋白的培养基中生长的培养物产生更多的真菌生物质(χ2(10)=98.24,p<0.0001)(表4)。
使用棉籽粉作为氮源和预培养物接种物,微菌核生产受到c:n比(χ2(2)=6.5,p=0.039)和发酵时间(χ2(2)=16.51,p=0.0003)显著影响,而不受它们的相互作用(χ2(1)=2.05,p=0.152)影响,表明了生长速率相似。与30:1c:n比的培养基相比,在10:1c:n比的培养基中生长的培养物中,在第2天产生更多的微菌核,而在第3天时,两种培养基的微菌核浓度均较低,无统计学差异(表5)。哈茨木霉的生长速度更快,从而在更多的氮和10:1c:n比的培养基中产生更多的生物质。c:n比(χ2(2)=66.25,p<0.0001)和发酵时间(χ2(2)=26.34,p<0.0001)二者及其相互作用(χ2(2)=10.8,p=0.001)对生物质积累产生显著影响,这表明培养基之间的生物质发育呈现不同的速率。与这些数据一致,并在再水合并在水琼脂上孵育时,与在30:1c:n比的培养基中生长的培养物的微菌核颗粒相比,在10:1c:n比培养基中生长的培养物中的干燥的微菌核颗粒产生更多25%的分生孢子(χ2(1)=17.95,p<0.0001)。尽管如此,两种培养基的微菌核均具有耐干燥性,在孵育24小时后显示出100%菌丝发芽。储存稳定性研究表明,储存月数(χ2(16)=46.63,p<0.0001)、温度变化(χ2(10)=32.93,p=0.0003)和氮含量(10:1c:n比)(χ2(10)=47.14,p<0.0001)较高的培养基中,由微菌核颗粒产生分生孢子的产量一般较高(图3)。随着时间的推移,对于从10:1c:n比获得的微菌核颗粒来说,在25℃下储存时分生孢子产量随着时间的推移普遍下降,而对于从30:1c:n比培养基获得的微菌核颗粒来说,在该相同温度下储存时,分生孢子产量增加(χ2(8)=25.16,p=0.0015)。
表5–通过在碳浓度为36gl-1且棉籽粉作为氮源的液体培养基中生长的哈茨木霉t-22的培养物评价c:n对微菌核(ms)和生物质产量的影响。
a在25℃下孵育7天后,通过再水合的ms颗粒在水琼脂上产生分生孢子。
在一列中后面没有用相同字母标记的平均值是显著不同的(p≤0.05)。
实施例3:多种木霉属物种的微菌核的液体培养物产生
在如实施例1中所述的摇瓶条件下,在微菌核和生物质的液体培养物产生中测试多种木霉属物种。使用棉籽粉而不是酸水解酪蛋白作为氮源,这些木霉培养物在液体培养基6(表1)中生长。如表6中所示,在所陈述的条件下,多种木霉属物种能够形成微菌核。在生长7天后,通过加入5%w/v的硅藻土(de)从培养物肉汤中收获微菌核,并在真空下过滤以除去废培养基。将de-微菌核滤饼在搅拌器中粉碎并空气干燥过夜至小于5%的水分。
表6-使用补充有葡萄糖和棉籽粉的基础盐培养基,通过各种物种的木霉的液体培养生产微菌核。培养物在旋转振荡器培养箱中在350rpm和28℃下生长7天
*nrrl保藏中心-usda,agriculturalresearchservice,nationalcenterforagriculturalutilizationresearch,peoria,il,61604.atcc–美国模式培养物保藏所(americantypeculturecollection),manassas,va,20110
实施例4:通过干燥微菌核颗粒的分生孢子产生
为了确定各种木霉属物种的空气干燥的微菌核颗粒的分生孢子产生,采用来自jacksonma,jaronskist,2009.productionofmicrosclerotiaofthefungalentomopathogenmetarhiziumanisopliaeandtheirpotentialforuseasabiocontrolagentforsoil-inhabitinginsects.mycologicalresearch113:842–850的方法。简言之,在水琼脂(2%w/v)板上接种25mg木霉的干燥微菌核-de制品,并在25℃下孵育。在再水合时,微菌核菌丝体萌芽地(芽管形成)和孢子发生地(分生孢子的产生)发芽。每个处理重复物使用两个水琼脂板(子样品)。在25℃下孵育24小时后,用立体显微镜(olympus,型号szh10)检查每个板中100个微菌核-de颗粒,检查菌丝发芽,作为活力的量度。为了列举分生孢子产生,将水琼脂板保持在25℃下共7天。然后将每个板充满7ml的0.04%吐温80溶液,并且使用无菌环将分生孢子从微菌核-de颗粒中移出。分生孢子移出后,从每个板移取可用液体,并且测定液体体积。使用血细胞计数器显微测量移取的液体中的分生孢子浓度,并计算每个板的分生孢子总数。为了确定每克空气干燥的微菌核-de制品产生的木霉的分生孢子数,将每个板收获的分生孢子数除以加入到每个水琼脂板的干燥的微菌核-de制品的重量(0.025g)。
表7.通过空气干燥后用5%硅藻土配制的各种木霉属物种的干燥微菌核(ms)颗粒的分生孢子生产。在使ms颗粒在25℃下在水琼脂上孵育7天后评估分生孢子产生。
*nrrl保藏中心-usda,agriculturalresearchservice,nationalcenterforagriculturalutilizationresearch,peoria,il,61604.
atcc–美国模式培养物保藏所(americantypeculturecollection),manassas,va,20110
实施例5:微菌核对出芽后幼苗腐烂病害的生物测定
使用甜瓜(cv.‘halesbest’)进行生物测定,来评估在液体培养物(36gc;30:1c:n比;在第4天收获并用5%硅藻土
与阴性对照或仅用哈茨木霉处理的种子相比(χ2(5)=44.37,p<0.0001),用立枯丝核菌处理灌封混合物降低出芽的瓜种子的百分数,并且也导致延迟出苗。与其它处理相比,立枯丝核菌的接种率较高,使种子发芽受到较大程度的损害。相比之下,在用于最高水平的立枯丝核菌接种物的拮抗剂存在下,瓜幼苗出苗百分数显著增加并且对于较低水平的立枯丝核菌接种物来说在算术上增加(尽管不显著)(表8)。基于当种子在单独用相同比率的病原体接种物感染的灌封混合物中生长时获得的病害水平,计算组合的立枯丝核菌和哈茨木霉的处理的病害减少。因此,哈茨木霉微菌核的存在明显增加了第15天健康幼苗的比例(χ2(5)=54.09,p<0.0001)。在仅用立枯丝核菌的两次处理中(对数秩检验:χ2(5)=194.7,p<0.0001)(图4),随着时间的推移出芽后幼苗腐烂的进展更明显。相比之下,与仅接触高水平和低水平的立枯丝核菌的土壤相比,拮抗剂使出芽后幼苗腐烂的水平分别降低了90%和100%。有趣的是,与没有拮抗剂的相应处理相比,将哈茨木霉微菌核颗粒添加到两种接种物水平中某一水平的立枯丝核菌,显著增加了瓜幼苗从出芽后幼苗腐烂中存活的可能性。具有出芽后幼苗腐烂症状的幼苗被证实被立枯丝核菌感染,如通过来自表面消毒的根和放置于mrb琼脂上的下胚轴组织的真菌生长的特征形态所揭示的(图5)。相反,用哈茨木霉处理来自灌封混合物的土壤样品和表面消毒的根茎和茎碎片,表现出当放置于mrb上时铺生的哈茨木霉的生长,表明这种生物防控真菌在接种的灌封混合物中保持较高的群体数,并且与植物根组织密切相关(图5)。
表8–为防控在播种后15天非无菌灌封培养基中以两个比率(0.563和1.5g/1000cm3)接种的对照立枯丝核菌,在用哈茨木霉t-22(0.4g配制的颗粒/1000cm3)处理后在生长室生物测定中出芽的甜瓜种子的百分数和发育成健康幼苗的百分数
a在三次独立实验中平均的在每个重复中播种18个种子中的幼苗出苗百分数。c在三次独立实验中平均的健康发育幼苗的18个种子的百分比。
列中后面没有用相同字母标记的平均值是显著不同的(p≤0.05)。
实施例5:经由生物反应器的哈茨木霉t-22微菌核和浸没式分生孢子的竞争生产(duelproduction)
使用如上所公开的哈茨木霉t-22,在5lb.braun发酵罐中以4l的体积,评估微菌核、分生孢子和生物质生产。使用补充有葡萄糖和棉籽粉以产生30:1c:n比且含有36g碳l-1的基础盐培养基。在28℃下使哈茨木霉t-22的培养物生长4天。将反应器设置为900rpm的叶轮速度,以允许每分钟1.5l空气,使得空气流维持接近或高于零的溶解氧水平,并提供至少0.1v的空气/v培养基。令人惊讶的是,在培养物生长4天后,生物反应器曝气允许提高微菌核的产量和提高浸没式分生孢子的产量,如表9所示。另外,如表10所示,当再水合并在水琼脂上孵育时,来自5l生物反应器的干燥的微菌核-硅藻土制品产生5.3×107个分生孢子/克。此外,在空气干燥至小于5%的水分后,在该液体发酵中形成的浸没式分生孢子的97%是有活力的。
表9
表10
就在说明书或权利要求书中使用术语“含有”或“包括”而言,其旨在以类似于术语“包含”在权利要求中用作过渡词时所理解的方式来具有包容性。此外,就采用术语“或”(例如,a或b)而言,其旨在表示“a或b或两者”。如果申请人旨在指示“仅a或b但不是两者”,则将采用术语“仅a或b但不是两者”。因此,本文中术语“或”的使用具有包容性,不具有排他性使用。参见bryana.garner,adictionaryofmodernlegalusage624(2d.ed.1995)。此外,就在说明书和权利要求书中使用术语“在…中”或“到…中”而言,其旨在额外地表示“在…上”或“到…上”。此外,就在说明书或权利要求书中使用术语“连接”而言,其旨在不仅表示“直接连接到”,而且也表示“间接连接到”,诸如通过另外的一个部件或多个部件进行连接。
虽然本申请已通过对实施方式的详细描述进行了说明,但这些细节并非意图限定所附权利要求书中所限定的本发明的保护范围。本申请中所引用的所有引证文献和出版专利申请通过引用并入本文中。要求保护的专有产权或特权的本发明的实施方式在权利要求书中限定。
- 还没有人留言评论。精彩留言会获得点赞!