一种修饰的聚乙烯亚胺化合物及其制备方法和应用与流程
本发明涉及基因递送系统领域,尤其涉及一种修饰的聚醚酰亚胺化合物及其制备方法和应用。
背景技术:
基因治疗主要是将外源性功能基因导入细胞中,以此来修饰或补充生物原有基因序列,改变其蛋白表达,实现疾病治疗目的。但是,外源性功能基因无法主动被靶细胞纳入,需要依靠基因递送系统完成细胞递送。因此制备出能够有效携带功能基因的载体系统,是基因治疗的关键环节。
目前,基因递送系统有两大类:病毒类和非病毒类递送系统。在病毒类递送系统中,常见的病毒转染体系主要包括逆转录酶病毒、腺病毒、慢病毒和单纯疱疹病毒等。虽然病毒递送系统转染率较高,但其制备难度较大、承载基因能力有限,并且存在与宿主基因组整合的潜在致病性危险,从而限制了其在在实验室及临床的应用,并难以大范围推广。非病毒基因递送系统中的阳离子聚合物,可通过静电吸附负电性的核酸大分子,如质粒DNA或者反义寡核苷酸,进而形成微粒、胶束或者脂质体实现基因的高效携带及细胞高效转染。聚乙烯亚胺(PEI)是现有技术常用的阳离子基因转染系统,其可以分为直链型和支链型,并且存在有不同的分子量产品。但由于PEI自身化学结构限制,具有强烈的正电性,在基因转染过程中易引发细胞毒性,造成细胞死亡。
技术实现要素:
有鉴于此,本发明的目的在于提供一种修饰的聚乙烯亚胺化合物,作为基因递送系统的载体,以提高基因递送系统的转染率,并降低基因递送系统的细胞毒性。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种修饰的聚乙烯亚胺化合物,由七氟丁酸酐对聚乙烯亚胺中的伯胺氢取代得到,所述聚乙烯亚胺的重均分子量为1.8K,所述聚乙烯亚胺中伯胺氢的摩尔取代比例为5~66.67%。
优选的,所述聚乙烯亚胺中伯胺氢的摩尔取代比例为15~55%。
本发明还提供了上述修饰的聚乙烯亚胺化合物的制备方法,包括以下步骤:
将七氟丁酸酐与聚乙烯亚胺溶于纯甲醇,得到混合溶液;
将所述混合溶液与催化剂混合后进行取代反应,得到修饰的聚乙烯亚胺化合物,所述催化剂为三乙胺。
优选的,所述七氟丁酸酐与聚乙烯亚胺中伯胺基的摩尔比为0.05~0.5:1。
优选的,所述反应的温度为22~27℃,所述反应的时间为40~60h。
优选的,所述的催化剂的添加量为七氟丁酸酐与聚乙烯亚胺总重量的0.01~10%.
优选的,所述取代反应后还包括:将所述取代反应的产物依次进行透析、过滤和冷冻干燥;所述的透析的截留分子量为15~2500,所述透析的时间为3~6天。
优选的,所述过滤采用滤膜进行,所述滤膜孔径为0.4~0.5μm。
本发明还提供了含有上述修饰的聚乙烯亚胺的基因递送系统。
本发明还提供了所述的基因递送系统在制备基因治疗药物中的应用。
本发明的有益效果:
本发明提供的修饰的聚乙烯亚胺化合物,由七氟丁酸酐对聚乙烯亚胺中的伯胺氢取代得到,由于七氟丁酸的修饰使得聚乙烯亚胺的性能得到改善,正电荷性减弱,细胞毒性低;并且本发明提供的修饰的聚乙烯亚胺化合物基因转染率较高于现有产品支化聚乙烯亚胺(重均分子量25000g/mol,PEI25K)、脂质体2000(Lipofectamine 2000),脂质体3000(Lipofectamine 3000)。
附图说明
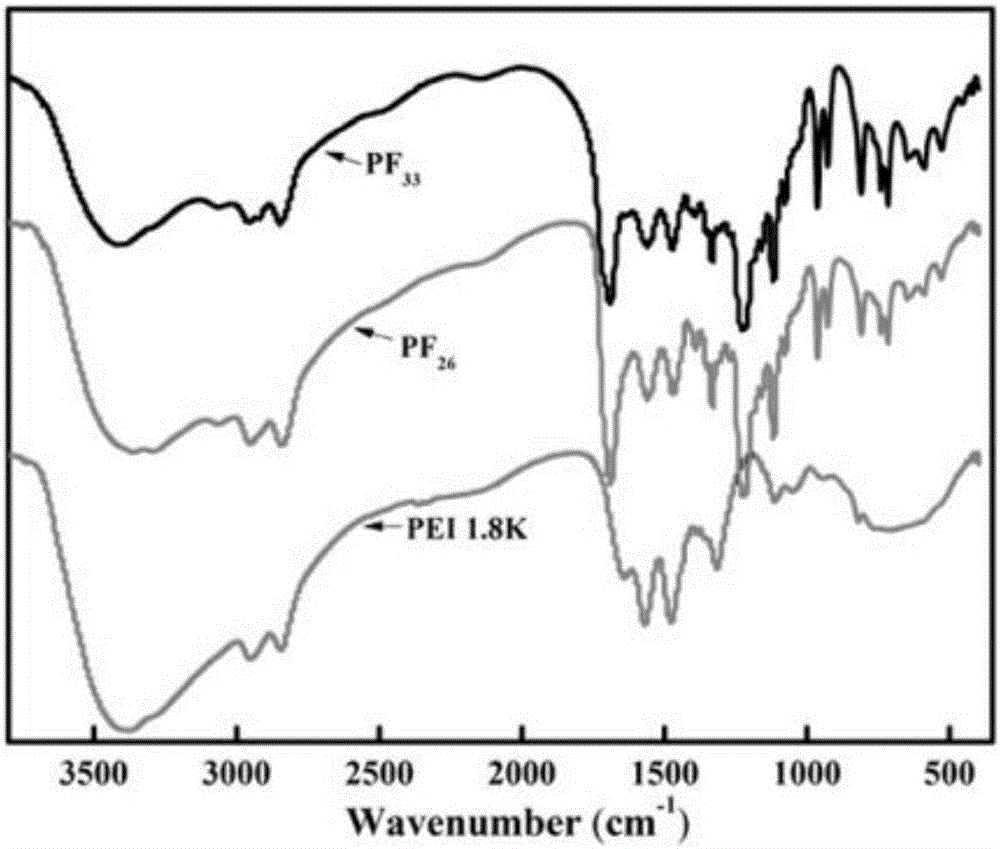
图1为聚乙烯亚胺中伯胺氢的摩尔取代比例33.33%和26%的修饰的聚乙烯亚胺化合物的红外光谱图;
图2为聚乙烯亚胺中伯胺氢的摩尔取代比例33.33%的修饰的聚乙烯亚胺化合物的核磁共振F谱图;
图3为用激光散射粒度仪检测PF33与质粒复合后的水合粒径;
图4为PF33与质粒复合后产物的透射电镜图;
图5为PF33以不同比例负载质粒的凝胶阻滞实验结果;
图6为无血清转染条件下,PF33、PEI 1.8K、PEI 25K、Lipofectamine 2000和Lipofectamine 3000对人结肠癌细胞株HCT116细胞的转染效率;
图7为30%血清的转染条件下,PF33、PEI 1.8K、PEI 25K、Lipofectamine2000和Lipofectamine 3000对人结肠癌细胞株HCT116细胞的转染效率;
图8为为无血清转染条件下,PF33、PEI 1.8K、PEI 25K、Lipofectamine 2000和Lipofectamine 3000对人卵巢癌细胞株SKOV3细胞的转染效率;
图9为30%血清的转染条件下,PF33、PEI 1.8K、PEI 25K、Lipofectamine2000和Lipofectamine 3000对人结肠癌细胞株HCT116细胞的转染效率。
具体实施方式
本发明提供了一种修饰的聚乙烯亚胺化合物,由七氟丁酸酐对聚乙烯亚胺中的伯胺氢取代得到,所述聚乙烯亚胺的重均分子量为1.8K,所述聚乙烯亚胺中伯胺氢的摩尔取代比例为5~66.67%。
本发明中,所述的聚乙烯亚胺为枝状聚乙烯亚胺,本发明对所述的聚乙烯亚胺的来源没有特殊的限定,具体的在本发明实施例中所使用的聚乙烯亚胺为市售商品聚乙烯亚胺1.8K。本发明对所述的七氟丁酸酐的来源没有限定,具体的在本发明实施例中使用的为市售的分析纯。
在本发明中,所述的聚乙烯亚胺中伯胺氢的摩尔取代比例为5~66.67%,优选的为15~55%,更优选的为25~45%,最优选的为33.33%。
七氟丁酸酐中的七氟丁酸基与伯胺氢发生的取代反应,取代聚乙烯亚胺中伯胺基上的氢,从而对聚乙烯亚胺进行一定的修饰,改变聚乙烯亚胺的性质。本发明还提供了上述修饰的聚乙烯亚胺化合物的制备方法,包括以下步骤:
在催化剂存在条件下,将七氟丁酸酐、聚乙烯亚胺和甲醇混合,再将所述混合溶液与催化剂混合后进行取代反应,得到修饰的聚乙烯亚胺化合物;本发明对催化剂、七氟丁酸酐、聚乙烯亚胺和甲醇混合的顺序没有特殊的限定,可以同时混合,也可以依次两两混合,只要能够实现混合即可。
本发明优选将七氟丁酸酐与聚乙烯亚胺溶于纯甲醇,得到混合溶液;在本发明中,所述七氟丁酸酐与聚乙烯亚胺中伯胺基的摩尔比优选的为0.05~0.5:1,更优选的为0.1~0.4:1,最优选的为0.2~0.3:1。本发明将七氟丁酸和聚乙烯亚胺按照上述摩尔比例用于纯甲醇得到混合溶液,所述纯甲醇的体积优选为七氟丁酸酐体积的3~8倍,更优选的为4~6倍,最优选的为5倍。
本发明在得到混合溶液后,将混合溶液与催化剂混合进行取代反应,所述取代反应的反应示意图如式I所示,得到修饰的聚乙烯亚胺,所述的催化剂为三乙胺。在本发明中,所述的催化剂的添加量优选的为七氟丁酸酐和聚乙烯亚胺总重量的0.01~10%,更优选的为0.1~5%,最优选的为0.5%。在本发明中,所述取代反应的温度为优选的为22~27℃,更优选的为23~26℃,最优选的为25℃;所述取代反应的时间优选的为40~60h,更优选的为45~55h,最优选的为50h。
所述取代反应后,本发明优选将所述取代反应的产物依次进行透析、过滤和冷冻干燥,得到修饰的聚乙烯亚胺化合物。在本发明中,所述透析采用透析袋进行,所述透析袋的截留分子量优选的为15~2500,更优选的为1000~2000,最优选的为1800;所述透析的时间优选为3~6天,更优选的为4~5天。
在本发明中,所述过滤优选的采用滤膜进行,所述滤膜孔径优选的为0.4~0.5μm,更优选的为0.45μm。
本发明对所述的冷冻干燥的方法没有特殊的限定,采用本领域常规的冷冻干燥设备和技术方案实现即可,在本发明实施例中具体使用冷冻干燥机进行冷冻干燥;在本发明中,所述冷冻干燥的温度优选为-10℃~-50℃,更优选为-20~-40℃;所述冷冻干燥的真空度优选为1.3~13Pa,更优选为2.0~10Pa;所述冷冻干燥的时间优选为8~30h,更优选为12~24h。
本发明还提供了含有上述技术方案所述修饰的聚乙烯亚胺的基因递送系统,包括载体和基因药物,所述的基因药物包括质粒,所述基因药物和载体的质量比优选为1:1~100,更优选为1:2~80。
本发明提供的基因递送系统的制备方法将修饰的聚乙烯亚胺与基因药物混合均匀后,静置即可;所述的混合采用较为柔和的方式进行,所述静置的时间优选的为10~30min,更优选的为15~25min。
本发明还提供了所述的基因递送系统在制备基因治疗药物中的应用。所述的基因治疗药物由所述的基因递送系统和目的基因组成。本发明中所述的目的基因为相应病症患者体内存在缺陷的基因或增强患者免疫力的基因,例如HGF,P-53,Ad-3等。
下面结合实施例对本发明提供的修饰的聚乙烯亚胺及其制备方法和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
七氟丁酸酐与聚乙烯亚胺按照七氟丁酸酐与聚乙烯亚胺中伯胺基的摩尔比为0.1:1和0.2:1,将聚乙烯亚胺1.8K和七氟丁酸酐一起溶于纯甲醇中得到混合溶液,并向其中加入七氟丁酸和聚乙烯亚胺总重量的0.5%的三乙胺作为催化剂,然后将上反应体系置于25℃,搅拌48小时进行取代反应,反应结束后将反应体系转移入截留分子量为1800的透析袋中,并在双蒸水中进行5天透析,透析后的溶液采用0.45μm的滤膜进行过滤,采用冷冻干燥机对过滤后的溶液进行冷冻干燥,得到白色粉末状产物,其中原料比例为0.1:1得到的为摩尔取代比例为26%的修饰的聚乙烯亚胺,原料比例为0.2:1得到的为摩尔取代比例为33.33%的修饰的聚乙烯亚胺。聚乙烯亚胺中伯胺氢的摩尔取代比例33.33%和26%的修饰的聚乙烯亚胺化合物的红外光谱如图1所示,摩尔取代比例33.33%和26%的修饰的聚乙烯亚胺都在1735出现了酰胺键的峰,而对照聚乙烯亚胺1.8K则没有出现上述的酰胺键的峰;
图2是聚乙烯亚胺中伯胺氢的摩尔取代比例33.33%的修饰的聚乙烯亚胺化合物的核磁共振F谱图,如图2所示,修饰的聚乙烯亚胺在对应的标准峰附近出现了1’,2’和3’三个峰,结合图1和图2的结果,证明取代比例33.33%修饰的聚乙烯亚胺成功合成。
实施例2
对实施例1中聚乙烯亚胺中伯胺氢的摩尔取代比例为33.33%的修饰的聚乙烯亚胺(记为PF33)体外负载质粒的能力的检测。将绿色荧光蛋白(GFP)质粒溶液50μL(40μg/mL,DMEM无血清培养基)与PF33溶液50μL(400μg/mL,DMEM无血清培养基)混合,轻轻上下颠倒4次,静置25分钟,进行粒径、透射电镜和凝胶阻滞实验。
PF33与质粒复合后,使用激光散射粒度仪检测其水合粒径,如说明书附图3所示,PF33与质粒复合后的水合粒径为78±4纳米;使用透射电镜观察PF33与质粒复合后的形状,如图4所示,PF33与质粒复合后的形状为球形;凝胶阻滞实验结果如图5所示,第一泳道为DNAmarker,第二泳道单独质粒,第三至第八泳道分别为PF33与质粒的质量比为0.25:1,0.5:1,1:1,2:1,4:1,8:1,根据结果显示在PF33与质粒的质量比为1:1及以上时,相应的泳道中并没有条带显现,说明PF33可以完全压缩质粒DNA,使质粒DNA快速通过凝胶的孔隙。本实施例说明PF33可以很好的负载质粒DNA。
实施例3
PF33在结肠癌细胞株HCT116细胞中的转染。在六孔板中加入含有2×105个细胞的2mL DMEM培养基(含10%胎牛血清)培养过夜。第二天,进行换液,分别加入DMEM无血清培养基和DMEM有血清培养基(含30%胎牛血清)。每个孔分别加入100μL的PF33质粒复合物(含质粒2μg,PF33,20μg;此比例为PF33的最佳比例),PEI 1.8K质粒复合物(含质粒2μg,PEI 1.8K,20μg;此比例为PEI 1.8K的最佳比例),PEI 25K质粒复合物(含质粒2μg,PEI 25K,4μg;此比例为PEI 25K的最佳比例),Lipofectamine2000质粒复合物(含质粒2μg,Lipofectamine 2000原液5μL;此比例为Lipofectamine 2000的最佳比例),Lipofectamine 3000质粒复合物(含质粒2μg,Lipofectamine 3000原液7.5μL;此比例为Lipofectamine 3000的最佳比例),5小时后,进行换液,丢弃含有质粒和材料的原培养基,换新的DMEM培养基(含10%胎牛血清),24小时后,进行流式细胞术分析。
结果如图6和7所示,在无血清转染条件(图6)下,PF33的转染效率显著高于PEI 1.8K、PEI 25K、Lipofectamine 3000转染效率更高;在含有30%血清的转染条件下(图7),PF33的转染效率仍然显著高于PEI 1.8K、PEI 25K、Lipofectamine 3000组。由此可见本实施例中的PF33不论转染过程中有无血清,PF33的转染效率都显著高于市售其他材料的转染效率。
实施例4
PF33在人卵巢癌细胞株SKOV3细胞中的转染。在六孔板中加入含有2×105个细胞的2mL DMEM培养基(含10%胎牛血清)培养过夜。第二天,进行换液,分别加入DMEM无血清培养基和DMEM有血清培养基(含30%胎牛血清)。每个孔分别加入100μL的PF33质粒复合物(含质粒2μg,PF3320μg;此比例为PF33的最佳比例),PEI 1.8K质粒复合物(含质粒2μg,PEI 1.8K,20μg;此比例为PEI 1.8K的最佳比例),PEI 25K质粒复合物(含质粒2μg,PEI 25K,4μg;此比例为PEI 25K的最佳比例),Lipofectamine 2000质粒复合物(含质粒2μg,Lipofectamine 2000原液5μL;此比例为Lipofectamine 2000的最佳比例),Lipofectamine 3000质粒复合物(含质粒2μg,Lipofectamine 3000原液7.5μL;此比例为Lipofectamine 3000的最佳比例),5小时后,进行换液,丢弃含有质粒和材料的原培养基,换新的DMEM培养基(含10%胎牛血清),24小时后,进行流式细胞术分析。
结果如图8和9所示,在无血清转染条件(图8)下,PF33的转染效率略高于Lipofectamine 3000和Lipofectamine 2000,显著高于PEI 25K和PEI 1.8K;在含有30%血清的转染条件下(图9),PF33的转染效率显著高于Lipofectamine3000,Lipofectamine 2000,PEI 25K和PEI 1.8K。由此可见本实施例中的PF33不论转染过程中有无血清,PF33的转染效率都高于市售其他材料的转染效率。
由以上实施例可知,本发明所述的修饰的聚乙烯亚胺化合物细胞毒性低,基因转染率较高于现有产品支化聚乙烯亚胺(重均分子量25000g/mol,PEI25K)、脂质体2000(Lipofectamine 2000),脂质体3000(Lipofectamine 3000),本发明所述的修饰的聚乙烯亚胺化合物可作为优良的基因递送系统。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!