一种合成C2‑乙酰氧基‑3‑吲哚酮类化合物及方法与流程
本发明属有机合成化学技术领域,具体涉及一种合成C2-乙酰氧基-3-吲哚酮类化合物及其方法。
背景技术:
3-吲哚酮同系物或衍生物是重要的杂环化合物,3-吲哚酮结构存在于许多药物活性分子中,在材料化学、医药化学等领域应用广泛。
常规的非吲哚直接氧化合成3-吲哚酮类的方法主要可以分为两类:
一类为成环反应,一般以1-硝基-2-(苯基乙炔基)苯类似物的成环反应或N-(2-乙炔苯基)-4-甲基苯磺酰胺类似物的成环反应为主。此类反应的原料不易得,有些反应要用到贵金属,或者各种复杂配体。如:2011年,Gagosz课题组以1-叠氮基-2-(丁-1-炔-1-基)苯为反应原料,选用复杂结构的贵金属金催化剂,二氯乙烷做溶剂,成环生成有手性中心的3-吲哚酮类产物,产率可达到90%,虽然该反应得到的产率很高,需要昂贵的且含有复杂配体的金金属的作为催化剂。(A.Wetzel and F.Gagosz,Angewandte Chemie,International Edition,2011,50,7354-7358.)。随后,在2015年,浙江大学贾义霞教授课题组以1-硝基-2-(苯基乙炔基)苯为反应原料,贵金属三氯化金作为催化剂,手性含膦酸作为配体,一定量分子筛下,甲苯作溶剂,生成了手性3-吲哚酮,虽然有较好的收率和光学活性,反应使用了贵重的金属催化剂,及复杂的膦手性配体。这些都严重限制了其在药物,工业上的发展。(R.-R.Liu,S.-C.Ye,C.-J.Lu,G.-L.Zhuang,J.-R.Gao and Y.-X.Jia,Angewandte Chemie,International Edition,2015,54,11205-11208.)。该类成环反应虽能较高产率地合成3-吲哚酮,却不能用于对吲哚化合物的直接修饰,制约了此类反应的进一步应用与发展。
第二类为在原有简单3-吲哚酮基本结构上构筑新的复杂3-吲哚酮类产物。近年来,此类反应在药物中间体,全合成前体,以及聚合物合成中得到极大的发展。2008年,耶鲁大学Hamilton课题组以2,2-取代的二氢吲哚-3-酮为基本结构,反应生成了类似蛋白质结构的含3-吲哚酮的聚合物,证明了3-吲哚酮结构在聚合物中,有一定的运用前景。(P.N.W.a.A.D.Hamilton,Journal of the American Chemical Society,2009,131,4566–4567.)。在2015年,上海有机所Dai课题组以1-乙基-2-苄基二氢吲哚-3-酮为反应物,和烯丙基甲基碳酸酯,在贵金属钯做催化剂,复杂膦配体,二甲醚作溶剂,-40摄氏度下,得到了C2位具有手性中心的复杂3-吲哚酮结构。(T.-G.Chen,P.Fang,X.-L.Hou and L.-X.Dai,Synthesis,2015,47,134-140.)。虽然该类反应确实能较高产率的合成出带有手性且复杂多样的3-吲哚酮产物,但它们大都反应步奏繁琐,需要复杂配体,及贵金属。且所需底物本身含有3-吲哚酮基本结构,这些大大的限制了,此类方法的运用。因此,开发一种新型的、经济适用且简单高效地3-吲哚酮类化合物的合成方法具有十分重要的应用价值。
通过吲哚直接氧化方法对吲哚类化合物进行修饰直接合成3-吲哚酮类化合物现有已经公开的方法:
2014年,Xiao课题组报道了以吲哚衍生物3-苄基-2-苯基吲哚为底物,直接氧化生成2-苄基-2-苯基吲哚-3-酮的合成方法。反应条件中,使用了含有钌的光催化剂,氯仿作溶剂,整个反应体系在室温,经LED灯的光照下,得以顺利进行。产率在25%-76%。反应过程中,涉及到了,光催化及重排,这些对于产物的生成,起了极大的作用。(W.Ding,Q.-Q.Zhou,J.Xuan,T.-R.Li,L.-Q.Lu and W.-J.Xiao,Tetrahedron Letters,2014,55,4648-4652.)。2016年,Guchhait课题组同样报道了吲哚直接氧化构造3-吲哚酮的新方法,并得到了较高的产率。(S.K.Guchhait,V.Chaudhary,V.A.Rana,G.Priyadarshani,S.Kandekar and M.Kashyap,Organic Letters,2016,18,1534-1537.)。上所述的合成方法需要使用昂贵的贵金属作催化剂,或者复杂的配体,因此,发展一种更简单高效的反应体系,来丰富与发展构造3-吲哚酮类化合物反应有着积极的意义。
技术实现要素:
本发明的目的在于提供一种成本低、简单、绿色环保的合成C2-乙酰氧基-3-吲哚酮类化合物的方法。
为了实现上述目的,本发明的技术方案如下:一种合成C2-乙酰氧基-3-吲哚酮类化合物的的方法,式I所示的C2-乙酰氧基-3-吲哚酮类化合物
是通过式II所示的吲哚或取代吲哚。
与式III所示的2-氯嘧啶反应
生成的式IV所示的1-(嘧啶基-2-基)-1H-吲哚类化合物
在醋酸碘苯,乙酸/乙酸酐的参与下进行氧化成酮反应,其反应通式为:
其中,R基选自氢、烷基、烷氧基、苄氧基、卤代基或酯基,取代于吲哚环的C3、C4、C5、C6或C7位。
上述的一种合成C2-乙酰氧基-3-吲哚酮类化合物的方法,具体步骤如下:
将1-(嘧啶基-2-基)-1H-吲哚类化合物、醋酸碘苯溶于乙酸/乙酸酐混合溶剂中,混合均匀后在厚壁耐压管中反应24-36小时,反应温度设定为60℃,反应结束后,使用乙酸乙酯萃取出有机相,用饱和碳酸氢钠水溶液除去溶剂,分离出有机相使用无水硫酸钠除水,干燥后使用减压蒸馏除去溶剂得到粗产物,再粗产物经柱层析(15%EA/PE)分离后即得纯产物取代C2-乙酰氧基-3-吲哚酮类化合物。
优选地,醋酸碘苯的摩尔量为1-(嘧啶基-2-基)-1H-吲哚类化合物摩尔量的3equiv.溶剂的量为乙酸/乙酸酐等于7比3,醋酸碘苯的摩尔体积比为0.25mol/L.。
优选地,1-(嘧啶基-2-基)-1H-吲哚类化合物通过如下步骤合成:
将吲哚或取代吲哚底物和NaH溶于N,N-二甲基甲酰胺(DMF)溶剂中,冰水浴条件下反应30~60分钟,然后加入2-氯嘧啶,在100~130℃下反应16~24小时,反应结束后冷却至室温,使用乙酸乙酯萃取出有机相,用水除去溶剂,分离出有机相使用无水硫酸钠除水,干燥后使用减压蒸馏除去溶剂得到粗产物,通过柱层析分离粗产物得到化合物1-(嘧啶基-2-基)-1H-吲哚类反应物。
优选地,1-(嘧啶基-2-基)-1H-吲哚类化合物合成步骤中所述的NaH的摩尔量为吲哚或取代吲哚摩尔量的1.2~1.8equiv.,2-氯嘧啶的摩尔量是吲哚或取代吲哚摩尔量的1.1~1.6equiv.。
优选地,取代吲哚中的取代基选自烷基、烷氧基、苄氧基、卤代基、卤素,取代于吲哚环的C3、C4、C5、C6、C7位。
附图说明
图1是实施例1制得的3-氧代-2-乙酰氧基-1-(嘧啶-2-基)吲哚的氢核磁谱图(a)和碳核磁谱图(b)。
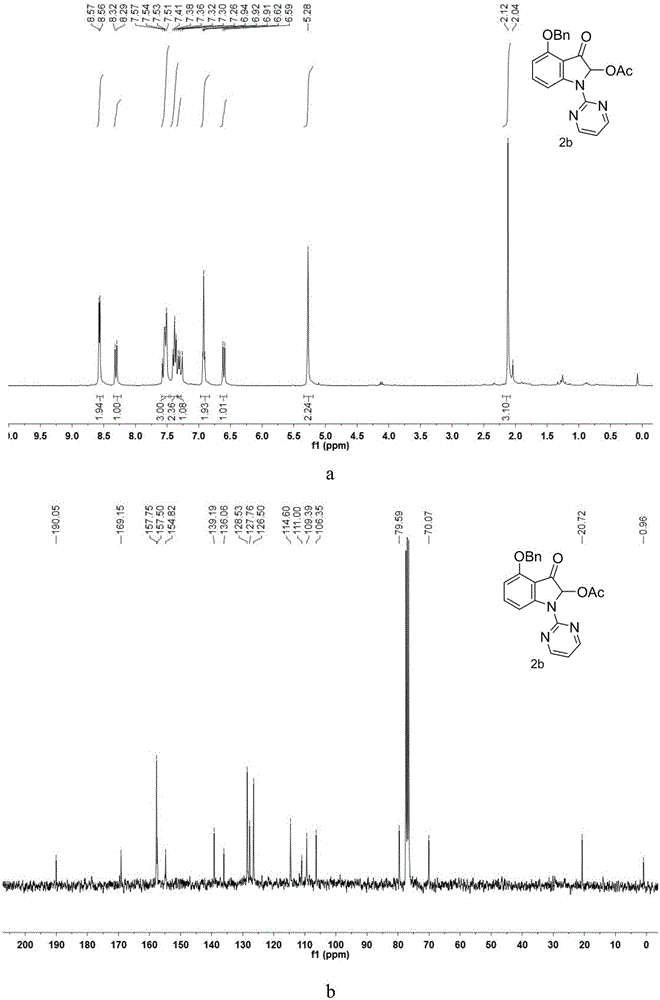
图2是实施例2制得的4-(苄氧基)-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的氢核磁谱图(a)和碳核磁谱图(b)。
图3是实施例3制得的5-甲基-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的氢核磁谱图(a)和碳核磁谱图(b)。
图4是实施例4制得的4-甲基-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的氢核磁谱图(a)和碳核磁谱图(b)。
图5是实施例5制得的6-氟-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的氢核磁谱图(a)和碳核磁谱图(b)。
图6是实施例6制得的6-氯-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的氢核磁谱图(a)和碳核磁谱图(b)。
图7是实施例7制得的5-溴-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的氢核磁谱图(a)和碳核磁谱图(b)。
图8是实施例8制得的5-氟-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的氢核磁谱图(a)和碳核磁谱图(b)。
图9是实施例9、10、11、12制得的5-氯-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的氢核磁谱图(a)和碳核磁谱图(b)。
与现有技术相比,本发明的显著效果如下:
(1)采用广泛易得、便宜的吲哚作为起始原料,运用吲哚直接氧化的反应方法,反应原子经济性高,避免了常规的C-H的预活化。
(2)采用非金属醋酸碘苯作为唯一氧化剂参与吲哚类底物的C2-乙酰氧基-3-吲哚酮反应,未使用昂贵贵金属及复杂配体,显著降低了成本。
(3)本发明合成的C2-乙酰氧基-3-吲哚酮类化合物可以对其进行产物运用,生成更为复杂结构,此结构单元具有广泛的生物活性和广阔的应用前景。
具体实施方式
以下通过列举实例和附图对本发明作进一步详细说明。
实验例1
3-氧代-2-乙酰氧基-1-(嘧啶-2-基)吲哚的合成
在反应容器中,加入吲哚(6mmol,702.9mg),NaH(质量分数60%,10.8mmol,432mg),DMF溶剂,低温条件下反应30分钟;然后加入2-氯嘧啶(9.6mmol,1099.488mg),混合物在130℃下反应24小时后,冷却到室温,萃取除去溶剂,过柱分离得到化合物1-(嘧啶基-2-基)-1H-吲哚反应物。用万分之一电子天平准确称量1-(嘧啶基-2-基)-1H-吲哚反应物(0.3mmol,58.50mg),转移至反应容器厚壁耐压管,向反应容器加入PhI(OAc)2(3eq,289.5mg)滴加2mL乙酸/乙酸酐=7/3混合溶剂,旋紧反应管塞使反应体系密封,加热至60℃,油浴搅拌条件下反应36h。反应结束后,将反应液冷却至室温,使用一段短硅胶柱去除一些金属杂质进行初步纯化,萃取并除溶剂酸后,减压旋蒸除去溶剂得到粗产物,粗产物进行柱层析分离(洗脱剂:乙酸乙酯/石油醚=15:75),得到纯净干燥的产物,产率65%。
1H NMR(300MHz,CDCl3)δ8.74(d,J=8.4Hz,1H),8.59(d,J=4.8Hz,2H),7.76(d,J=7.6Hz,1H),7.68(s,1H),7.16(d,J=7.4Hz,1H),6.94(t,J=4.8Hz,1H),6.90(s,1H),2.13(s,3H).13C NMR(75MHz,CDCl3)δ193.17,169.18,157.86,157.63,153.73,137.61,124.36,122.76,121.98,117.24(s),114.56(s),79.54(s),20.65(s).IR(neat):2979,2848,1754,1723,1559,1461,1461,1428,1012,745.HRMS(ESI)calcd.for C14H11N3O3:269.0800found 269.0806。
实验例2
4-(苄氧基)-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的合成
取100mL圆底烧瓶及大小适中的磁子,称量4-(苄氧基)-1H-吲哚(5mmol,1115mg)溶解于N,N-二甲基甲酰胺(DMF)中,并置于冰水浴中缓慢加入NaH(质量分数60%,7.5mmol,300mg)进行拔氢反应,反应1个小时后转移至130℃油浴,24h后通过TLC监测反应结束,用乙酸乙酯稀释后转移至250mL分液漏斗,用水洗三遍,洗净DMF后,收集有机相用无水硫酸钠除水,减压旋蒸除去有机溶剂后得到粗产物,通过柱层析(乙酸乙酯:石油醚=3:95)得到产物4-(苄氧基)-1H-(嘧啶-2-基)-1H-吲哚反应物。用万分之一电子天平准确称量4-(苄氧基)-1H-(嘧啶-2-基)-1H-吲哚反应物(0.3mmol,90.3mg),转移至反应容器厚壁耐压管中,向反应容器加入PhI(OAc)2(3eq,289.5mg)滴加乙酸/乙酸酐=7/3混合溶剂,旋紧反应管塞使反应体系密封,加热至60℃,油浴搅拌条件下反应36h。反应结束后,将反应液冷却至室温,使用一段短硅胶柱去除一些金属杂质进行初步纯化,萃取并除溶剂酸后,减压旋蒸除去溶剂得到粗产物,粗产物进行柱层析分离(洗脱剂:乙酸乙酯/石油醚=15:75),得到纯净干燥的产物,产率71%。
1H NMR(300MHz,CDCl3)δ8.57(d,J=4.7Hz,2H),8.31(d,J=8.3Hz,1H),7.54(dd,J=11.4,7.9Hz,3H),7.38(t,J=7.4Hz,2H),7.31(d,J=7.2Hz,1H),6.95–6.89(m,2H),6.60(d,J=8.3Hz,1H),5.28(s,2H),2.12(s,3H).13C NMR(75MHz,CDCl3)δ190.05,169.15,157.74,154.50,139.19,136.06,128.52,127.76,126.49,114.60,110.99,109.39,106.35,79.59,70.06,20.71,0.95.IR(neat):2923,2851,1752,1715,1619,1584,1560,1450,1416,1146,191.HRMS(ESI)calcd.for C21H17N3O4:375.1219found 375.1226。
实验例3
5-甲基-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的合成
取100mL圆底烧瓶及大小适中的磁子,称量5-甲基-1H-吲哚(5mmol,755mg)溶解于N,N-二甲基甲酰胺(DMF)中,并置于冰水浴中缓慢加入NaH(质量分数60%,7.5mmol,300mg)进行拔氢反应,反应1个小时后转移至130℃油浴,26h后通过TLC监测反应结束,用乙酸乙酯稀释后转移至250mL分液漏斗,用水洗三遍,洗净DMF后,收集有机相用无水硫酸钠除水,减压旋蒸除去有机溶剂后得到粗产物,通过柱层析(乙酸乙酯:石油醚=2:95)得到产物5-甲基-1H-(嘧啶-2-基)-1H-吲哚反应物。用万分之一电子天平准确称量5-甲基-1H-(嘧啶-2-基)-1H-吲哚反应物(0.3mmol,62.7mg),转移至反应容器厚壁耐压管中,向反应容器加入PhI(OAc)2(3eq,289.5mg)滴加乙酸/乙酸酐=7/3混合溶剂,旋紧反应管塞使反应体系密封,加热至60℃,油浴搅拌条件下反应36h。反应结束后,将反应液冷却至室温,使用一段短硅胶柱去除一些金属杂质进行初步纯化,萃取并除溶剂酸后,减压旋蒸除去溶剂得到粗产物,粗产物进行柱层析分离(洗脱剂:乙酸乙酯/石油醚=15:75),得到纯净干燥的产物,产率70%。
1H NMR(300MHz,CDCl3)δ8.61(s,1H),8.57(d,J=4.8Hz,2H),7.56(s,1H),7.49(d,J=8.1Hz,1H),6.91(t,J=4.8Hz,1H),6.87(s,1H),2.38(s,3H),2.12(s,3H).13C NMR(75MHz,CDCl3)δ193.19,169.21,157.76,151.88,138.62,132.58,124.10,117.05,114.27,79.83,20.64,20.50.IR(neat):2924,2850,1756,1715,1621,1581,1560,1417,1191,1146,788.HRMS(ESI)calcd.for C15H13N3O3:283.0957found 283.0962。
实验例4
4-甲基-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的合成
取100mL圆底烧瓶及大小适中的磁子,称量4-甲基吲哚(5mmol,656mg)溶解于N,N-二甲基甲酰胺(DMF)中,并置于冰水浴中缓慢加入NaH(质量分数60%,7.5mmol,300mg)进行拔氢反应,反应1个小时后转移至130℃油浴,24h后通过TLC监测反应结束,用乙酸乙酯稀释后转移至250mL分液漏斗,用水洗三遍,洗净DMF后,收集有机相用无水硫酸钠除水,减压旋蒸除去有机溶剂后得到粗产物,通过柱层析(乙酸乙酯:石油醚=3:95)得到产物4-甲基-1H-(嘧啶-2-基)-1H-吲哚反应物。用万分之一电子天平准确称量4-甲基-1-(嘧啶基-2-基)-1H-吲哚反应物((0.3mmol,62.7mg),转移至反应容器厚壁耐压管中,向反应容器加入PhI(OAc)2(3eq,289.5mg)滴加乙酸/乙酸酐=7/3混合溶剂,旋紧反应管塞使反应体系密封,加热至60℃,油浴搅拌条件下反应36h。反应结束后,将反应液冷却至室温,使用一段短硅胶柱去除一些金属杂质进行初步纯化,萃取并除溶剂酸后,减压旋蒸除去溶剂得到粗产物,粗产物进行柱层析分离(洗脱剂:乙酸乙酯/石油醚=15:75),得到纯净干燥的产物,产率65%。
1H NMR(300MHz,CDCl3)δ8.65–8.46(m,3H),7.63–7.35(m,1H),6.92(dd,J=6.2,3.4Hz,1H),6.89(d,J=6.6Hz,2H),2.62(d,J=8.5Hz,3H),2.11(d,J=9.9Hz,3H).13C NMR(75MHz,CDCl3)δ193.76(s),169.22(s),157.73(s),154.17(s),139.95(s),136.84(s),124.63(s),119.78(s),114.42(s),79.39(s),20.68(s),18.29(s).IR(neat):2931,2849,1745,1718,1597,1574,1558,1410,1207,779.HRMS(ESI)calcd.for C15H13N3O3:283.0957found 283.0949。
实验例5
6-氟-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的合成
取100mL圆底烧瓶及大小适中的磁子,称量6-氟吲哚(5mmol,675mg)溶解于N,N-二甲基甲酰胺(DMF)中,并置于冰水浴中缓慢加入NaH(质量分数60%,7.5mmol,300mg)进行拔氢反应,反应1个小时后转移至130℃油浴,24h后通过TLC监测反应结束,用乙酸乙酯稀释后转移至250mL分液漏斗,用水洗三遍,洗净DMF后,收集有机相用无水硫酸钠除水,减压旋蒸除去有机溶剂后得到粗产物,通过柱层析(乙酸乙酯:石油醚=3:95)得到产物6-氟-1H-(嘧啶-2-基)-1H-吲哚反应物。用万分之一电子天平准确称量6-氟-1-(嘧啶基-2-基)-1H-吲哚反应物((0.3mmol,63.9mg),转移至反应容器厚壁耐压管中,向反应容器加入PhI(OAc)2(3eq,289.5mg)滴加乙酸/乙酸酐=7/3混合溶剂,旋紧反应管塞使反应体系密封,加热至60℃,油浴搅拌条件下反应36h。反应结束后,将反应液冷却至室温,使用一段短硅胶柱去除一些金属杂质进行初步纯化,萃取并除溶剂酸后,减压旋蒸除去溶剂得到粗产物,粗产物进行柱层析分离(洗脱剂:乙酸乙酯/石油醚=15:75),得到纯净干燥的产物,产率60%。
1H NMR(300MHz,CDCl3)δ8.60(d,J=4.8Hz,2H),8.49(dd,J=11.0,2.2Hz,1H),7.76(dd,J=8.4,5.9Hz,1H),6.98(t,J=4.8Hz,1H),6.89(s,1H),6.88–6.79(m,1H),2.12(s,3H).13C NMR(75MHz,CDCl3)δ191.25,169.03,168.81(d,J=255.7Hz),157.87,157.46,155.41(d,J=14.9Hz),126.49(d,J=11.8Hz),118.43,114.99,110.72(d,J=24.5Hz),105.04(d,J=29.7Hz),79.86,20.58.IR(neat):2919,2850,1748,1717,1618,1576,1555,1456,1435,793.HRMS(ESI)calcd.for C14H10FN3O3:287.0706found 287.0709.
实验例6
6-氯-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的合成
取100mL圆底烧瓶及大小适中的磁子,称量6-氯吲哚(5mmol,755mg)溶解于N,N-二甲基甲酰胺(DMF)中,并置于冰水浴中缓慢加入NaH(质量分数60%,7.5mmol,300mg)进行拔氢反应,反应1个小时后转移至130℃油浴,24h后通过TLC监测反应结束,用乙酸乙酯稀释后转移至250mL分液漏斗,用水洗三遍,洗净DMF后,收集有机相用无水硫酸钠除水,减压旋蒸除去有机溶剂后得到粗产物,通过柱层析(乙酸乙酯:石油醚=3:95)得到产物6-氯-1H-(嘧啶-2-基)-1H-吲哚反应物。用万分之一电子天平准确称量6-氯-1-(嘧啶基-2-基)-1H-吲哚反应物((0.3mmol,68.7mg),转移至反应容器厚壁耐压管中,向反应容器加入PhI(OAc)2(3eq,289.5mg)滴加乙酸/乙酸酐=7/3混合溶剂,旋紧反应管塞使反应体系密封,加热至60℃,油浴搅拌条件下反应36h。反应结束后,将反应液冷却至室温,使用一段短硅胶柱去除一些金属杂质进行初步纯化,萃取并除溶剂酸后,减压旋蒸除去溶剂得到粗产物,粗产物进行柱层析分离(洗脱剂:乙酸乙酯/石油醚=15:75),得到纯净干燥的产物,产率59%。
1H NMR(300MHz,CDCl3)δ8.80(d,J=1.4Hz,1H),8.61(d,J=4.8Hz,2H),7.67(d,J=8.2Hz,1H),7.12(dd,J=8.2,1.4Hz,1H),6.97(d,J=4.8Hz,1H),6.87(s,1H),2.12(s,3H).13C NMR(75MHz,CDCl3)δ191.76,169.02,157.88,157.46,154.05,144.00,125.14,123.31,120.46,117.51,114.99,79.75,20.57.IR(neat):2997,2840,1750,1732,1603,1574,1554,1417,1065,786.HRMS(ESI)calcd.for C14H10ClN3O3:303.0411found 303.0405.
实验例7
5-溴-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的合成
取100mL圆底烧瓶及大小适中的磁子,称量5-溴吲哚(5mmol,975mg)溶解于N,N-二甲基甲酰胺(DMF)中,并置于冰水浴中缓慢加入NaH(质量分数60%,7.5mmol,300mg)进行拔氢反应,反应1个小时后转移至130℃油浴,24h后通过TLC监测反应结束,用乙酸乙酯稀释后转移至250mL分液漏斗,用水洗三遍,洗净DMF后,收集有机相用无水硫酸钠除水,减压旋蒸除去有机溶剂后得到粗产物,通过柱层析(乙酸乙酯:石油醚=3:95)得到产物5-溴-1H-(嘧啶-2-基)-1H-吲哚反应物。用万分之一电子天平准确称量5-溴-1-(嘧啶基-2-基)-1H-吲哚反应物((0.3mmol,81.9mg),转移至反应容器厚壁耐压管中,向反应容器加入PhI(OAc)2(3eq,289.5mg)滴加乙酸/乙酸酐=7/3混合溶剂,旋紧反应管塞使反应体系密封,加热至60℃,油浴搅拌条件下反应36h。反应结束后,将反应液冷却至室温,使用一段短硅胶柱去除一些金属杂质进行初步纯化,萃取并除溶剂酸后,减压旋蒸除去溶剂得到粗产物,粗产物进行柱层析分离(洗脱剂:乙酸乙酯/石油醚=15:75),得到纯净干燥的产物,产率57%。
1H NMR(300MHz,CDCl3)δ8.63(d,J=8.9Hz,1H),8.58(d,J=4.8Hz,2H),7.82(d,J=1.9Hz,1H),7.71(dd,J=8.9,2.1Hz,1H),6.96(t,J=4.8Hz,1H),6.81(s,1H),2.11(s,3H).13C NMR(75MHz,CDCl3)δ191.85,169.02,157.87,157.54,152.40,139.85,126.79,123.65,118.95,115.55,114.84,79.66,20.55.IR(neat):2921,2852,1734,1574,1463,1232,1044,733.HRMS(ESI)calcd.for C14H10BrN3O3:346.9906found 346.9909。
实验例8
5-氟-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的合成
取100mL圆底烧瓶及大小适中的磁子,称量5-氟吲哚(5mmol,675mg)溶解于N,N-二甲基甲酰胺(DMF)中,并置于冰水浴中缓慢加入NaH(质量分数60%,7.5mmol,300mg)进行拔氢反应,反应1个小时后转移至130℃油浴,24h后通过TLC监测反应结束,用乙酸乙酯稀释后转移至250mL分液漏斗,用水洗三遍,洗净DMF后,收集有机相用无水硫酸钠除水,减压旋蒸除去有机溶剂后得到粗产物,通过柱层析(乙酸乙酯:石油醚=3:95)得到产物5-氟-1H-(嘧啶-2-基)-1H-吲哚反应物。用万分之一电子天平准确称量5-氟-1-(嘧啶基-2-基)-1H-吲哚反应物((0.3mmol,63.9mg),转移至反应容器厚壁耐压管中,向反应容器加入PhI(OAc)2(3eq,289.5mg)滴加乙酸/乙酸酐=7/3混合溶剂,旋紧反应管塞使反应体系密封,加热至60℃,油浴搅拌条件下反应36h。反应结束后,将反应液冷却至室温,使用一段短硅胶柱去除一些金属杂质进行初步纯化,萃取并除溶剂酸后,减压旋蒸除去溶剂得到粗产物,粗产物进行柱层析分离(洗脱剂:乙酸乙酯/石油醚=15:75),得到纯净干燥的产物,产率56%。
1H NMR(300MHz,CDCl3)δ8.80–8.70(m,1H),8.58(d,J=4.8Hz,2H),7.41(d,J=7.7Hz,2H),6.95(s,1H),6.85(s,1H),2.13(s,3H).13C NMR(75MHz,CDCl3)δ192.47,169.09,157.84,157.64,157.19(d,J=245.7Hz),150.06(s),124.56(d,J=23.6Hz),123.06(d,J=7.5Hz),118.81(d,J=6.5Hz),114.62,109.86(d,J=23.3Hz),80.06,20.56.IR(neat):2979,1754,1727,1621,1579,1556,1418,1210,1133,882.HRMS(ESI)calcd.for C14H10FN3O3:287.0706found 287.0703.
实验例9
5-氯-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的合成
取100mL圆底烧瓶及大小适中的磁子,称量5-氯吲哚(5mmol,755mg)溶解于N,N-二甲基甲酰胺(DMF)中,并置于冰水浴中缓慢加入NaH(质量分数60%,7.5mmol,300mg)进行拔氢反应,反应1个小时后转移至130℃油浴,24h后通过TLC监测反应结束,用乙酸乙酯稀释后转移至250mL分液漏斗,用水洗三遍,洗净DMF后,收集有机相用无水硫酸钠除水,减压旋蒸除去有机溶剂后得到粗产物,通过柱层析(乙酸乙酯:石油醚=3:95)得到产物5-氯-1H-(嘧啶-2-基)-1H-吲哚反应物。用万分之一电子天平准确称量5-氯-1-(嘧啶基-2-基)-1H-吲哚反应物((0.3mmol,68.7mg),转移至反应容器厚壁耐压管中,向反应容器加入PhI(OAc)2(3eq,289.5mg)滴加乙酸/乙酸酐=7/3混合溶剂,旋紧反应管塞使反应体系密封,加热至60℃,油浴搅拌条件下反应36h。反应结束后,将反应液冷却至室温,使用一段短硅胶柱去除一些金属杂质进行初步纯化,萃取并除溶剂酸后,减压旋蒸除去溶剂得到粗产物,粗产物进行柱层析分离(洗脱剂:乙酸乙酯/石油醚=15:75),得到纯净干燥的产物,产率55%。
1H NMR(300MHz,CDCl3)δ8.69(d,J=8.9Hz,1H),8.58(d,J=4.8Hz,2H),7.68(s,1H),7.58(d,J=8.9Hz,1H),6.96(t,J=4.8Hz,1H),6.83(s,1H),2.11(s,3H).13C NMR(75MHz,CDCl3)δ192.0,169.05,157.87,157.4,152.01,137.09,128.35,123.71,123.23,118.59,114.82,79.81,20.55.IR(neat):2922,2846,1752,1733,1669,1771,1561,1456,834,700.HRMS(ESI)calcd.for C14H10ClN3O3:303.0411found 303.0401。
实验例10
5-氯-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的合成
取100mL圆底烧瓶及大小适中的磁子,称量5-氯吲哚(5mmol,755mg)溶解于N,N-二甲基甲酰胺(DMF)中,并置于冰水浴中缓慢加入NaH(质量分数60%,7.5mmol,300mg)进行拔氢反应,反应1个小时后转移至130℃油浴,24h后通过TLC监测反应结束,用乙酸乙酯稀释后转移至250mL分液漏斗,用水洗三遍,洗净DMF后,收集有机相用无水硫酸钠除水,减压旋蒸除去有机溶剂后得到粗产物,通过柱层析(乙酸乙酯:石油醚=3:95)得到产物5-氯-1H-(嘧啶-2-基)-1H-吲哚反应物。用万分之一电子天平准确称量5-氯-1-(嘧啶基-2-基)-1H-吲哚反应物((0.3mmol,68.7mg),转移至反应容器厚壁耐压管中,向反应容器加入PhI(OAc)2(3eq,289.5mg)滴加乙酸/乙酸酐=7/3混合溶剂,旋紧反应管塞使反应体系密封,加热至40℃,油浴搅拌条件下反应36h。反应结束后,将反应液冷却至室温,使用一段短硅胶柱去除一些金属杂质进行初步纯化,萃取并除溶剂酸后,减压旋蒸除去溶剂得到粗产物,粗产物进行柱层析分离(洗脱剂:乙酸乙酯/石油醚=15:75),得到纯净干燥的产物,产率为50%。
1H NMR(300MHz,CDCl3)δ8.69(d,J=8.9Hz,1H),8.58(d,J=4.8Hz,2H),7.68(s,1H),7.58(d,J=8.9Hz,1H),6.96(t,J=4.8Hz,1H),6.83(s,1H),2.11(s,3H).13C NMR(75MHz,CDCl3)δ192.0,169.05,157.87,157.4,152.01,137.09,128.35,123.71,123.23,118.59,114.82,79.81,20.55.IR(neat):2922,2846,1752,1733,1669,1771,1561,1456,834,700.HRMS(ESI)calcd.for C14H10ClN3O3:303.0411found 303.0401。
实验例11
5-氯-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的合成
取100mL圆底烧瓶及大小适中的磁子,称量5-氯吲哚(5mmol,755mg)溶解于N,N-二甲基甲酰胺(DMF)中,并置于冰水浴中缓慢加入NaH(质量分数60%,7.5mmol,300mg)进行拔氢反应,反应1个小时后转移至130℃油浴,24h后通过TLC监测反应结束,用乙酸乙酯稀释后转移至250mL分液漏斗,用水洗三遍,洗净DMF后,收集有机相用无水硫酸钠除水,减压旋蒸除去有机溶剂后得到粗产物,通过柱层析(乙酸乙酯:石油醚=3:95)得到产物5-氯-1H-(嘧啶-2-基)-1H-吲哚反应物。用万分之一电子天平准确称量5-氯-1-(嘧啶基-2-基)-1H-吲哚反应物((0.3mmol,68.7mg),转移至反应容器厚壁耐压管中,向反应容器加入PhI(OAc)2(3eq,289.5mg)滴加乙酸/乙酸酐=7/3混合溶剂,旋紧反应管塞使反应体系密封,加热至80℃,油浴搅拌条件下反应36h。反应结束后,将反应液冷却至室温,使用一段短硅胶柱去除一些金属杂质进行初步纯化,萃取并除溶剂酸后,减压旋蒸除去溶剂得到粗产物,粗产物进行柱层析分离(洗脱剂:乙酸乙酯/石油醚=15:75),得到纯净干燥的产物,产率为53%。
1H NMR(300MHz,CDCl3)δ8.69(d,J=8.9Hz,1H),8.58(d,J=4.8Hz,2H),7.68(s,1H),7.58(d,J=8.9Hz,1H),6.96(t,J=4.8Hz,1H),6.83(s,1H),2.11(s,3H).13C NMR(75MHz,CDCl3)δ192.0,169.05,157.87,157.4,152.01,137.09,128.35,123.71,123.23,118.59,114.82,79.81,20.55.IR(neat):2922,2846,1752,1733,1669,1771,1561,1456,834,700.HRMS(ESI)calcd.for C14H10ClN3O3:303.0411found 303.0401。
实验例12
5-氯-2-乙酰氧基-3-氧代-1-(嘧啶-2-基)吲哚的合成
取100mL圆底烧瓶及大小适中的磁子,称量5-氯吲哚(5mmol,755mg)溶解于N,N-二甲基甲酰胺(DMF)中,并置于冰水浴中缓慢加入NaH(质量分数60%,7.5mmol,300mg)进行拔氢反应,反应1个小时后转移至130℃油浴,24h后通过TLC监测反应结束,用乙酸乙酯稀释后转移至250mL分液漏斗,用水洗三遍,洗净DMF后,收集有机相用无水硫酸钠除水,减压旋蒸除去有机溶剂后得到粗产物,通过柱层析(乙酸乙酯:石油醚=3:95)得到产物5-氯-1H-(嘧啶-2-基)-1H-吲哚反应物。用万分之一电子天平准确称量5-氯-1-(嘧啶基-2-基)-1H-吲哚反应物((0.3mmol,68.7mg),转移至反应容器厚壁耐压管中,向反应容器加入PhI(OAc)2(3eq,289.5mg)滴加乙酸/乙酸酐=7/3混合溶剂,旋紧反应管塞使反应体系密封,加热至60℃,油浴搅拌条件下反应24h。反应结束后,将反应液冷却至室温,使用一段短硅胶柱去除一些金属杂质进行初步纯化,萃取并除溶剂酸后,减压旋蒸除去溶剂得到粗产物,粗产物进行柱层析分离(洗脱剂:乙酸乙酯/石油醚=15:75),得到纯净干燥的产物,产率为52%。
1H NMR(300MHz,CDCl3)δ8.69(d,J=8.9Hz,1H),8.58(d,J=4.8Hz,2H),7.68(s,1H),7.58(d,J=8.9Hz,1H),6.96(t,J=4.8Hz,1H),6.83(s,1H),2.11(s,3H).13C NMR(75MHz,CDCl3)δ192.0,169.05,157.87,157.4,152.01,137.09,128.35,123.71,123.23,118.59,114.82,79.81,20.55.IR(neat):2922,2846,1752,1733,1669,1771,1561,1456,834,700.HRMS(ESI)calcd.for C14H10ClN3O3:303.0411found 303.0401。
- 还没有人留言评论。精彩留言会获得点赞!