新鞘脂菌(Novosphingobiumsp.)1MP25菌株在降解多环芳烃中的应用的制作方法
本发明属于环境污染物生物处理技术领域,更具体地,涉及新鞘脂菌Novosphingobium sp.1MP25菌株在降解多环芳烃中的应用。
背景技术:
多环芳烃是指两个或两个以上苯环以线状、角状或簇状排列的多元环化合物,是有机物不完全燃烧或高温裂解的副产物。广泛存在于原油、煤炭等生物燃料中,具有潜在的致畸性、致癌性。而且,多环芳烃的结构稳定,半衰期长,一般很难被生物利用。
多环芳烃在自然界中的有多种可能的去除途径,例如光氧化、化学氧化、生物积累、土壤吸附和微生物降解等。已有大量研究证明微生物降解是去除环境中多环芳烃的最主要途径。微生物长期生活在多环芳烃污染的土壤中,经过自然驯化,逐渐进化出以多环芳烃作为碳源获取能源的能力,得以生长和繁殖,从而减少多环芳烃对生态环境的影响。
在环境中,烷基化的多环芳烃的含量占总多环芳烃的很大一部分,特别是在原油污染严重的土壤和水体中。而烷基化多环芳烃因其烷基化基团的存在,使其更加难以被微生物利用,因此,具有降解烷基化多环芳烃能力的新菌种是非常具有研究价值和开发潜力的。
新鞘脂菌属的菌种已被报道具有降解多种有机污染物的能力,如母体多环芳烃(参见文献Balkwill等,1997;Gao等,2015;Yuan等,2009;Suzuki和Hiraishi,2007;Sohn等,2004;Liu等,2005),氯乙酰胺,六六六等。但此前尚未发现该属菌种具有降解烷基化多环芳烃的能力。
技术实现要素:
本发明的目的在于根据现有技术中的不足,提供了新鞘脂菌(Novosphingobium sp.)1MP25菌株在降解多环芳烃中的应用。
本发明的目的通过以下技术方案实现:
本发明提供了新鞘脂菌(Novosphingobium sp.)1MP25菌株在降解多环芳烃中的应用,以及在制备能够降解多环芳烃的微生物制剂方面的应用。
所述新鞘脂菌1MP25菌株于2016年7月13日保藏于广东省微生物菌种保藏中心(GDMCC),保藏编号为GDMCC No:60058,保藏地址:广州市先烈中路100号大院59号楼5楼广东省微生物研究所。
优选地,所述多环芳烃为烷基化多环芳烃。
更优选地,所述烷基化多环芳烃为1-甲基菲。
本发明所述新鞘脂菌1MP25菌株是革兰氏阴性菌,在LB(Luria–Bertani)培养基平板上菌落呈圆形,湿润,透明,呈黄色;透射电镜下细胞呈杆状,长2.0±0.4μm,宽0.8±0.2μm,有鞭毛。
本发明另外提供一种降解多环芳烃的方法,包括如下步骤:
S1:将所述新鞘脂菌1MP25菌株进行培养,得到培养液;
S2:将S1中培养液离心后去上清得到菌体,用生理盐水重悬浮成菌悬液,加入到含多环芳烃的待处理样品中进行降解处理。
进一步优选地,S2中的菌悬液用生理盐水稀释到吸光度0.5~2,再加入到待处理样品中进行降解。
更优选地,S2中的菌悬液用生理盐水稀释到吸光度为1.0,再加入到待处理样品中进行降解。
优选地,S2中菌悬液和待处理样品的体积比为0.2~1:25。
更优选地,S2中菌悬液和待处理样品的体积比为0.5:25。
优选地,所述待处理样品中多环芳烃的溶度为80~120mg/L。
更优选地,所述待处理样品中多环芳烃的溶度为100mg/L。
优选地,所述多环芳烃为烷基化的多环芳烃。
优选地,步骤S1所述培养所用的培养基为LB培养基。
优选地,步骤S1所述培养的时间为20~30h。
更优选地,步骤S1所述培养的时间为24h。
优选地,步骤S2离心所用方法为5000~8000g离心8~15min。
更优选地,步骤S2离心所用方法为6000g离心10min。
另外,作为一种更适用于小规模降解实验的优选的降解多环芳烃的方法,包括如下步骤:
S1:将所述的新鞘脂菌1MP25菌株于LB培养基中培养,得到培养液;
S2:将S1中培养液离心后去除上清,得到菌体,重悬浮于生理盐水后制成菌悬液,加入到含多环芳烃的MS培养基(Mineral salts medium)中降解。
优选地,S2中,多环芳烃在MS培养基中的溶度为80~120mg/L,所述S2中菌悬液按照(0.2~1):25的体积比加入到含多环芳烃的MS培养基中。
优选地,S2中,多环芳烃在MS培养基中的溶度为100mg/L,所述S2中菌悬液按照0.5:25的体积比加入到含多环芳烃的MS培养基中。
优选地,MS培养基组成为:1升水中含有(NH4)SO4 1.0g,MgSO4.7H2O 0.2g,FeSO4.7H2O 0.01g,CaCl2 0.1g,0.05mol的磷酸缓冲体系。
本发明所提供的新鞘脂菌1MP25菌株可以快速降解烷基化多环芳烃1-甲基菲,14天可完全去除无碳源培养基中的1-甲基菲,显示了较强的降解效果。
与现有技术相比,本发明具有以下优点及有益效果:
本发明提供了一株可降解多环芳烃的新鞘脂菌1MP25菌株,所述菌株能够显著降解烷基化多环芳烃1-甲基菲,其在14天后可以实现对1-甲基菲的完全降解,显示出较强的烷基化多环芳烃降解能力,在生物降解原油污染严重的土壤和水体中等领域中具有很好的应用前景。
附图说明
图1为1MP25菌株的细胞透射电镜图。
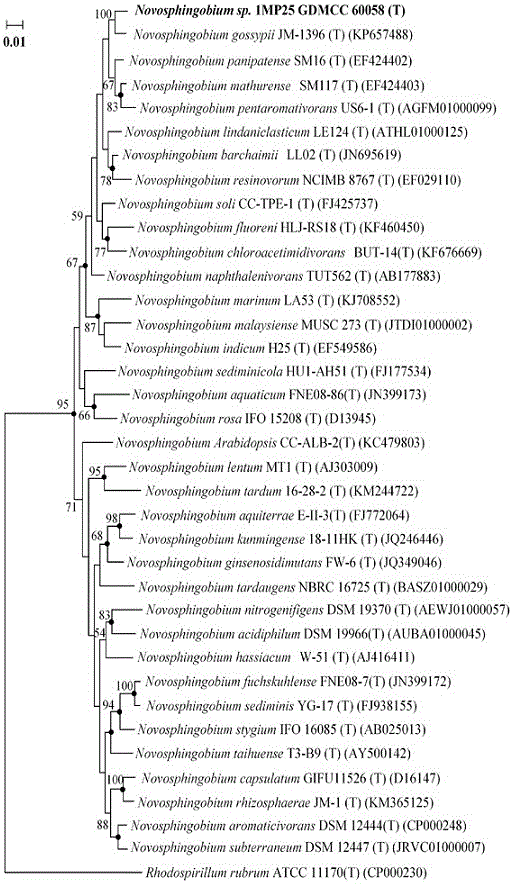
图2为1MP25菌株Neighbour-Joining算法系统进化树图,图2中黑点标注的分支表示该分支在Maximum-likelihood算法中依然保守。
图3为1MP25菌株的极性脂组分图。
图4为1MP25菌株对1-甲基菲的降解曲线图。
具体实施方式
以下结合具体实施例和附图来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,本发明所用试剂和材料均为市购。
实施例1新鞘脂菌1MP25菌株的分离、培养与鉴定
1、菌株分离与培养
(1)收集菌落:取新鲜土壤样品(采集地:广东省广州市广州石化厂区的废油污染土壤)5g至50ml灭菌的2.8g/L焦磷酸钠溶液中,在摇床中(150rpm,28℃)摇晃过夜。
(2)驯化菌群:吸取上述菌液5ml至含有1-甲基菲100mg/L的45ml MS培养基中,进行驯化,150rpm,28℃培养14天。14天后吸取0.5ml接入新的1-甲基菲MS培养基中,重复8次,得到菌群G8。
(3)获得纯菌株:将菌群G8涂板,得到单菌落,选取其中对1-甲基菲降解效果最好的单菌落,经过进一步涂板纯化后,得到一株纯菌株,命名为1MP25菌株。菌株的扩大培养用LB液体培养基,长期保存在-80℃冰箱中,保护剂为含有40%甘油的LB培养基。
2、菌株形态学鉴定
(1)1MP25菌株在LB平板上菌落呈圆形,湿润,透明,黄色。
(2)革兰氏染色:KOH-Test法,结果显示,该菌株为革兰氏阴性菌。
(3)透射电镜:JEM-100CXII,日本电子株式会社。采用负染法(0.5%磷钨酸盐)对样品进行处理。透射电镜下观察,细胞呈杆状,长2.0±0.4μm,宽0.8±0.2μm,有鞭毛(透射电镜图如附图1所示)。
3、分子鉴定
(1)首先进行16S rRNA测序:用DNA提取试剂盒提取1MP25菌株的基因组DNA后,对16S rRNA基因片段进行扩增,送到生物公司进行测序。
(2)在EzTaxon数据库(http://www.ezbiocloud.net/eztaxon)中收集所有新鞘脂菌属的菌种16S rRNA的序列,并选取一个其他属的菌种作为参考(Rhodospirillum rubrum ATCC 11170T)。所有的序列采用软件CLUSTAL_X进行对齐和剪切,采用软件MEGA 5.0构建进化树,算法为Neighbour-joining和Maximum-likelihood算法(Bootstrap:1000replications)。
利用序列比对结果进行系统发育分析,进化树见图2。该1MP25菌株属于新鞘脂菌属(Novosphingobium),并且最相近的菌种是Novosphingobium gossypii(相似度98.5%),N.panipatense(相似度98.2%),N.mathurense(相似度98.0%)和N.pentaromativorans(相似度96.5%)。
4、测定新鞘脂菌1MP25菌株及其相近菌种的各项生理生化指标
(1)测定方法
1)接触酶反应和氧化酶反应:接触酶用双氧水反应进行验证,氧化酶用四甲基对苯二胺反应进行验证。
2)DNA G+C含量:采用反相液相色谱法。方法参见文献Mesbah等,1989。
Mesbah,M.,Premachandran,U.,Whitman,W.B.(1989).Precise measurement of the G+C content of deoxyribonucleic acid by high-performance liquid chromatography.Int J Syst Bacteriol 39,159-167.
3)DNA-DNA杂交:移交广东省微生物研究所代为测定。方法参见文献:Huss 等,1983。
Huss,V.A.R.,H.Festl,and K.H.Schleifer.(1983).Studies on the spectrophotometric determination of DNA hybridization from renaturation rates.Syst Appl Microbiol 4,184-192.
4)生长温度,pH,盐度范围测定范围:
温度:5,10,15,20,25,30,35,40,45,50℃
pH:4.0,5.0,6.0,7.0,8.0,9.0,10.0
NaCl:1,2,3,4,8,12%(w/v)
5)脂肪酸:美国MIDI公司磷脂脂肪酸分析系统(MIDI)。
6)极性脂:提取方法参见文献Minnikin等,1979。
Minnikin,D.E.,Collins,M.D.,Goodfellow,M.(1979).Fatty acid and polar lipid composition in the classification of Cellulomonas,Oerskovia and related taxa.J Appl Bacteriol 47 87-95.
分离方法为二维薄层色谱法,参见文献Collins等,1980。
Collins,M.D.&Jones,D.(1980).Lipids in the classification and identification of coryneform bacteria containing peptidoglycans based on 2,4-diaminobutyric acid.J Appl Bacteriol 48,459-470.
7)呼吸醌:提取方法参见文献Collins等,1977。
Collins,M.D.,Pirouz,T.,Goodfellow,M.&Minnikin,D.E.(1977).Distribution of menaquinones in actinomycetes and corynebacteria.J Gen Microbiol 100,221-230.
分析方法参见文献Kroppenstedt,1982。
Kroppenstedt,R.M.(1982).Separation of bacterial menaquinones by HPLC using reverse phase(RP18)and a silver loaded ion exchanger as stationary phases.J Liq Chromatogr 5,2359-2367.
8)多胺:提取和分析方法参见文献Scherer and Kneifel,1983。
Scherer,P.&Kneifel,H.(1983).Distribution of polyamines in methanogenic bacteria.J Bacteriol 154,1315-1322.
9)碳源利用:美国Biolog公司自动微生物鉴定系统。
10)酶活性:梅里埃公司API ZYM试剂条。
11)抗生素药敏实验:采用纸片扩散法。参见文献Bauer等,1966。
Bauer,A.W.,W.M.M.Kirby,J.C.Sherris,M.Turck(1966).Antibiotic susceptibility testing by a standardized single disk method.Am J Clin Pathol 36,493-496.
(2)测定结果
经过鉴定,上述新鞘脂菌1MP25菌株的各项生理生化特征描述如下:
接触酶反应和细胞色素氧化酶反应均呈阴性。
1MP25菌株DNA G+C含量为60.2mol%。与进化树中最亲近菌种N.gossypii的DNA–DNA杂交结果为35.5%,远低于标准值70%,证明1MP25菌株是新鞘脂菌属中的独立的菌种。1MP25菌株生长温度范围10-35℃,pH范围为6.0-8.0,盐度范围为0-4%(w/v)。1MP25菌株的主要脂肪酸及其含量:C18:1ω7c(59.7%),C16:0(11.9%)和C16:1ω7c/C16:1ω6c(10.7%)。
1MP25菌株的极性脂组分主要由双磷脂酰甘油(DPG),磷脂酰甘油(PG),磷脂酰二甲基乙醇胺(PDE),磷脂酰乙醇胺(PE)和新鞘脂菌属特有的神经鞘糖脂类(SGL)组成,具体见图3所示。其中图3中,DPG:双磷脂酰甘油;PG:磷脂酰甘油;PDE:磷脂酰二甲基乙醇胺;PE:磷脂酰乙醇胺;SGL:新鞘脂菌属特有的神经鞘糖脂类。PL1,PL2,PL3,PL4,PL5:未知磷脂类;L1,L2:未知脂类;AL:未知氨基脂类;APL1,APL2,APL3:未知氨基磷脂类。
1MP25菌株的呼吸醌是泛醌Q-10,主要的多胺是亚精胺。
1MP25菌株可利用以下碳源:糊精,吐温40,D-葡萄糖,D-甘露糖,D-半乳糖,L-岩藻糖,D-水杨苷,D-麦芽糖,D-海藻糖,D-纤维二糖,龙胆二糖,D-半乳糖醛酸,半乳糖醛酸内酯,D-葡萄糖醛酸,丙三醇,N-乙酰-D-葡萄糖胺,丙酮酸甲 酯,L-乳酸,柠檬酸,α-羟基丁酸,β-羟基-D L-丁酸,α-酮-丁酸,L-乙酰乙酸,丙酸,醋酸,甘氨酰-L-脯氨酸,L-丙氨酸,L-天冬氨酸,L-谷氨酸,L-组氨酸。
1MP25菌株具有以下酶活性:碱性磷酸酶,亮氨酸芳胺酶,缬氨酸芳胺酶,胱氨酸芳胺酶,酸性磷酸酶,萘酚AS-BI磷酸水解酶,β-半乳糖苷酶,α-葡萄糖苷酶,β-葡萄糖苷酶。
1MP25菌株对以下抗生素敏感:氨苄西林,头孢他啶,环丙沙星,头孢噻肟,头孢吡肟,青霉素,哌拉西林/三唑巴坦,四环素,阿莫西林/克拉维酸,红霉素,亚胺培南,替卡西林,甲氧苄氨嘧啶/磺胺甲恶唑。
1MP25菌株对以下抗生素具有抗性,莫西沙星,左氧氟沙星,头孢曲松,克林霉素,头孢西丁,利奈唑胺,美罗培南,利福平,替考拉宁,万古霉素。
1MP25与最相近四株菌种的各项生理生化特征详细结果见表1。通过以上各项生理生化特征差异,表明1MP25菌株是新鞘脂菌属的一株新种,定名为新鞘脂菌Novosphingobium sp.1MP25。并于2016年7月13日保藏于广东省微生物菌种保藏中心(GDMCC),保藏编号为GDMCC No:60058。
表1为1MP25菌株及其相近菌株的生理生化特征对比
注:菌株1,1MP25;菌株2,N.gossypii JM-1396T;菌株3,N.panipatense DSM22890T;菌株4,N.mathurense DSM 23374T;菌株5,N.pentaromativorans DSM17173T。
+,阳性;-,阴性;w,弱阳性。
表中未出现的数据:
*所有菌株对以下物质的同化反应都呈现阳性:糊精,D-麦芽糖,β-羟基-D L-丁酸,醋酸,甘氨酰-L-脯氨酸,L-天冬氨酸,L-谷氨酸。所有菌株对以下物质的同化反应都呈现阴性:3-甲酰葡糖,D-岩藻糖,肌苷,水苏糖,葡糖醛酰胺,粘液酸,D-葡萄糖二酸,D-乳酸甲酯,D-山梨醇,D-甘露醇,D-阿拉伯醇,肌醇,N-乙酰-β- 甘露糖醇,N-乙酰-D-半乳糖胺,N-乙酰神经氨酸,p-羟基苯乙酸,α-酮戊二酸,D-苹果酸,γ-氨基丁酸,D-天门冬氨酸,D-丝氨酸,L-精氨酸。
*所有菌株都具有以下酶活性:碱性磷酸酶,亮氨酸芳胺酶,缬氨酸芳胺酶,酸性磷酸酶,萘酚AS-BI磷酸水解酶。所有菌株都不具有以下酶活性:脂肪酶(C14),α-糜蛋白酶,α-甘露糖苷酶,β-岩藻糖苷酶。
*所有菌株都对以下抗生素敏感:头孢他啶,头孢吡肟,哌拉西林/三唑巴坦,四环素,阿莫西林/克拉维酸,红霉素,亚胺培南,替卡西林,甲氧苄氨嘧啶/磺胺甲恶唑。所有菌株都具有克林霉素抗性。
实施例2新鞘脂菌1MP25菌株降解能力的验证
1、方法
(1)MS培养基:1升水中有无机盐(NH4)SO4 1.0g,MgSO4.7H2O 0.2g,FeSO4.7H2O 0.01g,CaCl2 0.1g和磷酸缓冲体系K2HPO4.3H2O 8.22g,KH2PO4 1.91g,使pH稳定在7.2。
(2)取实施例1中1MP25菌株在LB培养基中培养24h后,6000g离心,去上清,加入生理盐水震荡清洗,重复以上步骤,去除有机物。整个步骤注意保持无菌操作。最后将菌液稀释到吸光度1.0,取0.5ml加入到25ml含有1-甲基菲(100mg/L)的MS培养基中,放入28℃,150rpm的摇床中进行降解实验。
(3)在计划的采样时间,将含有1-甲基菲的MS培养基取出,用乙酸乙酯进行液液萃取,浓缩定容后,用气相色谱质谱联用仪进样,并对结果进行定量计算。
(4)设置对照实验,其为不加入菌株的空白实验,其他处理步骤同(1)、(2)和(3)。
2、结果如图4所示,相比较空白实验,本发明所提供的新鞘脂菌1MP25菌株可以快速降解烷基化多环芳烃1-甲基菲,14天可完全去除无碳源培养基中的1-甲基菲(100mg/L)。
- 还没有人留言评论。精彩留言会获得点赞!