一种可拮抗病原菌灿烂弧菌的海洋细菌及其用途的制作方法
本发明涉及一种海洋细菌,尤其是涉及一种可拮抗病原菌灿烂弧菌的海洋细菌及其用途。
背景技术:
灿烂弧菌是海水养殖环境中常见的重要条件致病菌,当环境条件不利时,可感染美国红鱼(Helen et al. 2009)、大菱鲆(Gatesoupe 1999; Thomson 2005)、贝类 (Saulnier 2010; Rosa et al. 2012; Liu et al. 2013)和刺参(王印庚 2006;王印庚 2013;李强2013)等多种海水养殖动物,引起水产动物病害的频繁、大规模发生。仿刺参养殖的单种类产值最高,产值每年以20%的速度增加,已然成为我国水产养殖业的重要支柱之一。然而近年来,随着刺参养殖规模的不断扩大,各种病害接踵而至,严重制约着该产业的健康可持续发展。其中,“腐皮综合症”是仿刺参的重要病症之一,具有波及面广、传染性强、死亡率高等特点,已经给水产养殖业造成了巨大经济损失(李剑桥,2012; 李强等,2013)。其中,灿烂弧菌是仿刺参腐皮综合症的重要病原之一。
目前,控制仿刺参的“腐皮综合症”等流行性疾病常用的方法一般是使用化学药物,包括长期大规模大量施用抗生素或化学制剂,这些药物虽然可暂时有效杀死或抑制病原菌,但是也会引起抗生素等化学制剂在环境中的残留、耐药基因的传播以及耐药菌的产生等问题,亦不能从根本上控制疾病的发生。因此,从微生物益生菌的角度出发,从健康生物的体内分离出对病原菌具有拮抗作用的微生物,用于抑制病原菌的生长和水产养殖动物疾病的防治,是水产养殖健康可持续发展的迫切需求。
技术实现要素:
本发明所要解决的技术问题是提供一种可拮抗病原菌灿烂弧菌的海洋细菌及其用途,该菌可有效抑制仿刺参的“腐皮综合症”重要病原灿烂弧菌的生长,并对灿烂弧菌感染仿刺参具有明显的保护效应,保护效率约为50%。
本发明解决上述技术问题所采用的技术方案为:一种可拮抗病原菌灿烂弧菌的海洋细菌,该菌株为33菌株,分类命名为弧菌(Vibrio sp.),其保藏编号为CGMCC No.12561,于2016年05月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心。
上述可拮抗病原菌灿烂弧菌的海洋细菌的用途,所述的弧菌33菌株在抑制灿烂弧菌生长方面的用途。
含有弧菌33的滤纸片在灿烂弧菌2216E固体培养基上可产生明显的抑菌圈,在灿烂弧菌培养过程中加入弧菌33的无菌上清液对灿烂弧菌的生长具有明显的抑制作用。
在海水中同时加入浓度分别为1.0×107 CFU/mL的弧菌33和灿烂弧菌,于25-28 ℃放置24小时后,弧菌33对海水中灿烂弧菌的抑制率可达86.7%。
在仿刺参的培养体系中加入弧菌33,可有效抑制病原菌灿烂弧菌感染仿刺参的过程,病原菌灿烂弧菌的剂量和弧菌33的浓度均为1.0×107 CFU/mL时,弧菌33对灿烂弧菌感染仿刺参的保护率为50%。
上述可拮抗病原菌灿烂弧菌的海洋细菌的筛选,采用滤纸片法进行灿烂弧菌拮抗菌的筛选,具体步骤如下:在2216E固体培养基的平板上,均匀涂布50μL浓度为1.0×108-5.0×108 CFU/mL的灿烂弧菌,并将涂布有灿烂弧菌的平板放置通风厨吹干;待检测菌液培养至对数生长期晚期,紫外分光光度计测定OD600为1.8-2.2时,采用灭菌滤纸片蘸取待检测细菌悬液,放置至平板上,25-28 ℃培养16-24小时,观察滤纸片周围是否出现抑菌圈;将出现明显抑菌圈的菌落进行纯培养和16S rRNA的PCR和菌株鉴定,获得的拮抗菌经16S rRNA鉴定为弧菌33菌株,于2016年05月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心,其保藏编号为CGMCC No.12561。
与现有技术相比,本发明的优点在于:本发明公开了一种可拮抗病原菌灿烂弧菌的海洋细菌及其用途和筛选方法,首次报道了该菌在抑制灿烂弧菌生长,拮抗灿烂弧菌感染仿刺参过程等特征。该菌来源于浙江宁波象山乌贼养殖基地的健康乌贼,通过滤纸片法筛选到该菌,并通过16S rRNA鉴定该菌为弧菌33。在海水中加入等量的灿烂弧菌和弧菌33,灿烂弧菌的数量可降低86.7%。在灿烂弧菌感染仿刺参的过程中加入弧菌33,可将仿刺参的相对存活率提高一倍。因此,该菌对灿烂弧菌的生长及其致病过程具有抑制作用,因此该菌有望在控制病原灿烂弧菌及其引起的仿刺参疾病中发挥重要作用。
综上所述,本发明一株灿烂弧菌的拮抗菌---海洋源弧菌33,该菌可有效抑制仿刺参的“腐皮综合症”重要病原灿烂弧菌的生长,并对灿烂弧菌感染仿刺参具有明显的保护效应。相比于采用抗生素等化学试剂相比,具有特异、不会引起环境的二次污染等优点。
该弧菌(Vibrio sp.)33菌株,已于2016年05月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.12561,保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。
附图说明
图1为弧菌33拮抗灿烂弧菌产生抑菌圈;
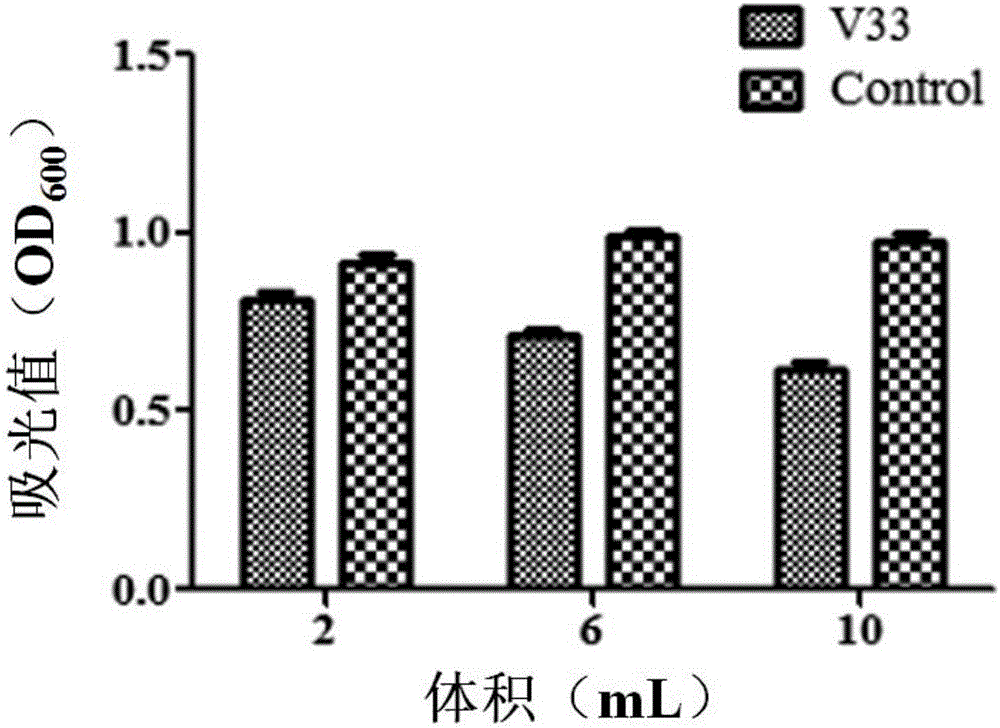
图2为不同体积的弧菌33( V33)无菌上清对灿烂弧菌的抑制效应结果图;
图3为弧菌33对海水中灿烂弧菌的抑制效应检测结果图;
图4为灿烂弧菌(Vs)、弧菌33以及灿烂弧菌与弧菌33混合菌悬液感染仿刺参的死亡率结果图,其中V33指弧菌33,Vs指灿烂弧菌。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
实施例1
健康乌贼体内可培养的细菌的培养及拮抗菌的筛选与鉴定
健康的乌贼取自浙江象山来发养殖场,取其组织液,涂布2216E固体平板,并放置于培养箱中25-28 ℃培养24小时。长出的可见菌落分别通过三线划线法进行菌株分离,获得单一纯培养菌种多株。将获得的纯培养菌株分别于2216E液体培养基中25-28℃震荡培养24小时,采用滤纸片法进行结抗菌的筛选,获得对灿烂弧菌具有拮抗能力的33(结果如图1所示),其中采用滤纸片法进行灿烂弧菌拮抗菌的筛选具体步骤如下:
在2216E固体培养基的平板上,均匀涂布50 μL浓度为1.0×108-5.0×108 CFU/mL的灿烂弧菌,并将涂布有灿烂弧菌的平板放置通风厨吹干;待检测菌液培养至对数生长期晚期,紫外分光光度计测定OD600为1.8-2.2时,采用灭菌滤纸片蘸取待检测细菌悬液,放置至平板上,25-28℃培养16-24小时,观察滤纸片周围是否出现抑菌圈;将出现明显抑菌圈的菌落进行纯培养和16S rRNA的PCR和菌株鉴定,获得菌株的种属信息;在本案例中,拮抗菌经16S rRNA鉴定为弧菌33。
鉴定方法如下: 采用16S rRNA法进行菌株33的鉴定。首先是采用PCR方法进行16S rRNA的扩增,具体的步骤为:正反向引物分别为SEQ ID NO.1:8F(5ˊ-AGAGTTTGATCATGGCTCAG -3ˊ)和SEQ ID NO.2:1492R(5ˊ-GGTTACCTTGTTACGACTT-3ˊ),菌株33的菌体为模板,25 μL的PCR的反应体系,分别加入以下量的物质:2.5 µL的10×PCR缓冲液 (200 mmol L-1 Tris–HCl (pH 8.4), 200 mmol L-1 KCl, 15 mmol L-1 MgCl2),0.5 µL的10 µmol L-1 正向引物,0.5 µL的10 µmol L-1 反向引物,2 µL的dNTP 混合物 (dATP、dGTP、dCTP和dTTP的浓度分别为2.5 mmol L-1),1 µL的模板,0.25 µL的 Taq DNA聚合酶和18.25 µL的灭菌双蒸水。混合好的PCR体系置于PCR仪中,反应条件设定为94℃变性 4 min,然后94 ℃变性 40 秒,55-59 ℃退火1 分钟,72 ℃ 延伸30 秒,30个循环,最后72 ℃继续延伸10 分钟。扩增产物在凝胶成像仪中观察分析后,呈现单一的约为1.6 kb的目的条带。将PCR产物送至上海生工生物工程有限公司进行测序,获得的部分序列如SEQ ID NO.3所示的核苷酸序列。将获得的DNA序列于NCBI数据库中的BLAST程序中进行序列比对。比对的结果显示,33号菌为弧菌属细菌,但是弧菌33是属于哪一种细菌有待于进一步的生理生化等鉴定。
该弧菌(Vibrio sp.)33菌株,于2016年05月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.12561,保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。
本案例中弧菌33和灿烂弧菌均采用2216E培养基进行培养,所述的2216E培养基的配方为:胰蛋白胨5 g/L,酵母浸粉 1 g/L,磷酸铁0.01 g/L,陈海水1 L,灭菌备用。
实施例2
弧菌33对灿烂弧菌生长的抑制效应检测
(1)弧菌33的无菌上清液对灿烂弧菌生长的抑制效应
将-80 ℃保存的弧菌33种子接种到2216E液体培养基中,于25-28 ℃摇床中培养过夜。按体积比10%的接种量将过夜培养的种子液接种至新鲜的2216E液体培养基中,25-30 ℃摇床中培养24小时,在紫外分光光度计中测定菌液的OD600约为2.0时。培养液12000 × g离心 5分钟,收集上清,并使用0.22 μm的膜过滤除菌,获得的无菌上清滤液置于无菌离心管中。将此无菌上清液按照不同的比例加入到含有浓度为5.0×107 CFU/mL灿烂弧菌的2216E液体培养基中,25-28 ℃继续培养24小时,以加入上清液的不同体积为横坐标,以各条件下菌液的OD600为纵坐标,作图2。由图2可见,加入的弧菌33上清对灿烂弧菌生物量的影响具有明显的剂量依赖性,随着加入的弧菌33上清液体积的增加,抑制作用逐渐增强。
(2)弧菌33对海水中灿烂弧菌的抑制效应检测
采集宁波附近海域的天然海水,并采用0.22 μm的膜过滤,获得无菌海水。将过滤除菌海水平均分为两份,每份10 mL。一份加入浓度为1.0×107 CFU/mL的灿烂弧菌,同时,另一份加入灿烂弧菌和弧菌33,使两株菌在海水中的浓度分别达到1.0×107 CFU/mL。两份海水在相同的条件下放置48小时后,分别稀释涂布含有氨苄抗生素的2216E固体培养基。25-28 ℃摇床中培养24小时后,进行菌落计数。结果如图3所示,海水环境中弧菌33的加入可引起灿烂弧菌的数量急剧降低,与对照组相比,弧菌33的抑制率可达86.7%。
实施例3
弧菌33对灿烂弧菌感染仿刺参的保护率测定
将培养至对数生长期的弧菌33和灿烂弧菌培养液离心浓缩,菌体重新悬浮于海水中,分别制备浓度为1.0×109 CFU/mL 的高浓度弧菌33和灿烂弧菌菌悬液。健康的仿海参购自烟台东方海洋生物科技有限公司,重约15克/尾。将饲养的仿海参分为3组,每20尾一组。第一组加入浓度为1.0×107 CFU/mL的弧菌33;第二组同时加入浓度分别为1.0×107 CFU/mL 灿烂弧菌菌悬液和浓度为1.0×107 CFU/mL的弧菌33,第三组加入浓度为1.0×107 CFU/mL的灿烂弧菌。加入菌体后的三组仿刺参继续观察5天,记录仿海参的存活率和存活状态。加入灿烂弧菌的海水中养殖的仿海参在培养的第3天即可发生明显的排脏现象,稍后死亡,而在只加入弧菌33,和同时加入弧菌33和灿烂弧菌的混合菌液海水中养殖的仿海参菌较好地贴壁,没有排脏的现象发生。以培养天数为横坐标,以海参的相对存活率作为纵坐标,作图4。由图4可见,加入灿烂弧菌后,仿刺参存活率为30%左右,弧菌33对灿烂弧菌感染仿刺参的过程具有明显的保护作用,可将仿刺参的存活率提高到存活率提高至68%左右。根据以下公式计算:
获得弧菌33对灿烂弧菌感染仿刺参的保护效率约为50%。
结果分析:相比于其他研究人员筛选获得的拮抗细菌,如假单胞菌、芽孢杆菌、希瓦氏菌、不动杆菌、柠檬黄假交替单胞菌和白色食琼脂菌相比,本案例明确指出了在天然海水环境中,拮抗菌弧菌33对灿烂弧菌数量的抑制率可达86.7%以上,这是首次定量化测定了拮抗菌抑制灿烂弧菌的效果。更进一步地,迄今为止,仅获得3株菌对灿烂弧菌感染仿刺参的保护率,分别是海水芽孢杆菌和柠檬黄假交替单胞菌保护率分别为:0和34.9%(被感染的宿主为1 g左右的仿刺参)。本案例中弧菌33的保护率约为50%,高于海水芽孢杆菌和柠檬黄假交替单胞菌。然而,在测定白色食琼脂菌的保护率实验中,使用浓度为107 CFU/mL的灿烂弧菌感染的是1 g的仿刺参,获得仿刺参排脏率为52%。在本案例中使用相同浓度的灿烂弧菌的浸泡感染15 g的仿刺参,仿刺参的死亡率可达70%,这些数据从某种程度上说明,本案例中使用的灿烂弧菌的致病性比测定白色食琼脂菌保护率时使用的灿烂弧菌具有更强的致病性(根据经验,越小的仿刺参对致病菌越敏感,越大的个体对致病菌的抵抗力越强),获得弧菌33的保护率为50%,在拮抗高致病性的病原菌时具有较大优势。
当然,上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,作出的变化、改型、添加或替换,也应属于本发明的保护范畴。
- 还没有人留言评论。精彩留言会获得点赞!