一种基于连接的环介导等温扩增技术用于基因突变检测方法与流程
本发明属于分子生物学和核酸化学领域,尤其是涉及一种基于连接的环介导等温扩增技术用于基因突变检测方法。
背景技术:
从分子水平上看,基因突变是指基因结构上发生碱基对组成或排列顺序的改变。基因突变可以发生在发育的任何时期,通常发生在DNA复制时期,即细胞分裂间期,包括有丝分裂间期和减数分裂间期,基因突变也是生物进化的重要因素之一,所以研究基因突变除了本身的理论意义外还有广泛的生物学意义,基因突变为遗传学研究提供突变型,为育种工作提供素材,所以它还有科学研究和生产上的实际意义。随着分子生物学及分子遗传学研究的深入,发现很多疾病如遗传学疾病、恶性肿瘤等与基因的突变有关。因此,直接的基因突变分析越来越受到重视。
近几年,一系列的基因突变的检测方法层出不穷,同时经典的方法也在不断地被改进,由于环介导等温扩增(LAMP)技术的发展,大大促进了基因突变检测研究的发展和应用。LAMP反应为聚合酶链式反应的一种特殊型式,在引物存在情况下,1小时内即可完成DNA或RNA的扩增反应,LAMP是一种在等温条件下进行的高效率的核酸放大技术,这种技术只需要一种具有链置换活性的DNA聚合酶,加之其有较高的灵敏度与专一性,非常适合应用于各种核酸检测。但是,目前还没有出现利用改进的LAMP来进行单碱基突变检测。
技术实现要素:
有鉴于此,本发明针对现有技术的不足,提出了一种基于连接的环介导等温扩增技术用于基因突变检测方法,提高了基因突变检测方法的灵敏度和选择性。
为达到上述目的,本发明的技术方案是这样实现的:
一种基于连接的环介导等温扩增技术用于基因突变检测方法,所述检测方法包括如下步骤:
(1)以目标DNA为模板设计两条DNA发夹探针H1和H2;
(2)在目标存在的情况下,目标DNA与H1和H2退火杂交,在H1的3'末端完全互补的情况下,用连接酶将H1和H2连接形成双哑铃DNA结构;
(3)以双哑铃DNA为模板进行环介导等温扩增反应,得到环介导等温扩增产物;
(4)向环介导等温扩增产物中加入DNA双链特异性染料SYBR GreenI后荧光信号增强,通过对荧光信号的检测实现对基因突变的定量检测。
优选的,所述H1有一段单链突出端和目标DNA的3'端互补杂交。
优选的,H1的3'末端包含目标DNA单碱基多态性位点
优选的,所述H2有一段单链突出端和目标DNA的5'端互补杂交。
优选的,所述连接酶为Taq DNA连接酶。
优选的,所述步骤(3)中环介导等温扩增反应的温度为50~60℃。
相对于现有技术,本发明所述的一种基于连接的环介导等温扩增技术用于基因突变检测方法具有以下优势:
(1)本发明所述的基因突变检测方法引入了高灵敏的环介导等温扩增技术使得该方法具有非常低的检测下限,另外方法采用连接酶识别错配的区分方式又使得方法具有较高的选择性,特异性;
(2)本发明所述的基因突变检测方法主要由目标介导的探针特异连接偶联LAMP信号放大技术构成,实验简单,操作简便,重复性高,通用性好,有利于高通量应用;
附图说明
构成本发明的附图部分用来提供对本发明的进一步理解,本发明的实施例及其说明用于解释本发明,但并不构成对本发明的不当限定。在附图中:
图1为本发明实施例所述的miRNA实验原理图;
图2为本发明实施例所述的LAMP反应实时荧光曲线;
图3为本发明实施例所述的静态荧光光谱图;
图4为本发明实施例所述的凝胶电泳图;
图5为本发明实施例所述的Taq DNA连接酶的特异性试验;
图6为本发明实施例所述的miRNA在四中肿瘤细胞中的表达。
具体实施方式
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
下面将参考附图并结合实施例来详细说明本发明。
实施例1
以miRNA的突变为例
miRNA、H1、H2的碱基序列见表1。
表1 miRNA及DNA探针序列表
具体实验步骤如下:
(1)反转录反应
目标miRNA首先被poly(A)聚合酶延伸,在3'端产生一个poly(A)的尾巴,接着和一条DNA引物杂交,在M-MuLV反转录酶的作用下形成一条与目标miRNA互补的cDNA。DNA引物包含两个区域,一个是和miRNA3'端互补的6个碱基,另一个是10个T碱基序列。因为DNA引物包含一个与目标miRNA特异结合的序列,所以只有目标miRNA可以被反转录形成其cDNA。最后,由于M-MuLV反转录酶固有的RNase H活性,cDNA:miRNA杂合双链中的miRNA会被降解,产生一条单链cDNA。
10μL的反应体系包含1μL10×M-MuLV反转录酶反应缓冲液(500mMTris-HCl,750mMKCl,30mM MgCl2,100mM DTT,pH8.3),0.1μLRNase抑制剂,1μL ATP(10mM),1μLdNTP(10mM),1μL E.colipoly(A)聚合酶,1μL M-MuLV反转录酶,1μL primer(100nM)和不同浓度的目标miRNA,37℃反应1小时,65℃反应20分钟,得到反转录产物。
(2)连接反应
cDNA与H1和H2退火杂交,在H1的3'末端完全互补的情况下,TaqDNA连接酶将H1和H2连接形成双哑铃DNA结构。20μL的反应体系包含1×Taq DNA连接酶反应缓冲液(20mMTris-HCl,25mM KAc,10mM Mg(Ac)2,10mM DTT,1mM NAD,0.1%Triton X-100,pH7.6),1nM H1,1nM H2,2U/μLTaq DNA连接酶和10μL反转录反应产物,37℃反应30分钟,然后95℃反应5分钟,再降温至4℃保持15分钟,得到双哑铃结构的反应产物。
(3)LAMP反应
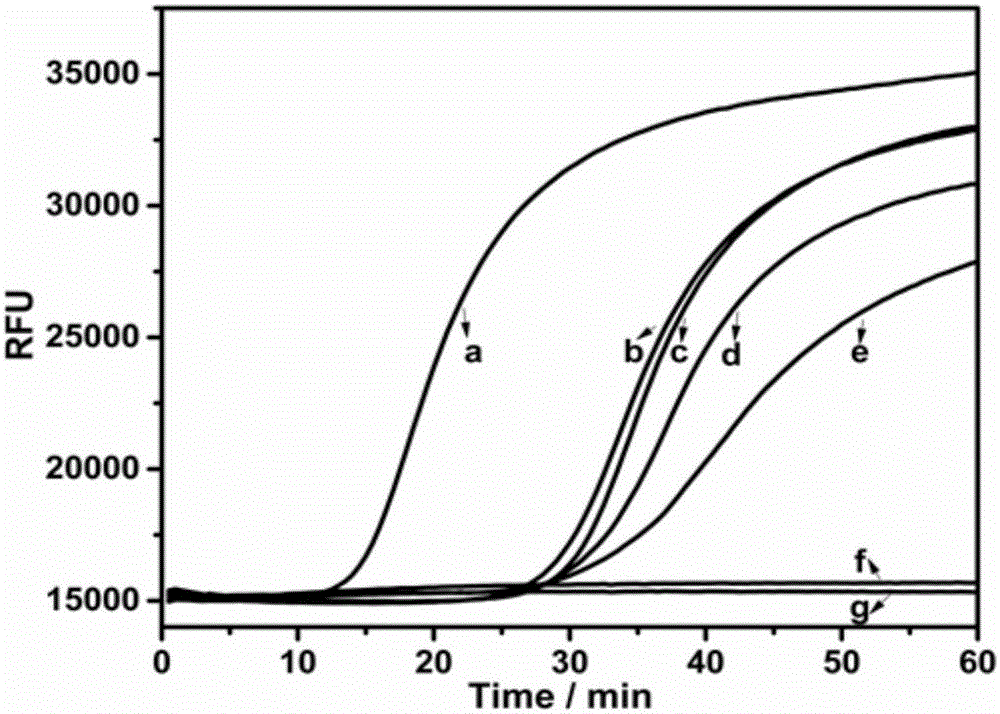
在两条引物和Bst DNA聚合酶存在时,双哑铃结构的连接产物引发高放大效率的LAMP反应,产生大量的长的双链DNA产物,实现了对连接产物的指数型放大,加入DNA双链特异性染料SYBR Green(SG)I后产生荧光信号,通过对荧光信号的检测实现对miRNA的定量检测。向连接反应结束后的溶液中加入12.5μL无RNA酶的水,5μL 105反应缓冲液(200mMTris-HCl,100mM(NH4)2SO4,100mMKCl,20mM MgSO4,1%X-100,pH8.8),3μL FP(5μM),3μL BP(5μM),2.5μL 10×SG I,3μLdNTP(10mM),1μLBst DNA聚合酶,反应温度为50℃,所用仪器为C1000Thermal Cycler(Bio-Rad,Hercules,CA,USA)包括一个CFX96原位检测系统。实时监测荧光选择FAM/SYBR Green通道,每间隔30s读取一次荧光值,具体结果见附图2:附图2中a表示1nM经miR-21反转录的cDNA,1nM H1和H2,2U/μLTaq DNA连接酶,0.3μM FP与BP,0.5×SG I,0.16U/μLBst DNA聚合酶,0.6mM dNTP;b表示反应过程中没有加入反转录酶,其他条件同a;c表示反应过程中没有miRNA,其他条件同a;d表示反应过程中没有加入Taq DNA连接酶,其他条件同a;e表示反应过程中没有加入H1和H2,其他条件同a;f表示反应过程中没有加入FP和BP,其他条件同a;g表示反应过程中没有加入Bst DNA聚合酶。
(4)静态荧光检测
荧光光谱测量在室温下进行,LAMP反应进行30分钟后,在50μL的反应产物中加入50μL水,配成100μL的样品,将此样品置于石英比色皿中,然后用F-7000荧光光谱仪测定,激发波长设为495nm,发射波长的范围为505nm~600nm,激发和发射狭缝宽度为5nm,具体结果见附图3:图中曲线a是1nM目标miR-21的荧光光谱,曲线c为没有目标存在时的荧光光谱,曲线b为1nM非目标miR-141的荧光光谱。由图可知,只有目标特异存在的时候才能发生特异扩增反应,产生强的荧光信号。
(5)凝胶电泳分析
对Ligation-LAMP反应产物进行琼脂糖凝胶电泳分析。制胶和电泳过程均在室温下进行,电泳分析使用3%的琼脂糖和0.5×TBE缓冲液(45mMTris,45mM Boric Acid,10mM EDTA,PH8.0),用0.5μg/mL GoldView和0.5μg/mL溴化乙锭进行染色,向上述样品中加入10μL样品混合液,样品混合液在101V电压下电泳90分钟,电泳结束后,用Tanon 4200SF凝胶成像系统(上海天能科技有限公司,中国)观察条带并拍照,具体结果见附图4:条带M为marker条带;条带1为目标miR-21的反转录产物cDNA条带;条带2为LAMP的两个扩增引物条带;条带3为H1和H2的条带;条带4为H1和H2与cDNA杂交的条带;条带5为除连接酶外所有反应物存在时的扩增条带;条带6为除目标外所有反应物存在时的扩增条带;条带7为非特异目标miR-141cDNA存在时的扩增条带;条带8为目标miR-21cDNA存在时的扩增条带。图中可知,只有目标miR-21cDNA特异存在,才能扩增产生不同长度的高分子量扩增产物,说明方法的可靠性。
(6)特异性实验
本实验考察了检测方法的特异性,具体结果见附图5:横坐标表示不同的目标,纵坐标代表实时扩增曲线中与空白对照相比相同荧光强度对应的时间差值。miR-141和let-7a代表非特异的目标,可以发现这两种情况几乎是不能反应的;2M-21和SM-21分别代表两个碱基突变和一个碱基突变存在的目标,可以看出与完全匹配的目标miR-21相比,区别比较明显,说明方法具有较好的错配区分能力;最后一个柱状带为miR-21、miR-141和let-7a同时存在时候的扩增反应,可以发现与miR-21单独存在非常接近,说明miR-141和let-7a几乎不会干扰特异的检测,方法具有良好的特异性。
(7)对细胞内提取的miRNA进行检测
四种待测细胞MCF-10A,HT1080,HeLa和MCF-7,其中MCF-10A、MCF-7及HeLa均在含有15%的热失活的胎牛血清(Invitrogen),100U/mL的青霉素和100g/mL链霉素的培基RPMI 1640(Thermo Scientific HyClone)中培养。HT1080在DMEM高糖培基中培养,细胞培养在5%CO2的培养箱中,温度为37℃。细胞中RNA的提取采用UNIQ-10柱式Trizol总RNA抽提试剂盒购自Sangon Biotech Co.Ltd.(上海,中国),提取完备的总RNA样品冻存于-80℃冰箱中备用,检测所提取的RNA样品中miRNA的相对表达水平,具体结果见附图6。此试验结果表明本发明所发展的方法与现有的实时PCR方法的检测结果大致相同,但本发明比现有实时PCR方法操作简单,节省了大量的成本。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种霍乱弧菌环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于检测番茄晚疫病菌的LAMP引物组合物和应用的制造方法与工艺
- 基于颜色判定的环介导等温扩增(LAMP)技术检测雪松疫霉根腐病菌的制造方法与工艺
- Sortase A介导的(S)‑羰基还原酶寡聚体高效催化(S)‑苯基乙二醇的合成的制造方法与工艺
- 用于旋转机器中的超导线圈的等温支承部和真空容器的制造方法与工艺
- 基于环介导等温扩增消光技术的转基因玉米MIR604检测方法与制造工艺
- 基于环介导等温扩增消光技术的玉米检测方法与制造工艺
- 一套鉴定甘蔗上三种短体线虫的环介导等温扩增引物及其试剂盒的制造方法与工艺
- RNA扩增方法与制造工艺
- 用于扩增核酸样品的等温方法与制造工艺
- 环介导等温扩增多重耐药基因oqxAB的检测引物、检测试剂盒及检测方法与制造工艺
- 一种气单胞菌的核酸等温扩增检测试剂盒及其检测方法与制造工艺
- 一种霍乱弧菌环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于检测番茄晚疫病菌的LAMP引物组合物和应用的制造方法与工艺
- 基于颜色判定的环介导等温扩增(LAMP)技术检测雪松疫霉根腐病菌的制造方法与工艺
- Sortase A介导的(S)‑羰基还原酶寡聚体高效催化(S)‑苯基乙二醇的合成的制造方法与工艺
- 用于旋转机器中的超导线圈的等温支承部和真空容器的制造方法与工艺
- 用于扩增细胞群的方法、试剂盒及装置与制造工艺
- 基于环介导等温扩增消光技术的转基因玉米MIR604检测方法与制造工艺
- 基于环介导等温扩增消光技术的玉米检测方法与制造工艺